Crotamina
| Crotamina | |||||||
|---|---|---|---|---|---|---|---|
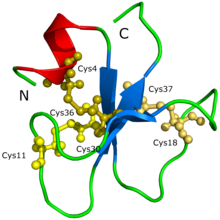 La estructura proteica de la crotamina ( PDB : 1H5O ) | |||||||
| Identificadores | |||||||
| Organismo | ? | ||||||
| Símbolo | CRO2 | ||||||
| Protección unificada | Q9PWF3 | ||||||
| |||||||
La crotamina es una toxina presente en el veneno de la serpiente de cascabel sudamericana ( Crotalus durissus terrificus ). Se trata de una proteína de 42 residuos de longitud que contiene 11 residuos básicos (nueve lisinas , dos argininas ) y seis cisteínas . También se ha aislado del veneno de la serpiente de cascabel de las praderas norteamericana, Crotalus viridis viridis . Fue aislada y purificada por primera vez por el científico brasileño José Moura Gonçalves , y luego estudiada intensivamente por su grupo de colaboradores en la Facultad de Medicina de Ribeirão Preto de la Universidad de São Paulo .
Función biológica
La crotamina tiene varias acciones biológicas: actúa sobre los canales de sodio de la membrana celular , es ligeramente analgésica y es miotóxica, es decir, penetra en las células de los músculos y promueve la necrosis . [1] La crotamina es homóloga a otras miotoxinas del veneno y es similar a las α-,β- defensinas .
Bioquímica y mecanismo
Ya se han determinado la secuencia de aminoácidos ( YKQCHKKGGHCFPKEKICLPPSSDFGKMDCRWRWKCCKKGSG , Cys4-Cys36, Cys11-Cys30, Cys18-Cys37) y la estructura molecular tridimensional de la crotamina.
La estructura proteica de la crotamina no pudo determinarse inicialmente a través de la cristalización de proteínas ni de la difracción de rayos X. [2] Se especuló que la dificultad se debía a que la crotamina tiene tantas isoformas , lo que lleva a la formación de agregados y diferentes conformaciones posibles de la proteína. La estructura y la forma de la proteína se propusieron a través de un modelo 3D generado por Siqueira et al. (2002) basado en cálculos computacionales que fueron respaldados con simulaciones intensivas de dinámica molecular y procedimientos de modelado de homología. Posteriormente, Nicastro et al. (2003) descubrieron la estructura de la crotamina a través de espectroscopia de resonancia magnética nuclear . La crotamina tiene una topología que nunca antes se había visto en toxinas activas que se dirigen a los canales iónicos; la proteína está compuesta por una hélice alfa N-terminal corta , un tipo de formación de proteína, y una pequeña hoja beta triple antiparalela, otro tipo de formación de proteína, dispuesta en una topología ab1b2b3. La crotamina tiene conformaciones de pliegues estructurales similares a la familia de las β-defensinas humanas , así como una disposición idéntica de tres puentes disulfuro . [2]
El gen y la localización cromosómica responsables de su síntesis han sido identificados por el grupo dirigido por Gandhi Rádis-Baptista, que trabaja en el Instituto Butantan , en São Paulo, Brasil. El ARNm tiene unos 340 nucleótidos y codifica una precrotamina, que incluye el péptido señal , la crotamina madura y una lisina final.
El gen de la crotamina fue el primer gen que se mapeó en un cromosoma de serpiente. [2] El gen responsable de codificar la proteína crotamina está etiquetado como Crt-p1 y su longitud de secuencia de pares de bases es de aproximadamente 1,1 kbp o 1100 pb. Se informó que el gen de la crotamina se aisló dos veces de dos especímenes diferentes, uno en un método que resultó en un tamaño de gen de 1,8 kbp y en el otro espécimen un tamaño de gen de 1,1 kbp. [3] El gen ha sido aislado previamente en el genoma de C. durissus terrificus y la proteína en sí pertenece a un grupo de pequeñas miotoxinas polipeptídicas básicas (SBPM). Los contenidos de los venenos de Crotalus pueden variar según la subespecie y la ubicación geográfica. [4] El gen Crt-p1, como lo describen Radis-Bastista et al. 2003, consta de unos tres exones separados por un intrón corto de fase 2 (140 pb) y un intrón largo de fase 1 (900 pb). El exón 1 codifica los primeros 19 aminoácidos del péptido señal e incluye la región 5' no traducida. El exón 2 codifica 39 aminoácidos de la crotamina madura y tres aminoácidos del péptido señal. El exón 3 codifica la lisina terminal y los últimos tres aminoácidos de la toxina madura. La investigación sobre las secuencias de aminoácidos de SBPM entre diferentes especies de Crotalus ha revelado un alto grado de similitud que va del 83% al 98%. [3]
Se ha secuenciado el código de aminoácidos de las proteínas de la familia de las miotoxinas, un pequeño polipéptido básico que incluye la crotamina. Se ha descubierto que son similares, con una divergencia media del 83 %. Se ha comparado una secuencia de aminoácidos de la crotamina con la del ADN clonado de la miotoxina a (la miotoxina utilizada para modelar el funcionamiento de las SBPM). En la comparación, las regiones codificantes de exones que incluyen la miotoxina madura y el péptido señal fueron similares en un 98 % y un 100 %, respectivamente. Las regiones no traducidas de 5' y 3' entre la muestra y el ADNc de la miotoxina a fueron del 60 % y del 80 %, respectivamente. Al comparar las secuencias de aminoácidos de otras proteínas que no pertenecen a la familia SBPM que se encuentran en los venenos de serpiente, suele haber una gran divergencia. Al observar las proteínas SBPM, tienen una gran similitud entre diferentes subespecies del género Crotalus y entre diferentes individuos de la misma subespecie. Esto indica, según Radis-Batista et al. Estudio de 2003 que demuestra que el gen de la crotamina y otros genes SBPM han evolucionado recientemente.
Referencias
- ^ Oliveira AL, Viegas MF, da Silva SL, Soares AM, Ramos MJ, Fernandes PA (10 de junio de 2022). "La química del veneno de serpiente y su potencial medicinal". Reseñas de la naturaleza. Química . 6 (7): 451–469. doi :10.1038/s41570-022-00393-7. PMC 9185726 . PMID 35702592.
- ^ abc Oguiura N, Boni-Mitake M, Rádis-Baptista G (septiembre de 2005). "Nueva visión de la crotamina, una pequeña miotoxina polipeptídica básica del veneno de la serpiente de cascabel sudamericana". Toxicon . 46 (4): 363–370. doi :10.1016/j.toxicon.2005.06.009. PMID 16115660. S2CID 40142037.
- ^ ab Samejima Y, Aoki Y, Mebs D (1991). "Secuencia de aminoácidos de una miotoxina del veneno de la serpiente de cascabel de espalda de diamante del este (Crotalus adamanteus)". Toxicon . 29 (4–5): 461–468. doi :10.1016/0041-0101(91)90020-r. PMID 1862521.
- ^ Schenberg S (mayo de 1959). "Patrón geográfico de la distribución de crotamina en la misma subespecie de serpiente de cascabel". Science . 129 (3359): 1361–1363. doi :10.1126/science.129.3359.1361. PMID 13658964.
Lectura adicional
- Goncalves JM, Deutsch HF (febrero de 1956). "Estudios de electroforesis ultracentrífuga y de zona de algunos venenos de crotalidae". Archivos de bioquímica y biofísica . 60 (2): 402–411. doi :10.1016/0003-9861(56)90444-1. PMID 13292919.
- Giglio JR (noviembre de 1975). "Estudios analíticos sobre el clorhidrato de crotamina". Analytical Biochemistry . 69 (1): 207–221. doi :10.1016/0003-2697(75)90581-3. PMID 2030.
- Laure CJ (febrero de 1975). "[La estructura primaria de la crotamina (traducción del autor)]". Zeitschrift für Physiologische Chemie de Hoppe-Seyler (en alemán). 356 (2): 213–215. PMID 1176086.
- De Lucca FL, Imaizumi MT, Haddad A (abril de 1974). "Caracterización de los ácidos ribonucleicos de las glándulas venenosas de Crotalus durissus terrifucus (Ophidia, Reptilia) después de la extracción manual del veneno. Estudios sobre la actividad de la plantilla y la composición de bases". The Biochemical Journal . 139 (1): 151–156. doi :10.1042/bj1390151. PMC 1166261 . PMID 4463939.
- Ownby CL, Cameron D, Tu AT (octubre de 1976). "Aislamiento del componente miotóxico del veneno de la serpiente de cascabel (Crotalus viridis viridis). Análisis microscópico electrónico del daño muscular". The American Journal of Pathology . 85 (1): 149–166. PMC 2032543 . PMID 970437.
- Rádis-Baptista G, Oguiura N, Hayashi MA, Camargo ME, Grego KF, Oliveira EB, Yamane T (julio de 1999). "Secuencia de nucleótidos de precursores de isoformas de crotamina de una sola serpiente de cascabel sudamericana (Crotalus durissus terrificus)". Toxico . 37 (7): 973–984. doi :10.1016/s0041-0101(98)00226-8. PMID 10484745.
- Kerkis A, Kerkis I, Rádis-Baptista G, Oliveira EB, Vianna-Morgante AM, Pereira LV, Yamane T (septiembre de 2004). "La crotamina es una nueva proteína que penetra las células procedente del veneno de la serpiente de cascabel Crotalus durissus terrificus". Revista FASEB . 18 (12): 1407-1409. doi : 10.1096/fj.03-1459fje . PMID 15231729. S2CID 20510076.
- Rádis-Baptista G, Kubo T, Oguiura N, Prieto da Silva AR, Hayashi MA, Oliveira EB, Yamane T (junio de 2004). "Identificación de crotasina, un gen relacionado con la crotamina de Crotalus durissus terrificus". Toxico . 43 (7): 751–759. doi :10.1016/j.toxicon.2004.02.023. PMID 15284009. S2CID 16350991.
- Rádis-Baptista G, Kubo T, Oguiura N, Svartman M, Almeida TM, Batistic RF, et al. (diciembre de 2003). "Estructura y localización cromosómica del gen de la crotamina, una toxina de la serpiente de cascabel sudamericana, Crotalus durissus terrificus". Toxicon . 42 (7): 747–752. doi :10.1016/j.toxicon.2003.10.019. PMID 14757205.
- Nicastro G, Franzoni L, de Chiara C, Mancin AC, Giglio JR, Spisni A (mayo de 2003). "Estructura de la solución de crotamina, un canal de Na + que afecta la toxina del veneno de Crotalus durissus terrificus". Revista europea de bioquímica . 270 (9): 1969-1979. doi : 10.1046/j.1432-1033.2003.03563.x . PMID 12709056. S2CID 20601072.
- Mouhat S, Jouirou B, Mosbah A, De Waard M, Sabatier JM (marzo de 2004). "Diversidad de pliegues en toxinas animales que actúan sobre canales iónicos". The Biochemical Journal . 378 (Pt 3): 717–726. doi :10.1042/BJ20031860. PMC 1224033 . PMID 14674883.
Enlaces externos
- Secuencia de nucleótidos y traducción de crotasina. Base de datos Entrez. Centro Nacional de Información Biotecnológica.