Vacuna antineumocócica conjugada
 Prevenir 13 | |
| Descripción de la vacuna | |
|---|---|
| Objetivo | Neumonía por estreptococo |
| Tipo de vacuna | Conjugado |
| Datos clínicos | |
| Nombres comerciales | Prevnar 20, Prevnar 13, Synflorix, otros; Prevnar descontinuado (PCV7) |
| Otros nombres | PCV, vacuna antineumocócica, polisacáridos capsulares [1] |
| AHFS / Drogas.com | Monografía |
| MedlinePlus | a607021 |
| Datos de licencia |
|
Categoría de embarazo |
|
| Vías de administración | Intramuscular |
| Código ATC |
|
| Estatus legal | |
| Estatus legal | |
| Identificadores | |
| Araña química |
|
| BARRIL |
|
La vacuna antineumocócica conjugada es una vacuna antineumocócica elaborada con el método de la vacuna conjugada y utilizada para proteger a los bebés , niños pequeños y adultos contra la enfermedad causada por la bacteria Streptococcus pneumoniae (neumococo). Contiene polisacárido capsular purificado de serotipos neumocócicos conjugado con una proteína transportadora para mejorar la respuesta de anticuerpos en comparación con la vacuna antineumocócica polisacárida . La Organización Mundial de la Salud (OMS) recomienda el uso de la vacuna conjugada en las inmunizaciones de rutina administradas a los niños. [16] [17]
La inmunidad mediada por la vacuna "se otorga principalmente por la muerte opsonofagocítica de S. pneumoniae ". [18]
Los efectos secundarios más comunes en niños son disminución del apetito, fiebre (sólo muy común en niños de seis semanas a cinco años), irritabilidad, reacciones en el lugar de la inyección (enrojecimiento o endurecimiento de la piel, hinchazón, dolor o sensibilidad), somnolencia (adormecimiento) y sueño de mala calidad. [11] [18] En adultos y ancianos, los efectos secundarios más comunes son disminución del apetito, dolores de cabeza, diarrea, fiebre (sólo muy común en adultos de 18 a 29 años), vómitos (sólo muy común en adultos de 18 a 49 años), erupción cutánea, reacciones en el lugar de la inyección, limitación del movimiento del brazo, artralgia y mialgia (dolor articular y muscular), escalofríos y fatiga. [11] [18]
Marcas
Capvaxive
Capvaxive es una vacuna conjugada neumocócica 21-valente fabricada por Merck y fue aprobada para uso médico en los Estados Unidos en junio de 2024. [19] [20] Está indicada para la inmunización activa para la prevención de la enfermedad invasiva causada por los serotipos 3, 6A, 7F, 8, 9N, 10A, 11A, 12F, 15A, 15B, 15C, 16F, 17F, 19A, 20A, 22F, 23A, 23B, 24F, 31, 33F y 35B de Streptococcus pneumoniae en personas de 18 años de edad o más; y la inmunización activa para la prevención de la neumonía causada por los serotipos 3, 6A, 7F, 8, 9N, 10A, 11A, 12F, 15A, 15C, 16F, 17F, 19A, 20A, 22F, 23A, 23B, 24F, 31, 33F y 35B de S. pneumoniae en personas de 18 años de edad y mayores. [19]
Neumosil
Pneumosil es una vacuna antineumocócica conjugada decavalente producida por el Serum Institute of India . Contiene los serotipos 1, 5, 6A, 6B, 7F, 9V, 14, 19A, 19F y 23F, y fue precalificada por la OMS en enero de 2020. [21] [22]
Prevnar

Prevnar 20 (PCV20) es la tercera versión de una vacuna producida por la subsidiaria Wyeth de Pfizer . En abril de 2023, la FDA aprobó Prevnar 20 para la prevención de enfermedades invasivas causadas por los 20 serotipos diferentes de S. pneumoniae contenidos en la vacuna (serotipos 1, 3, 4, 5, 6A, 6B, 7F, 8, 9V, 10A, 11A, 12F, 14, 15B, 18C, 19A, 19F, 22F, 23F y 33F) para personas de 6 semanas a 17 años de edad; y para la prevención de la otitis media (infección del oído) causada por 7 de los serotipos de Streptococcus pneumoniae contenidos en la vacuna para niños de 6 semanas a 5 años de edad. [23] En junio de 2023, el Comité Asesor sobre Prácticas de Inmunización (ACIP) aprobó la vacuna PCV20 (Prevnar 20) para su uso en niños estadounidenses. [24] [25]
La segunda versión, Prevnar 13 (PCV13), contenía trece serotipos de neumococo (1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F y 23F). [26] [7] Reemplazó a Prevnar, la vacuna conjugada heptavalente neumocócica (PCV7). [27] [28] Prevnar 13 fue aprobada para su uso en la Unión Europea en diciembre de 2009. [11] En febrero de 2010, Prevnar 13 fue aprobada en los Estados Unidos para reemplazar a Prevnar. [27] [29] Después de esperar el resultado de un ensayo en curso en los Países Bajos, los Centros para el Control y la Prevención de Enfermedades (CDC) recomendaron la vacuna para adultos mayores de 65 años en agosto de 2014. [30]
La primera versión, la Prevnar heptavalente (PCV7), se produjo a partir de las siete cepas más prevalentes de la bacteria Streptococcus pneumoniae en los EE. UU. (4, 6B, 9V, 14, 18C, 19F y 23F). Prevnar fue aprobada para su uso en los Estados Unidos en febrero de 2000, [31] [32] [33] y se recomendó la vacunación con Prevnar para todos los niños menores de 2 años y para los niños no vacunados entre 24 y 59 meses de edad que tenían un alto riesgo de infecciones neumocócicas. La formulación resultó en una probabilidad del 98% de protección contra las cepas constituyentes, que causaron el 80% de la enfermedad neumocócica en bebés en los EE. UU. La PCV7 ya no se produce. [34]
En las vacunas Prevnar, los azúcares de la cápsula celular bacteriana, una característica de estos patógenos, están unidos (conjugados) a través de aminación reductora a CRM197 , una variante recombinante no tóxica de la toxina de la difteria . CRM197 se deriva de la cepa C7 de Corynebacterium diphtheriae cultivada en un medio de casaminoácidos y extractos de levadura . [18] [35] Las bacterias que contienen los azúcares polisacáridos de la vacuna se cultivan por separado en caldos de peptona de soja. El glicoconjugado resultante [18] produce una respuesta inmunitaria más robusta en la mayoría de las personas sanas. También se añade aluminio a la vacuna como adyuvante , lo que mejora aún más la respuesta inmunitaria. [18]
Sinflorix
Synflorix (PCV10) es producida por GlaxoSmithKline . Es una vacuna decavalente y, por lo tanto, contiene diez serotipos de neumococo (1, 4, 5, 6B, 7F, 9V, 14, 18C, 19F y 23F) que están conjugados con una proteína transportadora. Synflorix recibió una opinión positiva de la Agencia Europea de Medicamentos (EMA) para su uso en la Unión Europea en enero de 2009, [36] y GSK recibió la autorización de la Comisión Europea para comercializar Synflorix en marzo de 2009. [37] [12]
Vacunación
Vaxneuvance es una vacuna conjugada antineumocócica 15-valente creada por Merck que fue aprobada para uso médico en los Estados Unidos en julio de 2021. [9] [38] La vacuna se desarrolló con el nombre en código "V114". [39] Es idéntica a la PCV13, excepto que agrega los serotipos 22F y 33F. [40] Estos dos serotipos son particularmente importantes porque, después del "uso generalizado de la PCV13... [vacuna] en muchos países", estos dos serotipos ahora se encuentran "entre los principales serotipos que causan ENI en niños y adultos". [40]
Vaxneuvance está indicado para la inmunización activa para la prevención de la enfermedad invasiva causada por los serotipos 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 22F, 23F y 33F de Streptococcus pneumoniae en adultos de 18 años de edad y mayores. [9] [38] [41]
El 14 de octubre de 2021, el Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA) adoptó un dictamen positivo, recomendando la concesión de una autorización de comercialización para el medicamento Vaxneuvance, destinado a la profilaxis contra la neumonía neumocócica y la enfermedad invasiva asociada. [42] El solicitante de este medicamento es Merck Sharp & Dohme BV [42] Vaxneuvance fue aprobado para uso médico en la Unión Europea en diciembre de 2021. [13] [14]
Calendario de vacunación
Como ocurre con todas las vacunas, si están disponibles o son obligatorias y en qué circunstancias varían según las decisiones que tomen las agencias de salud pública locales.
Los niños menores de dos años no consiguen una respuesta adecuada a la vacuna neumocócica de 23 serotipos para adultos, por lo que se utiliza una vacuna antineumocócica conjugada. Aunque esta vacuna sólo cubre siete cepas de más de noventa, estas siete cepas causan entre el 80% y el 90% de los casos de enfermedad neumocócica grave, y se considera que tiene una eficacia cercana al 100% contra estas cepas. [43]
Reino Unido
El calendario de vacunación infantil del Reino Unido para los bebés nacidos después del 31 de diciembre de 2019 consta de un ciclo primario de una dosis a las doce semanas de edad y una segunda dosis al año de edad. [44] [45] Para los bebés nacidos antes del 1 de enero de 2020 y los de Escocia, el calendario de vacunación infantil consta de un ciclo primario de dos dosis a las ocho y dieciséis semanas de edad y una tercera dosis final al año de edad. [45]
Los niños con riesgo especial (por ejemplo, enfermedad de células falciformes y asplenia ) requieren la protección más completa posible utilizando la vacuna conjugada, y la vacuna polisacárida más extensa se administra después del segundo año de vida: [45]
| Edad | 2–6 meses | 7–11 meses | 12–23 meses |
| Vacuna conjugada | 3 × dosis mensuales | 2 × dosis mensuales | 2 dosis con 2 meses de diferencia |
| Dosis adicional en el segundo año de vida | |||
| Vacuna 23-valente | Luego, después del segundo cumpleaños, dosis única de 23 valentes. | ||
Estados Unidos
En 2001, los Centros para el Control y la Prevención de Enfermedades (CDC), siguiendo el consejo de su Comité Asesor sobre Prácticas de Inmunización (ACIP), recomendaron que la vacuna se administrara a todos los bebés y niños pequeños en los Estados Unidos. La demanda resultante superó la producción, lo que creó una escasez que no se resolvió hasta 2004. Todos los niños, según el calendario de vacunación de los EE. UU. , deben recibir cuatro dosis, a los dos meses, a los cuatro meses, a los seis meses y nuevamente entre el año y los quince meses de edad. [46] [47]
Los CDC actualizaron las pautas de la vacuna neumocócica para adultos de 65 años o más en 2019. [48]
En octubre de 2021, los CDC recomendaron que los adultos de 65 años o más que no hayan recibido previamente una vacuna antineumocócica conjugada o cuyo historial de vacunación previo sea desconocido deberían recibir una vacuna antineumocócica conjugada (ya sea PCV20 o PCV15). [49] Si se utiliza PCV15, esta debería ir seguida de una dosis de PPSV23. [49] Los CDC recomendaron que los adultos de 19 a 64 años con ciertas afecciones médicas subyacentes u otros factores de riesgo que no hayan recibido previamente una vacuna antineumocócica conjugada o cuyo historial de vacunación previo sea desconocido deberían recibir una vacuna antineumocócica conjugada (ya sea PCV20 o PCV15). [49]
Los CDC publicaron pautas revisadas y consolidadas en septiembre de 2023 para adultos de 19 años o más. [50]
Eficacia
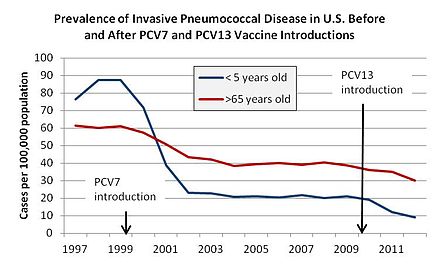
Prevnar-7 está diseñado para detener siete de los aproximadamente noventa serotipos neumocócicos que tienen el potencial de causar enfermedad neumocócica invasiva (ENI). En 2010, se introdujo una vacuna 13-valente. Cada año, la ENI mata aproximadamente a un millón de niños en todo el mundo. [52] Desde su aprobación, la eficacia de Prevnar en la prevención de la ENI ha sido documentada por una serie de estudios epidemiológicos . [53] [54] [55] Hay evidencia de que otras personas en el mismo hogar que un vacunado también se vuelven relativamente protegidas. [56] Hay evidencia de que la vacunación infantil de rutina reduce la carga de enfermedad neumocócica en adultos y especialmente adultos de alto riesgo, como aquellos que viven con VIH / SIDA . [57]
Sin embargo, la vacuna se desarrolló principalmente para la situación epidemiológica de Estados Unidos y Europa y, por lo tanto, solo tiene una cobertura limitada de los serotipos que causan infecciones neumocócicas graves en la mayoría de los países en desarrollo. [58]
Reacciones adversas
Las reacciones locales, como dolor, hinchazón o enrojecimiento, se producen en hasta el 50% de los vacunados con PCV13; de estos, el 8% se consideran graves. Las reacciones locales son más probables después de la cuarta dosis que de las dosis anteriores. [59] En ensayos clínicos, se informó fiebre superior a 100,4 °F (38 °C) a una tasa del 24-35% después de cualquier dosis de la serie primaria y los síntomas no específicos, como disminución del apetito o irritabilidad, se producen en hasta el 80% de los receptores. [59] En un estudio de enlace de datos de seguridad de la vacuna, se produjeron convulsiones febriles en aproximadamente 1 de cada 83.000 a 1 de cada 6.000 niños a los que se les administró PCV13, y en 1 de cada 21.000 a 1 de cada 2.000 de los que recibieron PCV13 y la vacuna antigripal trivalente al mismo tiempo. [59]
Evidencia que respalda la incorporación de la vacunación a los esquemas de vacunación de rutina
Tras la introducción de la vacuna antineumocócica conjugada en 2000, varios estudios describieron una disminución de la enfermedad neumocócica invasiva en los Estados Unidos. Un año después de su introducción, un grupo de investigadores encontró una disminución del 69% en la tasa de enfermedad invasiva en los niños menores de dos años de edad. [53] Para 2004, las tasas de admisión por neumonía por cualquier causa habían disminuido en un 39% (IC del 95%: 22-52) y las tasas de hospitalizaciones por meningitis neumocócica disminuyeron en un 66% (IC del 95%: 56,3-73,5) en niños menores de 2 años. [60] [61]
Las tasas de enfermedad neumocócica invasiva entre adultos también han disminuido desde la introducción de la vacuna. [53] [61]
Vacunación en países de bajos ingresos
Según la Organización Mundial de la Salud (OMS), la enfermedad neumocócica es la principal causa de muerte en niños pequeños que se puede prevenir mediante vacunación en todo el mundo. Solo en 2008, mató a más de 500.000 niños menores de cinco años. [62] Aproximadamente el noventa por ciento de estas muertes se producen en el mundo en desarrollo. [62] Históricamente, pasan entre 15 y 20 años antes de que una nueva vacuna llegue a una cuarta parte de la población del mundo en desarrollo. [63]
El Plan de desarrollo e introducción acelerados de vacunas antineumocócicas (PneumoADIP) fue un proyecto financiado por la Alianza GAVI para acelerar la introducción de vacunas antineumocócicas en países de bajos ingresos mediante asociaciones entre países, donantes, instituciones académicas, organizaciones internacionales y la industria. GAVI continúa con esta labor y, a marzo de 2013, 25 países que reúnen los requisitos y reciben apoyo de GAVI han introducido la vacuna antineumocócica conjugada. Además, otros 15 países de GAVI tienen planes de introducir la vacuna en su programa nacional de inmunización y otros 23 países han aprobado el apoyo de GAVI para introducir la vacuna. [64]
Sociedad y cultura
Estatus legal
El 16 de diciembre de 2021, el Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA) adoptó un dictamen positivo, recomendando la concesión de una autorización de comercialización para el medicamento Apexxnar, destinado a la profilaxis contra la neumonía neumocócica y la enfermedad invasiva asociada. [65] El solicitante de este medicamento es Pfizer Europe MA EEIG. [65] Apexxnar fue aprobado para uso médico en la Unión Europea en febrero de 2022. [15] [66]
Ciencias económicas
Prevnar 13 es el producto más vendido de Pfizer. [67] En 2020, sus ventas anuales ascendieron a 5.850 millones de dólares. [67] [68]
Investigación
Merck está investigando una vacuna 21-valente (cuyo nombre en código es V116) contra los serotipos del neumococo. [69] La vacuna está dirigida a personas que viven con el VIH. [69]
Referencias
- ^ ab "Actualizaciones de la base de datos de prescripción de medicamentos durante el embarazo". Therapeutic Goods Administration . 21 de diciembre de 2022. Archivado desde el original el 3 de abril de 2022 . Consultado el 2 de enero de 2023 .
- ^ ab "Vaxneuvance APMDS". Administración de Productos Terapéuticos . 24 de enero de 2022. Archivado desde el original el 5 de febrero de 2022. Consultado el 5 de febrero de 2022 .
- ^ ab "Prevenar 20". Administración de Productos Terapéuticos, Departamento de Salud y Atención a la Tercera Edad . Gobierno de Australia. Archivado desde el original el 5 de enero de 2023.
- ^ "Prevenar 20 (Pfizer Australia Pty Ltd)". Therapeutic Goods Administration . 13 de enero de 2023. Archivado desde el original el 27 de marzo de 2023 . Consultado el 9 de abril de 2023 .
- ^ "Base resumida de la decisión (SBD) para Vaxneuvance". Health Canada . 25 de febrero de 2022. Archivado desde el original el 29 de mayo de 2022 . Consultado el 29 de mayo de 2022 .
- ^ "Base resumida de la decisión - Prevnar 20". Health Canada . 31 de agosto de 2022. Archivado desde el original el 29 de septiembre de 2022 . Consultado el 22 de septiembre de 2022 .
- ^ ab "Prevnar 13-vacuna conjugada neumocócica 13-valente inyectable, suspensión". DailyMed . Archivado desde el original el 21 de agosto de 2021 . Consultado el 20 de agosto de 2021 .
- ^ "Prevnar 20: vacuna conjugada antineumocócica 20-valente inyectable, suspensión". DailyMed . Archivado desde el original el 21 de agosto de 2021 . Consultado el 20 de agosto de 2021 .
- ^ abc "Vaxneuvance: vacuna antineumocócica conjugada 15-valente, inyección adsorbida con proteína crm197, suspensión". DailyMed . Archivado desde el original el 21 de agosto de 2021 . Consultado el 20 de agosto de 2021 .
- ^ "Capvaxive: vacuna conjugada neumocócica 21-valente inyectable, solución". DailyMed . 17 de junio de 2024 . Consultado el 5 de septiembre de 2024 .
- ^ abcd «Prevenar 13 EPAR». Agencia Europea de Medicamentos (EMA) . 26 de marzo de 2020. Archivado desde el original el 26 de febrero de 2021. Consultado el 26 de marzo de 2020 .El texto se ha copiado de esta fuente, cuyos derechos de autor pertenecen a la Agencia Europea de Medicamentos. Se autoriza la reproducción siempre que se cite la fuente.
- ^ ab «Synflorix EPAR». Agencia Europea de Medicamentos (EMA) . 17 de septiembre de 2018. Archivado desde el original el 8 de enero de 2021. Consultado el 13 de julio de 2020 .
- ^ ab «EPAR de Vaxneuvance». Agencia Europea de Medicamentos (EMA) . 12 de octubre de 2021. Archivado desde el original el 18 de enero de 2022. Consultado el 17 de enero de 2022 .El texto se ha copiado de esta fuente, cuyos derechos de autor pertenecen a la Agencia Europea de Medicamentos. Se autoriza la reproducción siempre que se cite la fuente.
- ^ ab "Vaxneuvance". Registro de medicamentos de la Unión . Archivado desde el original el 11 de enero de 2022. Consultado el 11 de enero de 2022 .
- ^ ab "Apexxnar EPAR". Agencia Europea de Medicamentos (EMA) . 14 de diciembre de 2021. Archivado desde el original el 3 de marzo de 2022. Consultado el 2 de marzo de 2022 .
- ^ Organización Mundial de la Salud (2019). «Vacunas conjugadas antineumocócicas en lactantes y niños menores de 5 años: documento de posición de la OMS – febrero de 2019». Wkly Epidemiol Rec . 94 (8): 85–104. hdl :10665/310970.
- ^ "Resumen del documento de posición de la OMS sobre las vacunas antineumocócicas conjugadas en lactantes y niños menores de 5 años, febrero de 2019" (PDF) . Organización Mundial de la Salud (OMS) . 21 de abril de 2019. Archivado desde el original (PDF) el 8 de marzo de 2022.
- ^ abcdef «PREVNAR 20: vacuna conjugada antineumocócica 20-valente inyectable, suspensión: Wyeth Pharmaceutical Division de Wyeth Holdings LLC». Filadelfia, PA: Wyeth Pharmaceuticals, LLC (una subsidiaria de Pfizer Inc.). Junio de 2021. p. 11. Archivado desde el original el 5 de septiembre de 2022. Consultado el 9 de agosto de 2022 .
- ^ ab "Capvaxive". Administración de Alimentos y Medicamentos de Estados Unidos . 17 de junio de 2024. Archivado desde el original el 18 de junio de 2024. Consultado el 18 de junio de 2024 .
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ "La FDA de EE. UU. aprueba Capvaxive (vacuna conjugada antineumocócica 21-valente) para la prevención de la enfermedad neumocócica invasiva y la neumonía neumocócica en adultos" (Comunicado de prensa). Merck. 17 de junio de 2024. Consultado el 18 de junio de 2024 a través de Business Wire.
- ^ "Perfiles de vacunas conjugadas antineumocócicas respaldadas por Gavi para respaldar la toma de decisiones en los países" (PDF) . GAVI. 2019. Archivado (PDF) del original el 19 de mayo de 2020 . Consultado el 8 de abril de 2020 .
- ^ "Pneumosil, la nueva vacuna antineumocócica, obtiene la precalificación de la OMS, un paso clave para mejorar el acceso y la asequibilidad" (Comunicado de prensa). Serum Institute of India . PR Newswire. 28 de enero de 2020. Archivado desde el original el 17 de abril de 2021. Consultado el 8 de abril de 2020 .
- ^ "Resumen de la FDA: 28 de abril de 2023". Administración de Alimentos y Medicamentos de Estados Unidos . 28 de abril de 2023. Archivado desde el original el 29 de abril de 2023. Consultado el 29 de abril de 2023 .
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ "Actualizaciones del ACIP: Recomendaciones para el uso de la vacuna antineumocócica conjugada de 20 valencias en niños ― Estados Unidos, 2023". MMWR. Informe semanal de morbilidad y mortalidad . 72 (39): 1072. Septiembre de 2023. doi :10.15585/mmwr.mm7239a5. ISSN 0149-2195. PMC 10545431 . PMID 37768876. Archivado desde el original el 8 de octubre de 2023 . Consultado el 25 de octubre de 2023 .
- ^ "Actualizaciones del ACIP: Recomendaciones para el uso de la vacuna antineumocócica conjugada de 20 valencias en niños ― Estados Unidos, 2023". Archivado desde el original el 11 de diciembre de 2023 . Consultado el 10 de marzo de 2024 .
- ^ "Prevnar 13". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 1 de marzo de 2018. STN 125324. Archivado desde el original el 27 de noviembre de 2019. Consultado el 27 de septiembre de 2019 .
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ ab "La FDA aprueba la vacuna contra la enfermedad neumocócica con una protección más amplia" (Comunicado de prensa). 24 de febrero de 2010. Archivado desde el original el 11 de septiembre de 2010 . Consultado el 9 de septiembre de 2010 .
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ "Pfizer y Wyeth se unen: trabajan juntos por un mundo más saludable". Pfizer (nota de prensa). 15 de octubre de 2009. Archivado desde el original el 15 de diciembre de 2022. Consultado el 15 de diciembre de 2022 .
- ^ "Prevnar 13". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 12 de marzo de 2010. Archivado desde el original el 12 de marzo de 2010. Consultado el 27 de noviembre de 2019 .
{{cite web}}: CS1 maint: URL no apta ( enlace ) Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ "El Comité Asesor sobre Prácticas de Inmunización vota a favor de recomendar la vacuna Prevnar 13 de Pfizer para adultos de 65 años o más". MarketWatch.com . 13 de agosto de 2014. Archivado desde el original el 4 de marzo de 2016 . Consultado el 27 de abril de 2017 .
- ^ "Prevnar". Administración de Alimentos y Medicamentos de Estados Unidos (FDA). 24 de agosto de 2009. Archivado desde el original el 22 de julio de 2017. Consultado el 29 de septiembre de 2022 .
- ^ "Carta de aprobación del 17 de febrero de 2000". Administración de Alimentos y Medicamentos de Estados Unidos (FDA). Archivado desde el original el 10 de julio de 2009.
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ "Vacunación neumocócica: lo que todo el mundo debería saber". Centros para el Control y la Prevención de Enfermedades (CDC) de EE. UU. 24 de enero de 2022. Archivado desde el original el 12 de noviembre de 2019. Consultado el 15 de diciembre de 2022 .
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ "Cuadro de evidencias y recomendaciones del SAGE de la OMS" (PDF) . Organización Mundial de la Salud (OMS). Archivado (PDF) del original el 9 de mayo de 2021 . Consultado el 6 de abril de 2020 .
- ^ "Descripción del fármaco Prevnar (conjugado neumocócico 7-valente): medicamentos de venta con receta y medicamentos en RxList". Archivado desde el original el 11 de diciembre de 2007. Consultado el 21 de noviembre de 2007 .
- ^ "Documento EMEA" (PDF) . Emea.europa.eu . Archivado desde el original (PDF) el 19 de febrero de 2009 . Consultado el 27 de abril de 2017 .
- ^ "GSK Release". Gsk.com (Nota de prensa). Archivado desde el original el 4 de agosto de 2009. Consultado el 27 de abril de 2017 .
- ^ ab "Vaxneuvance". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 30 de julio de 2021. Archivado desde el original el 21 de agosto de 2021. Consultado el 20 de agosto de 2021 .
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ "GRADE: vacuna antineumocócica conjugada 15-valente (PCV15) en serie con vacuna antineumocócica conjugada 23-valente (PPSV23) para adultos ≥65 años". Centros para el Control y la Prevención de Enfermedades (CDC) de EE. UU . . 27 de enero de 2022. Archivado desde el original el 9 de agosto de 2022 . Consultado el 9 de agosto de 2022 .
- ^ ab Stacey HL, Rosen J, Peterson JT, Williams-Diaz A, Gakhar V, Sterling TM, et al. (2019). "Seguridad e inmunogenicidad de la vacuna antineumocócica conjugada 15-valente (PCV-15) en comparación con la PCV-13 en adultos mayores sanos". Vacunas humanas e inmunoterapias . 15 (3): 530–539. doi :10.1080/21645515.2018.1532249. PMC 6605726. PMID 30648919 .
- ^ "Merck anuncia la aprobación por parte de la FDA de EE. UU. de Vaxneuvance (vacuna conjugada antineumocócica 15-valente) para la prevención de la enfermedad neumocócica invasiva en personas de 6 semanas de edad o más causada por 15 serotipos" (Comunicado de prensa). Merck. 16 de julio de 2021. Archivado desde el original el 21 de agosto de 2021. Consultado el 20 de agosto de 2021 – vía Business Wire.
- ^ ab «Vaxneuvance: pendiente de decisión de la CE». Agencia Europea de Medicamentos (EMA) . 13 de octubre de 2021. Archivado desde el original el 18 de octubre de 2021. Consultado el 15 de octubre de 2021 .El texto se ha copiado de esta fuente, cuyos derechos de autor pertenecen a la Agencia Europea de Medicamentos. Se autoriza la reproducción siempre que se cite la fuente.
- ^ "Enfermedad neumocócica infantil". 21 de marzo de 2006. Archivado desde el original el 25 de octubre de 2006.- información sobre la enfermedad y la vacuna Prevnar, del gobierno del estado de Victoria (Australia). Incluye posibles efectos secundarios.
- ^ "Vacunas del NHS y cuándo administrarlas". 31 de julio de 2019. Archivado desde el original el 17 de diciembre de 2021. Consultado el 3 de septiembre de 2021 .
- ^ abcd Ramsay M, ed. (enero de 2020). «Capítulo 25: Neumococo». Inmunización contra enfermedades infecciosas. Public Health England. Archivado desde el original el 12 de noviembre de 2019. Consultado el 3 de septiembre de 2021 .
- ^ "Calendario de vacunación recomendado para niños y adolescentes de 18 años o menos, Estados Unidos, 2019". Centros para el Control y la Prevención de Enfermedades (CDC) . 5 de febrero de 2019. Archivado desde el original el 6 de marzo de 2016. Consultado el 3 de noviembre de 2019 .
- ^ Nuorti JP, Whitney CG (diciembre de 2010). "Prevención de la enfermedad neumocócica en lactantes y niños: uso de la vacuna conjugada neumocócica 13-valente y la vacuna polisacárida neumocócica 23-valente: recomendaciones del Comité Asesor sobre Prácticas de Inmunización (ACIP)" (PDF) . MMWR. Recomendaciones e informes . 59 (RR-11): 1–18. PMID 21150868. Archivado (PDF) del original el 2 de septiembre de 2021 . Consultado el 20 de noviembre de 2021 .
- ^ Matanock A, Lee G, Gierke R, Kobayashi M, Leidner A, Pilishvili T (noviembre de 2019). "Uso de la vacuna antineumocócica conjugada 13-valente y la vacuna antineumocócica polisacárida 23-valente entre adultos ≥65 años: recomendaciones actualizadas del Comité Asesor sobre Prácticas de Inmunización" (PDF) . MMWR. Informe semanal de morbilidad y mortalidad . 68 (46): 1069–1075. doi :10.15585/mmwr.mm6846a5. PMC 6871896 . PMID 31751323. Archivado (PDF) del original el 20 de noviembre de 2021 . Consultado el 20 de noviembre de 2021 .
- ^ abc «Recomendaciones y calendarios de vacunación del ACIP». Centros para el Control y la Prevención de Enfermedades (CDC) . Archivado desde el original el 20 de noviembre de 2021. Consultado el 19 de noviembre de 2021 .
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ Kobayashi M, Pilishvili T, Farrar JL, Leidner AJ, Gierke R, Prasad N, et al. (septiembre de 2023). "Vacuna antineumocócica para adultos ≥19 años: recomendaciones del Comité Asesor sobre Prácticas de Inmunización, Estados Unidos, 2023". MMWR. Recomendaciones e informes . 72 (3): 1–39. doi :10.15585/mmwr.rr7203a1. PMC 10495181 . PMID 37669242.
- ^ "CDC - ABCs: Página principal de informes de vigilancia - Vigilancia activa del núcleo bacteriano". 19 de julio de 2021. Archivado desde el original el 1 de diciembre de 2020. Consultado el 10 de septiembre de 2017 .
- ^ Allen A (21 de junio de 2007). "¿Qué sucede si una vacuna deja espacio para una nueva cepa de una enfermedad?". Slate.com . Archivado desde el original el 18 de mayo de 2011. Consultado el 27 de abril de 2017 .
- ^ abc Whitney CG, Farley MM, Hadler J, Harrison LH, Bennett NM, Lynfield R, et al. (mayo de 2003). "Disminución de la enfermedad neumocócica invasiva después de la introducción de la vacuna conjugada proteína-polisacárido". The New England Journal of Medicine . 348 (18): 1737–1746. doi : 10.1056/NEJMoa022823 . PMID 12724479.
- ^ Poehling KA, Talbot TR, Griffin MR, Craig AS, Whitney CG, Zell E, et al. (abril de 2006). "Enfermedad neumocócica invasiva en lactantes antes y después de la introducción de la vacuna neumocócica conjugada". JAMA . 295 (14): 1668–1674. doi :10.1001/jama.295.14.1668. PMID 16609088.
- ^ Whitney CG, Pilishvili T, Farley MM, Schaffner W, Craig AS, Lynfield R, et al. (octubre de 2006). "Efectividad de la vacuna conjugada neumocócica heptavalente contra la enfermedad neumocócica invasiva: un estudio de casos y controles emparejados". Lancet . 368 (9546): 1495–1502. doi :10.1016/S0140-6736(06)69637-2. PMID 17071283. S2CID 11834808. Archivado desde el original el 5 de diciembre de 2020 . Consultado el 5 de julio de 2019 .
- ^ Millar EV, Watt JP, Bronsdon MA, Dallas J, Reid R, Santosham M, et al. (octubre de 2008). "Efecto indirecto de la vacuna conjugada antineumocócica heptavalente en la colonización neumocócica entre miembros del hogar no vacunados". Enfermedades infecciosas clínicas . 47 (8): 989–996. doi : 10.1086/591966 . PMID 18781875.
- ^ Siemieniuk RA, Gregson DB, Gill MJ (noviembre de 2011). "La carga persistente de la enfermedad neumocócica invasiva en pacientes con VIH: un estudio de cohorte observacional". BMC Infectious Diseases . 11 : 314. doi : 10.1186/1471-2334-11-314 . PMC 3226630 . PMID 22078162.
- ^ Barocchi MA, Censini S, Rappuoli R (abril de 2007). "Vacunas en la era de la genómica: el desafío neumocócico". Vaccine . 25 (16): 2963–2973. doi :10.1016/j.vaccine.2007.01.065. PMID 17324490.
- ^ abc Gierke R, Wodi P, Kobayashi M, Hall E, Hamborsky J. "Pinkbook Pneumococcal Epidemiology of Vaccine-Preventable Diseases". Centros para el Control y la Prevención de Enfermedades (CDC) de EE. UU . Archivado desde el original el 1 de septiembre de 2022. Consultado el 10 de diciembre de 2017 .
- ^ Grijalva CG, Nuorti JP, Arbogast PG, Martin SW, Edwards KM, Griffin MR (abril de 2007). "Disminución de las admisiones por neumonía después de la inmunización infantil de rutina con la vacuna antineumocócica conjugada en los EE. UU.: un análisis de series temporales". Lancet . 369 (9568): 1179–1186. doi :10.1016/S0140-6736(07)60564-9. PMID 17416262. S2CID 26494828.
- ^ ab Tsai CJ, Griffin MR, Nuorti JP, Grijalva CG (junio de 2008). "Cambios en la epidemiología de la meningitis neumocócica después de la introducción de la vacuna neumocócica conjugada en los Estados Unidos". Clinical Infectious Diseases . 46 (11): 1664–1672. doi :10.1086/587897. PMC 4822508 . PMID 18433334.
- ^ ab O'Brien KL, Wolfson LJ, Watt JP, Henkle E, Deloria-Knoll M, McCall N, et al. (septiembre de 2009). "Carga de enfermedad causada por Streptococcus pneumoniae en niños menores de 5 años: estimaciones globales". Lancet . 374 (9693): 893–902. doi :10.1016/S0140-6736(09)61204-6. PMID 19748398. S2CID 18964449.
- ^ "PneumoADIP - Necesidad de PneumoADIP". Pneumoasdip.com . Archivado desde el original el 27 de agosto de 2021 . Consultado el 27 de abril de 2017 .
- ^ Johns Hopkins Bloomberg School of Public Health, International Vaccine Access Center (2013). "Informe VIMS: Introducción mundial de vacunas" (PDF) . Jhsph.edu . Archivado (PDF) del original el 3 de marzo de 2016 . Consultado el 27 de abril de 2017 .
- ^ ab «Apexxnar: pendiente de decisión de la CE». Agencia Europea de Medicamentos (EMA) . 15 de diciembre de 2021. Archivado desde el original el 17 de diciembre de 2021. Consultado el 18 de diciembre de 2021 .El texto se ha copiado de esta fuente, cuyos derechos de autor pertenecen a la Agencia Europea de Medicamentos. Se autoriza la reproducción siempre que se cite la fuente.
- ^ «Información del producto Apexxnar». Registro de medicamentos de la Unión . Archivado desde el original el 4 de marzo de 2023. Consultado el 3 de marzo de 2023 .
- ^ ab "Pfizer Inc. 2020 Form 10-K Annual Report" (PDF) . Pfizer. Archivado (PDF) del original el 23 de marzo de 2021 . Consultado el 21 de agosto de 2021 .
- ^ Herper M (24 de agosto de 2020). «En la carrera por una vacuna contra la COVID-19, Pfizer recurre a un científico con experiencia en desafiar a los escépticos y obtener resultados». Stat News . Archivado desde el original el 21 de diciembre de 2020 . Consultado el 2 de diciembre de 2020 .
- ^ ab "Seguridad e inmunogenicidad de V116 en adultos que viven con el virus de inmunodeficiencia humana (VIH) (V116-007, STRIDE-7)". ClinicalTrials.gov . 26 de mayo de 2022. Archivado desde el original el 9 de agosto de 2022 . Consultado el 29 de septiembre de 2022 .
Lectura adicional
- Centros para el Control y la Prevención de Enfermedades (2015). "Capítulo 17: Enfermedad neumocócica". En Hamborsky J, Kroger A, Wolfe S (eds.). Epidemiología y prevención de enfermedades prevenibles por vacunación (13.ª ed.). Washington, DC: Fundación de Salud Pública.
Enlaces externos
- "Declaración informativa sobre la vacuna antineumocócica conjugada". Centros para el Control y la Prevención de Enfermedades (CDC) de EE. UU . . 11 de mayo de 2023.

