Respuesta de proteína desplegada
Este artículo incluye una lista de referencias generales , pero carece de suficientes citas en línea correspondientes . ( Septiembre de 2012 ) |
La respuesta de proteína desplegada ( UPR ) es una respuesta de estrés celular relacionada con el estrés del retículo endoplásmico (RE). [1] Se ha descubierto que se conserva entre especies de mamíferos , [2] así como en levaduras [1] [3] y organismos de gusanos.
La UPR se activa en respuesta a una acumulación de proteínas desdobladas o mal plegadas en el lumen del retículo endoplasmático. En este escenario, la UPR tiene tres objetivos: inicialmente restaurar la función normal de la célula deteniendo la traducción de proteínas , degradando las proteínas mal plegadas y activando las vías de señalización que conducen a aumentar la producción de chaperonas moleculares involucradas en el plegamiento de proteínas . Si estos objetivos no se logran en un cierto lapso de tiempo o la interrupción se prolonga, la UPR apunta hacia la apoptosis .
La sobreactivación sostenida de la UPR se ha relacionado con enfermedades priónicas , así como con varias otras enfermedades neurodegenerativas , y la inhibición de la UPR podría convertirse en un tratamiento para esas enfermedades. [4] Las enfermedades susceptibles de inhibición de la UPR incluyen la enfermedad de Creutzfeldt-Jakob , la enfermedad de Alzheimer , la enfermedad de Parkinson y la enfermedad de Huntington . [5] [6]
Plegamiento de proteínas en el retículo endoplasmático
Síntesis de proteínas
El término plegamiento de proteínas incorpora todos los procesos involucrados en la producción de una proteína después de que los polipéptidos nacientes hayan sido sintetizados por los ribosomas . Las proteínas destinadas a ser secretadas o clasificadas a otros orgánulos celulares llevan una secuencia de señal N-terminal que interactuará con una partícula de reconocimiento de señal (SRP). La SRP conducirá todo el complejo ( ribosoma , ARN , polipéptido ) a la membrana del RE. Una vez que la secuencia se ha "acoplado", la proteína continúa la traducción, y la cadena resultante se alimenta a través del translocador de polipéptidos directamente al RE. El plegamiento de proteínas comienza tan pronto como el polipéptido ingresa al entorno luminal, incluso mientras continúa la traducción del polipéptido restante.
Control de calidad y plegamiento de proteínas
Los pasos de plegamiento de proteínas involucran una variedad de enzimas y chaperonas moleculares para coordinar y regular las reacciones, además de una variedad de sustratos necesarios para que las reacciones tengan lugar. Los más importantes a tener en cuenta son la glicosilación ligada a N y la formación de enlaces disulfuro. La glicosilación ligada a N ocurre tan pronto como la secuencia de proteína pasa al RE a través del translocón , donde se glicosila con una molécula de azúcar que forma el ligando clave para las moléculas de lectina calreticulina (CRT; soluble en el lumen del RE) y calnexina (CNX; unida a la membrana). [7] Favorecidas por el entorno altamente oxidante del RE, las isomerasas disulfuro de proteínas facilitan la formación de enlaces disulfuro, que confieren estabilidad estructural a la proteína para que resista condiciones adversas como extremos de pH y enzimas degradativas .
El RE es capaz de reconocer proteínas mal plegadas sin causar una interrupción en el funcionamiento del RE. La molécula de azúcar antes mencionada sigue siendo el medio por el cual la célula monitorea el plegamiento de proteínas, ya que la proteína mal plegada se vuelve característicamente desprovista de residuos de glucosa, y se dirige a ella para su identificación y re-glicosilación por la enzima UGGT (UDP-glucosa:glicoproteína glucosiltransferasa). [7] Si esto no logra restaurar el proceso de plegamiento normal, los residuos hidrofóbicos expuestos de la proteína mal plegada son unidos por la proteína reguladora de glucosa 78 (Grp78), un miembro de la familia de proteínas de choque térmico de 70 kDa [8] que evita que la proteína continúe su tránsito y secreción. [9]
Cuando las circunstancias continúan causando que una proteína particular se pliegue incorrectamente, la proteína se reconoce como una amenaza para el funcionamiento adecuado del RE, ya que pueden agregarse entre sí y acumularse. En tales circunstancias, la proteína es guiada a través de la degradación asociada al retículo endoplasmático ( ERAD ). La chaperona EDEM guía la retrotranslocación de la proteína mal plegada de regreso al citosol en complejos transitorios con PDI y Grp78. [10] Aquí ingresa a la vía ubiquitina-proteasoma, ya que está marcada por múltiples moléculas de ubiquitina, dirigiéndola para su degradación por proteasomas citosólicos.
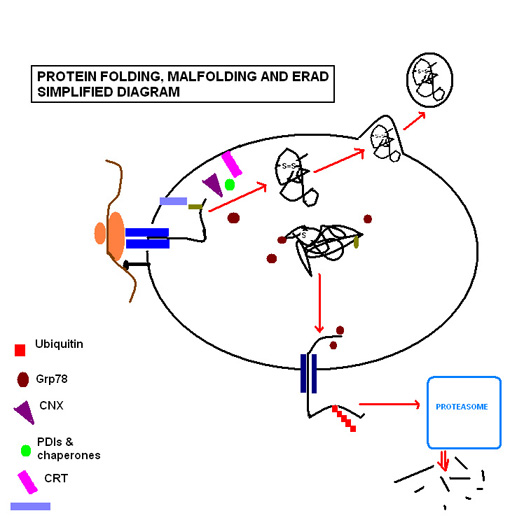
El plegamiento exitoso de proteínas requiere un entorno estrictamente controlado de sustratos que incluyen glucosa para satisfacer los requisitos de energía metabólica de las chaperonas moleculares funcionales; calcio que se almacena unido a las chaperonas moleculares residentes; y tampones redox que mantienen el entorno oxidante necesario para la formación de enlaces disulfuro. [11]
El plegamiento de proteínas no exitoso puede ser causado por HLA-B27 , que altera el equilibrio de proteínas de señalización importantes ( IL-10 y TNF ). Al menos algunas alteraciones dependen del plegamiento correcto de HLA-B27. [12]
Sin embargo, cuando las circunstancias provocan una alteración más global del plegamiento de proteínas que sobrepasa los mecanismos de afrontamiento del RE, se activa la UPR.
Mecanismo molecular
Iniciación
La chaperona molecular BiP/Grp78 tiene una variedad de funciones dentro del RE. Mantiene proteínas receptoras transmembrana específicas involucradas en la iniciación de la señalización descendente del UPR en un estado inactivo mediante la unión a sus dominios luminales. Una carga abrumadora de proteínas mal plegadas o simplemente la sobreexpresión de proteínas (por ejemplo, IgG) [13] requiere que más BiP/Grp78 disponible se una a las regiones hidrofóbicas expuestas de estas proteínas y, en consecuencia, BiP/Grp78 se disocia de estos sitios receptores para cumplir con este requisito. La disociación de los dominios receptores intracelulares les permite volverse activos. PERK dimeriza con BiP en células en reposo y oligomeriza en células estresadas por el RE.
Aunque este es el modelo tradicionalmente aceptado, se han planteado dudas sobre su validez. Se ha argumentado que la evidencia genética y estructural que respalda el modelo simplemente muestra que la disociación de BiP está meramente correlacionada con la activación de Ire1 , en lugar de causarla específicamente. [14] Se ha propuesto un modelo alternativo, mediante el cual las proteínas desplegadas interactúan directamente con el dominio luminal del RE de Ire1, causando oligomerización y transautofosforilación. [14] Sin embargo, estos modelos no son mutuamente excluyentes, también es posible que tanto la interacción directa de Ire1 con proteínas desplegadas como la disociación de BiP de IRE1 contribuyan a la activación de la vía de Ire1.
Funciones
Las fases iniciales de activación de la UPR tienen dos funciones clave:
Atenuación de la traducción y detención del ciclo celular por el receptor PERK Esto ocurre en cuestión de minutos u horas después de la activación de UPR para evitar una mayor carga traduccional del RE. PERK (proteína quinasa quinasa del retículo endoplásmico similar al ARN) se activa por oligomerización y autofosforilación del dominio luminal libre. El dominio citosólico activado causa atenuación traduccional al fosforilar directamente la subunidad α del iniciador regulador de la maquinaria de traducción del ARNm, eIF2. [15] Esto también produce atenuación traduccional de la maquinaria proteica involucrada en el funcionamiento del ciclo celular, produciendo detención del ciclo celular en la fase G1. [16] La deficiencia de PERK puede tener un impacto significativo en los estados fisiológicos asociados con el estrés del RE .

Aumento de la producción de proteínas implicadas en las funciones del UPR La activación del UPR también produce una regulación positiva de las proteínas implicadas en el acompañamiento de las proteínas mal plegadas, el plegamiento de proteínas y el ERAD, incluida una mayor producción de Grp78. En última instancia, esto aumenta los mecanismos moleculares de la célula mediante los cuales puede lidiar con la carga de proteínas mal plegadas. Estas proteínas receptoras se han identificado como:
- Quinasa 1 que requiere inositol, [17] cuyo dominio luminal libre se activa por homodimerización y transautofosforilación. [18] El dominio activado es capaz de activar el ARNm del factor de transcripción XBP1 (proteína de unión a Xbox) (el equivalente mamífero del ARNm Hac1 de levadura) mediante la escisión y eliminación de un intrón de 26 pb. El factor de transcripción activado regula positivamente los "genes de estrés" de UPR uniéndose directamente a los promotores de elementos de estrés en el núcleo. [19]
- El factor de transcripción activador 6 (ATF6) es un factor de transcripción con cremallera de leucina básico. [20] Tras la disociación de Grp78, la proteína completa de 90 kDa se transloca al Golgi, donde es escindida por proteasas para formar un factor de transcripción activo de 50 kDa [21] que se transloca al núcleo. Se une a los promotores de elementos de estrés antes de los genes que están regulados positivamente en el UPR. [22]
El objetivo de estas respuestas es eliminar la carga de proteínas acumulada y, al mismo tiempo, evitar que se añada más estrés, de modo que se pueda restablecer la función normal del RE lo antes posible.
Si la vía UPR se activa de forma anormal, como cuando la obesidad desencadena un estrés crónico del RE y la vía está activa de forma constitutiva, esto puede provocar insensibilidad a la señalización de la insulina y, por lo tanto, resistencia a la insulina. Las personas que padecen obesidad tienen una mayor demanda de los sistemas de secreción y síntesis de sus células. Esto activa la señalización del estrés celular y las vías inflamatorias debido a las condiciones anormales que alteran la homeostasis del RE.
Un efecto secundario del estrés del RE es una disminución significativa en la fosforilación estimulada por insulina de los residuos de tirosina del sustrato del receptor de insulina (IRS-1), que es el sustrato de la insulina tirosina quinasa (el receptor de insulina). La quinasa N-terminal C-Jun (JNK) también es activada en niveles altos por IRE-1α, que a su vez es fosforilada para activarse en presencia de estrés del RE. Posteriormente, JNK fosforila residuos de serina de IRS-1 y, por lo tanto, inhibe la señalización del receptor de insulina. IRE-1α también recluta el factor 2 asociado al receptor del factor de necrosis tumoral ( TRAF2 ). Esta cascada de quinasas que depende de IRE-1α y JNK media la inhibición inducida por el estrés del RE de la acción de la insulina. [23]
La obesidad proporciona estímulos celulares crónicos para la vía UPR como resultado de las tensiones y presiones que se ejercen sobre el RE, y sin permitir la restauración de la capacidad de respuesta celular normal a la señalización de la hormona insulina, es muy probable que un individuo desarrolle diabetes tipo 2.
Los músculos esqueléticos son sensibles al estrés fisiológico, ya que el ejercicio puede alterar la homeostasis del RE. Esto hace que la expresión de chaperonas del RE sea inducida por la UPR en respuesta al estrés del RE inducido por el ejercicio . La contracción muscular durante el ejercicio hace que se libere calcio del retículo sarcoplásmico (SR), una red especializada del RE en los músculos esqueléticos. Este calcio luego interactúa con la calcineurina y las quinasas dependientes de calcio/calmodulina que a su vez activan factores de transcripción. Estos factores de transcripción luego proceden a alterar la expresión de genes musculares regulados por el ejercicio. PGC-1alpha , un coactivador transcripcional, es un factor de transcripción clave involucrado en la mediación de la UPR de una manera específica de tejido en los músculos esqueléticos al coactivar ATF6alpha. Por lo tanto, PGC-1alpha se expresa en los músculos después del entrenamiento físico agudo y de largo plazo. La función de este factor de transcripción es aumentar el número y la función de las mitocondrias, así como inducir un cambio de las fibras esqueléticas a fibras musculares oxidativas lentas, ya que estas son resistentes a la fatiga. Por lo tanto, esta vía UPR media los cambios en los músculos que han sufrido un entrenamiento de resistencia haciéndolos más resistentes a la fatiga y protegiéndolos del estrés futuro. [24]
Iniciando la apoptosis
En condiciones de estrés prolongado, el objetivo del UPR cambia de ser el de promover la supervivencia celular a uno que comprometa a la célula a una vía de apoptosis. Se ha identificado que las proteínas que se encuentran aguas abajo de las tres vías del receptor UPR tienen funciones proapoptóticas. Sin embargo, todavía no se ha determinado el punto en el que se activa el "interruptor apoptótico", pero es lógico considerar que esto debería ocurrir después de un cierto período de tiempo en el que no se ha logrado la resolución del estrés. Los dos principales receptores UPR involucrados son Ire1 y PERK.
Al unirse con la proteína TRAF2, Ire1 activa una vía de señalización JNK, [25] momento en el que se cree que la procaspasa 4 humana causa apoptosis al activar las caspasas posteriores.
Aunque se sabe que PERK produce un bloqueo de la traducción, ciertos genes pueden evitar este bloqueo. Un ejemplo importante es que la proteína proapoptótica CHOP ( proteína homóloga de la proteína de unión al potenciador CCAAT ), se regula positivamente aguas abajo del factor de transcripción bZIP ATF4 (factor de transcripción activador 4) y responde de manera única al estrés del RE. [26] CHOP provoca la regulación negativa de la proteína mitocondrial antiapoptótica Bcl-2, [27] lo que favorece un impulso proapoptótico en las mitocondrias por parte de proteínas que causan daño mitocondrial, liberación de citocromo c y activación de la caspasa 3.
Enfermedades
Las enfermedades que pueden inhibirse mediante la UPR incluyen la enfermedad de Creutzfeldt-Jakob , la enfermedad de Alzheimer , la enfermedad de Parkinson y la enfermedad de Huntington . [28]
Se ha informado que el estrés del retículo endoplasmático desempeña un papel importante en la inducción y progresión de la enfermedad del hígado graso no alcohólico (NAFLD). Las ratas alimentadas con una dieta rica en grasas mostraron un aumento de los marcadores de estrés del RE CHOP , XBP1 y GRP78 . Se sabe que el estrés del RE activa la lipogénesis hepática de novo, inhibe la secreción de VLDL, promueve la resistencia a la insulina y el proceso inflamatorio y promueve la apoptosis celular. Por lo tanto, aumenta el nivel de acumulación de grasa y empeora la NAFLD a un estado hepático más grave. [29] Se informó que el extracto de Zingiber officinale (jengibre) y los ácidos grasos omega-3 mejoran el estrés del retículo endoplasmático en un modelo de rata con hígado graso no alcohólico. [29]
Como se indicó anteriormente, la UPR también puede activarse como un mecanismo compensatorio en estados patológicos. Por ejemplo, la UPR se regula positivamente en una forma hereditaria de miocardiopatía dilatada debido a una mutación en el gen que codifica la proteína Phospholamban. [30] Una mayor activación resultó terapéutica en un modelo de células madre pluripotentes inducidas humanas de miocardiopatía dilatada con mutación PLN. [30]
Inductores químicos
- La brefeldina A es un inductor muy común de la respuesta de la proteína desplegada o respuesta al estrés del retículo endoplásmico (estrés del RE) .
- La thapsigargina [31] conduce a un agotamiento de Ca 2+ del RE debido a la inhibición de la Ca 2+ -ATPasa del retículo sarcoplasmático (SERCA).
- A23187 [31] regula positivamente la expresión de proteínas de estrés del RE
- 2-desoxiglucosa [31]
- El ditiotreitol [31] reduce los puentes disulfuro de las proteínas. Las proteínas desnaturalizadas se acumulan dentro del RE.
- La fenretinida y el bortezomib (Velcade), cada uno actuando a través de diferentes mecanismos celulares, inducen estrés del RE, lo que conduce a la apoptosis en las células de melanoma.
- La tunicamicina inhibe la N-glicosilación.
Inductores biológicos
- El virus del dengue induce estrés del ER dependiente de PERK como parte de la respuesta inducida por el virus en las células infectadas para favorecer la replicación. [32]
- El virus de la influenza requiere la proteína del retículo endoplásmico 57-kD (ERp57) para la replicación y la inducción de la apoptosis en las células infectadas. [33]
Véase también
- Respuesta al estrés del retículo endoplásmico (estrés del RE)
- Respuesta de la proteína desplegada mitocondrial
- Agresivo
- Inhibidores de PERK
Referencias
- ^ ab Hetz C, Papa FR (enero de 2018). "La respuesta de las proteínas desplegadas y el control del destino celular". Molecular Cell . 69 (2): 169–181. doi : 10.1016/j.molcel.2017.06.017 . PMID 29107536.
- ^ "Breve charla de Peter Walter: El desarrollo de la EPU". Archivado desde el original el 12 de julio de 2017. Consultado el 24 de octubre de 2013 .
- ^ Kannan M, Sivaprakasam C, Prinz WA, Nachiappan V (diciembre de 2016). "El estrés del retículo endoplasmático afecta el transporte de fosfatidiletanolamina desde la mitocondria al retículo endoplasmático en S. cerevisiae". Biochimica et Biophysica Acta (BBA) - Biología molecular y celular de los lípidos . 1861 (12 Pt A): 1959–1967. doi :10.1016/j.bbalip.2016.09.015. PMC 6322925. PMID 27678054 .
- ^ Moreno JA, Halliday M, Molloy C, Radford H, Verity N, Axten JM, et al. (octubre de 2013). "El tratamiento oral dirigido a la respuesta de la proteína desplegada previene la neurodegeneración y la enfermedad clínica en ratones infectados con priones". Science Translational Medicine . 5 (206): 206ra138. doi :10.1126/scitranslmed.3006767. PMID 24107777. S2CID 25570626.
- ^ Scheper W, Hoozemans JJ (septiembre de 2015). "La respuesta de la proteína desplegada en enfermedades neurodegenerativas: una perspectiva neuropatológica". Acta Neuropathologica . 130 (3): 315–31. doi :10.1007/s00401-015-1462-8. PMC 4541706 . PMID 26210990.
- ^ Lakkaraju AK, Frontzek K, Lemes E, Herrmann U, Losa M, Marpakwar R, Aguzzi A (septiembre de 2021). "La pérdida de PIKfyve impulsa la degeneración espongiforme en las enfermedades priónicas". EMBO Molecular Medicine . 13 (9): e14714. doi :10.15252/emmm.202114714. PMC 8518562 . PMID 34291577.
- ^ ab Blond-Elguindi S, Cwirla SE, Dower WJ, Lipshutz RJ, Sprang SR, Sambrook JF, Gething MJ (noviembre de 1993). "La selección por afinidad de una biblioteca de péptidos que se muestran en bacteriófagos revela la especificidad de unión de BiP". Cell . 75 (4): 717–28. doi : 10.1016/0092-8674(93)90492-9 . PMID 7902213.
- ^ Brewer JW, Diehl JA (noviembre de 2000). "PERK media la salida del ciclo celular durante la respuesta de la proteína desplegada en los mamíferos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 97 (23): 12625–30. Bibcode :2000PNAS...9712625B. doi : 10.1073/pnas.220247197 . PMC 18814 . PMID 11035797.
- ^ Chen X, Shen J, Prywes R (abril de 2002). "El dominio luminal de ATF6 detecta el estrés del retículo endoplasmático (RE) y provoca la translocación de ATF6 desde el RE al Golgi". The Journal of Biological Chemistry . 277 (15): 13045–52. doi : 10.1074/jbc.M110636200 . PMID 11821395.
- ^ Cox JS, Shamu CE, Walter P (junio de 1993). "La inducción transcripcional de genes que codifican proteínas residentes en el retículo endoplásmico requiere una proteína quinasa transmembrana". Cell . 73 (6): 1197–206. doi :10.1016/0092-8674(93)90648-A. PMID 8513503. S2CID 16065404.
- ^ Hammond C, Braakman I, Helenius A (febrero de 1994). "Función del reconocimiento de oligosacáridos ligados a N, el recorte de glucosa y la calnexina en el plegamiento de la glucoproteína y el control de calidad". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 91 (3): 913–7. Bibcode :1994PNAS...91..913H. doi : 10.1073/pnas.91.3.913 . PMC 521423 . PMID 8302866.
- ^ LL Markus Penttinen (10 de enero de 2004). HLA-B27 asociado con resistencia debilitada de bacterias de salmonela (en finlandés). Biblioteca de la Universidad de Turku: Ann. Univ. Turkuensis D 619. ISBN 951-29-2742-X. Archivado desde el original el 6 de enero de 2013 . Consultado el 9 de octubre de 2012 .
- ^ Kober L, Zehe C, Bode J (octubre de 2012). "Desarrollo de un nuevo sistema de selección basado en el estrés del ER para el aislamiento de clones altamente productivos". Biotecnología y bioingeniería . 109 (10): 2599–611. doi :10.1002/bit.24527. PMID 22510960. S2CID 25858120.
- ^ ab Bernales S, Papa FR, Walter P (2006). "Señalización intracelular por la respuesta de la proteína desplegada". Revisión anual de biología celular y del desarrollo . 22 : 487–508. doi :10.1146/annurev.cellbio.21.122303.120200. PMID 16822172.
- ^ Harding HP , Zhang Y, Ron D (enero de 1999). "La traducción y el plegamiento de proteínas están acoplados por una quinasa residente en el retículo endoplasmático". Nature . 397 (6716): 271–4. Bibcode :1999Natur.397..271H. doi :10.1038/16729. PMID 9930704. S2CID 4416662.
- ^ Lee AH, Iwakoshi NN, Anderson KC, Glimcher LH (agosto de 2003). "Los inhibidores del proteasoma alteran la respuesta de la proteína desplegada en las células de mieloma". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 100 (17): 9946–51. Bibcode :2003PNAS..100.9946L. doi : 10.1073/pnas.1334037100 . PMC 187896 . PMID 12902539.
- ^ Lee AS (enero de 1987). "Regulación coordinada de un conjunto de genes por ionóforos de glucosa y calcio en células de mamíferos". Tendencias en Ciencias Bioquímicas . 12 : 20–3. doi :10.1016/0968-0004(87)90011-9.
- ^ Machamer CE, Doms RW, Bole DG, Helenius A, Rose JK (abril de 1990). "La proteína de unión a la cadena pesada reconoce formas incompletamente unidas por disulfuro de la proteína G del virus de la estomatitis vesicular". The Journal of Biological Chemistry . 265 (12): 6879–83. doi : 10.1016/S0021-9258(19)39231-2 . PMID 2157712.
- ^ Stĕrba O (1975). "Crecimiento prenatal del topo, Talpa europaea Linn., 1758". Folia Morphologica . 23 (3): 282–5. PMID 1158311.
- ^ Molinari M, Galli C, Piccaluga V, Pieren M, Paganetti P (julio de 2002). "Asistencia secuencial de chaperonas moleculares y formación transitoria de complejos covalentes durante la degradación de proteínas del RE". The Journal of Cell Biology . 158 (2): 247–57. doi :10.1083/jcb.200204122. PMC 2173128 . PMID 12119363.
- ^ Mori K, Ogawa N, Kawahara T, Yanagi H, Yura T (abril de 2000). "El reemplazo del extremo C del factor de transcripción Hac1p mediado por empalme de ARNm es necesario para la activación eficiente de la respuesta de la proteína desplegada". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 97 (9): 4660–5. Bibcode :2000PNAS...97.4660M. doi : 10.1073/pnas.050010197 . PMC 18289 . PMID 10781071.
- ^ Urano F, Wang X, Bertolotti A, Zhang Y, Chung P, Harding HP, Ron D (enero de 2000). "Acoplamiento del estrés en el RE a la activación de las quinasas de proteína JNK por la quinasa de proteína transmembrana IRE1". Science . 287 (5453): 664–6. Bibcode :2000Sci...287..664U. doi :10.1126/science.287.5453.664. PMID 10650002.
- ^ Ozcan U, Cao Q, Yilmaz E, Lee AH, Iwakoshi NN, Ozdelen E, et al. (octubre de 2004). "El estrés del retículo endoplásmico vincula la obesidad, la acción de la insulina y la diabetes tipo 2". Ciencia . 306 (5695): 457–61. Código bibliográfico : 2004 Ciencia... 306..457O. doi :10.1126/ciencia.1103160. PMID 15486293. S2CID 22517395.
- ^ Wu J, Ruas JL, Estall JL, Rasbach KA, Choi JH, Ye L, et al. (febrero de 2011). "La respuesta de la proteína desplegada media la adaptación al ejercicio en el músculo esquelético a través de un complejo PGC-1α/ATF6α". Metabolismo celular . 13 (2): 160–9. doi :10.1016/j.cmet.2011.01.003. PMC 3057411 . PMID 21284983.
- ^ Wang XZ, Lawson B, Brewer JW, Zinszner H, Sanjay A, Mi LJ, Boorstein R, Kreibich G, Hendershot LM, Ron D (agosto de 1996). "Las señales del retículo endoplasmático estresado inducen la proteína homóloga C/EBP (CHOP/GADD153)". Biología molecular y celular . 16 (8): 4273–80. doi :10.1128/mcb.16.8.4273. PMC 231426 . PMID 8754828.
- ^ Welihinda AA, Kaufman RJ (julio de 1996). "La vía de respuesta de la proteína desplegada en Saccharomyces cerevisiae. La oligomerización y la transfosforilación de Ire1p (Ern1p) son necesarias para la activación de la quinasa". The Journal of Biological Chemistry . 271 (30): 18181–7. doi : 10.1074/jbc.271.30.18181 . PMID 8663458.
- ^ Yoshida H, Haze K, Yanagi H, Yura T, Mori K (diciembre de 1998). "Identificación del elemento de respuesta al estrés del retículo endoplásmico que actúa en cis y es responsable de la inducción transcripcional de proteínas reguladas por glucosa en mamíferos. Participación de factores de transcripción básicos de cremallera de leucina". The Journal of Biological Chemistry . 273 (50): 33741–9. doi : 10.1074/jbc.273.50.33741 . PMID 9837962.
- ^ BBC Health News (10 de octubre de 2013). "El avance en el tratamiento del Alzheimer se considera un 'punto de inflexión'". British Broadcasting Co. Consultado el 10 de octubre de 2013 .
- ^ ab Kandeil, Mohamed A.; Hashem, Reem M.; Mahmoud, Mohamed O.; Hetta, Mona H.; Tohamy, Mohamed A. (2019). "El extracto de Zingiber officinale y los ácidos grasos omega-3 mejoran el estrés del retículo endoplásmico en un modelo de rata con hígado graso no alcohólico". Journal of Food Biochemistry . 43 (12): e13076. doi :10.1111/jfbc.13076. hdl : 2027.42/152724 . ISSN 1745-4514. PMID 31608477. S2CID 204544806.
- ^ ab Feyen, Dries AM; Perea-Gil, Isaac; Maas, Renée GC; Harakalova, Magdalena; Gavidia, Alexandra A.; Arthur Ataam, Jennifer; Wu, Ting-Hsuan; Vink, ario; Pei, Jiayi; Vadgama, Nirmal; Suurmeijer, Albert J. (3 de agosto de 2021). "Respuesta de la proteína desplegada como mecanismo compensatorio y posible objetivo terapéutico en la miocardiopatía PLN R14del". Circulación . 144 (5): 382–392. doi :10.1161/CIRCULATIONAHA.120.049844. ISSN 1524-4539. PMC 8667423 . PMID 33928785.
- ^ abcd M "Kitamura, M". Archivado desde el original el 10 de febrero de 2012. Consultado el 6 de febrero de 2008 .
{{cite web}}: Verificar|archive-url=valor ( ayuda ) ; Verificar|url=valor ( ayuda ) - ^ Datan E, Roy SG, Germain G, Zali N, McLean JE, Golshan G, et al. (marzo de 2016). "La autofagia inducida por el dengue, la replicación del virus y la protección contra la muerte celular requieren la activación de la vía de estrés del RE (PERK)". Muerte celular y enfermedad . 7 (e2127): e2127. doi :10.1038/cddis.2015.409. PMC 4823927 . PMID 26938301.
- ^ Roberson EC, Tully JE, Guala AS, Reiss JN, Godburn KE, Pociask DA, et al. (mayo de 2012). "La gripe induce estrés del retículo endoplásmico, apoptosis dependiente de la caspasa-12 y liberación del factor de crecimiento transformante β mediada por la quinasa N-terminal c-Jun en células epiteliales pulmonares". American Journal of Respiratory Cell and Molecular Biology . 46 (5): 573–81. doi :10.1165/rcmb.2010-0460OC. PMC 3359902 . PMID 21799120.
