Reordenamiento de Payne
La transposición de Payne es la isomerización, en condiciones básicas , de alcoholes 2,3-epoxi a alcoholes 1,2-epoxi isoméricos con inversión de configuración. También se conocen transposiciones aza- y tia-Payne de aziridinas y tiiranios, respectivamente. [1]
Introducción
En condiciones básicas y próticas, los alcoholes 2,3-epoxi sufren una transposición en la que el oxígeno del alcohol abre el epóxido con inversión de configuración, formando un alcohol 1,2-epoxi isomérico. En general, la transposición de Payne representa una migración del epóxido. Aunque la migración en sí es completamente reversible, la apertura nucleofílica en condiciones de Curtin-Hammett proporciona buenos rendimientos de dioles funcionalizados derivados de un único isómero de alcohol epoxi. [2] El atrapamiento electrofílico intramolecular del nuevo alcóxido generado tras la transposición también puede utilizarse para impulsar la reacción hasta su finalización. En algunos casos, la diferencia termodinámica entre los isómeros del epóxido es lo suficientemente grande como para obtener un único isómero con un rendimiento sintéticamente útil sin depender de las diferencias cinéticas asociadas con el atrapamiento.
(1)

Se requieren condiciones fuertemente básicas para inducir el equilibrio, lo que limita la utilidad sintética de la transformación en sustratos que carecen de funcionalidad lábil a las bases. Muchos equilibrios de alcoholes epoxi están muy finamente equilibrados; [3] sin embargo, aprovechar las estrategias de captura descritas anteriormente puede conducir a altos rendimientos de isómeros individuales.
Mecanismo y estereoquímica
Mecanismo prevaleciente
El mecanismo básico de la transposición de Payne implica la desprotonación del grupo hidroxilo libre, el ataque nucleofílico inverso sobre el carbono epóxido proximal y la reprotonación del alcóxido recién liberado. Cada paso del proceso es reversible. [4]
(2)

Varias observaciones sugieren que esta imagen mecanicista es demasiado simplificada. La migración de epóxido no ocurre o es muy lenta en condiciones apróticas [3] —se ha sugerido que el ataque nucleofílico se ralentiza por la coordinación de los iones metálicos con el oxígeno nucleofílico en condiciones apróticas. Además, cuando se agrega un nucleófilo externo a los isómeros de epóxido en equilibrio, la proporción de productos abiertos no refleja la proporción de isómeros de epóxido en solución o su estabilidad termodinámica relativa. [5] La apertura nucleofílica in situ de epóxidos en equilibrio es un ejemplo de condiciones de Curtin-Hammett —debido a que los epóxidos se equilibran rápidamente en relación con la velocidad de apertura del epóxido, son las barreras cinéticas de la apertura del anillo las que controlan la proporción de productos observada. En el ejemplo siguiente, el producto de la apertura del epóxido terminal es el producto principal, aunque el epóxido terminal en sí es menos estable termodinámicamente que el isómero interno.
(3)

Los halodioles pueden utilizarse como precursores de los alcoholes 2,3-epoxi antes de la reorganización. Pueden surgir problemas de selectividad de sitio si los dos grupos hidroxilo que flanquean el haluro no son equivalentes. En general, la formación de epóxidos internos sustituidos es más rápida que la formación de epóxidos terminales. [6] Esta idea puede utilizarse para predecir el curso de las migraciones de epóxidos generados in situ .
(4)

Estereoquímica
La transposición de Payne se produce con inversión de la estereoquímica en C-2. Los sustratos que contienen múltiples grupos hidroxilo adyacentes pueden sufrir migraciones de epóxido en "cascada" con inversión en cada sitio de ataque nucleofílico. En un ejemplo, la inversión de tres estereocentros contiguos se produce después de dos migraciones de epóxido, la apertura del epóxido por el carboxilato y la hidrólisis de la lactona resultante. [7]
(5)

Alcance y limitaciones
Reordenamiento de Payne
La posición de equilibrio en sistemas cíclicos y acíclicos puede predecirse a partir de las estructuras de los dos epóxidos en equilibrio. En los sistemas acíclicos, se han establecido estas reglas: [8]
- Se favorece una mayor sustitución en el anillo epóxido.
- Entre los epóxidos disustituidos, los isómeros trans son preferidos sobre los isómeros cis .
- Se favorecen los isómeros con grupos hidroxilo primarios.
- Los sustituyentes donadores de electrones en el epóxido son estabilizadores y los sustituyentes atractores de electrones son desestabilizadores.
Los piranósidos son los sistemas cíclicos más estudiados. Los estudios de la migración de epóxidos en piranósidos y otros alcoholes epóxicos cíclicos han revelado tres generalizaciones:
- Al igual que en los sistemas acíclicos, se favorece una mayor sustitución en el anillo epóxido.
- El isómero favorecido es el que tiene más sustituyentes pseudoecuatoriales.
- Los enlaces de hidrógeno intramoleculares y otras interacciones a través del espacio no juegan un papel en las relaciones de equilibrio.
Los piranósidos bloqueados conformacionalmente revelan la preferencia termodinámica de los sustratos cíclicos por grupos más pseudoecuatoriales. [9]
(6)

En condiciones apróticas, la apertura nucleofílica de los isómeros de epóxido se puede lograr con hidruros u organocupratos. El ataque nucleofílico generalmente ocurre en el carbono menos sustituido, lo que produce el producto diol más sustituido. [10]
(7)

En condiciones próticas, también suele favorecerse la apertura en la posición menos sustituida. Los nucleófilos que pueden utilizarse en condiciones próticas incluyen fenoles, aminas secundarias, aniones azida y sulfuros. [11]
(8)

La captura nucleofílica intermolecular de un único isómero de epóxido es difícil, ya que la reacción del alcohol epoxi con el electrófilo suele ser más rápida que la migración. Sin embargo, las electroforesis intramoleculares suelen ser eficaces para atrapar un único isómero de epóxido. Por ejemplo, un segundo epóxido cercano en el material de partida de la ecuación (9) queda atrapado por un único isómero de epóxido, lo que da lugar a un tetrahidrofurano . [12]
(9)

Reordenamientos de Aza- y Thia-Payne
La transposición aza-Payne puede efectuarse en dirección "directa" (de epóxido a aziridina) o "inversa" (de aziridina a epóxido) según las condiciones empleadas. Las aziridinas pobres en electrones experimentan la transposición inversa en presencia de una base hidruro, [13] mientras que las aminas epóxicas correspondientes experimentan la transposición directa en presencia de eterato de trifluoruro de boro. [14]
(10)

El reordenamiento de tia-Payne sólo se ha observado en dirección directa (epóxido a tiiranio) con apertura in situ del tiiranio. La apertura nucleofílica inversa en C-2 es posible mediante el uso de reactivos de trialquilaluminio. [15]
(11)

Aplicaciones sintéticas
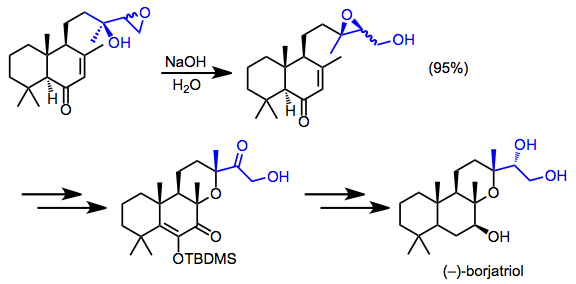
La síntesis del borjatriol implicó el aislamiento poco frecuente de un epóxido migrado. La mezcla diastereomérica de productos de reordenamiento se mantuvo durante el resto de la síntesis. [16]
(12)
Los dos pasos finales de la síntesis total del espátol implicaron la captura electrofílica intramolecular de un alcóxido derivado de un epóxido reordenado. El ataque del alcóxido intermedio sobre el mesilato adyacente proporcionó un bis(epóxido) y la desbencilación proporcionó el compuesto objetivo. [17]
(13)

Comparación con otros métodos
Otros métodos disponibles para la preparación de alcoholes 2,3-epoxi tienen la ventaja de que no comienzan con un alcohol 2,3-epoxi existente; sin embargo, tienden a implicar más pasos que la migración del epóxido. La dihidroxilación asimétrica se puede utilizar para sintetizar alcoholes epoxi con alta estereoselectividad, y algunos de los métodos que se basan en la dihidroxilación evitan el uso de condiciones fuertemente básicas. [18]
(14)

Un método alternativo que conduce a la retención de la configuración en C-2 implica la mesilación de un alcohol epoxi, la apertura del epóxido y el nuevo cierre mediante el desplazamiento del mesilato. [11]
(15)

Condiciones y procedimiento experimental
Condiciones típicas
La apertura de los epóxidos terminales por hidróxido adventicio puede ocurrir bajo las condiciones de reordenamiento; si esto no se desea, se deben utilizar solventes anhidros, reactivos y material de vidrio. El metóxido de sodio recién preparado en metanol se utiliza comúnmente para efectuar el reordenamiento sin apertura. La apertura nucleófila se puede lograr mediante el uso de azida de sodio , exceso de hidróxido o reactivos de cuprato en presencia de cloruro de litio . El atrapamiento electrofílico se lleva a cabo bajo condiciones estándar en presencia de un electrófilo como el bromuro de bencilo . Los haluros de sililo también se han utilizado como agentes de atrapamiento electrofílico.
Para evitar la migración de epóxidos, se pueden emplear condiciones débilmente básicas. Ni el carbonato de potasio acuoso ni las bases de amina acuosas provocan la reorganización de epóxidos. Las temperaturas bajas también son beneficiosas cuando no se desea la migración de epóxidos.
Procedimiento de ejemplo[19]
(16)

Se preparó una solución de metil(ciano)cuprato (Solución A) de la siguiente manera: a una suspensión de 0,35 g (3,91 mmol) de cianuro de cobre(I) en 5 mL de tetrahidrofurano bajo argón a 0° se le añadieron gota a gota durante aproximadamente 5 minutos 2,76 mL de una solución de metil-litio en éter etílico (1,4 M, 3,86 mmol). La solución incolora se agitó durante 10 minutos a 0°, se calentó a 25° durante 30 minutos y luego se enfrió nuevamente a 0°. Por separado, se preparó una solución de la sal de litio de (±)-cis-4-benciloxi-2,3-epoxi-1-butanol (solución B) de la siguiente manera: a una solución de 0,5 g (2,58 mmol) del alcohol epoxi y 0,90 g (21,4 mmol) de cloruro de litio en 10 ml de tetrahidrofurano bajo argón a -78° se añadió gota a gota 1,65 ml de una solución de n-butillitio en hexano (1,56 M, 2,58 mmol). La solución se agitó durante 5 minutos a -78°, se dejó calentar a 0° y luego se agitó a esa temperatura durante 10 minutos. La reacción se efectuó mediante la adición de la solución A a la solución B mediante una cánula a 0° seguida de calentamiento a temperatura ambiente durante 2 horas. La mezcla de reacción se agitó durante otras 12 horas y luego se trató con cuidado con 5 ml de cloruro de amonio acuoso saturado . La mezcla se agitó durante 1 a 2 horas para facilitar la eliminación de los residuos de cobre. Luego se agregó éter etílico (20 ml) y se separó la capa orgánica. La fase acuosa se extrajo dos veces con 20 mL de éter etílico y las fases orgánicas combinadas se secaron sobre sulfato de magnesio , se filtraron y se concentraron para dar 0,51 g del producto como un aceite incoloro (95 %), IR (película) 3400, 3100, 3060, 3030, 2970, 2930, 2870, 1600, 1500, 1465, 1445, 1385, 1370, 1320, 1285, 1210, 1180, 1120, 1100, 1075, 1030, 1020, 980, 905, 830, 750, 730, 710, 695 cm–1; RMN 1H (CDCl3 ) δ 0,90 (t, J = 6,0 Hz, 3 H), 1,37–1,53 (m, 2 H), 3,20 (s ancho, 2 H), 3,40–3,65 (m, 4 H), 4,48 (s, 2 H), 7,29 (s, 5 H).
Referencias
- ^ Hanson, R. Org. React. 2002 , 60 , 1. doi :10.1002/0471264180.or060.01
- ^ Seeman, JI Chem. Rev. 1983 , 83 , 83.
- ^ desde Payne, GB J. Org. Chem. 1962 , 27 , 3819.
- ^ Angyal, SJ; Gilham, PT J. Chem. Soc. 1957 , 3691.
- ^ Katsuki, T.; Lee, AWM; Mamá, P.; Martín, VS; Masamune, S.; Sin filo, KB; Tuddenham, D.; Walker, FJ J. Org. Química. 1982 , 47 , 1373.
- ^ Paulsen, H.; Eberstein, K. Chem. Ber. 1976 , 109 , 3891.
- ^ Bock, K.; Lundt, I.; Pedersen, C. Carbohidrato. Res. 1988 , 179 , 87.
- ^ Pierre, J.-L.; Chautemps, P.; Arnaud, P. Toro. Soc. Chim. P. 1969 , 106 , 1317.
- ^ Mubarak, A.; Fraser-Reid, B. J. Org. Chem. 1982 , 47 , 4265.
- ^ Página, PCB; Rayner, CM; Sutherland, IO J. Chem. Soc., Perkin Trans. 1 1990 , 1375.
- ^ por Behrens, CH; Ko, SY; Sharpless, KB; Walker, FJ J. Org. Chem. 1985 , 50 , 5687.
- ^ Klein, E.; Rojahn, W.; Henneberg, D. Tetraedro 1964 , 20 , 2025.
- ^ Harden, RC; Hodgkinson, TJ; McKillop, A.; Prowse, WG; Urquhart, MWJ Tetrahedron 1997 , 53 , 21.
- ^ Nakai, K.; Ibuka, T.; Otaka, A.; Tamamura, H.; Fujii, N.; Yamamoto, Y. Tetraedro Lett . 1995 , 36 , 6247.
- ^ Sasaki, M.; Tanino, K.; Miyashita, MJ Org. Química. 2001 , 66 , 5388.
- ^ Herlem, D.; Khuonghuu, F. Tetrahedron 1997 , 53 , 673.
- ^ Soloman, RG; Basu, B.; Roy, S.; Sachinuala, ND J. Am. Chem. Soc. 1991 , 113 , 3096.
- ^ Ko, SY; Malik, M. Tetraedro Lett . 1993 , 34 , 4675.
- ^ Página, PCB; Rayner, CM; Sutherland, IO J. Chem. Soc., Perkin Trans. 1 1990, 1375.