Receptor de células T
| Complejo TCR | |
|---|---|
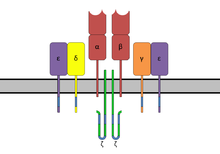 El complejo del receptor de células T con cadenas TCR-α y TCR-β (arriba), dos moléculas accesorias de cadena ζ ( CD247 ) (abajo) y CD3 (representado por CD3γ , CD3δ y dos CD3ε ). | |
| Identificadores | |
| Símbolo | TCR |
| Superfamilia OPM | 166 |
| Membranoma | 26 |

| Locus alfa del receptor de células T | |
|---|---|
| Identificadores | |
| Símbolo | TRA |
| Símbolos alternativos | TCRA, TRA@ |
| Gen NCBI | 6955 |
| HGNC | 12027 |
| OMI | 186880 |
| Otros datos | |
| Lugar | Crónica 14 q11.2 |
| Locus beta del receptor de células T | |
|---|---|
| Identificadores | |
| Símbolo | TRB |
| Símbolos alternativos | TCRB, TRB@ |
| Gen NCBI | 6957 |
| HGNC | 12155 |
| OMI | 186930 |
| Otros datos | |
| Lugar | Crónica 7 q34 |
| Locus delta del receptor de células T | |
|---|---|
| Identificadores | |
| Símbolo | TRD |
| Símbolos alternativos | TCRD, TRD@, TCRDV1 |
| Gen NCBI | 6964 |
| HGNC | 12252 |
| Otros datos | |
| Lugar | Crónica 14 q11.2 |
| Locus gamma del receptor de células T | |
|---|---|
| Identificadores | |
| Símbolo | TRG |
| Símbolos alternativos | TCRG, RG@ |
| Gen NCBI | 6965 |
| HGNC | 12271 |
| Otros datos | |
| Lugar | Cap. 7 pág. 14 |
El receptor de células T ( TCR ) es un complejo proteico que se encuentra en la superficie de las células T , o linfocitos T, [1] que se encarga de reconocer fragmentos de antígeno como péptidos unidos a moléculas del complejo mayor de histocompatibilidad (MHC). La unión entre el TCR y los péptidos antigénicos es de afinidad relativamente baja y es degenerada : es decir, muchos TCR reconocen el mismo péptido antigénico y muchos péptidos antigénicos son reconocidos por el mismo TCR. [2]
El TCR está compuesto por dos cadenas proteicas diferentes (es decir, es un heterodímero ). En los seres humanos, en el 95% de las células T el TCR consta de una cadena alfa (α) y una cadena beta (β) (codificadas por TRA y TRB , respectivamente), mientras que en el 5% de las células T el TCR consta de cadenas gamma y delta (γ/δ) (codificadas por TRG y TRD , respectivamente). Esta relación cambia durante la ontogenia y en estados patológicos (como la leucemia ). También difiere entre especies. Se han mapeado ortólogos de los 4 loci en varias especies. [3] [4] Cada locus puede producir una variedad de polipéptidos con regiones constantes y variables. [3]
Cuando el TCR se une al péptido antigénico y al MHC (péptido/MHC), el linfocito T se activa a través de la transducción de señales , es decir, una serie de eventos bioquímicos mediados por enzimas asociadas, correceptores, moléculas adaptadoras especializadas y factores de transcripción activados o liberados . Con base en el mecanismo de activación inicial del receptor, el TCR pertenece a la familia de receptores fosforilados en tirosina (NTR) no catalíticos . [5]
Historia
En 1982, el premio Nobel James P. Allison descubrió por primera vez un epítopo de superficie de células T expresado clonalmente en el linfoma T murino. [6] En 1983, Ellis Reinherz definió por primera vez la estructura del receptor de células T humano utilizando anticuerpos monoclonales antiidiotípicos para clones de células T, complementados con estudios en el ratón por Philippa Marrack y John Kappler . [7] [8] Luego, Tak Wah Mak [9] y Mark M. Davis [10] identificaron los clones de ADNc que codifican el TCR humano y de ratón respectivamente en 1984. Estos hallazgos permitieron revelar la entidad y la estructura del esquivo TCR, conocido antes como el "Santo Grial de la Inmunología". Esto permitió a los científicos de todo el mundo realizar estudios sobre el TCR, lo que condujo a estudios importantes en los campos de CAR-T , inmunoterapia del cáncer e inhibición de puntos de control .
Características estructurales
El TCR es una proteína heterodímera anclada a la membrana unida por disulfuro que normalmente consta de cadenas alfa (α) y beta (β) altamente variables expresadas como parte de un complejo con las moléculas de la cadena CD3 invariante . Las células T que expresan este receptor se denominan células T α:β (o αβ), aunque una minoría de células T expresan un receptor alternativo, formado por cadenas gamma (γ) y delta (δ) variables, denominadas células T γδ . [11]
Cada cadena está compuesta por dos dominios extracelulares: región variable (V) y región constante (C), ambas de dominios de la superfamilia de inmunoglobulinas (IgSF) que forman láminas β antiparalelas . La región constante está próxima a la membrana celular, seguida de una región transmembrana y una cola citoplasmática corta, mientras que la región variable se une al complejo péptido/MHC.
El dominio variable de la cadena α y la cadena β del TCR tiene cada uno tres regiones hipervariables o determinantes de complementariedad (CDR). También hay un área adicional de hipervariabilidad en la cadena β (HV4) que normalmente no entra en contacto con el antígeno y, por lo tanto, no se considera una CDR. [ cita requerida ]
Los residuos en estos dominios variables se encuentran en dos regiones del TCR, en la interfaz de las cadenas α y β y en la región marco de la cadena β que se cree que está cerca del complejo de transducción de señales CD3. [12] CDR3 es el CDR principal responsable de reconocer el antígeno procesado , aunque también se ha demostrado que CDR1 de la cadena alfa interactúa con la parte N-terminal del péptido antigénico, mientras que CDR1 de la cadena β interactúa con la parte C-terminal del péptido [ cita requerida ] .
Se cree que CDR2 reconoce el MHC. No se cree que HV4 de la cadena β participe en el reconocimiento de antígenos como en los CDR clásicos, pero se ha demostrado que interactúa con superantígenos . [13]
El dominio constante del TCR consiste en secuencias de conexión cortas en las que un residuo de cisteína forma enlaces disulfuro, que forman un enlace entre las dos cadenas.
El TCR es un miembro de la superfamilia de las inmunoglobulinas, un gran grupo de proteínas implicadas en la unión, el reconocimiento y la adhesión; la familia recibe su nombre de los anticuerpos (también llamados inmunoglobulinas). El TCR es similar a un semianticuerpo que consta de una sola cadena pesada y una sola cadena ligera, excepto que la cadena pesada no tiene su fracción cristalizable (Fc). Las dos subunidades principales del TCR (cadenas α y β) están entrelazadas. Las subunidades CD3 y zeta son necesarias para llevar a cabo la transducción de señales. La interacción MHC-TCR-CD3 para las células T es funcionalmente similar a la interacción antígeno (Ag)-inmunoglobulina (Ig)-FcR para los leucocitos mieloides, y la interacción Ag-Ig-CD79 para las células B.
Generación de la diversidad del TCR
La generación de diversidad de TCR es similar a la de los anticuerpos y los receptores de antígenos de células B. Surge principalmente de la recombinación genética de los segmentos codificados por ADN en células T somáticas individuales por recombinación somática V(D)J utilizando las recombinasas RAG1 y RAG2 . Sin embargo, a diferencia de las inmunoglobulinas , los genes TCR no experimentan hipermutación somática y las células T no expresan citidina desaminasa inducida por activación (AID). El proceso de recombinación que crea diversidad en BCR ( anticuerpos ) y TCR es exclusivo de los linfocitos (células T y B) durante las primeras etapas de su desarrollo en los órganos linfoides primarios ( timo para las células T, médula ósea para las células B).
Cada TCR recombinado posee una especificidad antigénica única , determinada por la estructura del sitio de unión al antígeno formado por las cadenas α y β en el caso de las células T αβ o las cadenas γ y δ en el caso de las células T γδ. [14]
- La cadena alfa del TCR se genera por recombinación VJ , mientras que la cadena beta se genera por recombinación VDJ (ambas implican una unión aleatoria de segmentos genéticos para generar la cadena TCR completa).
- Del mismo modo, la generación de la cadena gamma del TCR implica la recombinación VJ, mientras que la generación de la cadena delta del TCR ocurre mediante la recombinación VDJ.
La intersección de estas regiones específicas (V y J para la cadena alfa o gamma; V, D y J para la cadena beta o delta) corresponde a la región CDR3 que es importante para el reconocimiento de péptidos/MHC (ver arriba).
Es la combinación única de los segmentos de esta región, junto con las adiciones palindrómicas y aleatorias de nucleótidos (denominadas respectivamente "P-" y "N-"), lo que explica la diversidad aún mayor de la especificidad del receptor de células T para los péptidos antigénicos procesados.
Más tarde, durante el desarrollo, los bucles CDR individuales del TCR se pueden reeditar en la periferia fuera del timo mediante la reactivación de las recombinasas utilizando un proceso denominado revisión (edición) del TCR y cambiar su especificidad antigénica.
El complejo TCR
En la membrana plasmática, las cadenas del receptor TCR α y β se asocian con seis proteínas adaptadoras adicionales para formar un complejo octamérico. El complejo contiene cadenas α y β, que forman el sitio de unión del ligando, y los módulos de señalización CD3 δ, CD3γ, CD3ε y CD3ζ en la estequiometría TCR α β - CD3εγ - CD3εδ - CD3ζζ. Los residuos cargados en el dominio transmembrana de cada subunidad forman interacciones polares que permiten un ensamblaje correcto y estable del complejo. [15] La cola citoplasmática del TCR es muy corta, por lo tanto, las proteínas adaptadoras CD3 que contienen los motivos de señalización son necesarias para propagar la señal desde el TCR activado hacia la célula.
Los motivos de señalización implicados en la señalización del TCR son residuos de tirosina en la cola citoplasmática de estas proteínas adaptadoras que pueden fosforilarse en caso de unión del TCR con el pMHC. Los residuos de tirosina residen en una secuencia de aminoácidos específica de la firma Yxx(L/I)x6-8Yxx(L/I), donde Y, L, I indican residuos de tirosina, leucina e isoleucina, x denota cualquier aminoácido, el subíndice 6-8 indica una secuencia de 6 a 8 aminoácidos de longitud. Este motivo es muy común en los receptores activadores de la familia de receptores no catalíticos fosforilados en tirosina (NTR) y se denomina motivo de activación basado en tirosina del inmunorreceptor (ITAM). [5] CD3δ, CD3γ y CD3ε contienen cada uno un único ITAM, mientras que CD3ζ contiene tres ITAM. En total, el complejo TCR contiene 10 ITAM. [15] Los ITAM fosforilados actúan como sitio de unión para los dominios SH2 de proteínas reclutadas adicionalmente.
Discriminación de antígenos

Cada célula T expresa TCR clonales que reconocen un péptido específico cargado en una molécula MHC (pMHC), ya sea en MHC clase II en la superficie de las células presentadoras de antígenos o MHC clase I en cualquier otro tipo de célula. [16] Una característica única de las células T es su capacidad de discriminar entre péptidos derivados de células sanas, endógenas y péptidos de células extrañas o anormales (por ejemplo, infectadas o cancerosas) en el cuerpo. [17] Las células presentadoras de antígenos no discriminan entre péptidos propios y extraños y, por lo general, expresan una gran cantidad de pMHC derivados propios en su superficie celular y solo unas pocas copias de cualquier pMHC extraño. Por ejemplo, las células infectadas con VIH tienen solo entre 8 y 46 pMHC específicos del VIH, en comparación con 100 000 pMHC totales por célula. [18] [19]
Debido a que las células T experimentan una selección positiva en el timo, existe una afinidad no despreciable entre el pMHC propio y el TCR. Sin embargo, la señalización del receptor de células T no debería ser activada por el pMHC propio, de modo que las células T ignoren las células sanas endógenas. Sin embargo, cuando estas mismas células contienen incluso cantidades mínimas de pMHC derivado de patógenos, las células T deben activarse e iniciar respuestas inmunitarias. La capacidad de las células T de ignorar a las células sanas pero responder cuando estas mismas células expresan una pequeña cantidad de pMHC extraños se conoce como discriminación de antígenos. [20] [21]
Para ello, las células T tienen un grado muy alto de especificidad antigénica, a pesar del hecho de que la afinidad por el ligando péptido/MHC es bastante baja en comparación con otros tipos de receptores. [22] La afinidad, dada como la constante de disociación ( K d ), entre un TCR y un pMHC se determinó por resonancia de plasmón de superficie (SPR) en el rango de 1-100 μM, con una tasa de asociación ( k on ) de 1000 -10000 M −1 s −1 y una tasa de disociación ( k off ) de 0,01 -0,1 s −1 . [23] En comparación, las citocinas tienen una afinidad de KD = 10-600 pM por su receptor. [24] Se ha demostrado que incluso un cambio de un solo aminoácido en el péptido presentado que afecta la afinidad del pMHC al TCR reduce la respuesta de las células T y no puede compensarse con una mayor concentración de pMHC. [25] Se ha observado una correlación negativa entre la tasa de disociación del complejo pMHC-TCR y la fuerza de la respuesta de las células T. [26] Esto significa que los pMHC que se unen al TCR durante un tiempo más prolongado inician una activación más fuerte de la célula T. Además, las células T son muy sensibles; la interacción con un solo pMHC es suficiente para desencadenar la activación. [27] Las células T se alejan rápidamente de los antígenos que no desencadenan respuestas, escaneando rápidamente el pMHC en una célula presentadora de antígeno (APC) para aumentar la posibilidad de encontrar un pMHC específico. En promedio, una célula T encuentra 20 APC por hora. [ 28]
Se han propuesto diferentes modelos para los mecanismos moleculares que subyacen a este proceso altamente específico y altamente sensible de discriminación de antígenos. El modelo ocupacional simplemente sugiere que la respuesta del TCR es proporcional al número de pMHC unidos al receptor. Dado este modelo, una vida útil más corta de un péptido puede compensarse con una concentración más alta de modo que la respuesta máxima de la célula T permanezca igual. Sin embargo, esto no se puede ver en experimentos y el modelo ha sido ampliamente rechazado. [26] La opinión más aceptada es que el TCR participa en la corrección cinética. El modelo de corrección cinética propone que una señal no se produce directamente al unirse, sino que una serie de pasos intermedios aseguran un retraso de tiempo entre la unión y la salida de la señal. Estos pasos intermedios de "corrección" pueden ser múltiples rondas de fosforilación de tirosina. Estos pasos requieren energía y, por lo tanto, no ocurren espontáneamente, solo cuando el receptor está unido a su ligando. De esta manera, solo los ligandos con alta afinidad que se unen al TCR durante un tiempo lo suficientemente largo pueden iniciar una señal. Todos los pasos intermedios son reversibles, de modo que tras la disociación del ligando, el receptor vuelve a su estado original no fosforilado antes de que se una un nuevo ligando. [29] Este modelo predice que la respuesta máxima de las células T disminuye para pMHC con una vida útil más corta. Los experimentos han confirmado este modelo. [26] Sin embargo, el modelo básico de corrección cinética tiene un equilibrio entre sensibilidad y especificidad. Aumentar el número de pasos de corrección aumenta la especificidad pero reduce la sensibilidad del receptor. Por lo tanto, el modelo no es suficiente para explicar la alta sensibilidad y especificidad de los TCR que se han observado. (Altan Bonnet 2005) Se han propuesto múltiples modelos que extienden el modelo de corrección cinética, pero la evidencia de los modelos aún es controvertida. [17] [30] [31]
La sensibilidad a los antígenos es mayor en las células T con experiencia con antígenos que en las células T vírgenes. Las células T vírgenes pasan por el proceso de maduración de la avidez funcional sin cambios en la afinidad. Esto se basa en el hecho de que las células T efectoras y de memoria (con experiencia con antígenos) dependen menos de las señales coestimuladoras y de una mayor concentración de antígenos que las células T vírgenes. [32]
Vía de señalización
La función esencial del complejo TCR es identificar un antígeno específico derivado de un patógeno potencialmente dañino y provocar una respuesta distinta y crítica. Al mismo tiempo, debe ignorar cualquier antígeno propio y tolerar antígenos inofensivos, como los antígenos alimentarios. El mecanismo de transducción de señales por el cual una célula T provoca esta respuesta al entrar en contacto con su antígeno único se denomina activación de células T. Al unirse a pMHC, el TCR inicia una cascada de señalización que implica la activación de factores de transcripción y la remodelación del citoesqueleto, lo que da como resultado la activación de las células T. Las células T activas secretan citocinas, experimentan una rápida proliferación, tienen actividad citotóxica y se diferencian en células efectoras y de memoria. Cuando se activa el TCR, las células T forman una sinapsis inmunológica que les permite permanecer en contacto con la célula presentadora de antígeno durante varias horas. [33] A nivel de población, la activación de las células T depende de la fuerza de la estimulación del TCR; la curva dosis-respuesta de la producción de ligando a citocina es sigmoidea. Sin embargo, la activación de las células T a nivel de una sola célula puede caracterizarse por una respuesta similar a un interruptor digital, lo que significa que la célula T se activa por completo si el estímulo es superior a un umbral determinado; de lo contrario, la célula T permanece en su estado no activado. No hay un estado de activación intermedio. La robusta curva dosis-respuesta sigmoidea a nivel de población es el resultado de que las células T individuales tienen umbrales ligeramente diferentes. [25]
Las células T necesitan tres señales para activarse por completo. La señal 1 la proporciona el receptor de células T al reconocer un antígeno específico en una molécula MHC. La señal 2 proviene de receptores coestimuladores en células T como CD28 , activados a través de ligandos presentados en la superficie de otras células inmunes como CD80 y CD86. Estos receptores coestimuladores se expresan solo cuando el sistema inmune innato detecta una infección o un estímulo inflamatorio, conocido como "señal de peligro". Este sistema de dos señales se asegura de que las células T solo respondan a estímulos dañinos (es decir, patógenos o lesiones) y no a autoantígenos. Una tercera señal adicional es proporcionada por las citocinas , que regulan la diferenciación de las células T en diferentes subconjuntos de células T efectoras. [33] Hay una miríada de moléculas involucradas en el complejo proceso bioquímico (llamado señalización transmembrana ) por el cual se produce la activación de las células T. A continuación, se describe en detalle la cascada de señalización.
Activación del receptor
La activación inicial sigue el mecanismo común para todos los miembros de la familia de receptores NTR . Una vez que el TCR se une a un pMHC específico, los residuos de tirosina de los motivos de activación basados en tirosina del inmunorreceptor (ITAM) en sus proteínas adaptadoras CD3 se fosforilan. Los residuos sirven como sitios de acoplamiento para las moléculas de señalización descendentes, que pueden propagar la señal. [34] [35] La fosforilación de los ITAM está mediada por la quinasa Src Lck . Lck se ancla a la membrana plasmática al asociarse con el correceptor CD4 o CD8 , dependiendo del subtipo de célula T. CD4 se expresa en células T auxiliares y células T reguladoras , y es específico para MHC clase II . CD8, por otro lado, específico para MHC clase I , se expresa en células T citotóxicas . La unión del correceptor al MHC lleva a Lck en estrecha proximidad a los ITAM CD3. Se ha demostrado que el 40% de Lck está activo incluso antes de que el TCR se una a pMHC y, por lo tanto, tiene la capacidad de fosforilar constantemente el TCR. [36] La señalización tónica del TCR se evita mediante la presencia de la fosfatasa CD45 que elimina la fosforilación de los residuos de tirosina e inhibe la iniciación de la señal. Al unirse, se altera el equilibrio entre la actividad de la quinasa y la actividad de la fosfatasa, lo que conduce a un exceso de fosforilación e iniciación de la señal. Todavía se debate cómo se logra dicha perturbación mediante la unión del TCR. Se han sugerido mecanismos que involucran el cambio conformacional del TCR, la agregación del TCR y la segregación cinética . [34] La tirosina quinasa Fyn podría estar involucrada en la fosforilación de ITAM, pero no es esencial para la señalización del TCR. [37] [38]
Señalización TCR proximal
Los ITAM fosforilados en las colas citoplasmáticas de CD3 reclutan a la proteína tirosina quinasa Zap70 que puede unirse a los residuos de tirosina fosforilados con su dominio SH2 . Esto acerca a Zap70 a Lck, lo que da como resultado su fosforilación y activación por Lck. [39] Lck fosforila varias proteínas diferentes en la vía TCR. [40] Una vez activada, Zap70 puede fosforilar múltiples residuos de tirosina de la proteína transmembrana LAT . LAT es una proteína de andamiaje asociada con la membrana. En sí misma no tiene ninguna actividad catalítica, pero proporciona sitios de unión para moléculas de señalización a través de residuos de tirosina fosforilados. LAT se asocia con otra proteína de andamiaje Slp-76 a través de la proteína adaptadora Grap2 , que proporciona sitios de unión adicionales. Juntos, LAT y Slp-76 proporcionan una plataforma para el reclutamiento de muchas moléculas de señalización descendentes. Al acercar estas moléculas de señalización, pueden ser activadas por Lck, Zap70 y otras quinasas. Por lo tanto, el complejo LAT/Slp76 actúa como un señalosoma altamente cooperativo. [39]
Las moléculas que se unen al complejo LAT/Slp76 incluyen: Fosfolipasa C γ1 ( PLCγ1 ), SOS a través de un adaptador Grb2 , Itk , Vav , Nck1 y Fyb . [39]
Transducción de señales al núcleo
La PLCγ es una enzima muy importante en la vía, ya que genera moléculas de segundo mensajero . Es activada por la tirosina quinasa Itk, que se recluta en la membrana celular mediante la unión al fosfatidilinositol (3,4,5)-trifosfato (PIP3). El PIP3 se produce por la acción de la fosfoinosítido 3-quinasa (PI-3K), que fosforila el fosfatidilinositol 4,5-bisfosfato (PIP2) para producir PIP3. No se sabe que el PI-3K sea activado por el propio receptor de células T, pero hay evidencia de que CD28, un receptor coestimulador que proporciona la segunda señal, es capaz de activar PI-3K. La interacción entre PLCγ, Itk y PI-3K podría ser el punto en la vía donde se integran la primera y la segunda señal. Solo si ambas señales están presentes, se activa la PLCγ. [33] Una vez que la PLCγ se activa por fosforilación. Hidroliza PIP2 en dos moléculas mensajeras secundarias , a saber, el diacilglicerol unido a la membrana (DAG) y el inositol 1,4,5-trifosfato soluble (IP3). [41]
Estas moléculas de segundo mensajero amplifican la señal del TCR y distribuyen la activación localizada previa a toda la célula y activan cascadas de proteínas que finalmente conducen a la activación de factores de transcripción . Los factores de transcripción involucrados en la vía de señalización de células T son NFAT , NF-κB y AP1 , un heterodímero de proteínas Fos y Jun . Los tres factores de transcripción son necesarios para activar la transcripción del gen de la interleucina-2 (IL2). [33]
NFAT
La activación de NFAT depende de la señalización de calcio . El IP3 producido por PLC-γ ya no está unido a la membrana y se difunde rápidamente en la célula. La unión de IP3 a los receptores de los canales de calcio en el retículo endoplasmático (RE) induce la liberación de calcio (Ca 2+ ) en el citosol. La bajaconcentración de Ca 2+ resultante en el RE provoca la agrupación de STIM1 en la membrana del RE, lo que a su vez conduce a la activación de los canales CRAC de la membrana celular que permiten que fluya calcio adicional al citosol desde el espacio extracelular. Por lo tanto, los niveles de Ca 2+ aumentan fuertemente en la célula T. Este calcio citosólico se une a la calmodulina , induciendo un cambio conformacional de la proteína de modo que luego puede unirse y activar la calcineurina . La calcineurina, a su vez, desfosforila NFAT. En su estado desactivado, NFAT no puede entrar en el núcleo ya que su secuencia de localización nuclear (NLS) no puede ser reconocida por los transportadores nucleares debido a la fosforilación por GSK-3 . Cuando la calcineurina desfosforila el NFAT, es posible su translocación al núcleo. [33] Además, hay evidencia de que PI-3K, a través de moléculas de señal, recluta la proteína quinasa AKT a la membrana celular. AKT es capaz de desactivar GSK3 y, por lo tanto, inhibir la fosforilación del NFAT, lo que podría contribuir a la activación del NFAT. [39]
NF-κB
La activación de NF-κB es iniciada por DAG, el segundo producto unido a la membrana de la hidrolización de PIP2 por PLCγ. DAG se une y recluta a la proteína quinasa C θ (PKCθ) a la membrana donde puede activar la proteína de andamiaje unida a la membrana CARMA1 . Luego, CARMA1 sufre un cambio conformacional que le permite oligomerizarse y unirse a las proteínas adaptadoras BCL10 , el dominio CARD y MALT1 . Este complejo de múltiples subunidades se une a la ligasa de ubiquitina TRAF6 . La ubiquitinación de TRAF6 sirve como andamiaje para reclutar a NEMO , la quinasa IκB (IKK) y TAK1 . [33] TAK 1 fosforila IKK, que a su vez fosforila al inhibidor de NF-κB I-κB , lo que lleva a la ubiquitinación y posterior degradación de I-κB. El I-κB bloquea la NLS del NF-κB, impidiendo así su translocación al núcleo. Una vez que el I-κB se degrada, no puede unirse al NF-κB y la NLS del NF-κB se vuelve accesible para la translocación nuclear. [33]
AP1
La activación del factor AP1 implica tres vías de señalización MAPK . Estas vías utilizan una cascada de fosforilación de tres proteínas quinasas que actúan sucesivas para transmitir una señal. Las tres vías MAPK en las células T implican quinasas de diferentes especificidades que pertenecen a cada una de las familias MAP3K , MAP2K y MAPK . La activación inicial la realiza la GTPasa Ras o Rac que fosforila la MAP3K. [33] Una cascada que involucra a las enzimas Raf , MEK1 y ERK da como resultado la fosforilación de Jun, el cambio conformacional permite que Jun se una a Fos y, por lo tanto, se forme AP-1. AP-1 luego actúa como factor de transcripción. Raf se activa a través del segundo mensajero DAG, SOS y Ras. DAG recluta, entre otras proteínas, la proteína liberadora de nucleótidos de guanina RAS ( RasGRP ), un factor de intercambio de nucleótidos de guanina (GEF), a la membrana. RasGRP activa la pequeña GTPasa Ras intercambiando el difosfato de guanosina (GDP) unido a Ras por el trifosfato de guanosina (GTP). Ras también puede ser activado por el factor de intercambio de nucleótidos de guanina SOS que se une al signalosoma LAT. Ras inicia entonces la cascada MAPK. [39] La segunda cascada MAPK con MEKK1 , JNKK, JNK induce la expresión de la proteína Jun. Otra cascada, que también involucra a MEKK1 como MAPK3, pero que luego activa MKK3 /6 y p38 induce la transcripción de Fos. La activación de MEKK1, además de ser activada por Ras, involucra a Slp-76 reclutando el GEF Vav al signalosoma LAT, que luego activa la GTPasa Rac. Rac y Ras activan MEKK1 y, por lo tanto, inician la cascada MAPK. [39]
Véase también
Referencias
- ^ Kindt TJ, Goldsby RA, Osborne BA, Kuby J (2007). Inmunología de Kuby. Macmillan. págs.223–. ISBN 978-1-4292-0211-4. Consultado el 28 de noviembre de 2010 .
- ^ Sewell AK (septiembre de 2012). "¿Por qué las células T deben tener reactividad cruzada?". Nature Reviews. Inmunología . 12 (9): 669–77. doi :10.1038/nri3279. PMC 7097784 . PMID 22918468.
- ^ ab Glusman G, Rowen L, Lee I, Boysen C, Roach JC, Smit AF, et al. (septiembre de 2001). "Genómica comparativa de los loci de los receptores de células T humanos y de ratón". Inmunidad . 15 (3): 337–49. doi : 10.1016/s1074-7613(01)00200-x . PMID 11567625.
- ^ Deakin JE, Parra ZE, Graves JA, Miller RD (2006). "Mapeo físico de los loci de los receptores de células T (TRA@, TRB@, TRD@ y TRG@) en la zarigüeya (Monodelphis domestica)". Cytogenetic and Genome Research . 112 (3–4): 342K. doi : 10.1159/000089901 . PMID 16484802.
- ^ ab Dushek O, Goyette J, van der Merwe PA (noviembre de 2012). "Receptores fosforilados en tirosina no catalíticos". Revisiones inmunológicas . 250 (1): 258–76. doi :10.1111/imr.12008. PMID 23046135. S2CID 1549902.
- ^ Allison JP, McIntyre BW, Bloch D (noviembre de 1982). "Antígeno tumoral específico del linfoma T murino definido con anticuerpo monoclonal". Journal of Immunology . 129 (5): 2293–2300. doi : 10.4049/jimmunol.129.5.2293 . PMID 6181166. S2CID 13249566.
- ^ Meuer SC, Fitzgerald KA, Hussey RE, Hodgdon JC, Schlossman SF, Reinherz EL (febrero de 1983). "Estructuras clonotípicas implicadas en la función de las células T humanas específicas de antígeno. Relación con el complejo molecular T3". The Journal of Experimental Medicine . 157 (2): 705–719. doi :10.1084/jem.157.2.705. PMC 2186929 . PMID 6185617.
- ^ Haskins K, Kubo R, White J, Pigeon M, Kappler J, Marrack P (abril de 1983). "El receptor de antígeno restringido por el complejo mayor de histocompatibilidad en las células T. I. Aislamiento con un anticuerpo monoclonal". The Journal of Experimental Medicine . 157 (4): 1149–1169. doi :10.1084/jem.157.4.1149. PMC 2186983 . PMID 6601175.
- ^ Yanagi Y, Yoshikai Y, Leggett K, Clark SP, Aleksander I, Mak TW (8 de marzo de 1984). "Un clon de ADNc específico de células T humanas codifica una proteína que tiene una homología extensa con las cadenas de inmunoglobulina". Nature . 308 (5955): 145–149. Bibcode :1984Natur.308..145Y. doi :10.1038/308145a0. PMID 6336315. S2CID 4229210.
- ^ Hedrick SM, Cohen DI, Nielsen EA, Davis MM (8 de marzo de 1984). "Aislamiento de clones de ADNc que codifican proteínas asociadas a la membrana específicas de las células T". Nature . 308 (5955): 149–153. Bibcode :1984Natur.308..149H. doi :10.1038/308149a0. PMID 6199676. S2CID 4273688.
- ^ Janeway Jr CA, Travers P, Walport M, et al. (2001). Inmunobiología: el sistema inmunitario en la salud y la enfermedad. Quinta edición. Glosario: Garland Science.
- ^ Kieke MC, Shusta EV, Boder ET, Teyton L, Wittrup KD, Kranz DM (mayo de 1999). "Selección de mutantes funcionales del receptor de células T a partir de una biblioteca de presentación en superficie de levadura". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 96 (10): 5651–6. Bibcode :1999PNAS...96.5651K. doi : 10.1073/pnas.96.10.5651 . PMC 21915 . PMID 10318939.
- ^ Sundberg EJ, Deng L, Mariuzza RA (agosto de 2007). "Reconocimiento por TCR de complejos péptido/MHC de clase II y superantígenos". Seminarios de inmunología . Estructura y función de los receptores de antígenos. 19 (4): 262–271. doi :10.1016/j.smim.2007.04.006. PMC 2949352. PMID 17560120 .
- ^ Janeway CA, Travers P, Walport M, et al. (2001). "La generación de receptores de antígenos linfocíticos". Inmunobiología: el sistema inmunitario en la salud y la enfermedad (5.ª ed.). Garland Science.
- ^ ab Call ME, Pyrdol J, Wiedmann M, Wucherpfennig KW (diciembre de 2002). "El principio organizador en la formación del complejo receptor de células T-CD3". Cell . 111 (7): 967–79. doi :10.1016/s0092-8674(02)01194-7. PMC 3420808 . PMID 12507424.
- ^ Smith-Garvin JE, Koretzky GA, Jordan MS (2009). "Activación de células T". Revisión anual de inmunología . 27 : 591–619. doi :10.1146/annurev.immunol.021908.132706. PMC 2740335 . PMID 19132916.
- ^ ab Feinerman O, Germain RN, Altan-Bonnet G (febrero de 2008). "Desafíos cuantitativos en la comprensión de la discriminación de ligandos por parte de las células T de la cadena alfa". Inmunología molecular . 45 (3): 619–31. doi :10.1016/j.molimm.2007.03.028. PMC 2131735 . PMID 17825415.
- ^ Yang H, Buisson S, Bossi G, Wallace Z, Hancock G, So C, et al. (noviembre de 2016). "Eliminación de células latentemente infectadas por VIH de sujetos suprimidos por terapia antirretroviral mediante receptores de células T inmunomovilizadores diseñados". Molecular Therapy . 24 (11): 1913–1925. doi :10.1038/mt.2016.114. PMC 5154472 . PMID 27401039.
- ^ Blum JS, Wearsch PA, Cresswell P (2013). "Vías de procesamiento de antígenos". Revisión anual de inmunología . 31 : 443–73. doi :10.1146/annurev-immunol-032712-095910. PMC 4026165 . PMID 23298205.
- ^ Evavold BD, Allen PM (mayo de 1991). "Separación de la producción de IL-4 de la proliferación de células Th por un ligando del receptor de células T alterado". Science . 252 (5010): 1308–10. Bibcode :1991Sci...252.1308E. doi :10.1126/science.1833816. PMID 1833816.
- ^ Kersh GJ, Allen PM (octubre de 1996). "Base estructural para el reconocimiento de ligandos peptídicos alterados por parte de las células T: un único receptor de células T puede reconocer de forma productiva un gran continuo de ligandos relacionados". The Journal of Experimental Medicine . 184 (4): 1259–68. doi :10.1084/jem.184.4.1259. PMC 2192852 . PMID 8879197.
- ^ Donermeyer DL, Weber KS, Kranz DM, Allen PM (noviembre de 2006). "El estudio de los TCR de alta afinidad revela dualidad en el reconocimiento de antígenos por parte de las células T: especificidad y degeneración". Journal of Immunology . 177 (10): 6911–9. doi : 10.4049/jimmunol.177.10.6911 . PMID 17082606.
- ^ Cole DK, Pumphrey NJ, Boulter JM, Sami M, Bell JI, Gostick E, et al. (mayo de 2007). "La afinidad de unión del TCR humano está regida por la restricción de clase del MHC". Journal of Immunology . 178 (9): 5727–34. doi : 10.4049/jimmunol.178.9.5727 . PMID 17442956.
- ^ Whitty A, Raskin N, Olson DL, Borysenko CW, Ambrose CM, Benjamin CD, Burkly LC (octubre de 1998). "Afinidad de interacción entre los componentes del receptor de citocinas en la superficie celular". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 95 (22): 13165–70. Bibcode :1998PNAS...9513165W. doi : 10.1073/pnas.95.22.13165 . PMC 23746 . PMID 9789059.
- ^ ab Altan-Bonnet G, Germain RN (noviembre de 2005). "Modelado de la discriminación de antígenos de células T basado en el control de retroalimentación de respuestas digitales de ERK". PLOS Biology . 3 (11): e356. doi : 10.1371/journal.pbio.0030356 . PMC 1262625 . PMID 16231973.
- ^ abc Dushek O, Aleksic M, Wheeler RJ, Zhang H, Cordoba SP, Peng YC, et al. (junio de 2011). "La potencia antigénica y la eficacia máxima revelan un mecanismo de activación eficiente de las células T". Science Signaling . 4 (176): ra39. doi :10.1126/scisignal.2001430. PMC 4143974 . PMID 21653229.
- ^ Huang J, Brameshuber M, Zeng X, Xie J, Li QJ, Chien YH, et al. (noviembre de 2013). "Un ligando de un solo péptido-complejo mayor de histocompatibilidad desencadena la secreción de citocinas digitales en células T CD4(+)". Inmunidad . 39 (5): 846–57. doi :10.1016/j.immuni.2013.08.036. PMC 3846396 . PMID 24120362.
- ^ Miller MJ, Hejazi AS, Wei SH, Cahalan MD, Parker I (enero de 2004). "El escaneo del repertorio de células T es promovido por el comportamiento dinámico de las células dendríticas y la motilidad aleatoria de las células T en el ganglio linfático". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 101 (4): 998–1003. Bibcode :2004PNAS..101..998M. doi : 10.1073/pnas.0306407101 . PMC 327133 . PMID 14722354.
- ^ McKeithan TW (mayo de 1995). "Corrección cinética en la transducción de señales del receptor de células T". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 92 (11): 5042–6. Bibcode :1995PNAS...92.5042M. doi : 10.1073/pnas.92.11.5042 . PMC 41844 . PMID 7761445.
- ^ Dushek O, van der Merwe PA (abril de 2014). "Un modelo de discriminación de antígenos mediante la reunificación inducida". Tendencias en inmunología . 35 (4): 153–8. doi :10.1016/j.it.2014.02.002. PMC 3989030 . PMID 24636916.
- ^ Lever M, Maini PK, van der Merwe PA, Dushek O (septiembre de 2014). "Modelos fenotípicos de activación de células T". Nature Reviews. Inmunología . 14 (9): 619–29. doi :10.1038/nri3728. PMID 25145757. S2CID 14274400.
- ^ von Essen MR, Kongsbak M, Geisler C (2012). "Mecanismos detrás de la maduración de la avidez funcional en células T". Inmunología clínica y del desarrollo . 2012 : 163453. doi : 10.1155/2012/163453 . PMC 3351025. PMID 22611418 .
- ^ abcdefgh Murphy KM, Weaver C (22 de marzo de 2016). Inmunobiología de Janeway (novena edición). WW Norton & Company. ISBN 978-0815345510.
- ^ ab van der Merwe PA, Dushek O (2011). "Mecanismos de activación del receptor de células T". Nature Reviews Immunology . 11 (1): 47–55. doi :10.1038/nri2887. PMID 21127503. S2CID 22423010.
- ^ Abram CL, Lowell CA (marzo de 2007). "El papel en expansión de las vías de señalización basadas en ITAM en las células inmunitarias". Science's STKE . 2007 (377): re2. doi :10.1126/stke.3772007re2. PMID 17356173. S2CID 44314604.
- ^ Nika K, Soldani C, Salek M, Paster W, Gray A, Etzensperger R, et al. (junio de 2010). "La quinasa Lck constitutivamente activa en las células T impulsa la transducción de señales del receptor de antígeno". Inmunidad . 32 (6): 766–77. doi : 10.1016/j.immuni.2010.05.011 . PMC 2996607 . PMID 20541955.
- ^ Tang Q, Subudhi SK, Henriksen KJ, Long CG, Vives F, Bluestone JA (mayo de 2002). "La quinasa Fyn de la familia Src media las señales inducidas por antagonistas del TCR". Journal of Immunology . 168 (9): 4480–7. doi : 10.4049/jimmunol.168.9.4480 . PMID 11970992.
- ^ Salmond RJ, Filby A, Qureshi I, Caserta S, Zamoyska R (marzo de 2009). "La señalización proximal del receptor de células T a través de las quinasas de la familia Src, Lck y Fyn, influye en la activación, diferenciación y tolerancia de las células T". Revisiones inmunológicas . 228 (1): 9–22. doi :10.1111/j.1600-065X.2008.00745.x. PMID 19290918. S2CID 46343285.
- ^ abcdef Huse M (mayo de 2009). "La red de señalización del receptor de células T". Journal of Cell Science . 122 (Pt 9): 1269–73. doi : 10.1242/jcs.042762 . PMID 19386893.
- ^ "UniProtKB - P06239 (LCK_HUMAN)". Uniprot . Consultado el 7 de mayo de 2020 .
- ^ Essen LO, Perisic O, Katan M, Wu Y, Roberts MF, Williams RL (febrero de 1997). "Mapeo estructural del mecanismo catalítico de una fosfolipasa C específica de fosfoinosítidos en mamíferos". Bioquímica . 36 (7): 1704–18. doi :10.1021/bi962512p. PMID 9048554.
Enlaces externos
- Receptor de células T+ en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
