Administración de fármacos oftálmicos

La administración de fármacos oftálmicos es la administración de un fármaco a los ojos, generalmente en forma de gotas oftálmicas . Las formulaciones tópicas se utilizan para combatir una multitud de enfermedades oculares. Estas enfermedades pueden incluir infecciones bacterianas , lesiones oculares, glaucoma y ojo seco . [1] Sin embargo, existen muchos desafíos asociados con la administración tópica de fármacos a la córnea del ojo.
Formulaciones de gotas para los ojos
Dos de los mayores desafíos que se enfrentan al usar tópicos para tratar estados patológicos del ojo incluyen el cumplimiento del paciente y la absorción ineficaz de los medicamentos en la córnea debido a los cortos tiempos de contacto, el drenaje de la solución, la renovación de las lágrimas y la dilución o lagrimeo. [1] [2] [3] [4] [ 5] [6] [7] De hecho, los investigadores en este campo de administración de medicamentos coinciden en que menos del 7% de los medicamentos administrados al ojo alcanzan y penetran la barrera corneal, por lo tanto, aumenta la frecuencia de dosificación utilizada para los tópicos. [1] [2] [3] [4] [5] [6] [7] Este es uno de los problemas fundamentales asociados con el uso de tópicos para administrar medicamentos a la córnea y, por lo tanto, conduce a una mayor demanda de cumplimiento del paciente. Juntos, estos dos factores impulsan una necesidad en el campo de la investigación científica y la ingeniería de una forma de administrar mejor los medicamentos a la córnea del ojo mientras se reduce la frecuencia de dosificación y la demanda de cumplimiento del paciente. Las estrategias para lograr un tiempo de residencia prolongado de los sistemas de administración de fármacos en la superficie ocular incluyen polímeros mucoadhesivos y gelificantes in situ y ciclodextrinas tioladas (ver tiómeros ). [8] Además de los problemas logísticos asociados con el uso de tópicos, también existen efectos secundarios sistémicos que resultan de la administración de algunos fármacos utilizados para combatir los estados patológicos del ojo. [3] Con el aumento de la concentración de fármacos en tópicos y la aplicación frecuente en el ojo, la mayoría del fármaco se drena del ojo a través del drenaje nasolagrimal. [3] Se cree que este drenaje es la razón por la que existen efectos secundarios sistémicos de dicha administración. [2] [3] [6]
Lentes de contacto como dispositivos de administración

Los Centros para el Control y la Prevención de Enfermedades (CDC) de Estados Unidos afirman que en 2018 había "aproximadamente 41 millones de usuarios de lentes de contacto mayores de 18 años en Estados Unidos". [9] De todos estos usuarios, casi el 90 % usa lentes de contacto conocidas como "lentes de contacto blandas" (SCL, por sus siglas en inglés). [9] Las lentes de contacto están reguladas por la Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en inglés). [10]
Los principales enfoques que utilizan actualmente los investigadores en este campo son: la impresión molecular, el remojo supercrítico, la impregnación con disolventes y la carga de nanopartículas . [2] [4] [5] [7] Cada una de estas técnicas ayuda a administrar los medicamentos a un ritmo más bajo y sostenido que no requiere una mayor exigencia de cumplimiento por parte del paciente ni los efectos secundarios sistémicos de los sistemas de administración tópica de medicamentos . Sin embargo, cada uno de estos diferentes tipos de técnicas de carga da como resultado lentes de contacto que tienen desafíos físicos y químicos separados cuando se trata de la liberación sostenida y la penetración de medicamentos específicos a nivel molecular en lo que respecta a la córnea del ojo.

Impronta molecular
La impronta molecular es un proceso mediante el cual la polimerización de un polímero alrededor de una plantilla da como resultado una matriz de polímero con plantillas incrustadas. [2] [5] Después de retirar la plantilla, se forma una cavidad con los monómeros funcionalizados dentro de la cavidad del polímero. Esta cavidad es la posición ideal para la carga del fármaco, ya que este proceso se puede diseñar específicamente para reclutar y retener fármacos debido a la especificidad química. [2] [5] Esta técnica se puede visualizar mejor consultando la Figura 3.0. Este tipo de carga de fármacos se puede utilizar como una forma de crear un sistema sensible al pH, que libera fármaco(s) a medida que cambia el pH del sistema biológico. [2] [5] Algunos fármacos que se han cargado con éxito mediante este método son: timolol , norfloxacino , ketotifeno , polivinilpirrolidona y ácido hialurónico . [5] [11] [12] Las estructuras moleculares de cada uno de estos fármacos se muestran a continuación en el índice de terminología científica importante.
Remojo supercrítico/impregnación con disolventes
El método de remojo supercrítico se utiliza comúnmente en lentes de contacto a base de hidrogel y es el más común de todos los tipos de técnicas de carga de fármacos moleculares. Dado que esta técnica no requiere equipo especial ni conocimientos avanzados de hidrogeles a base de polímeros, es el menos complejo de todos los tipos de carga. [4] Para cargar la matriz de hidrogel con un determinado fármaco, las lentes de contacto simplemente se colocan en una solución del fármaco y el fármaco se difunde en la matriz. [4] [5] [7] Dado que esta técnica de carga está impulsada únicamente por el gradiente de la concentración del fármaco que rodea la lente en relación con la matriz de hidrogel, la velocidad de difusión y la cantidad de fármaco que se carga se pueden controlar únicamente por la concentración de la solución del fármaco. [4] [7] Dado que este proceso permite cargar cantidades específicas de un determinado fármaco en la matriz de hidrogel, este método de carga se ha vuelto importante para la medicina y los tratamientos específicos para el paciente (personalizados).
.jpg/440px-Nanoparticle;_Gold_(5978123772).jpg)
Carga de nanopartículas
La técnica de carga de nanopartículas incluye dos partes principales. La primera parte de este proceso es la creación y conjugación de un fármaco específico en una nanopartícula u otra partícula coloidal. [5] A continuación, la nanopartícula se carga en la matriz de hidrogel de la lente de contacto. [5] En este caso, antes de que el fármaco pueda difundirse fuera de la matriz de hidrogel para llegar a la córnea, también debe difundirse o liberarse fuera de la nanopartícula. [5]
Desafíos físicos y químicos de la carga
Es importante reconocer los aspectos positivos y negativos asociados con cada tipo de carga de fármaco para el uso de lentes de contacto como dispositivos de administración de fármacos. Para abordar seriamente la posibilidad de la traducción clínica de estos dispositivos, es importante reconocer las barreras físicas y químicas. Al comprender esto mejor, se puede optimizar el mecanismo de carga de fármacos y la liberación controlada y sostenida de fármacos en el ojo de un paciente.
Transparencia de la lente
Dado que las lentes de contacto se utilizan en una parte del cuerpo que es importante para el funcionamiento diario normal (la vista), es fundamental que los científicos tengan en cuenta la transparencia de la lente. [5] A medida que se cargan más y más medicamentos/objetos en una lente de contacto, esta comienza a abarrotar físicamente el espacio disponible, lo que dificulta que la luz penetre y llegue al ojo.
Concepto fundamental: Una analogía sencilla es la de un área llena de gente frente a una vacía mientras llueve. Cuando hay mucha gente, la lluvia cae sobre la gente y se dirige al suelo de forma lenta pero segura y dispersa. En un área vacía, la lluvia puede caer y caer al suelo fácilmente y sin interferencias de la gente. En esta analogía, la lluvia es análoga a la luz y la gente es análoga a las drogas que se introducen en una lente de contacto. Cuanto más drogas se añaden a la lente de contacto, menos luz puede penetrar sin dispersarse aleatoriamente. La dispersión aleatoria de la luz puede dar lugar a una visión borrosa y desenfocada.
Los investigadores han observado que al utilizar la técnica de carga de nanopartículas, la transparencia disminuye casi un 10 %. [5] Por el contrario, los investigadores han confirmado que al utilizar los métodos de impresión molecular y remojo supercrítico para la carga de fármacos, la transparencia de las lentes de contacto se ha mantenido igual o por encima de la transparencia de las lentes de contacto aprobadas actualmente por la FDA. [5] [12]
Permeabilidad al oxígeno
La permeabilidad al oxígeno es otra característica importante de todas las lentes de contacto y debe optimizarse al máximo posible al crear dispositivos de administración de medicamentos para el ojo. La lente de contacto se adhiere a la córnea externa del ojo, que está formada por una capa de células. [13] Las células, al ser el componente básico de los organismos vivos, requieren un acceso sostenido y constante al oxígeno para sobrevivir. La córnea del ojo no recibe sangre como la mayoría de las demás células del cuerpo, lo que la convierte en una parte difícil del cuerpo a la que administrar medicamentos. [13] La disminución de la oxigenación del ojo puede provocar efectos secundarios indeseables. [5] Los investigadores en este campo han observado que los diferentes tipos de lentes de contacto tienen distintos grados de permeabilidad al oxígeno. Por ejemplo, se ha demostrado que las SCL tienen una permeabilidad al oxígeno limitada, mientras que las lentes de contacto a base de silicona tienen una permeabilidad al oxígeno mucho mejor. [1] [5] [12] [14] También se ha demostrado que las lentes de contacto a base de silicona tienen otros parámetros físicos muy importantes. [1] [5] [12] [14]
Los investigadores han intentado aumentar el grosor de las lentes de contacto para aumentar la capacidad de carga de fármacos de la lente de contacto. [12] Sin embargo, para las lentes de contacto a base de silicona, este parámetro es inversamente proporcional a la permeabilidad al oxígeno (es decir, a medida que aumenta el grosor de la lente de contacto, la permeabilidad al oxígeno disminuye). [12] Además, se ha demostrado que a medida que aumenta el contenido de agua en las lentes de contacto a base de silicona, la permeabilidad al oxígeno disminuye, otra relación que es inversamente proporcional. [12] Sorprendentemente, a medida que aumentan las SCL con el contenido de agua, la permeabilidad al oxígeno también aumenta (una relación directamente proporcional). [12]
En cuanto a si las lentes de contacto a base de silicona o las SCL son mejores candidatas como dispositivo de administración de fármacos oftálmicos, es una pregunta que sigue sin respuesta y no existe un consenso uniforme en la comunidad científica. Por ejemplo, Ciolino et al. afirman que las lentes de contacto a base de silicona son mejores candidatas para pacientes que usan lentes de contacto a largo plazo. [2] [3] Por el contrario, Kim et al. sugieren que las SCL son mejores candidatas porque muestran la posibilidad de poder superar la dificultad de la permeabilidad al oxígeno, así como la integridad mecánica de la lente. [7] Kim et al. han demostrado que la resistencia mecánica de las SCL se puede aumentar incorporando una infraestructura de nanodiamantes (ND) en la matriz de la lente de contacto. [7]
Además, muchos investigadores han estudiado las implicaciones de cargar vitamina E en la matriz de las lentes de contacto de los SCL. [6] Aunque se ha demostrado que la incorporación de vitamina E en la matriz ralentiza la liberación de fármacos en el ojo y en la córnea (una característica deseable de un sistema de administración oftálmica), también se ha demostrado que disminuye la permeabilidad al oxígeno. [6] La permeabilidad al oxígeno sigue siendo un factor extremadamente importante en el desarrollo de estos dispositivos y es una de las principales razones por las que muchas investigaciones están empezando a centrarse en esta área de administración de fármacos.
Contenido de agua
La cantidad de contenido de agua que puede retener una determinada lente de contacto es otro factor extremadamente importante que debe tenerse en cuenta cuando se diseñan estos dispositivos. Las investigaciones en esta área específica de diseño sugieren que los usuarios de lentes de contacto encuentran más cómodo usar lentes que retienen agua más que aquellos que la repelen. [5] [12] Para las SCL, a medida que aumenta el contenido de agua de una lente, también lo hace la permeabilidad al oxígeno. [12] Por el contrario, a medida que aumenta el contenido de agua en las lentes de contacto a base de silicona, disminuye la permeabilidad al oxígeno. [2] [3] [12] En referencia a las SCL, un mayor contenido de agua en las lentes de contacto permite una carga más fácil utilizando el método de remojo supercrítico. [3] [5] [12] [15] Esto podría deberse a que el agua actúa como lubricante para algunos fármacos y permite que el fármaco se introduzca más fácilmente en la matriz. Esto permitiría esencialmente que se cargara más fármaco en lentes de contacto de este tipo. [5] [12] Este aumento en la capacidad de carga del fármaco es un avance importante y permitiría a los pacientes un período más prolongado de liberación del fármaco y, con suerte, sería más sostenido. [5]
Además, Guzmán-Aranguez et al. han demostrado que cuando se utiliza el método de impronta molecular para cargar fármacos como ketotifeno y norfloxacino en la lente de contacto, el contenido de agua no se ve afectado en gran medida. [5] Además, Peng et al. han predicho mediante el uso de modelos cinéticos de liberación de Fick que, aunque el contenido de agua cambia una vez que las lentes de contacto se insertan en la córnea del ojo, esto no planteará desafíos significativos cuando se trata de la liberación de alfombras de las SCL. [16]
Cinética de liberación de fármacos
El factor más importante que se debe tener en cuenta al diseñar cualquier tipo de dispositivo de administración de fármacos, y específicamente dispositivos oculares, es la velocidad de liberación del fármaco. Como se ha comentado anteriormente, la velocidad de administración y la cinética asociadas a los fármacos en el ojo pueden alcanzar niveles tóxicos para el ojo o incluso provocar efectos secundarios indeseables. La velocidad de liberación de un fármaco también es importante porque una liberación demasiado lenta podría no tener ningún resultado beneficioso para el paciente y una liberación demasiado rápida podría provocar efectos secundarios negativos. [10] [14] [16] [17] Por tanto, es importante equilibrar los factores que rigen la liberación de fármacos de las lentes de contacto como posibles dispositivos de administración de fármacos. Investigadores como C. Alvarez-Lorenzo han realizado pruebas (con modelos animales) y tienen datos que respaldan que las lentes de contacto con impresión molecular liberan fármacos en un período de tiempo prolongado y sostenido. [12] Los investigadores también han respaldado que la velocidad de liberación del fármaco se puede controlar incorporando vitamina E dentro de la matriz de hidrógeno. [6]
Efectos secundarios sistémicos
Con el tiempo, se ha informado que muchos de los mismos medicamentos y gotas para los ojos utilizados para tratar enfermedades oculares particulares, de hecho, dan lugar a efectos secundarios sistémicos que posiblemente podrían minimizarse o limitarse debido a una liberación más lenta y sostenida del medicamento. Los efectos secundarios sistémicos de los medicamentos para el glaucoma, como el latanoprost, aumentaron la frecuencia cardíaca, lo que resultó en arritmias cardíacas, broncoconstricción e hipotensión. [16] [17] [18] Estas complicaciones podrían poner en peligro la vida. Algunos otros medicamentos que ayudan a reducir los efectos del glaucoma en el ojo dan lugar a vómitos, diarrea, taquicardia y broncoespasmo. [15] [16] [17] [18] Se ha descubierto que algunos medicamentos administrados en forma de gotas para los ojos son altamente tóxicos para los niños, ya que su volumen corporal total y los volúmenes de tejido son mucho menores que los de un adulto para el que están destinados a su uso. [17] En este caso, algunos padres no son conscientes de estas implicaciones y podrían utilizar el mismo fármaco que utilizarían para ayudar a tratar las infecciones bacterianas oculares de sus hijos. Además, se ha demostrado que algunos fármacos administrados en el ojo provocan depresión cardíaca y propagación de algunos trastornos como el asma. [16] [17] [18] Con la investigación continua en esta área, se ha sabido que la irritación de la piel, el picor o el sarpullido se asocian comúnmente con los fármacos utilizados para tratar las infecciones bacterianas oculares. [15] [16] [17] [18]
Trastornos oculares
Actualmente hay cuatro trastornos oculares principales que se han investigado intensamente y que han demostrado tener éxito con el uso de lentes de contacto como posibles dispositivos para la administración de fármacos moleculares.
Infección bacteriana

La velocidad de liberación del fármaco es extremadamente importante en el tratamiento de muchas enfermedades oculares, siendo una de ellas las infecciones bacterianas. La ciprofloxacina y la norfloxacina son fármacos que se utilizan normalmente para tratar infecciones bacterianas oculares. Es de suma importancia que estos fármacos permanezcan en la ventana terapéutica durante un período prolongado de tiempo para que sean completamente efectivos y maten las bacterias. [5] [12] Para mantener el fármaco específico en la ventana terapéutica utilizando gotas para los ojos, el tópico debe aplicarse aproximadamente cada 30 minutos para que sea completamente efectivo. [5] [12] Tener que aplicar gotas para los ojos cada 30 minutos sería casi imposible para cualquier persona y no es el mecanismo ideal para administrar dichos fármacos al ojo. Los investigadores han reunido datos que respaldan la idea de que las lentes de contacto a base de silicona con ciprofloxacina podrían liberar el fármaco en la ventana terapéutica durante aproximadamente un mes. [5] Ana Guzmán-Aranguez et al. también confirmaron que las lentes de contacto utilizadas también conservaban propiedades importantes como la transparencia, la permeabilidad al oxígeno, la resistencia mecánica y la farmacocinética de liberación de orden cero. [5]

Lesión corneal
Muchos factores pueden provocar una lesión corneal y causar el deterioro o la muerte de las células que forman la córnea del ojo. [5] [12] Las células epiteliales que forman la córnea son importantes para una visión normal. Estas células desempeñan un papel en la creación de un entorno físico que puede doblar correctamente los rayos de luz para ayudar a proyectar imágenes en la retina del ojo. [5] [12] Se han realizado ensayos clínicos exitosos en humanos con el uso de SCL infundidos con factor de crecimiento epidérmico (EGF) que mostraron una mayor tasa de curación de la capa de células epiteliales de la córnea. [5]

Glaucoma
El glaucoma es la principal causa de ceguera en el mundo y es una enfermedad progresiva e irreversible del ojo. [18] Ciolino et al. demostraron que una lente de contacto a base de ácido poli(láctico-co-glicólico) libera latanoprost a una velocidad de liberación sostenida de hasta un mes en modelos animales en la Facultad de Medicina de Harvard y el Instituto Tecnológico de Massachusetts. [18] El latanoprost es una de las intervenciones farmacológicas utilizadas para tratar a pacientes con glaucoma, generalmente en forma de tópicos como gotas para los ojos . [18]

Ojo seco
Más del 50% de todos los usuarios de lentes de contacto informan que sufren de ojo seco . [5] Para ayudar a combatir este problema y estar seguros de que esto no ocurra en personas que algún día usarán lentes de contacto liberadores de fármacos, es importante asegurarse de que esta complicación se investigue a fondo. Sin embargo, estas investigaciones no solo serán beneficiosas para los lentes de contacto como dispositivos de administración de fármacos, sino que también tendrán implicaciones positivas para los usuarios de lentes de contacto que usan lentes para corregir la visión y la apariencia.
| Término | Definición |
|---|---|
| Sistema sensible al pH | la capacidad de un sistema biológico de sufrir cambios que promueven la actividad, inactividad, liberación de compuestos o degradación como resultado de cambios realizados en el pH del microambiente de un determinado sistema |
| drenaje nasolagrimal | Drenaje de partículas/fluidos hacia el cuerpo a través del conducto lagrimal (nasolagrimal) |
| sistémico | de o relacionado con todo el cuerpo |
| cinética de orden cero | liberación de un fármaco desde un dispositivo de administración a una velocidad singular y constante durante todo el tiempo de liberación |
| Timolol (1-[(2-metil-2-propanil)amino]-3-{[4-(4-morfolinil)-1,2,5-tiadiazol-3-il]oxi}-2-propanol) |  |
| Norfloxacino (ácido 1-etil-6-fluoro-4-oxo-7-(1-piperazinil)-1,4-dihidro-3-quinolincarboxílico) |  |
| Ketotifeno (10 H -benzo(4,5)ciclohepta(1,2- b )tiofen-10-ona, 4,9-dihidro-4-(1-metil-4-piperidinilideno) |  |
| Polivinilpirrolidona |  |
| Ácido hialurónico | 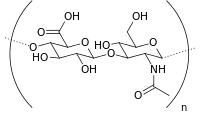 |
| Latanoprost (isopropil-(Z) 7[(1R,2R,3R,5S)3,5-dihidroxi-2-[(3R)-3-hidroxi-5-fenilpentil]ciclopentil]-5-heptenoato) | 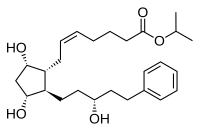 |
Referencias
- ^ abcde Tashakori-Sabzevar F, Mohajeri SA (mayo de 2015). "Desarrollo de sistemas de administración de fármacos oculares utilizando lentes de contacto blandas con impresión molecular". Desarrollo de fármacos y farmacia industrial . 41 (5): 703–13. doi :10.3109/03639045.2014.948451. PMID 25113431. S2CID 207465615.
- ^ abcdefghi Ciolino JB, Hoare TR, Iwata NG, Behlau I, Dohlman CH, Langer R, Kohane DS (julio de 2009). "Una lente de contacto liberadora de fármacos". Oftalmología investigativa y ciencia visual . 50 (7): 3346–52. doi :10.1167/iovs.08-2826. PMC 4657544. PMID 19136709 .
- ^ abcdefgh Ciolino JB, Hudson SP, Mobbs AN, Hoare TR, Iwata NG, Fink GR, Kohane DS (agosto de 2011). "Un prototipo de lente de contacto antimicótico". Oftalmología investigativa y ciencia visual . 52 (9): 6286–91. doi :10.1167/iovs.10-6935. PMC 3176015 . PMID 21527380.
- ^ abcdef Faccia PA, Pardini FM, Amalvy JI (junio de 2019). "Captación y liberación de dexametasona mediante hidrogeles de poli(2-hidroxietil metacrilato-co-2-(diisopropilamino)etil metacrilato) sensibles al pH para su posible uso en la administración ocular de fármacos". Journal of Drug Delivery Science and Technology . 51 : 45–54. doi :10.1016/j.jddst.2019.02.018. S2CID 104465994.
- ^ abcdefghijklmnopqrstu vwxyz aa ab ac ad Guzman-Aranguez A, Colligris B, Pintor J (marzo de 2013). "Lentes de contacto: dispositivos prometedores para la administración ocular de fármacos". Journal of Ocular Pharmacology and Therapeutics . 29 (2): 189–99. doi :10.1089/jop.2012.0212. PMID 23215541.
- ^ abcdef Hsu KH, Carbia BE, Plummer C, Chauhan A (agosto de 2015). "Administración dual de fármacos desde lentes de contacto cargadas con vitamina E para el tratamiento del glaucoma". Revista Europea de Farmacia y Biofarmacia . 94 : 312–21. doi :10.1016/j.ejpb.2015.06.001. PMID 26071799.
- ^ abcdefg Verma, Shalu; Nainwal, Nidhi; Kikon, Nueva York; Ali, Ashif; Jakhmola, Vikas. "Esperanzas y obstáculos de los nanogeles en el tratamiento de enfermedades oculares". Revista de Ciencias Farmacéuticas Aplicadas . 14 (2): 1–12. doi : 10.7324/JAPS.2023.153962 .
- ^ Grassiri B, Zambito Y, Bernkop-Schnürch A (2021). "Estrategias para prolongar el tiempo de residencia de los sistemas de administración de fármacos en la superficie ocular". Adv Colloid Interface Sci . 288 : 102342. doi :10.1016/j.cis.2020.102342. PMID 33444845.
- ^ ab Cope JR, Collier SA, Nethercut H, Jones JM, Yates K, Yoder JS (agosto de 2017). "Conductas de riesgo de infecciones oculares relacionadas con lentes de contacto entre adultos y adolescentes - Estados Unidos, 2016" (PDF) . MMWR. Informe semanal de morbilidad y mortalidad . 66 (32): 841–5. doi :10.15585/mmwr.mm6632a2. PMC 5657667 . PMID 28817556.
- ^ ab Centro de Dispositivos y Salud Radiológica (28 de octubre de 2019). «Lentes de contacto». Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . Consultado el 1 de abril de 2020 .
- ^ Lloyd AW, Faragher RG, Denyer SP (abril de 2001). "Biomateriales e implantes oculares". Biomateriales . 22 (8): 769–85. doi :10.1016/S0142-9612(00)00237-4. PMID 11246945.
- ^ abcdefghijklmnopqr Alvarez-Lorenzo C, Anguiano-Igea S, Varela-García A, Vivero-Lopez M, Concheiro A (enero de 2019). "Hidrogeles bioinspirados para lentes de contacto liberadores de fármacos". Acta Biomaterialia . 84 : 49–62. doi : 10.1016/j.actbio.2018.11.020 . PMID 30448434.
- ^ ab Sridhar M (2003). "Capítulo 17 LASIK hipermetrópico". Paso a paso en la cirugía LASIK . Jaypee Brothers Medical Publishers (P) Ltd. págs. 153–162. doi :10.5005/jp/books/10819_17. ISBN 978-81-8061-099-8.
- ^ abc Li CC, Chauhan A (mayo de 2006). "Modelado de la administración de fármacos oftálmicos mediante lentes de contacto empapadas". Investigación en química industrial e ingeniería . 45 (10): 3718–3734. doi :10.1021/ie0507934. ISSN 0888-5885.
- ^ abc Xu J, Li X, Sun F (febrero de 2011). "Evaluación in vitro e in vivo de lentes de contacto de hidrogel de silicona cargadas con fumarato de ketotifeno para la administración ocular de fármacos". Administración de fármacos . 18 (2): 150–8. doi : 10.3109/10717544.2010.522612 . PMID 21043996.
- ^ abcdef Peng CC, Burke MT, Carbia BE, Plummer C, Chauhan A (agosto de 2012). "Liberación prolongada de fármacos mediante lentes de contacto para el tratamiento del glaucoma". Journal of Controlled Release . 162 (1): 152–8. doi :10.1016/j.jconrel.2012.06.017. PMID 22721817.
- ^ abcdef Mikkelson TJ, Chrai SS, Robinson JR (octubre de 1973). "Biodisponibilidad alterada de fármacos en el ojo debido a la interacción fármaco-proteína". Journal of Pharmaceutical Sciences . 62 (10): 1648–53. doi :10.1002/jps.2600621014. PMID 4752109.
- ^ abcdefg Ciolino JB, Stefanescu CF, Ross AE, Salvador-Culla B, Cortez P, Ford EM, et al. (enero de 2014). "Rendimiento in vivo de una lente de contacto liberadora de fármacos para tratar el glaucoma durante un mes". Biomateriales . 35 (1): 432–9. doi :10.1016/j.biomaterials.2013.09.032. PMC 3874329 . PMID 24094935.