Arenavirus
| Arenavirus | |
|---|---|
 | |
| (A) Micrografía electrónica del virus Lassa , barra = 100 nm (B) diagrama y (C) genoma del arenavirus | |
| Clasificación de virus | |
| (sin clasificar): | Virus |
| Reino : | Riboviridae |
| Reino: | Virus de la ortiga |
| Filo: | Negarnaviricota |
| Clase: | Elioviricetes |
| Orden: | Virus Bunya |
| Familia: | Arenavirus |
| Géneros | |
| |
Un arenavirus es un virus de ARN ambisentido bisegmentado o trisegmentado que es miembro de la familia Arenaviridae . [1] [2] Estos virus infectan a roedores y ocasionalmente a humanos. También se ha descubierto una clase de arenavirus nuevos y altamente divergentes, conocidos propiamente como reptarenavirus, que infectan a las serpientes para producir la enfermedad de los cuerpos de inclusión , principalmente en boas constrictoras . Se sabe que al menos ocho arenavirus causan enfermedades humanas. Las enfermedades derivadas de los arenavirus varían en gravedad. La meningitis aséptica, una enfermedad humana grave que causa inflamación que cubre el cerebro y la médula espinal, puede surgir del virus de la coriomeningitis linfocítica . Los síndromes de fiebre hemorrágica , incluida la fiebre de Lassa , se derivan de infecciones como el virus Guanarito , el virus Junin , el virus Lassa , el virus Lujo , [3] el virus Machupo , el virus Sabia o el virus Whitewater Arroyo . [4] Debido a la asociación epidemiológica con roedores, algunos arenavirus y bunyavirus se denominan robovirus .
Estructura
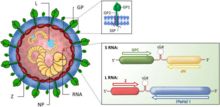
En un corte transversal, los arenavirus contienen partículas granuladas que son ribosomas adquiridos de sus células hospedadoras. Es por esta característica que adquirieron el nombre arena , de la raíz latina que significa arena . [5] No se cree que las estructuras ribosómicas sean esenciales para la replicación del virus. Las partículas virales, o viriones, son pleomórficas (de forma variable) pero a menudo son esféricas, con un diámetro de 60 a 300 nm, y están cubiertas con picos de glucoproteína superficial. [6]
El virus contiene una nucleocápside con dos segmentos de ARN monocatenario . La nucleocápside consiste en un núcleo de ácido nucleico encerrado en una capa de proteína. Aunque se los clasifica como virus de sentido negativo , [7] los arenavirus son ambisentidos . Mientras que secciones de su genoma codifican genes en sentido negativo (polaridad inversa), otras secciones codifican genes en la dirección opuesta (sentido directo/positivo). Se cree que esta compleja estructura de expresión génica es un sistema regulador primitivo, que permite al virus controlar qué proteínas se sintetizan en qué punto del ciclo de vida. El ciclo de vida del arenavirus está restringido al citoplasma celular. [ cita requerida ]
Genoma

Los arenavirus tienen un genoma de ARN segmentado que consta de dos ARN ambisentido monocatenarios. [8] Al igual que con todos los virus de ARN de sentido negativo, el ARN genómico por sí solo no es infeccioso y se requiere la maquinaria de replicación viral para iniciar la infección dentro de una célula huésped. [9] El ARN genómico de sentido empaquetado en el virión del arenavirus se denomina ARN de sentido negativo y primero debe copiarse en un ARNm de sentido positivo para producir proteína viral . [10] Los segmentos de ARN se denominan Pequeño (S), Mediano (M; si está presente) y Grande (L), [8] [11] y codifican cuatro proteínas virales en una estrategia de codificación ambisentido única. [12] [13] Para los mammarenavirus y reptarenavirus, cada segmento de ARN codifica dos proteínas virales en orientación opuesta, de modo que el genoma de ARN de sentido negativo sirve como plantilla para la transcripción de un único ARNm y la copia de sentido positivo del genoma de ARN moldea un segundo ARNm . [10] Las secuencias codificantes separadas de las dos proteínas virales están divididas por una secuencia de ARN de la región intergénica que se predice que se pliega en una estructura de horquilla estable. [14]
Los extremos terminales de cada segmento de ARN contienen una secuencia altamente conservada de 19 nucleótidos que es crítica para el reclutamiento de la maquinaria de replicación viral y el inicio de la transcripción del ARNm viral y la replicación genómica . [15] [16] [17] [18] [19] Las secuencias conservadas de los extremos 5' y 3' del ARN son complementarias y permiten que cada segmento de ARN adopte una estructura de panhandle de ARN bicatenario [20] que mantiene los extremos en estrecha proximidad y da como resultado una apariencia circular en las plantillas genómicas de arenavirus purificadas visualizadas por microscopía electrónica . [21] [22] La estructura de panhandle de ARN bicatenario es crítica para la síntesis eficiente de ARN viral, [18] [23] pero las posibles interacciones interterminales de ARN bicatenario deben aliviarse transitoriamente para reclutar la polimerasa viral . [19]
El ARN del segmento S tiene aproximadamente 3,5 kb y codifica la proteína de la nucleocápside viral (NP) y la glicoproteína (GPC). [24] El ARN del segmento L tiene aproximadamente 7,2 kb y codifica la ARN polimerasa dependiente del ARN viral (L) y una pequeña proteína que contiene el dominio RING (Z). [25] [26] [27]
La proteína Z forma homooligómeros y un componente estructural de los viriones. [28] La formación de estos oligómeros es un paso esencial para el ensamblaje y la gemación de partículas. La unión entre Z y el complejo de glucoproteína de la envoltura viral es necesaria para la infectividad del virión. Z también interactúa con las proteínas L y NP. La actividad de la polimerasa parece estar modulada por la asociación entre las proteínas L y Z. La interacción entre las proteínas Z y NP es fundamental para el empaquetamiento del genoma. [ cita requerida ]
Microbiología

La glicoproteína (GP) se sintetiza como molécula precursora. [29] Se divide en tres partes: GP1, GP2 y un péptido señal estable (SSP). Estas reacciones son catalizadas por peptidasas de señal celulares y la enzima celular isoenzima-1 de la subtilisina kexina (SKI-1)/proteasa del sitio 1 (S1P). Estos procesos son esenciales para la competencia de fusión y la incorporación de GP madura en partículas de virión en ciernes nacientes. [ cita requerida ]
Taxonomía
Dentro de la familia Arenaviridae , los arenavirus se clasificaban anteriormente en el género Arenavirus , pero en 2015 se dividieron en los géneros Mammarenavirus para aquellos con huéspedes mamíferos y Reptarenavirus para aquellos que infectan serpientes. [30] [31] Los reptarenavirus y los mammarenavirus están separados por una barrera de especies impenetrable. Los roedores infectados no pueden transmitir la enfermedad a las serpientes, y la EII en serpientes cautivas no es transmisible a los humanos. [ cita requerida ]
También se ha establecido un tercer género, Hartmanivirus ( que no debe confundirse con el género Haartmanvirus de vibriófagos de la familia Demerecviridae , orden Caudovirales ), [32] que incluye otras especies que infectan a las serpientes. La organización del genoma de este género es típica de los arenavirus, pero sus glicoproteínas se parecen a las de los filovirus . Las especies de este género carecen de la proteína matriz. [33]
También se ha establecido un cuarto género, Antennavirus , [34] para dar cabida a dos arenavirus que se encuentran en el pez sapo estriado ( Antennarius striatus ). [35] Se ha detectado un tercer Antennavirus en el salmón Chinook y el salmón rojo . [36]
Los mammarenavirus se pueden dividir en dos serogrupos, que difieren genéticamente y por distribución geográfica: [37] Cuando el virus se clasifica como "Viejo Mundo", esto significa que se encontró en el hemisferio oriental en lugares como Europa, Asia y África. Cuando se encuentra en el hemisferio occidental, en lugares como Argentina, Bolivia, Venezuela, Brasil y Estados Unidos, se clasifica como "Nuevo Mundo". El virus de la coriomeningitis linfocítica (LCM) es el único mammarenavirus que se encuentra en todo el mundo debido a su ubicuo huésped del Viejo Mundo, el ratón doméstico . Los virus de las áreas del Viejo y Nuevo Mundo parecen haber divergido hace ~45.000 años. [38] Los mammarenavirus del Viejo Mundo se originaron hace ~23,1-1,88 mil años, muy probablemente en el sur de África, mientras que los mammarenavirus del Nuevo Mundo evolucionaron en la región de América Latina y el Caribe hace ~41,4-3,3 mil años. [38]
Mammarenavirus
Complejo del Viejo Mundo

- Virus Alxa (ALXV)
- Virus Bitu (BITV)
- Virus Dandenong (DANV)
- Virus Dhati Welel (DHWV)
- Virus Gairo (GAIV)
- Virus Gbagroube
- Virus Ippy (IPPYV)
- Virus Kitale (KTLV)
- Virus Kodoko (KODV)
- Virus Kwanza (KWAV)
- Virus de Lassa (LASV)
- Virus de Lijiang (LIJV)
- Virus del río Loei (LORV)
- Virus de Lujo (LUJV)
- Virus Luna (LUAV)
- Virus del Lunk (LNKV)
- Virus de la coriomeningitis linfocítica (LCMV)
- Virus Mafiga (MAFV)
- Virus mariental (MRTV)
- Virus del paso del merino (MRWV)
- Virus Menekre
- Virus minúsculo
- Virus Mobala (MOBV)
- Virus de la mopea (MOPV)
- Virus de Morogoro (MORV)
- Virus Okahandja (OKAV)
- Virus de Ryukyu (RYKV)
- Virus Solwezi (SOLV)
- Virus de la gripe (SOUV)
- Virus de Wenzhou (WENV)
Complejo del Nuevo Mundo
- Clado A
- Virus Allpahuayo (AALV)
- Virus flexal (FLEV)
- Virus Paraná (PRAV)
- Virus Pichindé (PICHV)
- Virus pirita (PIRV)
- Clado B
- Virus Amapari (AMAV)
- Virus Aporé (APOV)
- Virus del Chapare (CHAPV)
- Virus Cupixi (CUPXV)
- Virus Guanarito (GTOV)
- Virus Junín (JUNV)
- Virus Machupo (MACV)
- Virus Ocozocoautla de Espinosa
- Virus Real de Catorce (RCTV)
- Virus Tacaribe (TCRV)
- Virus Xapuri (XAPV)
- Virus Sabiá (SBAV)
- Clado C
- Virus latino (LATV)
- Virus Oliveros (OLVV)
- Clado D
- Virus del Cañón del Oso (BCNV)
- Virus de la catarina (CTNV)
- Virus del tanque Skinner (SKTV)
- Virus Tamiami (TMMV)
- Virus de los arroyos de aguas bravas (WWAV)
- Virus de la catarina (CTNV)
- Virus del tanque de matorrales grandes (BBTV)
- Virus del tanque Skinner (SKTV)
- Virus de Tonto Creek (TTCV)
- Otros
- Virus de Patawa
Virus de la reptación
- Reptarenavirus de California
- Reptarenavirus de Giessen
- Reptarenavirus dorado
- Reptarenavirus común
- Reptarenavirus de Róterdam
Virus Hartmani
- Virus de Haartman
- Hartmanivirus doméstico
- Hartmanivirus de Muikkunen
- Hartmanivirus de la escuela
- Vacuna contra el hartmanivirus
- Hartmanivirus de Zúrich
Virus de antena
- Virus de la antena peluda
- Virus de la antena del salmón
- Virus de la antena estriada
Evolución
Se ha estudiado la evolución del género Mammarenavirus. [38] Las especies del Nuevo Mundo y del Viejo Mundo divergieron hace menos de 45.000 años. Las especies del Nuevo Mundo evolucionaron entre 41.400 y 3.300 años atrás en la región de América Latina y el Caribe. Las especies del Viejo Mundo evolucionaron entre 23.100 y 1.880 años atrás, muy probablemente en el sur de África. [38]
Embalses
Algunos arenavirus son patógenos zoonóticos y generalmente se asocian con enfermedades transmitidas por roedores a los humanos. Cada virus suele estar asociado con una especie particular de roedor huésped en la que se mantiene. Los arenavirus persisten en la naturaleza infectando primero a los roedores y luego transmitiéndose a los humanos. Los humanos pueden infectarse a través de la exposición de las mucosas a aerosoles o por contacto directo de la piel raspada con el material infeccioso, derivado de roedores infectados. [6] Los aerosoles son nieblas finas o aerosoles de excrementos secos de roedores, especialmente orina, que se dejan caer en el medio ambiente. La mayoría de los Arenavirus que contraen los humanos están dentro de sus propios hogares cuando estos roedores buscan refugio. El virus puede contraerse en fábricas, a partir de alimentos que han sido contaminados o dentro de áreas de trabajo agrícola. El riesgo de que los humanos contraigan la infección por Arenavirus está relacionado con la edad, la raza o el sexo dentro del grado de contacto con los excrementos secos de roedores. [ cita requerida ]
Epidemiología
Anfitriones
| Virus | Enfermedad | Anfitrión | Distribución |
|---|---|---|---|
| Dandenong [39] | Fiebre hemorrágica de Dandenong | Desconocido | Viejo mundo (casos australianos de Serbia) |
| Virus de la coriomeningitis linfocítica | Coriomeningitis linfocítica | Ratón doméstico ( Mus musculus ) | Mundial |
| Virus de Lassa | Fiebre de Lassa | Ratón multimamífero natal ( Mastomys natalensis ) | África occidental |
| Virus Junín | Fiebre hemorrágica argentina | Ratón vespertino de tierras secas ( Calomys musculinus ) | Argentina |
| Virus Machupo | Fiebre hemorrágica boliviana | Ratón vespertino grande ( Calomys callosus ) | Bolivia |
| Virus Guanarito | Fiebre hemorrágica venezolana | Ratón de caña de cola corta ( Zygodontomys brevicauda ) | Venezuela |
| Virus Sabiá | Fiebre hemorrágica brasileña | Desconocido | Brasil |
| Virus Tacaribe | Murciélago ( Artibeus ) | Trinidad | |
| Virus flexal | Enfermedad parecida a la gripe | Rata arrocera ( Oryzomys ) | Brasil |
| Virus de los arroyos de aguas bravas | Fiebre hemorrágica | Rata de bosque ( Neotoma ) | Suroeste de Estados Unidos |
Enfermedades clínicas

- Los virus de la coriomeningitis linfocítica (LCM) causan una enfermedad febril similar a la gripe , pero ocasionalmente pueden causar meningitis, característicamente acompañada por grandes cantidades de linfocitos en el líquido cefalorraquídeo (como sugiere el nombre LCM).
- El virus de Lassa causa la fiebre de Lassa . La fiebre de Lassa es endémica en África occidental. El virus se aisló por primera vez en una población estadounidense destinada en la aldea de Lassa, en Nigeria. El virus puede transmitirse de persona a persona.
- Enfermedades subclínicas: Los estudios serológicos sugieren que las infecciones asintomáticas son comunes, particularmente entre miembros de tribus de cazadores.
- Infecciones clínicas: La fiebre de Lassa se caracteriza por fiebre alta, mialgia intensa, coagulopatía, erupción cutánea hemorrágica y hemorragia visceral ocasional, así como necrosis del hígado y el bazo.
- Otros Arenavirus como el virus Junín y el virus Machupo causan fiebres hemorrágicas.
Todas estas enfermedades representan una gran amenaza para la salud pública en las regiones donde se producen. Por ejemplo, cuando el virus Lassa del Viejo Mundo se transforma en fiebre Lassa, esto suele dar lugar a una cantidad significativa de mortalidad. De manera similar, el virus Junín del Nuevo Mundo causa la fiebre hemorrágica argentina. Esta fiebre es una enfermedad grave con manifestaciones hemorrágicas y neurológicas y una tasa de letalidad del quince al treinta por ciento. [6] La forma en que este virus se propaga es a través del aumento de los viajes hacia y desde las regiones endémicas. Estos viajes han llevado a la importación de la fiebre Lassa a áreas metropolitanas no endémicas de todo el mundo.
Brotes recientes
Una nueva especie de arenavirus llamada virus Lujo ha sido relacionada con cinco pacientes que presentaron síntomas de fiebre hemorrágica viral en Sudáfrica. [40] La enfermedad se originó cerca de Lusaka, Zambia y se propagó a Johannesburgo , Sudáfrica , después de que el primer paciente fuera trasladado a un hospital allí. Los resultados de las pruebas de secuenciación genética realizadas por epidemiólogos de la Universidad de Columbia en la ciudad de Nueva York , EE. UU., y en la División de Patógenos Especiales de los Centros para el Control y Prevención de Enfermedades en Atlanta , EE. UU., proporcionaron evidencia de que el agente causal de la enfermedad es un virus de la familia Arenaviridae, que finalmente resultó en la muerte de cuatro de los cinco infectados en Zambia y Sudáfrica durante el brote que comenzó en septiembre de 2008. [ cita requerida ]
El arenavirus también ha sido señalado como la causa de muerte de tres receptores de órganos de donantes en Australia que contrajeron el virus después de recibir donaciones de riñón y de hígado de un solo donante de órganos infectado a finales de 2006. Los tres murieron en la primera semana de 2007. [41] [42]
La OMS y sus socios de la Red Mundial de Alerta y Respuesta ante Brotes Epidémicos (GOARN) siguen apoyando a los Ministerios de Salud de los dos países en diversas facetas de la investigación del brote, incluidos el diagnóstico de laboratorio, las investigaciones, la búsqueda activa de casos y el seguimiento de los contactos. [43]
Tratos
Existen muy pocos métodos de tratamiento disponibles. La falta actual de una vacuna autorizada y las limitadas opciones terapéuticas para el arenavirus hacen que se trate de uno de los grupos de virus más desatendidos. El único fármaco autorizado para el tratamiento de la infección humana por arenavirus es el análogo de nucleósido ribavirina . [44] La ribavirina reduce la morbilidad y la mortalidad en humanos infectados con ciertos arenavirus, como las infecciones por LASV y JUNV, si se toma en las primeras etapas de la enfermedad. La ribavirina muestra un éxito mixto en el tratamiento de la enfermedad grave por arenavirus y se asocia con toxicidades significativas. [45]
Enfoques experimentales
Es necesario producir fármacos antivirales eficaces a bajo coste, tomarlos por vía oral y que puedan soportar climas tropicales debido a las regiones en las que se producen estas infecciones. Por este motivo, el cribado de alto rendimiento (HTS) de pequeñas bibliotecas moleculares podría ser la respuesta para encontrar un mejor remedio. El HTS recopila bibliotecas de pequeñas moléculas sintéticas que se pueden utilizar para identificar moléculas "agonistas" promotoras de proteínas o interacciones "antagonistas" inhibidoras de proteínas. [44] Con el HTS se pueden descubrir fármacos antivirales sostenibles contra posibles nuevos virus patógenos humanos.
La inmunoterapia es otro enfoque potencial. Se han probado anticuerpos monoclonales contra el virus Junin en modelos animales. En 2020 se estaba investigando un agente inmunoterapéutico activo contra todos los mammarenavirus probados que utilizan el receptor 1 de transferrina como receptor. [46]
Referencias
- ^ Radoshitzky, SR; Buchmeier, MJ; Charrel, enfermera registrada; Clegg, JCS; González, JJ; Günther, S; Hepojoki, J; Kuhn, JH; Lukashevich, IS; Romanowski, V; Salvato, MS; Sironi, M; Stenglein, MD; de la Torre, JC; Informe ICTV, Consorcio (agosto 2019). "Perfil de taxonomía de virus ICTV: Arenaviridae". La Revista de Virología General . 100 (8): 1200–1201. doi : 10.1099/jgv.0.001280 . hdl : 10281/509719 . PMID 31192784.
- ^ Shi, Mang; Lin, Xian-Dan; Chen, Xiao; Tian, Jun-Hua; Chen, Liang-Jun; Li, Kun; Wang, Wen; Edén, John-Sebastian; Shen, Jin-Jin; Li, Liu; Holmes, Edward C.; Zhang, Yong-Zhen (2018). "La historia evolutiva de los virus de ARN de vertebrados". Naturaleza . 561 (7722): 202.doi : 10.1038 /s41586-018-0310-0 . PMID 29946168. S2CID 49433735.
- ^ Briese T, Paweska JT, McMullan LK, et al. (mayo de 2009). "Detección genética y caracterización del virus Lujo, un nuevo arenavirus asociado a la fiebre hemorrágica del sur de África". PLOS Pathog . 5 (5): e1000455. doi : 10.1371/journal.ppat.1000455 . PMC 2680969 . PMID 19478873.
- ^ Botten, J; Whitton, JL; Barrowman, P; Sidney, J; Whitmire, JK; Alexander, J; Kotturi, MF; Sette, A; Buchmeier, MJ (2010). "Una estrategia de vacunación multivalente para la prevención de la infección por arenavirus del Viejo Mundo en humanos". Journal of Virology . 84 (19): 9947–56. doi :10.1128/JVI.00672-10. PMC 2937778 . PMID 20668086.
- ^ Rowe, Wallace P.; Murphy, Frederick A.; Bergold, Gernot H.; Casals, Jordi; Hotchin, John; Johnson, Karl M.; Lehmann-Grube, Fritz; Mims, Cedric A.; Traub, Eric; Webb, Patricia A. (mayo de 1970). "Arenovirus: nombre propuesto para un grupo de virus recientemente definido". Revista de Virología . 5 (5): 652. doi :10.1128/jvi.5.5.651-652.1970. PMC 376052 . PMID 4986852.
- ^ abc Emonet, Sebastien E.; Urata, Shuzo; De La Torre, Juan C. (2011). "Genética inversa de arenavirus: nuevos enfoques para la investigación de la biología de arenavirus y desarrollo de estrategias antivirales". Virología . 411 (2): 416–425. doi :10.1016/j.virol.2011.01.013. PMC 3057228 . PMID 21324503.
- ^ "Arenaviridae - Virus ARN de sentido negativo - Virus ARN de sentido negativo (2011)". Comité Internacional de Taxonomía de Virus (ICTV) . Archivado desde el original el 19 de diciembre de 2018. Consultado el 23 de mayo de 2019 .
- ^ ab Añón MC, Grau O, Segovia ZM, Franzefernández MT (junio de 1976). "Composición de ARN del virus Junín". J. Virol . 18 (3): 833–8. doi :10.1128/JVI.18.3.833-838.1976. PMC 354781 . PMID 178925.
- ^ Lee KJ, Novella IS, Teng MN, Oldstone MB, de La Torre JC (abril de 2000). "Las proteínas NP y L del virus de la coriomeningitis linfocítica (LCMV) son suficientes para la transcripción y replicación eficientes de los análogos del ARN genómico del LCMV". J. Virol . 74 (8): 3470–7. doi :10.1128/jvi.74.8.3470-3477.2000. PMC 111854 . PMID 10729120.
- ^ ab Meyer BJ, de la Torre JC, Southern PJ (2002). "Arenavirus: ARN genómico, transcripción y replicación". Arenavirus I. Temas actuales en microbiología e inmunología. Vol. 262. págs. 139–57. doi :10.1007/978-3-642-56029-3_6. ISBN 978-3-540-42244-0. Número de identificación personal 11987804.
{{cite book}}:|journal=ignorado ( ayuda ) - ^ Pedersen IR (marzo de 1973). "Diferentes clases de ácido ribonucleico aisladas del virus de la coriomeningitis linfocítica". J. Virol . 11 (3): 416–23. doi :10.1128/JVI.11.3.416-423.1973. PMC 355116 . PMID 4734917.
- ^ Auperin DD, Romanowski V, Galinski M, Bishop DH (diciembre de 1984). "Los estudios de secuenciación del ARN S del arenavirus pichinde indican una nueva estrategia de codificación, un ARN S viral ambisentido". J. Virol . 52 (3): 897–904. doi :10.1128/JVI.52.3.897-904.1984. PMC 254611 . PMID 6492264.
- ^ Auperin DD, McCormick JB (febrero de 1989). "Secuencia de nucleótidos del genoma S del virus Lassa (cepa Josiah) Comparación de la secuencia de aminoácidos y ARN de las proteínas N y GPC con otros arenavirus". Virology . 168 (2): 421–5. doi :10.1016/0042-6822(89)90287-0. PMID 2916333.
- ^ Auperin DD, Galinski M, Bishop DH (abril de 1984). "Las secuencias del gen de la proteína N y la región intergénica del ARN S del arenavirus de Pichinde". Virología . 134 (1): 208–19. doi :10.1016/0042-6822(84)90286-1. PMID 6324469.
- ^ Auperin D, Dimock K, Cash P, Rawls WE, Leung WC, Bishop DH (enero de 1982). "Análisis de los genomas del prototipo de arenavirus de Pichinde y un derivado virulento de Pichinde Munchique: evidencia de conservación de secuencias en los extremos 3' de sus especies de ARN virales". Virología . 116 (1): 363–7. doi :10.1016/0042-6822(82)90429-9. PMID 6278715.
- ^ Auperin DD, Compans RW, Bishop DH (agosto de 1982). "Conservación de la secuencia de nucleótidos en los extremos 3' de las especies de ARN del virión de los arenavirus del Nuevo Mundo y del Viejo Mundo". Virology . 121 (1): 200–3. doi :10.1016/0042-6822(82)90130-1. PMID 6287720.
- ^ Mattsson L (1989). "Hepatitis crónica no A ni B con especial referencia a la forma asociada a la transfusión". Scand J Infect Dis Suppl . 59 : 1–55. doi :10.3109/inf.1988.20.suppl-59.01. PMID 2502835.
- ^ ab Hass M, Westerkofsky M, Müller S, Becker-Ziaja B, Busch C, Günther S (diciembre de 2006). "Análisis mutacional del promotor del virus Lassa". J. Virol . 80 (24): 12414–9. doi :10.1128/JVI.01374-06. PMC 1676312 . PMID 17005649.
- ^ ab Kranzusch PJ, Schenk AD, Rahmeh AA, et al. (noviembre de 2010). "Ensamblaje de un complejo polimerasa funcional del virus Machupo". Proc. Natl. Sci. USA . 107 (46): 20069–74. Bibcode :2010PNAS..10720069K. doi : 10.1073/pnas.1007152107 . PMC 2993349 . PMID 20978208.
- ^ Bishop DH, Auperin DD (1987). "Estructura y organización de los genes de los arenavirus". Arenavirus . Temas actuales en microbiología e inmunología. Vol. 133. págs. 5-17. doi :10.1007/978-3-642-71683-6_2. ISBN 978-3-642-71685-0. Número PMID 2435460.
{{cite book}}:|journal=ignorado ( ayuda ) - ^ Young PR, Howard CR (abril de 1983). "Análisis de la estructura fina de las nucleocápsides del virus Pichinde". J. Gen. Virol . 64 (4): 833–42. doi : 10.1099/0022-1317-64-4-833 . PMID 6682139.
- ^ Palmer EL, Obijeski JF, Webb PA, Johnson KM (septiembre de 1977). "La nucleocápside circular y segmentada de un virus arenavirus-Tacaribe". J. General Virol . 36 (3): 541–5. doi : 10.1099/0022-1317-36-3-541 . PMID 199698.
- ^ Perez M, de la Torre JC (enero de 2003). "Caracterización del promotor genómico del virus prototípico de la coriomeningitis linfocítica arenavirus". J. Virol . 77 (2): 1184–94. doi :10.1128/jvi.77.2.1184-1194.2003. PMC 140842 . PMID 12502835.
- ^ Ghiringhelli PD, Rivera-Pomar RV, Lozano ME, Grau O, Romanowski V (septiembre de 1991). "Organización molecular del ARN S del virus Junin: secuencia completa de nucleótidos, relación con otros miembros de Arenaviridae y estructuras secundarias inusuales". J. Gen. Virol . 72 (9): 2129–41. CiteSeerX 10.1.1.325.5606 . doi :10.1099/0022-1317-72-9-2129. PMID 1654373.
- ^ Iapalucci S, López N, Rey O, Zakin MM, Cohen GN, Franze-Fernández MT (noviembre de 1989). "La región 5 'del ARN L del virus Tacaribe codifica una proteína con un potencial dominio de unión a metal". Virología . 173 (1): 357–61. doi :10.1016/0042-6822(89)90257-2. PMID 2510403.
- ^ Iapalucci S, Lopez R, Rey O, et al. (Mayo de 1989). "El gen L del virus Tacaribe codifica una proteína de 2210 residuos de aminoácidos". Virología . 170 (1): 40–7. doi :10.1016/0042-6822(89)90349-8. PMID 2718387.
- ^ Salvato MS, Shimomaye EM (noviembre de 1989). "La secuencia completa del virus de la coriomeningitis linfocítica revela una estructura única de ARN y un gen para una proteína de dedo de zinc". Virología . 173 (1): 1–10. doi :10.1016/0042-6822(89)90216-X. PMID 2510401.
- ^ Loureiro ME, D'Antuono A, Levingston Macleod JM, López N (septiembre de 2012). "Descubrimiento de interacciones proteína-proteína virales y su papel en el ciclo de vida de los arenavirus". Viruses . 4 (9): 1651–67. doi : 10.3390/v4091651 . PMC 3499824 . PMID 23170177.
- ^ Burri DJ, da Palma JR, Kunz S, Pasquato A (octubre de 2012). "Glicoproteína de envoltura de arenavirus". Viruses . 4 (10): 2162–81. doi : 10.3390/v4102162 . PMC 3497046 . PMID 23202458.
- ^ Propuestas de ICTV 2014.011a-dV et al. Archivado el 4 de marzo de 2016 en Wayback Machine , Mark D. Stenglein et al.
- ^ Propuestas de ICTV 2014.012aV et al. Archivado el 4 de marzo de 2016 en Wayback Machine , Michael J. Buchmeier et al.
- ^ Stenglein MD, Sanders C, Kistler AL, et al. (2012). "Identificación, caracterización y cultivo in vitro de arenavirus altamente divergentes de boas constrictoras y boas arbóreas anuladas: agentes etiológicos candidatos para la enfermedad de cuerpos de inclusión de serpientes". mBio . 3 (4): e00180–12. doi :10.1128/mBio.00180-12. PMC 3419519 . PMID 22893382.
- ^ Hepojoki, Jussi; Hepojoki, Satu; Smura, Teemu; Szirovicza, Leonóra; Dervas, Eva; Prähauser, Barbara; Nufer, Lisbeth; Schraner, Elisabeth M.; Vapalahti, Olli; Kipar, Anja; Hetzel, Udo (2018). "Caracterización del virus de la serpiente-1 del Instituto Haartman (HISV-1) y virus similares al HISV: los representantes del género Hartmanivirus, familia Arenaviridae". Más patógenos . 14 (11): e1007415. doi : 10.1371/journal.ppat.1007415 . PMC 6261641 . PMID 30427944.
- ^ "Taxonomía de virus: publicación de 2019". talk.ictvonline.org . Comité Internacional de Taxonomía de Virus . Consultado el 6 de mayo de 2020 .
- ^ Zhang YZ, Wu WC, Shi M, Holmes EC (2018) La diversidad, evolución y orígenes de los virus ARN vertebrados. Curr Opin Virol 31:9-16
- ^ Mardoqueo, GJ; Molinero, KM; Di Cicco, E; Schulze, AD; Kaukinen, KH; Ming, TJ; Li, S; Tábata, A; Teffer, A; Patterson, DA; Ferguson, HW; Suttle, CA (2019). "Salmón salvaje en peligro de extinción infectado por virus recién descubiertos". eVida . 8 : e47615. doi : 10.7554/eLife.47615 . PMC 6721791 . PMID 31478480.
- ^ Delgado S, Erickson BR, Agudo R, et al. (abril de 2008). "Virus Chapare, un arenavirus recientemente descubierto y aislado de un caso fatal de fiebre hemorrágica en Bolivia". PLOS Pathog . 4 (4): e1000047. doi : 10.1371/journal.ppat.1000047 . PMC 2277458 . PMID 18421377.
- ^ abcd Forni, D; Pontremoli, C; Pozzoli, U; Clerici, M; Cagliani, R; Sironi, M (1 de marzo de 2018). "Evolución antigua de los Mammarenavirus: adaptación a través de cambios en la proteína L y sin evidencia de codivergencia entre el huésped y el virus". Genome Biology and Evolution . 10 (3): 863–874. doi :10.1093/gbe/evy050. PMC 5863214 . PMID 29608723 . Consultado el 16 de febrero de 2019 .
- ^ Paweska, Janusz T.; Sewlall, Nivesh H.; Ksiazek, Thomas G.; Blumberg, Lucille H.; Hale, Martín J.; Lipkin, W. Ian; Weyer, Jacqueline; Nichol, Stuart T.; Rollin, Pierre E.; McMullan, Laura K.; Paddock, Christopher D.; Briese, Thomas; Mnyaluza, Alegría; Dinh, Thu-Ha; Mukonka, Víctor; Ching, Pamela; Duse, Adriano; Richards, chico; de Jong, Gillian; Cohen, Cheryl; Ikalafeng, Bridget; Mugero, Carlos; Asomugha, Chika; Malotle, Mirriam M.; Nteo, Dorothy M.; Misiani, Eunice; Swanepoel, Robert; Zaki, Sherif R. (octubre de 2009). "Brote nosocomial de nueva infección por arenavirus, África austral". Enfermedades infecciosas emergentes . 15 (10): 1598–1602. doi : 10.3201/eid1510.090211 . PMC 2866397 . PMID 19861052.
- ^ Científicos identifican nuevo virus letal en África
- ^ "Tres mujeres recibieron trasplantes de órganos de un donante. Todas murieron en la misma semana". ABC News . 10 de octubre de 2020 . Consultado el 11 de octubre de 2020 .
- ^ "Virus identificado - enfermera enferma". News24.com. Archivado desde el original el 13 de octubre de 2008. Consultado el 13 de octubre de 2008 .
- ^ "Virus mata a receptores de órganos". www.theage.com.au . Consultado el 16 de octubre de 2009 .
- ^ ab Lee, AM; Pasquato, A.; Kunz, S. (2011). "Nuevos enfoques en el desarrollo de fármacos anti-arenavirales". Virology . 411 (2): 163–169. doi :10.1016/j.virol.2010.11.022. PMC 3057354 . PMID 21183197.
- ^ Mendenhall, M.; Russell, A.; Juelich, T.; Messina, EL; Smee, DF; Freiberg, AN; Holbrook, MR; Furuta, Y.; et al. (2010). "Inhibición de la replicación del arenavirus en cultivo celular por T-705 (favipiravir)". Agentes antimicrobianos y quimioterapia . 55 (2): 782–787. doi :10.1128/AAC.01219-10. PMC 3028760 . PMID 21115797.
- ^ Hadas Cohen-Dvashi; Ron Amon; Krystle N. Agans; Robert W. Cruz; Aliza Borenstein-Katz; Mathieu Mateo; Sylvain Baize; Vered Padler-Karavani; Thomas W. Geisbert; Ron Diskin (2020). "Diseño racional de inmunoterapia universal para arenavirus trópicos TfR1". Comunicaciones de la naturaleza . 11 (1): 67. Código Bib : 2020NatCo..11...67C. doi :10.1038/s41467-019-13924-6. PMC 6941993 . PMID 31900422.
Enlaces externos
- Informe del ICTV: Arenaviridae
- Zona viral: Arenavirus
- Base de datos y recursos de análisis de virus y patógenos (ViPR): Arenaviridae
- Información genómica y bioinformática detallada sobre Arenaviridae en la base de datos financiada por el NIH.
- Genomas de Arenaviridae Archivado el 5 de abril de 2017 en los resultados de búsqueda de la base de datos Wayback Machine del Centro de recursos de bioinformática viral.
- Información del blog de Google.Org sobre el brote reciente.
- Arenavirus
- "Arenavirus". Navegador de taxonomía del NCBI. 11618.