Tolerancia central
En inmunología , la tolerancia central (también conocida como selección negativa ) es el proceso de eliminación de cualquier linfocito T o B en desarrollo que sea autorreactivo, es decir, reactivo al propio cuerpo. [1] A través de la eliminación de linfocitos autorreactivos, la tolerancia asegura que el sistema inmunológico no ataque a los péptidos propios . [2] La maduración de los linfocitos (y la tolerancia central) ocurre en órganos linfoides primarios como la médula ósea y el timo . En los mamíferos, las células B maduran en la médula ósea y las células T maduran en el timo. [1]
La tolerancia central no es perfecta, por lo que la tolerancia periférica existe como un mecanismo secundario para garantizar que las células T y B no sean autorreactivas una vez que abandonan los órganos linfoides primarios. [3] [ página necesaria ] La tolerancia periférica se diferencia de la tolerancia central en que ocurre una vez que las células inmunes en desarrollo salen de los órganos linfoides primarios (el timo y la médula ósea), antes de su exportación a la periferia. [1]
Función
La tolerancia central es esencial para el funcionamiento adecuado de las células inmunitarias porque ayuda a garantizar que las células B y T maduras no reconozcan los autoantígenos como microbios extraños. [2] Más específicamente, la tolerancia central es necesaria porque los receptores de células T (TCR) y los receptores de células B (BCR) son producidos por las células a través de un reordenamiento somático aleatorio. [1] Este proceso, conocido como recombinación V(D)J , es importante porque aumenta la diversidad de receptores, lo que aumenta la probabilidad de que las células B y las células T tengan receptores para antígenos nuevos. [1] La diversidad de unión ocurre durante la recombinación y sirve para aumentar aún más la diversidad de BCR y TCR. [1] La producción de TCR y BCR aleatorios es un método importante de defensa contra los microbios debido a su alta tasa de mutación. Este proceso también juega un papel importante en la promoción de la supervivencia de una especie, porque habrá una variedad de disposiciones de receptores dentro de una especie, lo que permite una probabilidad muy alta de que al menos un miembro de la especie tenga receptores para un antígeno nuevo. [1]
Si bien el proceso de recombinación somática es esencial para una defensa inmunitaria exitosa, puede conducir a la autorreactividad. Por ejemplo, la falta de RAG1/2 funcional , enzimas necesarias para la recombinación somática, se ha relacionado con el desarrollo de citopenias inmunitarias en las que se producen anticuerpos contra las células sanguíneas del paciente. [4] Debido a la naturaleza de una recombinación aleatoria de receptores, se producirán algunos BCR y TCR que reconocen los antígenos propios como extraños. [2] Esto es problemático, ya que estas células B y T, si se activan, montarían una respuesta inmunitaria contra sí mismas si no son eliminadas o inactivadas por mecanismos de tolerancia central. [5] [ página necesaria ] Por lo tanto, sin tolerancia central, el sistema inmunitario podría atacar a sí mismo, lo que no es sostenible y podría resultar en un trastorno autoinmunitario. [3] [ página necesaria ]
Mecanismo
El resultado de la tolerancia central es una población de linfocitos que no desarrollan una respuesta inmunitaria frente a los antígenos propios. Estas células utilizan su especificidad TCR o BCR para reconocer antígenos extraños, con el fin de desempeñar sus funciones específicas en la reacción inmunitaria contra esos antígenos. [2] [6]
De esta manera, los mecanismos de tolerancia central garantizan que los linfocitos que reconocerían antígenos propios de una manera que podría poner en peligro al huésped no se liberen a la periferia.
Cabe destacar que las células T, a pesar de los mecanismos de tolerancia, son al menos hasta cierto punto autorreactivas. El TCR de las células T convencionales debe ser capaz de reconocer partes de las moléculas del complejo mayor de histocompatibilidad (MHC) ( MHC de clase I en el caso de las células T CD8+ o MHC de clase II en el caso de las células T CD4+) para crear una interacción adecuada con la célula presentadora de antígeno. Además, los TCR de las células T reguladoras (células Treg) son directamente reactivos hacia los autoantígenos (aunque su autorreactividad no es muy fuerte) y utilizan esta autorreactividad para regular las reacciones inmunes suprimiendo el sistema inmunológico cuando no debería estar activo. [6] [7] [8] Es importante destacar que los linfocitos solo pueden desarrollar tolerancia hacia los antígenos que están presentes en la médula ósea (para las células B) y el timo (para las células T). [9]
Célula T
Los progenitores de células T (también llamados timocitos ) se crean en la médula ósea y luego migran al timo donde continúan su desarrollo. [1] [10] Durante este desarrollo, los timocitos realizan la recombinación V(D)J y algunos de los clones de células T en desarrollo producen TCR que es completamente disfuncional (incapaz de unirse a complejos péptido-MHC) y algunos producen TCR que es autorreactivo y, por lo tanto, podría promover la autoinmunidad. [11] [2] Por lo tanto, estos clones "problemáticos" se eliminan del grupo de células T mediante mecanismos específicos.
En primer lugar, durante la " selección positiva ", se prueban los timocitos para ver si su TCR funciona correctamente y aquellos con TCR no funcional se eliminan por apoptosis . [6] [7] El mecanismo tiene su nombre porque selecciona para la supervivencia solo aquellos timocitos cuyos TCR interactúan con los complejos péptido-MHC en las células presentadoras de antígeno en el timo.
Durante la última etapa de la selección positiva, se produce otro proceso denominado " restricción del MHC " (o compromiso de linaje). En este proceso, los timocitos cuyo TCR reconoce moléculas MHCI ( MHC de clase I ) se convierten en CD4- CD8+ y los timocitos cuyo TCR reconoce moléculas MHCII ( MHC de clase II ) se convierten en CD4+ CD8-.
Posteriormente, los timocitos seleccionados positivamente pasan por una " selección negativa " que prueba la autorreactividad de los timocitos. Las células que son fuertemente autorreactivas (y por lo tanto propensas a atacar a las células huésped) son eliminadas por apoptosis. Los timocitos que aún son autorreactivos, pero solo se desarrollan ligeramente en células T reguladoras (Treg). Los timocitos que no son autorreactivos se convierten en células T maduras vírgenes. Tanto las células Treg como las células T maduras vírgenes migran posteriormente a los órganos linfoides secundarios. [6] [7] La selección negativa debe su nombre a que selecciona para la supervivencia solo aquellos timocitos cuyos TCR no interactúan (o interactúan solo ligeramente) con los complejos péptido-MHC en las células presentadoras de antígenos en el timo.
Otros dos términos, tolerancia recesiva y tolerancia dominante, también son importantes en relación con la tolerancia central de las células T. Ambos términos se refieren a dos posibles formas de establecimiento de tolerancia hacia un antígeno particular (normalmente, un antígeno propio). La " tolerancia recesiva " significa que el antígeno es tolerado mediante la eliminación de aquellas células T que facilitarían la respuesta inmunitaria contra el antígeno (eliminación de células autorreactivas en la selección negativa). La " tolerancia dominante " significa que los clones de células T específicos para el antígeno se desvían hacia las células Treg y, por lo tanto, suprimen la respuesta inmunitaria contra el antígeno (selección de Treg durante la selección negativa). [6] [7] [12]
Etapas de la tolerancia de las células T [2] [13]
- Desarrollo de progenitores de células T [14] [15] [16] Los precursores de células T se originan en la médula ósea (MO). La población de los primeros progenitores hematopoyéticos no porta marcadores de células diferenciadas (por eso se los llama Lin- "linaje negativo") pero expresan moléculas como SCA1 (antígeno de células madre) y KIT (receptor para el factor de células madre SCF). Con base en estos marcadores, las células se denominan LSK (Lineage-SCA1-KIT). Esta población se puede dividir a su vez, con base en la expresión de marcadores como CD150 y tirosina quinasa 3 relacionada con FMS (FLT3), en células madre hematopoyéticas (HSC) CD150+ FLT3- y progenitores multipotentes (MPP) CD150- FLT3low. Las HSC son "verdaderas células madre hematopoyéticas " porque tienen la capacidad de autorrenovarse (generando nuevas HSC) y también tienen el potencial de diferenciarse en todos los tipos de células sanguíneas. Los descendientes directos de las HSC son los progenitores multipotentes (MPP) más maduros que proliferan altamente, pueden diferenciarse en todos los tipos de células sanguíneas pero no son capaces de autorrenovarse (no tienen la capacidad de generar nuevas MPP indefinidamente y por lo tanto las HSC son necesarias para la generación de nuevas MPP). Algunas de las MPP regulan aún más la expresión de FLT3 (convirtiéndose en CD150- FLT3high) y comienzan a regular positivamente los genes específicos para el linaje linfoide (por ejemplo Rag1) (pero siguen siendo Lin-). Estos progenitores (que aún pertenecen a las células LSK) consisten en dos poblaciones similares denominadas MPP cebadas para linfoides (LMPP) y progenitores linfoides tempranos (ELP). Las LMPP/ELP posteriormente dan lugar a progenitores linfoides comunes (CLP). Estas células (FLT3high LIN- KITlow) no pertenecen al grupo de LSK, son más maduras y más propensas al linaje linfoide, lo que significa que en circunstancias normales finalmente darán lugar a células T o B u otros linfocitos ( células NK ). Pero como solo son progenitores, su destino celular no está estrictamente predeterminado y aún tienen la capacidad de diferenciarse en otros linajes.
- Migración al timo [14] [16] [17] Los progenitores de la médula ósea (MO), incluso las HSC, tienen la capacidad de salir aleatoriamente de la MO al torrente sanguíneo y, por lo tanto, pueden detectarse fácilmente allí. Por lo tanto, después de generarse, los progenitores de células T salen de la MO y son transportados aleatoriamente por la sangre a todo el cuerpo. En el momento en que alcanzan las vénulas poscapilares en la unión corticomedular tímica , comienzan a disminuir su velocidad y a rodar por el endotelio, porque todos los progenitores, incluidas las células LSK, expresan en su superficie la glicoproteína PSGL1, que es un ligando para la P-selectina, expresada en el endotelio tímico. Pero de todos los progenitores de células T mencionados anteriormente, solo las LMPP/ELP y las CLP expresan los receptores de quimiocina CCR7 y CCR9 que les permiten ingresar al timo. El endotelio tímico expresa quimiocinas CCL19 y CCL21, que son ligandos para CCR7 y CCL25 que es un ligando para CCR9. La parte final de la entrada tímica aún no se entiende completamente. El modelo sugerido es que la detección del receptor de quimiocinas por parte de los progenitores activa sus integrinas (las integrinas sugeridas son VLA-4 y LFA-1) que se unen a los ligandos en el endotelio. Esta interacción detiene el rodamiento, conduce al paro celular y finalmente a la transmigración a lo largo del gradiente de quimiocinas dentro del timo. Por lo tanto, todos los progenitores estarán rodando en el endotelio tímico, pero solo los LMPP/ELP y CLP ingresarán al timo porque solo ellos tienen el equipo receptor adecuado para hacerlo. El mecanismo es muy similar a la transmigración , que es utilizada por los leucocitos para ingresar a los ganglios linfáticos o tejidos inflamados.
- Desarrollo tímico temprano [14] [17] [18] [19] Desde el momento en que las LMPP/ETP y las CLP ingresan al timo en la unión corticomedular, se las conoce como progenitores de asentamiento del timo (TSP). Los TSP proliferan altamente y comienzan a migrar a la zona subcapsular del timo. No está claro qué señales impulsan la migración. Una posibilidad es que migren a lo largo de gradientes de quimiocinas, utilizando receptores CXCR4, CCR7 y CCR9, pero la migración también puede ser impulsada solo por interacciones de integrinas y otras células y ECM (matriz extracelular) sin participación directa de las quimiocinas. [14] A medida que migran hacia la zona subcapsular, los TSP continúan con su diferenciación, que es impulsada principalmente por el microambiente tímico. De las muchas señales que reciben las TSP y otros precursores posteriores del microambiente, la señalización Notch es especialmente importante para determinar su destino de diferenciación. Los precursores expresan el receptor Notch1, que se activa mediante ligandos presentes en el tejido tímico. La activación posterior de la vía Notch conduce a una pérdida gradual de la capacidad de los progenitores para generar otros linajes celulares y, en última instancia, solo son capaces de crear células T, pero esto ocurre en las últimas etapas de la diferenciación. En la etapa de las TSP, los progenitores aún conservan la capacidad de crear células tanto linfoides como mieloides. Dada su capacidad para generar otros linajes celulares (principalmente in vitro), incluso se debate si pueden contribuir fisiológicamente, al menos parcialmente, a la generación de otros tipos de células presentes en el timo, principalmente células dendríticas plasmocitoides (pDC). Pero esto aún no se ha demostrado claramente. [19]
- Etapas DN a DP [14] [17] [18] [19] En el siguiente paso, las TSP dan lugar a precursores tímicos tempranos (ETP), también llamados células doble negativas 1 (DN1). El término "doble negativo" se refiere al hecho de que en esta etapa los precursores no expresan correceptores CD4 ni CD8 (a veces incluso se los denomina "triple negativo" porque tampoco expresan el complejo CD3). Las etapas DN se pueden distinguir por la expresión de los marcadores de superficie CD44 y CD25, siendo las células DN1 CD44+ CD25-. De manera similar a las TSP, las células DN1 aún son capaces de generar otros tipos de células además de las células T, como células B, células NK, DC y macrófagos (linaje linfoide y mieloide). [18] Pero, debido a la señalización Notch, comienzan a comprometerse hacia el linaje de células T mediante la expresión de factores de transcripción (TF) como GATA3 y TCF1. Posteriormente, las células DN1 se diferencian en células DN2, que son CD44+ y CD25+. La etapa DN2 se puede dividir a su vez en dos subetapas DN2a y DN2b. La transición de la subetapa DN2a anterior a la posterior DN2b también se denomina compromiso, porque es en este momento cuando el precursor de células T finalmente y por completo pierde su capacidad de generar otros linajes celulares y a partir de ese momento solo pueden (incluso in vitro) diferenciarse en células T. Después del compromiso, en la subetapa DN2b, los precursores también comienzan a producir el complejo CD3 (componente de señalización del futuro complejo del receptor TCR). A continuación, los precursores continúan su diferenciación en la fase DN3 en la que son CD44- CD25+. En esta etapa, las células finalmente llegan a la zona subcapsular del timo, proliferan aún más y, lo más importante, comienzan a expresar Rag1 y Rag2 (recombinasas de la recombinación V(D)J de los receptores de células T o B). Por lo tanto, es la etapa DN3 en la que los precursores de células T comienzan a construir sus TCR. [18] [19]También es en esta etapa cuando los precursores deciden si se convertirán en células T αβ o γδ. Hay dos modelos posibles de cómo se toma esta decisión. La primera posibilidad es que el destino de la célula simplemente se determina durante el desarrollo del precursor por el compromiso similar al desarrollo de otros linajes celulares. Por lo tanto, algunos precursores de células T se comprometen con células T γδ y, por lo tanto, en este paso recombinan γδTCR y algunos se comprometen con células T αβ y, de manera similar, recombinan αβTCR. El otro modelo, generalmente más aceptado, es que el compromiso se determina durante la reorganización y formación del TCR. Dado que la recombinación V(D)J es un proceso paso a paso, los precursores primero recombinan sus genes para producir γδTCR. En ese momento, la fuerza de la señal que produce el TCR recién formado decide. Si el γδTCR se forma correctamente y recibe una señal fuerte al interactuar con los ligandos presentes en el timo, entonces el precursor continúa su desarrollo en célula T γδ a través de procesos de selección específicos. Si el precursor de célula T recibe solo una señal débil, entonces la formación de γδTCR se raya y comienza la recombinación hacia αβTCR. [18] [20] [21] Esos precursores primero recombinan la cadena TCRβ y la combinan con TCRα invariante (cadena sustituta) y en etapas anteriores formaron el complejo CD3 para crear el llamado pre-TCR. Con este TCR prematuro, entran en un proceso llamado β-selección . Este es un paso de control, en el que el progenitor necesita recibir una señal positiva del pre-TCR para sobrevivir. Además, necesitan la señal de CXCR4 (el ligando es CXCL12) que no sirve aquí para dirigir la migración sino como una señal de supervivencia junto con la señalización Notch. Por lo tanto, el paso de selección β controla si la cadena TCRβ está formada correctamente y es funcional. También puede entenderse como una selección positiva específica solo para la cadena TCRβ (la cadena TCRα aún no está formada), pero el control de la autorreactividad no está incluido en este paso y viene más tarde, especialmente en la sección medular. Las células que no crean γδTCR o pre-TCR funcionales o que no pasan con éxito la selección β son eliminadas por apoptosis. [18] [20] Las células que superan con éxito la selección β continúan su desarrollo hasta la etapa DN4, detienen la expresión de CD25 y se convierten en CD44- CD25- y comienzan la migración hacia el interior de la corteza tímica. Una vez más, no está del todo claro qué impulsa la migración. Probablemente, los receptores CXCR4 y CXCR9 en las células DN4 impulsan la migración a lo largo de gradientes de quimiocinas CXCL12 y CCL25, aunque se establecieron otros modelos de migración a la corteza basados principalmente en la dinámica del movimiento de las células debido a su extensa proliferación o corrientes de fluidos en el timo sin participación directa de la migración impulsada por quimiocinas. Posteriormente, las células DN4 comienzan la expresión de correceptores CD8 y CD4 y se convierten en células CD8+ CD4+ DP (DP significa doble positivo porque expresan ambos correceptores). Una vez en la corteza tímica, las células DP finalizan el reordenamiento de la cadena TCRα, lo que resulta en la producción del complejo αβTCR completo, que marca a las células listas para entrar en la selección positiva, que tiene lugar en la corteza tímica. [14] [18]
- Durante la selección positiva , se comprueba la capacidad de las células T para unirse a los complejos péptido-MHC con afinidad. Si la célula T no puede unirse al complejo MHC de clase I o MHC de clase II , no recibe señales de supervivencia, por lo que muere por apoptosis. Los receptores de células T con suficiente afinidad por los complejos péptido-MHC se seleccionan para la supervivencia.
- Durante la selección negativa , se prueba la afinidad de las células T con su propio péptido. Si se unen a un péptido propio, se les indica que entren en apoptosis (proceso de deleción clonal).
- Las células epiteliales tímicas muestran su propio antígeno a las células T para comprobar su afinidad por ellas mismas.
- Los reguladores transcripcionales AIRE y Fezf2 desempeñan funciones importantes en la expresión de antígenos tisulares propios en las células epiteliales tímicas del timo.
- La selección negativa ocurre en la unión cortico-medular y en la médula tímica.
- Las células T que no se unen a sí mismas, pero que reconocen complejos antígeno/MHC y son CD4+ o CD8+, migran a órganos linfoides secundarios como células T maduras ingenuas.
Las células T reguladoras son otro tipo de células T que maduran en el timo. La selección de células T reguladoras se produce en la médula tímica y va acompañada de la transcripción de FOXP3 . Las células T reguladoras son importantes para regular la autoinmunidad al suprimir el sistema inmunitario cuando no debería estar activo. [8]
Célula B
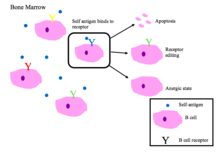
Las células B inmaduras en la médula ósea sufren una selección negativa cuando se unen a péptidos propios. [2]
Los receptores de células B que funcionan correctamente reconocen antígenos no propios o proteínas moleculares asociadas a patógenos ( PAMP ). [1]
Principales resultados de la autorreactividad de los BCR [1] [2]
- Apoptosis (eliminación clonal)
- Edición de receptores : la célula B autorreactiva cambia su especificidad reorganizando los genes y desarrolla un nuevo BCR que no responde a sí misma. Este proceso le da a la célula B la oportunidad de editar el BCR antes de que se le indique que se apoptotice o se vuelva anérgica.
- Inducción de anergia (un estado de no reactividad)
Enfermedades genéticas
Los defectos genéticos en la tolerancia central pueden conducir a la autoinmunidad.
- El síndrome de poliendocrinopatía autoinmune tipo I es causado por mutaciones en el gen humano AIRE . Esto conduce a una falta de expresión de antígenos periféricos en el timo y, por lo tanto, a una falta de selección negativa hacia proteínas periféricas clave como la insulina. [22] [23] El resultado son múltiples síntomas autoinmunes.
Historia
El primer uso de la tolerancia central fue realizado por Ray Owen en 1945, cuando notó que los gemelos dicigóticos no producían anticuerpos cuando a uno de ellos se le inyectaba la sangre del otro. [24] Sus hallazgos fueron confirmados por experimentos posteriores de Hasek y Billingham. [24] Los resultados fueron explicados por la hipótesis de selección clonal de Burnet . [25] Burnet y Medawar ganaron el Premio Nobel en 1960 por su trabajo para explicar cómo funciona la tolerancia inmunológica. [25] [26]
Véase también
Referencias
- ^ abcdefghij Owen JA, Punt J, Stranford SA, Jones PP, Kuby J (2013). Inmunología de Kuby (7ª ed.). Nueva York: WH Freeman. ISBN 978-1-4292-1919-8.OCLC 820117219 .
- ^ abcdefgh Romagnani S (2006). "Tolerancia inmunológica y autoinmunidad". Medicina interna y de urgencias . 1 (3): 187–196. doi :10.1007/bf02934736. PMID 17120464. S2CID 27585046.
- ^ ab Janeway Jr CA, Travers P, Walport M, Shlomchik MJ (2001). Inmunobiología 5: El sistema inmunitario en la salud y la enfermedad (5.ª ed.). Nueva York: Garland. ISBN 978-0-8153-3642-6.OCLC 45708106 .
- ^ Chen K, Wu W, Mathew D, Zhang Y, Browne SK, Rosen LB, et al. (marzo de 2014). "Autoinmunidad debida a deficiencia de RAG e incidencia estimada de enfermedad en mutaciones de RAG1/2". The Journal of Allergy and Clinical Immunology . 133 (3): 880–2.e10. doi :10.1016/j.jaci.2013.11.038. PMC 4107635 . PMID 24472623.
- ^ Janeway Jr CA, Travers P, Walport M, Shlomchik MJ (2001). "Capítulo 13: Autotolerancia y su pérdida". Inmunobiología 5: El sistema inmunitario en la salud y la enfermedad (5.ª ed.). Nueva York, NY: Garland Science. págs. 533–546. ISBN 978-0-443-07098-3.
- ^ abcde Klein L, Robey EA, Hsieh CS (enero de 2019). "Tolerancia central de células T CD4+: deleción frente a diferenciación de células T reguladoras" (PDF) . Nature Reviews. Inmunología . 19 (1): 7–18. doi :10.1038/s41577-018-0083-6. PMID 30420705.
- ^ abcd Liu YJ (mayo de 2006). "Una teoría unificada de la tolerancia central en el timo". Tendencias en inmunología . 27 (5): 215–221. doi :10.1016/j.it.2006.03.004. PMID 16580260.
- ^ ab Bettelli E, Carrier Y, Gao W, Korn T, Strom TB, Oukka M, et al. (mayo de 2006). "Vías de desarrollo recíprocas para la generación de células T reguladoras y efectoras patógenas TH17". Nature . 441 (7090): 235–238. Bibcode :2006Natur.441..235B. doi :10.1038/nature04753. PMID 16648838. S2CID 4391497.
- ^ Malhotra D, Linehan JL, Dileepan T, Lee YJ, Purtha WE, Lu JV, et al. (febrero de 2016). "La tolerancia se establece en las células T CD4(+) policlonales mediante mecanismos distintos, según los patrones de expresión de péptidos propios". Nature Immunology . 17 (2): 187–195. doi :10.1038/ni.3327. PMC 4718891 . PMID 26726812.
- ^ Cosway EJ, Ohigashi I, Schauble K, Parnell SM, Jenkinson WE, Luther S, et al. (julio de 2018). "La formación del grupo de células dendríticas intratímicas requiere el reclutamiento de progenitores CCR7+ al timo mediado por CCL21". Journal of Immunology . 201 (2): 516–523. doi :10.4049/jimmunol.1800348. PMC 6036229 . PMID 29784760.
- ^ Palmer E (mayo de 2003). "Selección negativa: eliminación de las manzanas podridas del repertorio de células T". Nature Reviews. Inmunología . 3 (5): 383–391. doi :10.1038/nri1085. PMID 12766760.
- ^ Kim JM, Rasmussen JP, Rudensky AY (febrero de 2007). "Las células T reguladoras previenen la autoinmunidad catastrófica a lo largo de la vida de los ratones". Nature Immunology . 8 (2): 191–197. doi :10.1038/ni1428. PMID 17136045.
- ^ Sprent J, Kishimoto H (mayo de 2001). "El timo y la tolerancia central". Philosophical Transactions of the Royal Society of London . Serie B, Ciencias Biológicas. 356 (1409): 609–616. doi :10.1098/rstb.2001.0846. PMC 1088448 . PMID 11375064.
- ^ abcdef Love, Paul E.; Bhandoola, Avinash (2011). "Integración de señales y comunicación cruzada durante la migración y emigración de timocitos". Nature Reviews Immunology . 11 (7): 469–477. doi :10.1038/nri2989. ISSN 1474-1733. PMC 3710714 . PMID 21701522.
- ^ Zlotoff, Daniel A.; Schwarz, Benjamin A.; Bhandoola, Avinash (2008). "El largo camino hacia el timo: la generación, movilización y circulación de progenitores de células T en ratones y humanos". Seminarios en inmunopatología . 30 (4): 371–382. doi :10.1007/s00281-008-0133-4. ISSN 1863-2297. PMID 18925398.
- ^ ab Zlotoff, Daniel A.; Sambandam, Arivazhagan; Logan, Theodore D.; Bell, J. Jeremiah; Schwarz, Benjamin A.; Bhandoola, Avinash (11 de marzo de 2010). "CCR7 y CCR9 juntos reclutan progenitores hematopoyéticos al timo adulto". Sangre . 115 (10): 1897–1905. doi :10.1182/sangre-2009-08-237784. ISSN 0006-4971. PMC 2837318 . PMID 19965655.
- ^ abc Zlotoff, Daniel A.; Bhandoola, Avinash (2011). "Migración de progenitores hematopoyéticos al timo adulto". Anales de la Academia de Ciencias de Nueva York . 1217 (1): 122–138. Bibcode :2011NYASA1217..122Z. doi :10.1111/j.1749-6632.2010.05881.x. ISSN 0077-8923. PMC 3076003 . PMID 21251013.
- ^ abcdefg Shah, Divya K.; Zúñiga-Pflücker, Juan Carlos (1 de mayo de 2014). "Una descripción general de las complejidades intratímicas del desarrollo de células T". La Revista de Inmunología . 192 (9): 4017–4023. doi :10.4049/jimmunol.1302259. ISSN 0022-1767. PMID 24748636.
- ^ abcd Rothenberg, Ellen V. (2021). "Información unicelular sobre la generación hematopoyética de precursores de linfocitos T en ratones y humanos". Hematología experimental . 95 : 1–12. doi :10.1016/j.exphem.2020.12.005. PMC 8018899 . PMID 33454362.
- ^ ab Parker, Morgan E.; Ciofani, Maria (2020). "Regulación de la diversificación de los efectores de células T γδ en el timo". Frontiers in Immunology . 11 : 42. doi : 10.3389/fimmu.2020.00042 . ISSN 1664-3224. PMC 6992645 . PMID 32038664.
- ^ Ciofani, Maria; Zúñiga-Pflücker, Juan Carlos (2010). "Determinación del desarrollo de células T γδ versus αß". Nature Reviews. Inmunología . 10 (9): 657–663. doi :10.1038/nri2820. ISSN 1474-1741. PMID 20725107.
- ^ Anderson MS, Venanzi ES, Klein L, Chen Z, Berzins SP, Turley SJ, et al. (noviembre de 2002). "Proyección de una sombra inmunológica propia dentro del timo por la proteína aire". Science . 298 (5597): 1395–1401. Bibcode :2002Sci...298.1395A. doi :10.1126/science.1075958. PMID 12376594. S2CID 13989491.
- ^ Liston A, Lesage S, Wilson J, Peltonen L, Goodnow CC (abril de 2003). "Aire regula la selección negativa de células T específicas de órganos". Nature Immunology . 4 (4): 350–354. doi :10.1038/ni906. PMID 12612579. S2CID 4561402.
- ^ ab Schwartz RH (abril de 2012). "Resumen histórico de la tolerancia inmunológica". Cold Spring Harbor Perspectives in Biology . 4 (4): a006908. doi :10.1101/cshperspect.a006908. PMC 3312674 . PMID 22395097.
- ^ ab Liston A (enero de 2011). "Tolerancia inmunológica 50 años después del Premio Nobel Burnet". Inmunología y biología celular . 89 (1): 14–15. doi : 10.1038/icb.2010.138 . PMID 21209621.
- ^ Silverstein AM (marzo de 2016). "El curioso caso del Premio Nobel de 1960 para Burnet y Medawar". Inmunología . 147 (3): 269–274. doi :10.1111/imm.12558. PMC 4754613 . PMID 26790994.