Síntesis de piridina de Hantzsch
| Síntesis de piridina de Hantzsch | |
|---|---|
| Llamado en honor a | Arthur Rudolf Hantzsch |
| Tipo de reacción | Reacción de formación de anillos |
| Identificadores | |
| Portal de química orgánica | Síntesis de dihidropiridinas de Hantzsch |
| Identificación de ontología RSC | Número de receta: 0000268 |
La síntesis de piridina de Hantzsch o síntesis de dihidropiridina de Hantzsch es una reacción orgánica multicomponente entre un aldehído como el formaldehído , 2 equivalentes de un éster β-ceto como el acetoacetato de etilo y un donante de nitrógeno como el acetato de amonio o el amoniaco . [1] [2] El producto de reacción inicial es una dihidropiridina que se puede oxidar en un paso posterior a una piridina . [3] La fuerza impulsora de este segundo paso de reacción es la aromatización . Esta reacción fue informada en 1881 por Arthur Rudolf Hantzsch .
El dicarboxilato de 1,4-dihidropiridina también se denomina compuesto 1,4-DHP o éster de Hantzsch . Estos compuestos son una clase importante de bloqueadores de los canales de calcio [2] y, como tales, se comercializan, por ejemplo, en nifedipina , amlodipina o nimodipina .
Se ha demostrado que la reacción se lleva a cabo en agua como disolvente de reacción y con aromatización directa mediante cloruro férrico , dióxido de manganeso o permanganato de potasio en una síntesis en un solo recipiente . [4]

La síntesis de dihidropiridina de Hantzsch se ha efectuado mediante química de microondas . [5]
Mecanismo
Se han propuesto al menos cinco vías significativas para la síntesis de 1,4-dihidropiridina mediante la reacción de Hantzch. Pueden surgir productos inesperados y de bajo rendimiento con distintos reactivos y condiciones de reacción. Estudios previos han probado las reacciones de intermediarios preformados para determinar el mecanismo más probable y diseñar síntesis exitosas. [6] Un estudio temprano del mecanismo utilizando RMN de 13 C y 15 N indicó la intermediación de la chalcona 6 y la enamina 3. Estos datos sugirieron la siguiente ruta para la reacción. [7]
Investigaciones posteriores que utilizaron monitoreo de espectrometría de masas con reactivos marcados con carga respaldaron la vía intermedia A como una ruta probable y mostraron evidencia de que la reacción siguió dos vías intermedias adicionales que convergen al precursor 7. [6] Los reactivos probablemente influyen en la ruta tomada, ya que cuando el grupo metilo de 1 es reemplazado por un grupo que atrae electrones, la reacción en cambio procede a través de un intermediario dicetona . [8]
Optimización de las condiciones de reacción
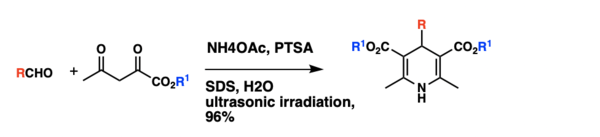
El método clásico para la síntesis de 1,4-dihidropiridinas de Hantzsch, que implica una condensación en un solo recipiente de aldehídos con acetoacetato de etilo y amoníaco, tiene varios inconvenientes, como condiciones de reacción duras, tiempos de reacción largos y, en general, un bajo rendimiento de productos. Una síntesis de 1,4-dihidropiridinas en micelas acuosas catalizada por PTSA bajo irradiación ultrasónica. Usando la condensación de benzaldehído , acetoacetato de etilo y acetato de amonio como modelo, los experimentos han demostrado que cuando se cataliza con ácido p-toluenosulfónico (PTSA) bajo irradiación ultrasónica, la reacción puede tener un rendimiento de producto del 96% en acuoso (SDS, 0,1 M). La reacción también se había llevado a cabo en varios sistemas de disolventes, y se descubrió que la irradiación ultrasónica en micelas acuosas dio mejores rendimientos que en disolventes como metanol, etanol, THF. Utilizando las condiciones de reacción optimizadas, se sintetizaron una serie de 1,4-dihidropiridinas, y todas ellas tienen un rendimiento de reacción superior al 90%. [9]
Aromatización
La oxidación de 1,4-DHP representa una de las formas más fáciles de acceder a los derivados de piridina. [10] Los oxidantes comunes utilizados para promover la aromatización de 1,4-DHP son CrO 3 , KMnO 4 y HNO 3 . [11] Sin embargo, la aromatización a menudo va acompañada de: bajos rendimientos químicos, fuertes condiciones oxidativas, tratamientos engorrosos, la formación de productos secundarios o la necesidad de un exceso de oxidante. [11] [12] Como tal, se ha prestado especial atención al desarrollo de métodos de aromatización para producir derivados de piridina en condiciones más suaves y eficientes. Dichas condiciones incluyen, pero no se limitan a: yodo en metanol a reflujo, [11] dióxido de cromo (CrO 2 ), [12] clorito de sodio , [13] y en condiciones fotoquímicas libres de metales utilizando tanto luz UV como luz visible. [14] Durante el metabolismo, los fármacos antihipertensivos basados en 1,4-DHP sufren una oxidación a través del citocromo P-450 en el hígado y, por lo tanto, se convierten en sus derivados de piridina. [11] Como resultado, se ha prestado especial atención a la aromatización de 1,4-DHP como un medio para comprender los sistemas biológicos y desarrollar nuevos métodos para acceder a las piridinas. [13]
Química verde
Como reacción de múltiples componentes , la síntesis de piridina de Hantzsch es mucho más eficiente en términos de átomos y con un número más simple de pasos de reacción que una síntesis de estrategia lineal. En los últimos años, la investigación ha buscado hacer de esta una reacción aún más respetuosa con el medio ambiente mediante la investigación de disolventes y condiciones de reacción "más ecológicos". [15] Una línea de estudio ha experimentado con el uso de líquidos iónicos como catalizadores para reacciones a temperatura ambiente. Los líquidos iónicos son una opción fácil de manejar y no tóxica para reemplazar los catalizadores tradicionales. Además, este catalizador conduce a un alto rendimiento a temperatura ambiente, lo que reduce el impacto de calentar la reacción durante un tiempo prolongado. Un segundo estudio utilizó nitrato de amonio cérico (CAN) como catalizador alternativo y logró una reacción a temperatura ambiente sin disolventes. [16]
Modificación de Knoevenagel-Fries
La modificación de Knoevenagel-Fries permite la síntesis de compuestos de piridina asimétricos. [17]
Véase también
Referencias
- ^ Hantzsch, A. (1881). "Condensationprodukte aus Aldehydammoniak und Ketonartigen Verbindungen". Chemische Berichte . 14 (2): 1637–8. doi :10.1002/cber.18810140214.
- ^ ab Li, Jie Jack (19 de julio de 2006). Reacciones al nombre (3.ª ed.). Springer. ISBN 3-540-30030-9.
- ^ Li, Jie Jack (11 de octubre de 2004). Reacciones de nombres en la química heterocíclica . John Wiley & Sons. p. 304. ISBN 0-471-30215-5.
- ^ Xia, JJ; Wang, GW (2005). "Síntesis y aromatización en un solo recipiente de 1,4-dihidropiridinas en agua a reflujo". Síntesis . 2005 (14): 2379–83. doi :10.1055/s-2005-870022.
- ^ van den Eynde, JJ; Mayence, A. (2003). "Síntesis y aromatización de 1,4-dihidropiridinas de Hantzsch bajo irradiación de microondas. Una descripción general" (PDF) . Moléculas . 8 (4): 381–91. doi : 10.3390/80400381 . S2CID 98443099.
- ^ ab Santos, Vanessa G. (2014). "La reacción de Hantzsch multicomponente: monitoreo integral por espectrometría de masas utilizando reactivos con etiquetas de carga". Química: una revista europea . 20 (40): 12808–12816. doi :10.1002/chem.201303065. PMID 25179028.
- ^ Katrinsky, Alan R.; Ostercamp, Daryl L.; Yousaf, Taher I. (1986). "El mecanismo de la síntesis de piridina de Hantzsch: un estudio mediante espectroscopia de RMN de 15N y 13C". Tetrahedron . 42 (20): 5729–5738. doi :10.1016/S0040-4020(01)88178-3.
- ^ Saini, Anil (febrero de 2008). "Reacción de Hantzsch: avances recientes en 1,4-dihidropiridinas de Hantzsch" (PDF) . Revista de investigación científica e industrial . 67 : 95–111.
- ^ Kumar, Atul (5 de agosto de 2008). "Resumen de ChemInform: Síntesis eficiente de ésteres de Hantzsch y derivados de polihidroquinolina en micelas acuosas". ChemInform . 39 (32). doi :10.1002/chin.200832145.
- ^ Mashraqui, Sabir H. (1998). "Nitrato de bismuto pentahidratado: un reactivo conveniente para la oxidación de 1,4-dihidropiridinas de Hantzsch". Síntesis . 1998 (5): 713–714. doi :10.1055/s-1998-4516.
- ^ abcd Yadav, Jhillu S. (2000). "Aromatización de 1,4-dihidropiridinas de Hantzsch con I 2 -MeOH". Síntesis . 2000 (11): 1532–1534. doi :10.1055/s-2000-7613.
- ^ ab Ko, Kwang-Youn (1999). "Aromatización de 1,4-dihidropiridinas de Hantzsch con Magtrieve". Tetrahedron Letters . 40 : 3207–3208. doi :10.1016/S0040-4039(99)00467-0.
- ^ ab Liao, Xiali (2010). "Aromatización oxidativa de 1,4-dihidropiridinas de Hantzsch mediante clorito de sodio". Tetrahedron Letters . 51 (29): 3859–3861. doi :10.1016/j.tetlet.2010.05.091. S2CID 94650170.
- ^ Wei, Xiaojing (2014). "Aromatización por oxidación mediada por metales libres de 1,4-dihidropiridinas a piridinas utilizando luz visible y aire". Revista china de química . 32 (12): 1245–1250. doi :10.1002/cjoc.201400521.
- ^ Jassem, Ahmed Majeed; Almashal, Faeza Abdul Kareem; Mohammed, Mohammed Qasim; Jabir, Hadi Abdal Samad (7 de febrero de 2020). "Un método catalítico y ecológico para la síntesis en un solo paso de nuevas 1,4-dihidropiridinas de Hantzsch". SN Applied Sciences . 2 (3). doi : 10.1007/s42452-020-2165-x .
- ^ Sharma, MG; Rajani, DP; Patel, HM (14 de junio de 2017). "Enfoque ecológico para la síntesis de derivados bioactivos de 1,4-dihidropiridina de Hantzsch basados en la fracción de tiofeno mediante una reacción multicomponente". Royal Society Open Science . 4 (6): 170006. Bibcode :2017RSOS....470006S. doi :10.1098/rsos.170006. PMC 5493906 . PMID 28680664.
- ^ Knoevenagel, E .; Papas fritas, A. (1898). "Synthesen in der Pyridinreihe. Ueber eine Erweiterung der Hantzsch'schen Dihidropiridinsynthese". Berichte der Deutschen Chemischen Gesellschaft . 31 (1): 761–7. doi :10.1002/cber.189803101157.