Bradicardia
| Bradicardia | |
|---|---|
| Otros nombres | Bradiarritmia, braquicardia |
 | |
| Se observa bradicardia sinusal en la derivación II con una frecuencia cardíaca de aproximadamente 50 lpm | |
| Pronunciación | |
| Especialidad | Cardiología |
| Método de diagnóstico | electrocardiograma |
| Frecuencia | 15% (hombres), 7% (mujeres) |
La bradicardia , también llamada bradiarritmia , es una frecuencia cardíaca en reposo inferior a 60 latidos por minuto (LPM). [1] Si bien la bradicardia puede ser resultado de varios procesos patológicos, comúnmente es una respuesta fisiológica al condicionamiento cardiovascular o se debe a un bloqueo auriculoventricular tipo 1 asintomático .
Las frecuencias cardíacas en reposo de menos de 50 lpm suelen ser normales durante el sueño en adultos jóvenes y sanos y en deportistas . [2] En estudios de gran población de adultos sin enfermedad cardíaca subyacente, las frecuencias cardíacas en reposo de 45-50 lpm parecen ser los límites inferiores de lo normal, dependiendo de la edad y el sexo. [3] [4] Es más probable que la bradicardia se descubra en los ancianos, ya que la edad y la progresión de la enfermedad cardíaca subyacente contribuyen a su desarrollo. [5]
La bradicardia puede estar asociada con síntomas de fatiga , disnea , mareos , confusión y síncope franco debido a la reducción del flujo sanguíneo hacia el cerebro, los pulmones y el músculo esquelético. [6] Los tipos de síntomas a menudo dependen de la etiología de la frecuencia cardíaca lenta, clasificada por la ubicación anatómica de una disfunción dentro del sistema de conducción cardíaca . [2] Generalmente, estas clasificaciones involucran las amplias categorías de disfunción del nódulo sinusal (SND), bloqueo auriculoventricular y otras enfermedades del tejido de conducción. [5] Sin embargo, la bradicardia también puede resultar sin disfunción del sistema de conducción nativo, surgiendo secundariamente a medicamentos que incluyen betabloqueantes , bloqueadores de los canales de calcio , antiarrítmicos y otros fármacos colinérgicos . El exceso de actividad del nervio vago o la hipersensibilidad del seno carotídeo son causas neurológicas de bradicardia sintomática transitoria. El hipotiroidismo y los trastornos metabólicos son otras causas extrínsecas comunes de bradicardia. [6]
El tratamiento de la bradicardia generalmente se reserva para pacientes con síntomas, independientemente de la frecuencia cardíaca mínima durante el sueño o la presencia de anomalías concomitantes del ritmo cardíaco (ver: pausa sinusal ), que son comunes en esta afección. [6] Se ha demostrado que la SND no tratada aumenta el riesgo futuro de insuficiencia cardíaca y síncope, lo que a veces justifica un tratamiento definitivo con un marcapasos implantado . [7] [5] En las causas auriculoventriculares de bradicardia, a menudo se requiere la implantación de un marcapasos permanente cuando no se encuentran causas reversibles de la enfermedad. [6] [2] Tanto en la SND como en los bloqueos auriculoventriculares, la terapia médica tiene poco papel a menos que un paciente sea hemodinámicamente inestable , lo que puede requerir el uso de medicamentos como atropina e isoproterenol e intervenciones como marcapasos transcutáneo hasta el momento en que se pueda realizar una evaluación adecuada y seleccionar un tratamiento a largo plazo. [2] Si bien las bradicardias asintomáticas rara vez requieren tratamiento, se recomienda la consulta con un médico, especialmente en los ancianos. [ cita requerida ]
El término "bradicardia relativa" puede referirse a una frecuencia cardíaca inferior a la esperada en un estado patológico particular, a menudo una enfermedad febril. [8] La incompetencia cronotrópica (IC) se refiere a un aumento inadecuado de la frecuencia cardíaca durante períodos de mayor demanda, a menudo debido al ejercicio, y es un signo importante de SND y una indicación para la implantación de un marcapasos. [5] [2]
La palabra "bradicardia" proviene del griego βραδύς bradys "lento" y καρδία kardia "corazón". [9]
Conducción cardíaca normal
El corazón es un músculo especializado que contiene unidades repetitivas de cardiomiocitos , o células del músculo cardíaco. Como la mayoría de las células, los cardiomiocitos mantienen un voltaje negativo altamente regulado en reposo y son capaces de propagar potenciales de acción , de manera muy similar a las neuronas. [10] Mientras está en reposo, el voltaje celular negativo de un cardiomiocito puede elevarse por encima de un cierto umbral (la llamada despolarización ) por un potencial de acción entrante, lo que hace que el miocito se contraiga . Cuando estas contracciones ocurren de manera coordinada, las aurículas y los ventrículos del corazón bombearán, entregando sangre al resto del cuerpo. [10]
Normalmente, el origen del potencial de acción que provoca la contracción de los cardiomiocitos se origina en el nódulo sinoauricular (nódulo SA). Este conjunto de tejido de conducción especializado se encuentra en la aurícula derecha, cerca de la entrada de la vena cava superior . [11] El nódulo SA contiene células marcapasos que demuestran "automaticidad" y pueden generar impulsos que viajan a través del corazón y crean un latido cardíaco constante. [11]
Al comienzo del ciclo cardíaco, el nódulo SA genera un potencial de acción eléctrica que se propaga a través de las aurículas derecha e izquierda , lo que provoca la contracción auricular del ciclo cardíaco . [11] Este impulso eléctrico continúa hasta el nódulo auriculoventricular (nódulo AV), otra agrupación especializada de células ubicada en la base de la aurícula derecha, que es la única conexión eléctrica anatómicamente normal entre las aurículas y los ventrículos. Los impulsos que pasan por el nódulo AV se ralentizan antes de continuar hasta los ventrículos, [12] lo que permite un llenado adecuado de los ventrículos antes de la contracción. Los nódulos SA y AV están regulados de cerca por las fibras del sistema nervioso autónomo, lo que permite el ajuste del gasto cardíaco por parte del sistema nervioso central en momentos de mayor demanda metabólica.
Tras una conducción más lenta a través del nódulo auriculoventricular, el potencial de acción producido inicialmente en el nódulo SA fluye ahora a través del sistema His-Purkinje. El haz de His se origina en el nódulo AV y rápidamente se divide en una rama izquierda y otra derecha, cada una destinada a un ventrículo diferente. Finalmente, estas ramas del haz terminan en las pequeñas fibras de Purkinje que inervan el tejido miocárdico. El sistema His-Purkinje conduce los potenciales de acción mucho más rápido de lo que se puede propagar entre las células miocárdicas, lo que permite que todo el miocardio ventricular se contraiga en menos tiempo, mejorando la función de bombeo. [11]
Clasificación

La mayoría de las causas patológicas de bradicardia son resultado de un daño a este sistema de conducción cardíaca normal en varios niveles: el nódulo sinoauricular, el nódulo auriculoventricular o daño al tejido de conducción entre o después de estos nódulos.
Nódulo sinusal
La bradicardia causada por alteraciones de la actividad del nodo sinusal se divide en tres tipos.
Bradicardia sinusal
La bradicardia sinusal es un ritmo sinusal de menos de 50 LPM. [5] Los potenciales de acción cardíaca se generan desde el nódulo SA y se propagan a través de un sistema de conducción por lo demás normal, pero ocurren a un ritmo lento. Es una afección común que se encuentra tanto en individuos sanos como en aquellos considerados atletas bien acondicionados. [1] Los estudios han encontrado que el 50-85% de los atletas acondicionados tienen bradicardia sinusal benigna, en comparación con el 23% de la población general estudiada. [13] El músculo cardíaco de los atletas tiene un mayor volumen sistólico , lo que requiere menos contracciones para circular el mismo volumen de sangre. [14] La bradicardia sinusal asintomática disminuye en prevalencia con la edad.
Arritmia sinusal
Las arritmias sinusales son anomalías del ritmo cardíaco que se caracterizan por variaciones en la duración del ciclo cardíaco de más de 120 milisegundos (ciclo más largo - ciclo más corto). [2] Son el tipo de arritmia más común en la población general y no suelen tener consecuencias significativas. Suelen presentarse en jóvenes, deportistas o tras la administración de medicamentos como la morfina. Los tipos de arritmia sinusal se dividen en categorías respiratorias y no respiratorias. [2]
Arritmia sinusal respiratoria
La arritmia sinusal respiratoria se refiere a la variación fisiológicamente normal de la frecuencia cardíaca debido a la respiración. Durante la inspiración, la actividad del nervio vago disminuye, lo que reduce la inervación parasimpática del nódulo sinoatrial y provoca un aumento de la frecuencia cardíaca. Durante la espiración, la frecuencia cardíaca disminuye debido a que ocurre lo contrario. [2]
Arritmia sinusal no respiratoria
Las causas no respiratorias de arritmia sinusal incluyen pausa sinusal, paro sinusal y bloqueo de salida sinoauricular . La pausa y el paro sinusal implican la desaceleración o la detención de la generación automática de impulsos desde el nódulo sinusal. Esto puede provocar asistolia o paro cardíaco si los ritmos de escape ventricular no crean fuentes de respaldo de potenciales de acción cardíaca. [2]
El bloqueo de salida sinoauricular es un fenómeno no respiratorio similar en el que se pierden temporalmente los impulsos sinoauriculares. Sin embargo, a diferencia de una pausa sinusal, el potencial de acción se sigue generando en el nódulo SA, pero no puede salir del nódulo o tarda en hacerlo, lo que impide o retrasa la despolarización auricular y la posterior sístole ventricular. Por lo tanto, la duración de la pausa en los latidos del corazón suele ser un múltiplo del intervalo PP, como se observa en la electrocardiografía. Al igual que una pausa sinusal, un bloqueo de salida sinoauricular puede ser sintomático, especialmente si la duración de la pausa es prolongada. [2]
Disfunción del nodo sinusal
Un síndrome de enfermedad intrínseca del nódulo sinusal, conocido como síndrome del seno enfermo o disfunción del nódulo sinusal , abarca afecciones que incluyen bradicardia sinusal sintomática o incompetencia cronotrópica persistente, bloqueo sinoauricular , paro sinusal y síndrome de taquicardia-bradicardia. [2] Estas afecciones pueden ser causadas por daño al nódulo sinusal nativo en sí y con frecuencia se acompañan de conducción del nódulo AV dañada y actividad reducida del marcapasos de respaldo. [15] La afección también puede ser causada por disfunción del sistema nervioso autónomo que regula el nódulo y comúnmente se ve exacerbada por medicamentos. [2]
Nódulo auriculoventricular
La bradicardia también puede ser consecuencia de la inhibición del flujo de potenciales de acción a través del nódulo auriculoventricular (AV). Si bien esto puede ser normal en pacientes jóvenes debido al tono excesivo del nervio vago, la bradicardia sintomática debida a la disfunción del nódulo AV en personas mayores se debe comúnmente a una cardiopatía estructural, isquemia miocárdica o fibrosis relacionada con la edad. [16]
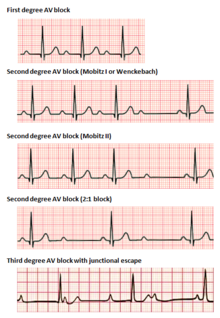
Bloqueo auriculoventricular
Los bloqueos auriculoventriculares se dividen en tres categorías, clasificadas según su gravedad. El bloqueo AV se diagnostica mediante un ECG de superficie, que suele ser suficiente para localizar la lesión causal del bloqueo sin necesidad de un estudio electrofisiológico invasivo . [2]
En el bloqueo AV de primer grado , los impulsos eléctricos que se originan en el nódulo SA (u otro foco ectópico por encima de los ventrículos) se conducen con un retraso significativo a través del nódulo AV. Esta afección se diagnostica mediante ECG, con intervalos PR superiores a 200 milisegundos. [2] El intervalo PR representa el tiempo transcurrido entre el inicio de la despolarización auricular y el inicio de la despolarización ventricular, y representa el flujo de impulsos eléctricos entre los nódulos SA y AV. A pesar del término "bloqueo", ningún impulso se pierde por completo en esta conducción, sino que simplemente se retrasa. La ubicación de la lesión causal puede estar en cualquier lugar entre el nódulo AV y el sistema His-Purkinje, pero se encuentra más comúnmente en el propio nódulo AV. [17] Generalmente, la prolongación aislada del PR en el bloqueo AV de primer grado no se asocia con un aumento de la mortalidad o la hospitalización. [18]
El bloqueo AV de segundo grado se caracteriza por la pérdida intermitente de la conducción de impulsos entre el nódulo SA y los ventrículos. El bloqueo de segundo grado se clasifica en dos tipos. El bloqueo de tipo 1 de Mobitz, también conocido por el epónimo Wenckebach , muestra clásicamente patrones agrupados de latidos cardíacos en el ECG. A lo largo del grupo, el intervalo PR se alarga gradualmente hasta que se produce una caída de la conducción, lo que da como resultado que no se observe ningún complejo QRS en el ECG de superficie después de la última onda P. Después de un retraso, la agrupación se repite y el intervalo PR se acorta nuevamente hasta la línea de base. [17] El bloqueo AV de segundo grado de tipo 1 debido a una enfermedad en el nódulo AV (a diferencia del sistema His-Purkinje) rara vez necesita intervención con implantación de marcapasos. [17]
El bloqueo AV de segundo grado, tipo Mobitz 2, es otro fenómeno de complejos QRS intermitentemente disminuidos después de agrupaciones características de latidos observados en el ECG de superficie. Los intervalos PR y RR son constantes en esta afección, seguidos de un bloqueo AV repentino y una disminución del complejo QRS. [17] Debido a que los bloqueos de tipo 2 se deben típicamente a lesiones por debajo del nodo AV, la capacidad de los ritmos de escape ventriculares para mantener el gasto cardíaco se ve comprometida. A menudo se requiere la implantación de un marcapasos permanente. [16]
Ritmos de unión
Un ritmo de la unión AV , o bradicardia del nódulo auriculoventricular, suele deberse a la ausencia del impulso eléctrico del nódulo sinusal . Esto suele aparecer en un electrocardiograma con un complejo QRS normal acompañado de una onda P invertida antes, durante o después del complejo QRS. [14]
Un latido de escape de la unión AV es un latido cardíaco retrasado que se origina en un foco ectópico en algún lugar de la unión AV. Ocurre cuando la tasa de despolarización del nódulo SA cae por debajo de la frecuencia del nódulo AV . [14] Esta arritmia también puede ocurrir cuando los impulsos eléctricos del nódulo SA no llegan al nódulo AV debido a un bloqueo SA o AV. [19] Este es un mecanismo de protección del corazón para compensar un nódulo SA que ya no maneja la actividad de marcapasos y es uno de una serie de sitios de respaldo que pueden asumir la función de marcapasos cuando el nódulo SA deja de hacerlo. Esto se presentaría con un intervalo PR más largo . Un complejo de escape de la unión AV es una respuesta normal que puede resultar de un tono vagal excesivo en el nódulo SA. Las causas patológicas incluyen bradicardia sinusal, paro sinusal, bloqueo de salida sinusal o bloqueo AV. [14]
Ventricular
El ritmo idioventricular , también conocido como bradicardia auriculoventricular o ritmo de escape ventricular, es una frecuencia cardíaca de menos de 50 lpm. Este es un mecanismo de seguridad cuando se produce una falta de impulso eléctrico o estímulos de la aurícula . [14] Los impulsos que se originan dentro o debajo del haz de His en el nódulo AV producirán un complejo QRS ancho con frecuencias cardíacas entre 20 y 40 lpm. Aquellos por encima del haz de His, también conocidos como de unión, normalmente oscilarán entre 40 y 60 lpm con un complejo QRS estrecho. [20] [21] En un bloqueo cardíaco de tercer grado , aproximadamente el 61% se produce en el sistema de Purkinje de la rama del haz, el 21% en el nódulo AV y el 15% en el haz de His. [21] El bloqueo AV se puede descartar con un ECG que indique "una relación 1:1 entre las ondas P y los complejos QRS". [20] Las bradicardias ventriculares se presentan con bradicardia sinusal, paro sinusal y bloqueo auriculoventricular. El tratamiento suele consistir en la administración de atropina y estimulación cardíaca . [14]
Infantil
En el caso de los bebés, la bradicardia se define como una frecuencia cardíaca inferior a 100 lpm (lo normal es de alrededor de 120 a 160 lpm). Los bebés prematuros tienen más probabilidades que los bebés nacidos a término de sufrir episodios de apnea y bradicardia; su causa no se entiende claramente. Los episodios pueden estar relacionados con centros dentro del cerebro que regulan la respiración y que pueden no estar completamente desarrollados. Tocar al bebé suavemente o mecer la incubadora ligeramente casi siempre hará que el bebé comience a respirar de nuevo, lo que aumenta la frecuencia cardíaca. La práctica estándar en la unidad de cuidados intensivos neonatales es monitorear electrónicamente el corazón y los pulmones. [ cita requerida ]
Causas
La arritmia bradicardia puede tener muchas causas, tanto cardíacas como no cardíacas.
Las causas no cardíacas suelen ser secundarias y pueden implicar el uso o abuso de drogas recreativas , problemas metabólicos o endocrinos, especialmente hipotiroidismo , un desequilibrio electrolítico , factores neurológicos, reflejos autónomos , factores situacionales, como reposo prolongado en cama y autoinmunidad . [22] En reposo, aunque la taquicardia se observa más comúnmente en los trastornos de oxidación de ácidos grasos , la bradicardia aguda puede ocurrir con menor frecuencia. [23]
Las causas cardíacas incluyen cardiopatía isquémica aguda o crónica , cardiopatía vascular, cardiopatía valvular o enfermedad eléctrica primaria degenerativa. En definitiva, las causas actúan mediante tres mecanismos: depresión del automatismo del corazón, bloqueo de la conducción o marcapasos y ritmos de escape. [24]
En general, dos tipos de problemas provocan bradicardias: trastornos del nódulo SA y trastornos del nódulo AV. [25]
En caso de disfunción del nodo SA (a veces llamada síndrome del seno enfermo), puede haber un automatismo desordenado o una conducción deficiente del impulso desde el nodo SA hacia el tejido auricular circundante (un "bloqueo de salida"). Los bloqueos sinoauriculares de segundo grado solo se pueden detectar mediante el uso de un ECG de 12 derivaciones. [26] Es difícil y a veces imposible asignar un mecanismo a una bradicardia en particular, pero el mecanismo subyacente no es clínicamente relevante para el tratamiento, que es el mismo en ambos casos de síndrome del seno enfermo: un marcapasos permanente . [24]
Los trastornos de la conducción AV (bloqueo AV; bloqueo AV primario , bloqueo AV secundario tipo I , bloqueo AV secundario tipo II , bloqueo AV terciario ) pueden ser resultado de una conducción alterada en el nódulo AV o en cualquier parte debajo de él, como en el haz de His. La relevancia clínica de los bloqueos AV es mayor que la de los bloqueos SA. [26]
Una variedad de medicamentos pueden inducir o exacerbar la bradicardia. [5] Estos incluyen betabloqueantes como el propranolol , bloqueantes de los canales de calcio como el verapamilo y el diltiazem , glucósidos cardíacos como la digoxina , agonistas alfa-2 como la clonidina y litio , entre otros. [5] [27] Los betabloqueantes pueden reducir la frecuencia cardíaca a un nivel peligroso si se prescriben con bloqueadores de los canales de calcio. [28]
El consumo crónico de cocaína se ha asociado con bradicardia. [29] [30] [31] Se ha sugerido que la desensibilización de los receptores β-adrenérgicos es una posible causa de esto. [29] [31] Sin embargo, a diferencia de la cocaína, la metanfetamina no se ha asociado con bradiarritmias. [29]
La bradicardia también es parte del reflejo de buceo de los mamíferos . [32]
Se ha descubierto que la COVID-19 es causa de bradicardia. [33]
Diagnóstico
El diagnóstico de bradicardia en adultos se basa en una frecuencia cardíaca inferior a 60 lpm, [1] aunque algunos estudios utilizan una frecuencia cardíaca inferior a 50 lpm. [34] Esto suele determinarse mediante palpación o ECG. [1] Si se presentan síntomas, una determinación de electrolitos puede ayudar a determinar la causa subyacente. [28]
Muchos adultos jóvenes sanos, y en particular los deportistas bien entrenados, tienen bradicardia sinusal asintomática. [5] Esto puede incluir frecuencias cardíacas inferiores a 50 o 60 lpm o incluso inferiores a 40 lpm. [5] Estas personas, sin síntomas, no requieren tratamiento. [5]
La correlación temporal de los síntomas con la bradicardia es necesaria para el diagnóstico de la bradicardia sintomática. [5] Esto a veces puede ser difícil. [5] La provocación con teofilina oral se puede utilizar como agente de diagnóstico en personas con bradicardia causada por disfunción del nódulo sinusal (SND) para ayudar a correlacionar los síntomas. [5] La teofilina aumenta la frecuencia cardíaca en reposo y mejora los síntomas subjetivos en la mayoría de las personas con bradicardia debido a SND. [5]
Gestión
El tratamiento de la bradicardia depende de si la persona está estable o inestable. [1] [34] [5]
Crónica o estable
No es necesario un tratamiento de emergencia si la persona es asintomática o presenta síntomas mínimos. [34]
El tratamiento de la bradicardia sintomática crónica requiere en primer lugar la correlación de los síntomas. [5] Una vez que los síntomas se han vinculado claramente con la bradicardia, se puede proporcionar una estimulación cardíaca permanente para aumentar la frecuencia cardíaca y los síntomas mejorarán. [5]
En personas que no están dispuestas a someterse a la implantación de un marcapasos o no son candidatas para la estimulación cardíaca, se puede considerar la teofilina oral crónica , un antagonista del receptor de adenosina , para el tratamiento de la bradicardia sintomática. [5] [35] También se han utilizado otros cronotropos positivos para tratar la bradicardia, incluido el agente vasodilatador y antihipertensivo hidralazina , el bloqueador alfa-1 prazosina , anticolinérgicos y agentes simpaticomiméticos como los agonistas beta-1 . [35] Sin embargo, los efectos secundarios , como la hipotensión ortostática con hidralazina, prazosina y anticolinérgicos y la toxicidad miocárdica con simpaticomiméticos, así como los datos limitados para esta indicación, dificultan su uso rutinario y a largo plazo. [35]
Si el hipotiroidismo está presente y es la causa de la bradicardia sintomática, los síntomas responden bien a la terapia de reemplazo con hormona tiroidea . [5]
La interrupción de los medicamentos que inducen o exacerban la bradicardia, como los betabloqueantes , los bloqueantes de los canales de calcio , los bloqueantes de los canales de sodio y los bloqueantes de los canales de potasio , puede mejorar los síntomas. [5] Si la interrupción de estos medicamentos no es posible debido a la necesidad clínica, se puede considerar la estimulación cardíaca con la continuación de los medicamentos. [5] Los betabloqueantes con actividad simpaticomimética intrínseca (es decir, actividad agonista parcial ), como el pindolol , tienen menos riesgo de bradicardia y pueden ser útiles como reemplazos de los betabloqueantes puros, como el propranolol , el atenolol y el metoprolol . [36] [37] [38]
Aguda o inestable
Si una persona está inestable, el tratamiento inicial recomendado es atropina intravenosa . [34] No se deben utilizar dosis inferiores a 0,5 mg, ya que pueden reducir aún más la frecuencia. [34] Si esto no es efectivo, se debe utilizar una infusión intravenosa de inotrópicos ( dopamina , epinefrina ) o un marcapasos transcutáneo . [34] Puede ser necesario un marcapasos transvenoso si la causa de la bradicardia no es rápidamente reversible. [34] Las metilxantinas como la teofilina y la aminofilina también se utilizan en el tratamiento de la bradicardia aguda debido a la disfunción del nódulo sinusal (SND). [5]
En los niños se recomienda administrar oxígeno, apoyar la respiración y realizar compresiones torácicas . [39] [40]
Epidemiología
![[icono]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1c/Wiki_letter_w_cropped.svg/20px-Wiki_letter_w_cropped.svg.png) | Esta sección necesita una ampliación con: discusión sobre el umbral de 60 bpm. Puedes ayudar agregando algo más. ( Diciembre de 2018 ) |
En la práctica clínica, las personas mayores de 65 años y los atletas jóvenes de ambos sexos pueden tener bradicardia sinusal. [1] Los Centros para el Control y la Prevención de Enfermedades de los EE. UU. informaron en 2011 que el 15,2 % de los hombres adultos y el 6,9 % de las mujeres adultas tenían bradicardia clínicamente definida (una frecuencia cardíaca en reposo inferior a 60 lpm). [41]
Sociedad y cultura
Archivos
- Daniel Green tiene el récord mundial del latido cardíaco más lento en un ser humano sano, con una frecuencia cardíaca medida en 2014 de 26 LPM. [42]
- Martin Brady posee el récord mundial Guinness por la frecuencia cardíaca más lenta, con una frecuencia certificada de 27 pulsaciones por minuto durante un minuto. [43]
- Durante su carrera, el ciclista profesional Miguel Indurain tuvo una frecuencia cardíaca en reposo de 28 LPM. [44]
Véase también
- Reflejo de Bezold-Jarisch : procesos que provocan hipopnea
Referencias
- ^ abcdef Hafeez Y, Grossman SA (9 de agosto de 2021). "Bradicardia sinusal". StatPearls [Internet] . Treasure Island (FL): StatPearls Publishing. PMID 29630253. Consultado el 16 de enero de 2022 .
- ^ abcdefghijklmn Patterson KK, Olgin JE (2022). "Bradiarritmias y bloqueo auriculoventricular". Braunwald's Heart Disease: A Textbook of Cardiovascular Medicine (12.ª ed.). Filadelfia, PA: Elsevier. págs. 1312–1320. ISBN 978-0-323-82467-5.
- ^ Rijnbeek PR, van Herpen G, Bots ML, Man S, Verweij N, Hofman A, et al. (2014). "Valores normales del electrocardiograma para edades de 16 a 90 años". Revista de electrocardiología . 47 (6): 914–921. doi :10.1016/j.jelectrocard.2014.07.022. hdl : 1887/117357 . PMID 25194872.
- ^ Rijnbeek PR (2012). "Valores normales del ECG". Róterdam, Países Bajos.
- ^ abcdefghijklmnopqrstu v Kusumoto FM, Schoenfeld MH, Barrett C, Edgerton JR, Ellenbogen KA, Gold MR, et al. (agosto de 2019). "Guía ACC/AHA/HRS de 2018 sobre la evaluación y el tratamiento de pacientes con bradicardia y retraso de la conducción cardíaca: un informe del grupo de trabajo sobre guías de práctica clínica del Colegio Estadounidense de Cardiología/Asociación Estadounidense del Corazón y la Heart Rhythm Society". Circulation . 140 (8): e382–e482. doi : 10.1161/CIR.0000000000000628 . PMID 30586772.
- ^ abcd Sidhu S, Marine JE (julio de 2020). «Evaluación y manejo de la bradicardia». Tendencias en medicina cardiovascular . 30 (5): 265–272. doi : 10.1016/j.tcm.2019.07.001 . PMID: 31311698.
- ^ Menozzi C, Brignole M, Alboni P, Boni L, Paparella N, Gaggioli G, et al. (noviembre de 1998). "El curso natural del síndrome del seno enfermo no tratado e identificación de las variables predictivas de un resultado desfavorable". The American Journal of Cardiology . 82 (10): 1205–1209. doi :10.1016/s0002-9149(98)00605-5. PMID 9832095.
- ^ Ye F, Hatahet M, Youniss MA, Toklu HZ, Mazza JJ, Yale S (junio de 2018). "La importancia clínica de la bradicardia relativa". WMJ . 117 (2): 73–78. PMID 30048576.
- ^ Prutchi, David (2005). Diseño y desarrollo de instrumentación electrónica médica. John Wiley & Sons. pág. 371. ISBN 9780471681830.
- ^ ab Loscalzo J, Keaney JF, MacRae CA (2022). "Biología básica del sistema cardiovascular". En Loscalzo J, Fauci AS, Kasper DL, Hauser S, Longo D, Jameson JL (eds.). Principios de medicina interna de Harrison (21.ª ed.). McGraw Hill. ISBN 978-1-264-26850-4.
- ^ abcd Sauer WH, Koplan BA, Zei PC (2022). "Principios de electrofisiología cardíaca clínica". En Loscalzo J, Fauci AS, Kasper DL, Hauser S, Longo D, Jameson JL (eds.). Principios de medicina interna de Harrison (21.ª ed.). McGraw Hill. ISBN 978-1-264-26850-4.
- ^ Kurian T, Ambrosi C, Hucker W, Fedorov VV, Efimov IR (junio de 2010). "Anatomía y electrofisiología del nodo AV humano". Electrofisiología clínica y estimulación . 33 (6): 754–762. doi :10.1111/j.1540-8159.2010.02699.x. PMC 2889145. PMID 20180918 .
- ^ Bryan G, Ward A, Rippe JM (abril de 1992). "Síndrome del corazón atlético". Clinics in Sports Medicine . 11 (2). Elsevier: 259–272. doi :10.1016/S0278-5919(20)30529-9. PMID 1591784.
- ^ abcdef Allan B. Wolfson, ed. (2005). Práctica clínica de la medicina de urgencias de Harwood-Nuss (4.ª ed.). Lippincott Williams & Wilkins. pág. 260. ISBN 978-0-7817-5125-4.
- ^ John RM, Kumar S (mayo de 2016). "Nodo sinusal y arritmias auriculares". Circulation . 133 (19): 1892–1900. doi : 10.1161/CIRCULATIONAHA.116.018011 . PMID 27166347.
- ^ ab Sauer WH, Koplan BA (2022). "Bradiarritmias: trastornos del nódulo auriculoventricular". En Loscalzo J, Fauci AS, Kasper DL, Hauser S, Longo D, Jameson JL (eds.). Principios de medicina interna de Harrison (21.ª ed.). McGraw Hill. ISBN 978-1-264-26850-4.
- ^ abcd Clark BA, Prystowsky EN (diciembre de 2021). "Electrocardiografía del bloqueo auriculoventricular". Clínicas de electrofisiología cardíaca . 13 (4): 599–605. doi :10.1016/j.ccep.2021.07.001. PMID 34689889. S2CID 239091592.
- ^ Aro AL, Anttonen O, Kerola T, Junttila MJ, Tikkanen JT, Rissanen HA, et al. (Enero de 2014). "Importancia pronóstica del intervalo PR prolongado en la población general". Revista europea del corazón . 35 (2): 123-129. doi : 10.1093/eurheartj/eht176 . PMID 23677846.
- ^ "Alteraciones del ritmo de la unión AV (para profesionales)". Asociación Estadounidense del Corazón. 4 de diciembre de 2008. Consultado el 15 de diciembre de 2009 .
- ^ ab "Arritmias y trastornos de la conducción". Manuales Merck: Biblioteca médica en línea . Merck Sharp and Dohme Corp. Enero de 2008. Consultado el 16 de diciembre de 2009 .
- ^ ab Adams MG, Pelter MM (septiembre de 2003). "Ritmos de escape ventricular". American Journal of Critical Care . 12 (5): 477–478. doi :10.4037/ajcc2003.12.5.477. PMID 14503433.
- ^ Ye F, Hatahet M, Youniss MA, Toklu HZ, Mazza JJ, Yale S (junio de 2018). "La importancia clínica de la bradicardia relativa". WMJ . 117 (2): 73–78. PMID 30048576.
- ^ Bonnet D, Martin D, Villain E, Jouvet P, Rabier D, Brivet M, et al. (noviembre de 1999). "Arritmias y defectos de conducción como síntomas de presentación de trastornos de oxidación de ácidos grasos en niños". Circulation . 100 (22): 2248–2253. doi : 10.1161/01.cir.100.22.2248 . PMID 10577999.
- ^ ab "¿Qué es la bradicardia?". WebMD . Consultado el 5 de julio de 2021 .
- ^ "Bradiarritmias". Biblioteca de conceptos médicos de Lecturio . Consultado el 5 de julio de 2021 .
- ^ ab Ufberg JW, Clark JS (febrero de 2006). "Bradiarritmias y bloqueos de la conducción auriculoventricular". Emergency Medicine Clinics of North America . 24 (1): 1–9, v. doi :10.1016/j.emc.2005.08.006. PMID 16308110.
- ^ Miller MB (mayo de 1998). "Arritmias asociadas con toxicidad farmacológica". Emerg Med Clin North Am . 16 (2): 405–417. doi :10.1016/s0733-8627(05)70009-2. PMID 9621850.
- ^ ab "¿Qué es la bradicardia?". WebMD . Consultado el 5 de julio de 2021 .
- ^ abc Dominic P, Ahmad J, Awwab H, Bhuiyan MS, Kevil CG, Goeders NE, et al. (enero de 2022). "Drogas estimulantes de abuso y arritmias cardíacas". Circ Arrhythm Electrophysiol . 15 (1): e010273. doi :10.1161/CIRCEP.121.010273. PMC 8766923 . PMID 34961335.
- ^ Sharma J, Rathnayaka N, Green C, Moeller FG, Schmitz JM, Shoham D, et al. (2016). "Bradicardia como marcador del consumo crónico de cocaína: un nuevo hallazgo cardiovascular". Behav Med . 42 (1): 1–8. doi :10.1080/08964289.2014.897931. PMC 4162850 . PMID 24621090.
- ^ ab Franklin SM, Thihalolipavan S, Fontaine JM (mayo de 2017). "Bradicardia sinusal en consumidores habituales de cocaína". Am J Cardiol . 119 (10): 1611–1615. doi :10.1016/j.amjcard.2017.02.018. PMID 28341362.
- ^ Panneton WM (septiembre de 2013). "La respuesta de buceo de los mamíferos: ¿un reflejo enigmático para preservar la vida?". Fisiología . 28 (5): 284–297. doi :10.1152/physiol.00020.2013. PMC 3768097 . PMID 23997188.
- ^ Douedi S, Mararenko A, Alshami A, Al-Azzawi M, Ajam F, Patel S, et al. (agosto de 2021). "Bradiarritmia inducida por COVID-19 y bradicardia relativa: una descripción general". J Arritmo . 37 (4): 888–892. doi :10.1002/joa3.12578. PMC 8339085 . PMID 34386113.
- ^ abcdefg Neumar RW, Otto CW, Link MS, Kronick SL, Shuster M, Callaway CW, et al. (noviembre de 2010). "Parte 8: soporte vital cardiovascular avanzado para adultos: Pautas de la American Heart Association de 2010 para reanimación cardiopulmonar y atención cardiovascular de emergencia". Circulation . 122 (18 Suppl 3): S729–S767. doi : 10.1161/CIRCULATIONAHA.110.970988 . PMID 20956224.
- ^ abc Ling CA, Crouch MA (1998). "Teofilina para la bradicardia sintomática crónica en ancianos". Ann Pharmacother . 32 (7–8): 837–839. doi :10.1345/aph.17463. PMID 9681101.
- ^ Northcote RJ (mayo de 1987). "La importancia clínica de la actividad simpaticomimética intrínseca". Int J Cardiol . 15 (2): 133–150. doi :10.1016/0167-5273(87)90309-3. PMID 2884187.
- ^ Mangrum JM, DiMarco JP (marzo de 2000). "Evaluación y tratamiento de la bradicardia" (PDF) . N Engl J Med . 342 (10): 703–709. doi :10.1056/NEJM200003093421006. PMID 10706901.
- ^ Jaillon P (septiembre de 1990). "Relevancia de la actividad simpaticomimética intrínseca de los betabloqueantes". Am J Cardiol . 66 (9): 21C–23C. doi :10.1016/0002-9149(90)90758-s. PMID 1977302.
- ^ de Caen AR, Berg MD, Chameides L, Gooden CK, Hickey RW, Scott HF, et al. (noviembre de 2015). "Parte 12: Soporte vital avanzado pediátrico: actualización de las pautas de la American Heart Association de 2015 para reanimación cardiopulmonar y atención cardiovascular de emergencia". Circulation . 132 (18 Suppl 2): S526–S542. doi :10.1161/cir.0000000000000266. PMC 6191296 . PMID 26473000.
- ^ Atkins DL, Berger S, Duff JP, Gonzales JC, Hunt EA, Joyner BL, et al. (noviembre de 2015). "Parte 11: Soporte vital básico pediátrico y calidad de la reanimación cardiopulmonar: actualización de las directrices de la American Heart Association de 2015 para la reanimación cardiopulmonar y la atención cardiovascular de emergencia". Circulation . 132 (18 Suppl 2): S519–S525. doi : 10.1161/cir.0000000000000265 . PMID 26472999.
- ^ Yechiam Ostchega, et al. (24 de agosto de 2011). «Datos de referencia de la frecuencia cardíaca en reposo para niños, adolescentes y adultos: Estados Unidos, 1999-2008» (PDF) . Informes de estadísticas sanitarias nacionales . Centros para el Control y la Prevención de Enfermedades. Archivado (PDF) del original el 10 de octubre de 2022. Consultado el 15 de diciembre de 2018 .
- ^ "Frecuencia cardíaca más lenta: Daniel Green rompe récord Guinness World Records". Academia de récords mundiales . 29 de noviembre de 2014. Consultado el 5 de agosto de 2015 .
- ^ "Frecuencia cardíaca más baja". Libro Guinness de los récords . 11 de agosto de 2005. Consultado el 5 de agosto de 2015 .
- ^ Lovgren S (20 de agosto de 2004). «El oro olímpico comienza con buenos genes, dicen los expertos». National Geographic News . Archivado desde el original el 20 de agosto de 2004. Consultado el 8 de septiembre de 2014 .