Retinoblastoma
| Retinoblastoma | |
|---|---|
 | |
| Muestra patológica de un tumor de retinoblastoma de un ojo enucleado de una niña de 3 años. | |
| Especialidad | Neurooncología |
| Síntomas | Leucocoria observada en la pupila del paciente en fotografías Mala visión Uno o ambos ojos girados hacia adentro o hacia afuera Dolor ocular [1] |
| Inicio habitual | Menores de 3 años [1] |
| Tratamiento | Cirugía (incluida la extirpación del ojo en casos avanzados) Quimioterapia (después de la cirugía en casos de metástasis) Terapia focal [1] |
| Frecuencia | Entre 250 y 300 niños diagnosticados anualmente (Estados Unidos) [1] |
El retinoblastoma (Rb) es una forma rara de cáncer que se desarrolla rápidamente a partir de las células inmaduras de la retina , [2] el tejido que detecta la luz del ojo. [3] Es el cáncer intraocular maligno primario más común en niños, especialmente en los menores de 3 años. [4] [5]
Aunque la mayoría de los niños en países de altos ingresos sobreviven a este cáncer, [2] pueden perder la visión en el ojo o los ojos afectados [6] o necesitar que les extirpen el ojo . [2]
Casi la mitad de los niños con retinoblastoma tienen un defecto genético hereditario asociado. En otros casos, el retinoblastoma es causado por una mutación congénita en el gen 13q14 del cromosoma 13 ( proteína del retinoblastoma ). [7]
Signos y síntomas


El retinoblastoma es el cáncer intraocular más invasivo entre los niños. La probabilidad de supervivencia y conservación del ojo depende totalmente de la gravedad. El retinoblastoma es extremadamente raro, ya que solo hay entre 200 y 300 casos por año en los Estados Unidos. A nivel mundial, solo 1 de cada 15 000 niños padece esta neoplasia maligna, aunque las tasas siguen aumentando. [3]
Las neoplasias malignas intraoculares se tratan con relativa mayor frecuencia que las neoplasias malignas extraoculares, probablemente debido a una detección relativamente temprana y un tratamiento posterior. Los pediatras pueden examinar a los bebés con pruebas de visión anuales, en las que se pueden detectar anomalías. Durante una prueba de reflejo rojo, la luz de un oftalmoscopio pasa a través de partes transparentes del ojo y se refleja en el fondo ocular. Si hay retinoblastoma, puede impedir parcial o totalmente que la luz atraviese este camino. Esto puede resultar en un reflejo rojo anormal o leucocoria , que puede ser un indicador común de retinoblastoma (cuando la luz es reflejada por el tumor, se bloquea la visión normal de la retina roja). El retinoblastoma puede ser visible como una masa blanquecina y translúcida. [8] Si el tumor no se ha diseminado y está contenido dentro del ojo, las probabilidades de un tratamiento exitoso son favorables. Si se ignoran los signos iniciales o se retrasa significativamente el diagnóstico, los resultados y el pronóstico empeoran. Los efectos del retinoblastoma pueden extenderse fuera del ojo, a veces dando lugar a proptosis . El retinoblastoma que se ha diseminado puede ser significativamente más difícil de tratar. [9]
El signo más común y obvio del retinoblastoma es una apariencia anormal de la retina vista a través de la pupila, cuyo término médico es leucocoria , también conocida como reflejo de ojo de gato amaurótico. [5] Otros signos y síntomas incluyen deterioro de la visión, un ojo rojo e irritado con glaucoma y crecimiento vacilante o desarrollo retrasado. Algunos niños con retinoblastoma pueden desarrollar estrabismo, [10] comúnmente conocido como "bizco" o "bizqueo" ( estrabismo ). El retinoblastoma se presenta como una enfermedad avanzada en los países en desarrollo y el agrandamiento de los ojos es un hallazgo común. [11]
Dependiendo de la posición de los tumores, pueden ser visibles durante un simple examen ocular utilizando un oftalmoscopio para mirar a través de la pupila . Un diagnóstico positivo generalmente se hace solo con un examen bajo anestesia ( EUA ). Un reflejo en el ojo blanco no siempre es una indicación positiva de retinoblastoma y puede ser causado por una mala reflexión de la luz [12] o por otras afecciones como la enfermedad de Coats . [13]
La presencia del defecto fotográfico de ojo rojo en un solo ojo y no en el otro puede ser un signo de retinoblastoma. Un signo más claro es el “ojo blanco” u “ojo de gato” (leucocoria). [14]
Causa
La mutación de genes, que se encuentran en los cromosomas, puede afectar la forma en que las células crecen y se desarrollan dentro del cuerpo. [15] Las alteraciones en RB1 o MYCN pueden dar lugar al retinoblastoma.
RB1
En los niños con la forma genética hereditaria del retinoblastoma, se produce una mutación en el gen RB1 en el cromosoma 13. RB1 fue el primer gen supresor de tumores clonado. [ 15] Aunque RB1 interactúa con más de 100 proteínas celulares, [15] su efecto regulador negativo sobre el ciclo celular surge principalmente de la unión e inactivación del factor de transcripción E2F , reprimiendo así la transcripción de genes necesarios para la fase S. [15 ]
El gen RB1 defectuoso puede heredarse de cualquiera de los padres; sin embargo, en algunos niños, la mutación se produce en las primeras etapas del desarrollo fetal. La expresión del alelo RB1 es autosómica dominante con una penetración del 90 % . [16]
Las formas hereditarias de retinoblastomas tienen más probabilidades de ser bilaterales. Además, los retinoblastomas hereditarios uni o bilaterales pueden estar asociados con pineoblastoma y otros tumores neuroectodérmicos primitivos supratentoriales de la línea media malignos (PNET) con un pronóstico desalentador; el retinoblastoma concurrente con un PNET se conoce como retinoblastoma trilateral . [17] Un metanálisis de 2014 mostró que la supervivencia a 5 años del retinoblastoma trilateral aumentó del 6% antes de 1995 al 57% en 2014, atribuido a la detección temprana y la quimioterapia mejorada. [18]
El desarrollo del retinoblastoma se puede explicar mediante el modelo de dos impactos . Según el modelo de dos impactos, ambos alelos deben verse afectados, por lo que son necesarios dos eventos para que la célula o células de la retina se conviertan en tumores. El primer evento mutacional puede ser heredado ( germinal o constitucional), que luego estará presente en todas las células del cuerpo. El segundo “impacto” resulta en la pérdida del alelo normal restante (gen) y ocurre dentro de una célula retiniana en particular. [19] En la forma esporádica, no hereditaria del retinoblastoma, ambos eventos mutacionales ocurren dentro de una sola célula retiniana después de la fertilización (eventos somáticos); el retinoblastoma esporádico tiende a ser unilateral.
Se han desarrollado varios métodos para detectar las mutaciones del gen RB1 . [20] [21] Los intentos de correlacionar las mutaciones genéticas con el estadio de presentación no han mostrado evidencia convincente de una correlación. [22]
MI CN
No todos los casos de retinoblastoma presentan inactivación de RB1. Existen casos reportados con solo una mutación de RB1 o incluso dos alelos funcionales de RB1, lo que indica otras lesiones oncogénicas de retinoblastoma. [23] La amplificación somática del oncogén MYCN es responsable de algunos casos de retinoblastoma unilateral, agresivo, de aparición temprana y no hereditario. MYCN puede actuar como un factor de transcripción y promueve la proliferación regulando la expresión de genes del ciclo celular. [24] [25] Aunque la amplificación de MYCN representó solo el 1,4% de los casos de retinoblastoma, los investigadores lo identificaron en el 18% de los bebés diagnosticados antes de los 6 meses de edad. La edad media en el momento del diagnóstico del retinoblastoma MYCN fue de 4,5 meses, en comparación con los 24 meses de los que tenían enfermedad unilateral no familiar con dos mutaciones del gen RB1 . [26]
Diagnóstico

La detección del retinoblastoma debe formar parte de una evaluación del "bebé sano" para los recién nacidos durante los primeros 3 meses de vida, que incluya: [27]
- El reflejo rojo : comprobar si hay un reflejo rojizo-anaranjado normal en la retina del ojo con un oftalmoscopio o retinoscopio desde unos 30 cm o 1 pie, generalmente en una habitación oscura o con poca luz.
- Reflejo luminoso corneal o prueba de Hirschberg : comprobar el reflejo simétrico del haz de luz en el mismo punto de cada ojo cuando se proyecta una luz sobre cada córnea, para ayudar a determinar si los ojos están bizcos.
- Examen ocular : detección de anomalías estructurales.
Clasificación
Las dos formas de la enfermedad son la hereditaria y la no hereditaria (todos los cánceres se consideran genéticos en el sentido de que se requieren mutaciones del genoma para su desarrollo, pero esto no implica que sean hereditarios o que se transmitan a la descendencia). Aproximadamente el 40% de los pacientes tienen una forma hereditaria de retinoblastoma, que lleva una mutación en el gen RB1 . [28] Si no existen antecedentes de la enfermedad dentro de la familia, la enfermedad se etiqueta como "esporádica", pero esto no indica necesariamente que sea la forma no hereditaria. Los retinoblastomas bilaterales son comúnmente hereditarios, mientras que los retinoblastomas unilaterales son comúnmente no hereditarios. [ cita requerida ]
En aproximadamente dos tercios de los casos, [29] sólo se ve afectado un ojo (retinoblastoma unilateral); en el otro tercio, los tumores se desarrollan en ambos ojos (retinoblastoma bilateral). La cantidad y el tamaño de los tumores en cada ojo pueden variar. En ciertos casos, también se ve afectada la glándula pineal o la región supraselar o paraselar (o en casos muy raros otras localizaciones intracraneales de la línea media) (retinoblastoma trilateral). La posición, el tamaño y la cantidad de tumores se tienen en cuenta al elegir el tipo de tratamiento para la enfermedad. [ cita requerida ]
Diagnóstico diferencial

- 1. La vasculatura fetal persistente es una anomalía congénita del desarrollo del ojo que resulta de la falla de la vasculatura embriológica, vítrea primaria y hialoidea para retroceder, por lo que el ojo es más corto, desarrolla una catarata y puede presentarse con blanqueamiento de la pupila.
- 2. La enfermedad de Coats es una enfermedad típicamente unilateral que se caracteriza por el desarrollo anormal de los vasos sanguíneos detrás de la retina, lo que conduce a anomalías de los vasos sanguíneos en la retina y desprendimiento de retina que imita el retinoblastoma.
- 3. La toxocariasis es una enfermedad parasitaria del ojo asociada a la exposición a cachorros infectados, que provoca una lesión en la retina que conduce al desprendimiento de retina.
- 4. La retinopatía del prematuro se asocia a bebés con bajo peso al nacer que reciben oxígeno suplementario en el período inmediatamente posterior al nacimiento, e implica daño al tejido retiniano y puede llevar al desprendimiento de retina.
- 5. Catarata congénita
- 6. Enfermedad de Norrie
Si el examen ocular es anormal, se pueden realizar otras pruebas, como estudios de diagnóstico por imágenes, como tomografía computarizada (TC), resonancia magnética (RM) y ecografía . [30] La TC y la RM pueden ayudar a definir las anomalías estructurales y revelar cualquier depósito de calcio. La ecografía puede ayudar a definir la altura y el grosor del tumor. También se puede realizar un examen de médula ósea o una punción lumbar para determinar si hay metástasis en los huesos o el cerebro. [ cita requerida ]
Morfología
El aspecto macroscópico y microscópico del retinoblastoma es idéntico tanto en el tipo hereditario como en el esporádico. Macroscópicamente, se encuentran células tumorales viables cerca de los vasos sanguíneos, mientras que las zonas de necrosis se encuentran en áreas relativamente avasculares. Microscópicamente, pueden estar presentes elementos tanto indiferenciados como diferenciados. Los elementos indiferenciados aparecen como colecciones de células pequeñas y redondas con núcleos hipercromáticos; los elementos diferenciados incluyen rosetas de Flexner-Wintersteiner , rosetas de Homer Wright [31] y fleurettes de diferenciación de fotorreceptores. [32]
- Dibujo de un retinoblastoma de gran tamaño
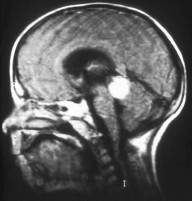
- Aspecto del retinoblastoma trilateral en la resonancia magnética
- Ecografía ocular de un gran tumor de retinoblastoma dentro del ojo de un niño de 3 años
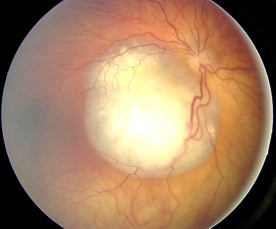
- Hallazgo fundoscópico de un retinoblastoma
- Aspecto del fondo ocular del retinoblastoma
- Gran tumor blanco exofítico con focos de calcificación que produce desprendimiento de retina exudativo total
- Rosetas de Flexner-Wintersteiner en el retinoblastoma
- Retinoblastoma, aumento de 400X
- Estructura cristalina de la proteína supresora de tumores del retinoblastoma unida al polímero peptídico E2F
Pruebas genéticas
Identificar la mutación del gen RB1 que provocó el retinoblastoma en un niño puede ser importante para la atención clínica del individuo afectado y para el cuidado de sus (futuros) hermanos y descendientes. Puede ser hereditaria.
- Se espera que los individuos afectados bilateralmente y el 13-15% de los afectados unilateralmente, [33] [34] muestren una mutación RB1 en la sangre. Al identificar la mutación RB1 en el individuo afectado, se puede realizar una prueba de la mutación a los (futuros) hermanos, hijos y otros familiares; si no son portadores de la mutación, los familiares niños no corren riesgo de sufrir retinoblastoma, por lo que no necesitan someterse al trauma y los gastos de los exámenes bajo anestesia. [35] En el 85% de los pacientes afectados unilateralmente que no son portadores de ninguna de las mutaciones RB1 de su tumor ocular en la sangre, no se requieren pruebas moleculares ni vigilancia clínica de los hermanos.
- Si se identifica la mutación RB1 de un individuo afectado, se pueden analizar las células amnióticas en un embarazo de riesgo para detectar la mutación familiar; cualquier feto que sea portador de la mutación puede nacer de manera temprana, lo que permite el tratamiento temprano de cualquier tumor ocular y conduce a mejores resultados visuales. [35]
- En los casos de retinoblastoma unilateral en los que no se dispone de un tumor ocular para realizar pruebas, si no se detecta una mutación RB1 en la sangre después de una prueba molecular de alta sensibilidad (es decir, una sensibilidad de detección de la mutación RB1 >93 % ), el riesgo de una mutación de la línea germinal RB1 se reduce a menos del 1 %, [34] un nivel en el que solo se recomienda un examen clínico (y no exámenes bajo anestesia) para el individuo afectado y su futura descendencia (Estrategia Nacional para el Retinoblastoma, Pautas Canadienses para el Cuidado). [36]
Imágenes
La ecografía tradicional puede detectar calcificaciones en el tumor, mientras que la ecografía de alta frecuencia puede proporcionar una resolución mayor que la ecografía tradicional y determinar la proximidad del tumor con la parte frontal del ojo. La resonancia magnética puede detectar características de alto riesgo, como invasión del nervio óptico, invasión coroidea, invasión escleral e invasión intracraneal. La tomografía computarizada generalmente se evita porque la radiación puede estimular la formación de más tumores oculares en aquellos con mutación genética RB1. [37]
Puesta en escena
Para diagnosticar correctamente el retinoblastoma, se deben seguir unas pautas para clasificar correctamente el riesgo del tumor. El sistema de clasificación de Reese Ellsworth, del Dr. Algernon Reese y el Dr. Robert Ellsworth, se utiliza universalmente para determinar el tamaño, la ubicación y la multifocalidad del tumor. [38] El sistema se utilizó originalmente para decidir el mejor resultado del tratamiento mediante radioterapia de haz externo, así como la probabilidad de salvar el globo ocular. Debido a que la quimioterapia no forma parte del sistema de clasificación de Reese Ellsworth, era necesario contar con un sistema de clasificación actualizado para prever los resultados del tratamiento de la quimioterapia. La Clasificación Internacional para el Retinoblastoma Intraocular es ahora el sistema actual que se utiliza, y fue creado por Murphree y asociados. [38] Según Reese y Ellsworth, había diferentes grupos que tenían diversas características para clasificar el salvamento del globo ocular como muy favorable a la categoría de muy desfavorable. Para salvar el ojo afectado, el diámetro del disco tenía que ser de alrededor de 4DD y estar detrás del ecuador para tener una mayor favorabilidad. Si el tumor tenía alrededor de diez de diámetro de disco y afectaba aproximadamente el 50% de la retina, se consideró desfavorable salvar el globo ocular, lo que podría resultar en enucleación . Según Murphree, los diferentes grupos se clasificaron desde riesgo muy bajo a riesgo muy alto, lo que se determinó por las características del tumor en cuestión. Riesgo muy bajo significa que el tumor tiene que ser menor de 3 mm y no debe haber siembra del vítreo o área subretinal. Cuando un paciente es de riesgo muy alto, el tumor se presenta con múltiples características y tendrá que ser tratado con modalidades de tratamiento conservador o enucleación. [39]
| Grupo | Características clínicas |
|---|---|
| A Riesgo muy bajo | Todos los tumores miden 3 mm o menos, están confinados en la retina y se encuentran al menos a 3 mm de la fóvea y a 1,5 mm del nervio óptico. No hay diseminación vítrea ni subretinal. |
| B Riesgo bajo | Los tumores de retina pueden ser de cualquier tamaño o ubicación que no estén en el Grupo A. No se permite la siembra vítrea o subretinal. Se permite un pequeño manguito de líquido subretinal que no se extienda más de 5 mm desde la base del tumor. |
| do Riesgo moderado | Ojos con diseminación vítrea o subretinal focal y tumores retinianos discretos de cualquier tamaño y ubicación. La diseminación vítrea o subretinal puede extenderse hasta 3 mm desde el tumor. Puede haber hasta un cuadrante de líquido subretinal |
| D Alto riesgo | Ojos con diseminación vítrea o subretinal difusa y/o enfermedad endofítica o exofítica masiva no discreta. Desprendimiento de retina en más de un cuadrante |
| mi Ojos de muy alto riesgo | Ojos con uno o más de los siguientes: Glaucoma neovascular irreversible Hemorragia intraocular masiva Celulitis orbitaria aséptica Tisis o pretisis Tumor anterior a la cara vítrea anterior Tumor que toca el cristalino Retinoblastoma infiltrante difuso |
Clasificación internacional del retinoblastoma intraocular [38] [39]
Tratamiento

La prioridad del tratamiento del retinoblastoma es preservar la vida del niño, luego preservar la visión y luego minimizar las complicaciones o los efectos secundarios del tratamiento. El curso exacto del tratamiento depende de cada caso individual y lo decide el oftalmólogo en consulta con el oncólogo pediátrico. [40] El tratamiento correcto también depende del tipo de mutación, ya sea una mutación de línea germinal RB1, una mutación esporádica RB1 o una amplificación de MYCN con RB1 funcional. [41] Los niños con afectación de ambos ojos en el momento del diagnóstico generalmente requieren terapia multimodal (quimioterapia, terapias locales).
Las diversas modalidades de tratamiento para el retinoblastoma incluyen: [40] [42] [43]
- Enucleación del ojo : la mayoría de los pacientes con enfermedad unilateral presentan una enfermedad intraocular avanzada, por lo que generalmente se someten a una enucleación, que da como resultado una tasa de curación del 95%. En el caso de la Rb bilateral, la enucleación generalmente se reserva para los ojos en los que no han respondido a todas las terapias efectivas conocidas o que no tienen visión útil.
- Radioterapia de haz externo (EBRT): la indicación más común para la EBRT es para el ojo en un niño pequeño con retinoblastoma bilateral que tiene enfermedad activa o recurrente después de completar la quimioterapia y las terapias locales. Sin embargo, se informa que los pacientes con enfermedad hereditaria que recibieron terapia EBRT tienen un riesgo del 35 % de sufrir un segundo cáncer. [44]
- La braquiterapia consiste en la colocación de un implante radioactivo (placa), generalmente en la esclerótica adyacente a la base de un tumor. Se utiliza como tratamiento primario, o con mayor frecuencia, en pacientes con tumores pequeños o en aquellos en los que no ha funcionado la terapia inicial, incluida la terapia EBRT previa.
- La termoterapia consiste en aplicar calor directamente al tumor, generalmente en forma de radiación infrarroja. También se utiliza en tumores pequeños.
- La fotocoagulación con láser se recomienda únicamente para tumores pequeños en la zona posterior. Se utiliza un láser de argón o de diodo o un arco de xenón para coagular todo el aporte sanguíneo al tumor.
- La crioterapia induce daño al endotelio vascular con trombosis secundaria e infarto del tejido tumoral al congelarlo rápidamente. Puede utilizarse como terapia primaria para tumores periféricos pequeños o para tumores pequeños recurrentes tratados previamente con otros métodos.
- La quimioterapia sistémica ha pasado a ocupar un lugar de primera línea en el tratamiento durante la última década, en la búsqueda de medidas que preserven el globo ocular y eviten los efectos adversos de la terapia con radioterapia de haz externo. Las indicaciones comunes para la quimioterapia en el retinoblastoma intraocular incluyen tumores que son grandes y que no pueden tratarse solo con terapias locales en niños con tumores bilaterales. También se utiliza en pacientes con enfermedad unilateral cuando los tumores son pequeños, pero no pueden controlarse solo con terapias locales.
- Quimioterapia intraarterial: los medicamentos quimioterapéuticos se administran localmente mediante un catéter delgado introducido a través de la ingle, la aorta y el cuello, directamente en los vasos ópticos. [45]
- Quimioterapia con nanopartículas – Para reducir los efectos adversos de la terapia sistémica, se ha desarrollado la inyección subconjuntival (local) de portadores de nanopartículas que contienen agentes quimioterapéuticos (carboplatino), que ha mostrado resultados prometedores en el tratamiento del retinoblastoma en modelos animales sin efectos adversos. [46] [47]
- La quimiorreducción es un enfoque combinado que utiliza quimioterapia para reducir inicialmente el tamaño del tumor y tratamientos focales adyuvantes, como la termoterapia transpupilar, para controlar el tumor. [48] [49]
Pronóstico
En el mundo desarrollado, el retinoblastoma tiene una de las mejores tasas de curación de todos los cánceres infantiles (95-98%), y más del 90% de los pacientes sobreviven hasta la edad adulta. En el Reino Unido, se diagnostican alrededor de 40 a 50 casos nuevos cada año. [50] Un buen pronóstico depende de la presentación temprana del niño en un centro de salud. [51] La presentación tardía se asocia con un mal pronóstico. [52] Los sobrevivientes del retinoblastoma hereditario tienen un mayor riesgo de desarrollar otros cánceres más adelante en la vida.
Epidemiología
El retinoblastoma se presenta con una tasa de incidencia acumulada a lo largo de la vida de un caso de retinoblastoma por cada 18.000 a 30.000 nacidos vivos en todo el mundo. [53] Se observa una mayor incidencia en los países en desarrollo, lo que se ha atribuido a un nivel socioeconómico más bajo y a la presencia de secuencias del virus del papiloma humano en el tejido del retinoblastoma. [54]
Casi el 80% de los niños con retinoblastoma son diagnosticados antes de los tres años de edad y el diagnóstico en niños mayores de seis años es extremadamente raro. [55] En el Reino Unido, los casos bilaterales suelen presentarse entre los 14 y 16 meses, mientras que el diagnóstico de casos unilaterales alcanza su punto máximo entre los 24 y 30 meses.
Véase también
Referencias
- ^ abcd "Retinoblastoma". St. Jude Children's Research Hospital . Consultado el 9 de marzo de 2022 .
- ^ abc Dimaras H, Corson TW, Cobrinik D, White A, Zhao J, Munier FL, et al. (Agosto de 2015). "Retinoblastoma". Reseñas de la naturaleza. Cebadores de enfermedades . 1 : 15021. doi : 10.1038/nrdp.2015.21. PMC 5744255 . PMID 27189421.
- ^ ab "Retinoblastoma: síntomas y causas". Mayo Clinic . Consultado el 17 de marzo de 2021 .
- ^ Rao R, Honavar SG (diciembre de 2017). "Retinoblastoma". Revista India de Pediatría . 84 (12): 937–944. doi :10.1007/s12098-017-2395-0. PMID 28620731.
- ^ ab Sociedad Estadounidense del Cáncer (2003). "Capítulo 85. Neoplasias del ojo". Medicina del cáncer . Hamilton, Ontario: BC Decker Inc. ISBN 978-1-55009-213-4.
- ^ Warda O, Naeem Z, Roelofs KA, Sagoo MS, Reddy MA (abril de 2023). "Retinoblastoma y visión". Eye . 37 (5): 797–808. doi :10.1038/s41433-021-01845-y. PMC 10050411 . PMID 34987197. S2CID 245672434.
- ^ Ryan SJ, Schachat AP, Wilkinson CP, Hinton DR, Sadda SR, Wiedemann P (1 de noviembre de 2012). Retina. Elsevier Health Sciences. pág. 2105. ISBN 978-1455737802.
- ^ Dimaras H, Gallie BL (2016). "Proteína del retinoblastoma, funciones biológicas y clínicas". En Schwab M (ed.). Enciclopedia del cáncer . Berlín, Heidelberg: Springer. págs. 1–5. doi :10.1007/978-3-642-27841-9_5069-9. ISBN 978-3-642-27841-9.
- ^ Dimaras H, Kimani K, Dimba EA, Gronsdahl P, White A, Chan HS y col. (Abril de 2012). "Retinoblastoma". Lanceta . 379 (9824): 1436–1446. doi : 10.1016/s0140-6736(11)61137-9 . PMID 22414599. S2CID 235331617.
- ^ Elkington AR, Khaw PT (septiembre de 1988). "ABC de los ojos. Estrabismo". BMJ . 297 (6648): 608–611. doi :10.1136/bmj.297.6648.608. PMC 1834556 . PMID 3139234.
- ^ "Retinoblastoma | Instituto Nacional del Ojo". www.nei.nih.gov . Archivado desde el original el 2022-08-26 . Consultado el 2022-08-26 .
- ^ "¿Ha visto un brillo blanco en una fotografía?". chect.org.uk . The Childhood Eye Cancer Trust. 18 de enero de 2017 . Consultado el 31 de diciembre de 2022 .
- ^ Balmer A, Munier F (diciembre de 2007). "Diagnóstico diferencial de leucocoria y estrabismo, primeros signos de presentación de retinoblastoma". Clinical Ophthalmology . 1 (4): 431–439. PMC 2704541 . PMID 19668520.
- ^ Introducción al ojo blanco Archivado el 26 de abril de 2011 en Wayback Machine , Daisy's Eye Cancer Fund.
- ^ abcd Du W, Pogoriler J (agosto de 2006). "Genes de la familia del retinoblastoma". Oncogene . 25 (38): 5190–5200. doi :10.1038/sj.onc.1209651. PMC 1899835 . PMID 16936737.
- ^ Lohmann DR, Gallie BL (1993). "Retinoblastoma". En Adam MP, Feldman J, Mirzaa GM, Pagon RA, Wallace SE, Bean LJ, Gripp KW, Amemiya A (eds.). GeneReviews® . Seattle (WA): Universidad de Washington, Seattle. PMID 20301625 . Consultado el 27 de junio de 2022 .
- ^ Kivelä T (junio de 1999). "Retinoblastoma trilateral: un metaanálisis del retinoblastoma hereditario asociado con el retinoblastoma intracraneal ectópico primario". Revista de Oncología Clínica . 17 (6): 1829–1837. doi :10.1200/JCO.1999.17.6.1829. PMID 10561222.
- ^ de Jong MC, Kors WA, de Graaf P, Castelijns JA, Kivelä T, Moll AC (septiembre de 2014). "Retinoblastoma trilateral: una revisión sistemática y un metanálisis". La lanceta. Oncología . 15 (10): 1157-1167. doi :10.1016/s1470-2045(14)70336-5. PMID 25126964.
- ^ Harbour JW, Dean DC Función de Rb en la regulación del ciclo celular y la apoptosis" Nature Cell Biology. 2000;94:E65–E67.
- ^ Parsam VL, Kannabiran C, Honavar S, Vemuganti GK, Ali MJ (diciembre de 2009). "Un enfoque integral, sensible y económico para la detección de mutaciones en el gen RB1 en el retinoblastoma". Journal of Genetics . 88 (4): 517–527. doi :10.1007/s12041-009-0069-z. PMID 20090211. S2CID 10723496.
- ^ Lohmann DR, Gallie BL (2010). "Retinoblastoma". GeneReviews . Seattle, WA: Universidad de Washington. PMID 20301625.
- ^ Ali MJ, Parsam VL, Honavar SG, Kannabiran C, Vemuganti GK, Reddy VA (octubre de 2010). "Mutaciones del gen RB1 en retinoblastoma y su correlación clínica". Revista Saudita de Oftalmología . 24 (4): 119-123. doi :10.1016/j.sjopt.2010.05.003. PMC 3729507 . PMID 23960888.
- ^ Rushlow DE, Mol BM, Kennett JY, Yee S, Pajovic S, Thériault BL, et al. (abril de 2013). "Caracterización de retinoblastomas sin mutaciones de RB1: estudios genómicos, de expresión génica y clínicos". The Lancet. Oncología . 14 (4): 327–334. doi :10.1016/S1470-2045(13)70045-7. PMID 23498719.
- ^ Woo CW, Tan F, Cassano H, Lee J, Lee KC, Thiele CJ (febrero de 2008). "Uso de la interferencia de ARN para dilucidar el efecto de MYCN en el ciclo celular en el neuroblastoma". Pediatric Blood & Cancer . 50 (2): 208–212. doi :10.1002/pbc.21195. PMID 17420990. S2CID 22765085.
- ^ Stenfelt S, Blixt MK, All-Ericsson C, Hallböök F, Boije H (noviembre de 2017). "Heterogeneidad en el retinoblastoma: una historia de moléculas y modelos". Medicina clínica y traslacional . 6 (1): 42. doi : 10.1186/s40169-017-0173-2 . PMC 5680409 . PMID 29124525.
- ^ Lewis R (19 de marzo de 2013). "Algunos retinoblastomas agresivos carecen de mutaciones RB1". Medscape Online . Archivado desde el original el 19 de septiembre de 2017.
- ^ Malik AN, Evans JR, Gupta S, Mariotti S, Gordon I, Bowman R, et al. (octubre de 2022). "Examen ocular universal para recién nacidos: una revisión sistemática de la literatura y una revisión de las directrices internacionales". Journal of Global Health . 12 : 12003. doi :10.7189/jogh.12.12003. PMC 9586142 . PMID 36269293.
- ^ Tonorezos ES, Friedman DN, Barnea D, Bosscha MI, Chantada G, Dommering CJ, et al. (noviembre de 2020). "Recomendaciones para el seguimiento a largo plazo de adultos con retinoblastoma hereditario". Oftalmología . 127 (11): 1549-1557. doi :10.1016/j.ophtha.2020.05.024. PMC 7606265 . PMID 32422154.
- ^ MacCarthy A, Birch JM, Draper GJ, Hungerford JL, Kingston JE, Kroll ME, et al. (enero de 2009). "Retinoblastoma en Gran Bretaña 1963-2002". The British Journal of Ophthalmology . 93 (1): 33–37. doi :10.1136/bjo.2008.139618. PMID 18838413. S2CID 27049728.
- ^ de Jong MC, de Graaf P, Noij DP, Göricke S, Maeder P, Galluzzi P, et al. (mayo de 2014). "Rendimiento diagnóstico de la resonancia magnética y la tomografía computarizada para el retinoblastoma avanzado: una revisión sistemática y un metanálisis". Oftalmología . 121 (5): 1109–1118. doi :10.1016/j.ophtha.2013.11.021. PMID 24589388.
- ^ Sehu WK, Lee W (2005). Patología oftálmica: una guía ilustrada para médicos. Malden: Publicación de Blackwell. pag. 262.ISBN 978-0-7279-1779-9.
- ^ Kumar V, Abbas AK, Fausto N (1999). Base patológica de la enfermedad de Robbins (6ª ed.). Filadelfia: Saunders. pag. 1442.ISBN 978-0-7216-0187-8.
- ^ Schüler A, Weber S, Neuhäuser M, Jurklies C, Lehnert T, Heimann H, et al. (marzo de 2005). "La edad en el momento del diagnóstico de retinoblastoma unilateral aislado no distingue entre pacientes con y sin mutación constitucional del gen RB1, pero está influida por un efecto de origen parental". Revista Europea del Cáncer . 41 (5): 735–740. doi :10.1016/j.ejca.2004.12.022. PMID 15763650.
- ^ ab Rushlow D, Piovesan B, Zhang K, Prigoda-Lee NL, Marchong MN, Clark RD, et al. (mayo de 2009). "Detección de mutaciones en mosaico de RB1 en familias con retinoblastoma". Human Mutation . 30 (5): 842–851. doi :10.1002/humu.20940. PMID 19280657. S2CID 31887184.
- ^ ab Richter S, Vandezande K, Chen N, Zhang K, Sutherland J, Anderson J, et al. (febrero de 2003). "La detección sensible y eficiente de las mutaciones del gen RB1 mejora la atención a las familias con retinoblastoma". American Journal of Human Genetics . 72 (2): 253–269. doi :10.1086/345651. PMC 379221 . PMID 12541220.
- ^ Sociedad Canadiense de Oftalmología (diciembre de 2009). "Estrategia Nacional para el Retinoblastoma: Pautas Canadienses para el Cuidado" (PDF) . Revista Canadiense de Oftalmología . 44 (Supl 2): S1-88. doi :10.3129/i09-194. PMID 20237571. Archivado desde el original (PDF) el 29 de septiembre de 2011.
- ^ Dimaras H, Corson TW (enero de 2019). "Retinoblastoma, el tumor visible del sistema nervioso central: una revisión". Revista de investigación en neurociencia . 97 (1): 29–44. doi :10.1002/jnr.24213. PMC 6034991 . PMID 29314142.
- ^ abc Chawla B, Jain A, Azad R (septiembre de 2013). "Modalidades de tratamiento conservador en el retinoblastoma". Indian Journal of Ophthalmology . 61 (9): 479–485. doi : 10.4103/0301-4738.119424 . PMC 3831762 . PMID 24104705.
- ^ ab Fabian ID, Reddy A, Sagoo MS (2018). "Clasificación y estadificación del retinoblastoma". Salud ocular comunitaria . 31 (101): 11–13. PMC 5998397. PMID 29915461 .
- ^ ab Chintagumpala M, Chevez-Barrios P, Paysse EA, Plon SE, Hurwitz R (octubre de 2007). "Retinoblastoma: revisión del tratamiento actual". The Oncologist . 12 (10): 1237–1246. CiteSeerX 10.1.1.585.5448 . doi :10.1634/theoncologist.12-10-1237. PMID 17962617. S2CID 15465073.
- ^ Li WL, Buckley J, Sanchez-Lara PA, Maglinte DT, Viduetsky L, Tatarinova TV, et al. (julio de 2016). "Un método de secuenciación de próxima generación rápido y sensible para detectar mutaciones de RB1 mejora la atención a los pacientes con retinoblastoma y sus familias". The Journal of Molecular Diagnostics . 18 (4): 480–493. doi :10.1016/j.jmoldx.2016.02.006. PMC 5820122 . PMID 27155049.
- ^ Zhao B, Li B, Liu Q, Gao F, Zhang Z, Bai H, et al. (septiembre de 2020). "Efectos de la matrina en la proliferación y apoptosis de células de retinoblastoma resistentes a la vincristina". Medicina experimental y terapéutica . 20 (3): 2838–2844. doi :10.3892/etm.2020.8992. PMC 7401942. PMID 32765780 .
- ^ Li C, Dong K, Zhuang Y, Luo Z, Qiu D, Luo Y, et al. (marzo de 2024). "ACOT7 promueve la resistencia del retinoblastoma a la vincristina regulando la reprogramación del metabolismo de los ácidos grasos". Heliyon . 10 (5): e27156. doi : 10.1016/j.heliyon.2024.e27156 . PMC 10920713 . PMID 38463820.
- ^ Roarty JD, McLean IW, Zimmerman LE (noviembre de 1988). "Incidencia de segundas neoplasias en pacientes con retinoblastoma bilateral". Oftalmología . 95 (11): 1583–1587. doi :10.1016/s0161-6420(88)32971-4. PMID 3211467.
- ^ Shields CL, Ramasubramanian A, Rosenwasser R, Shields JA (septiembre de 2009). "Cateterización superselectiva de la arteria oftálmica para quimioterapia intraarterial para retinoblastoma". Retina . 29 (8): 1207–1209. doi :10.1097/IAE.0b013e3181b4ce39. PMID 19734768. S2CID 47557934.
- ^ Shome D, Poddar N, Sharma V, Sheorey U, Maru GB, Ingle A, et al. (diciembre de 2009). "¿Una nanomolécula de carboplatino inyectada periocularmente ayuda a alcanzar concentraciones intravítreas más altas?". Investigative Ophthalmology & Visual Science . 50 (12): 5896–5900. doi :10.1167/iovs.09-3914. PMID 19628744. S2CID 7361361.
- ^ Kang SJ, Durairaj C, Kompella UB, O'Brien JM, Grossniklaus HE (agosto de 2009). "Nanopartículas subconjuntivales de carboplatino en el tratamiento del retinoblastoma murino". Archivos de Oftalmología . 127 (8): 1043–1047. doi :10.1001/archophthalmol.2009.185. PMC 2726977 . PMID 19667343.
- ^ Fabian ID, Johnson KP, Stacey AW, Sagoo MS, Reddy MA (junio de 2017). "Tratamiento con láser focal además de quimioterapia para el retinoblastoma". Base de datos Cochrane de revisiones sistemáticas . 2017 (6): CD012366. doi :10.1002/14651858.CD012366.pub2. PMC 6481366. PMID 28589646 .
- ^ Shields CL, Mashayekhi A, Cater J, Shelil A, Ness S, Meadows AT, et al. (junio de 2005). "Retinoblastoma macular tratado con quimiorreducción: análisis del control tumoral con o sin termoterapia adyuvante en 68 tumores". Archivos de Oftalmología . 123 (6): 765–773. doi :10.1001/archopht.123.6.765. PMID 15955977.
- ^ Beddard N, McGeechan GJ, Taylor J, Swainston K (marzo de 2020). "Cáncer ocular infantil desde la perspectiva de los padres: la experiencia vivida por padres con hijos que han tenido retinoblastoma". Revista Europea de Atención del Cáncer . 29 (2): e13209. doi : 10.1111/ecc.13209 . PMID 31845431. S2CID 196549559.
- ^ Oftalmología concisa: para estudiantes de medicina (4.ª ed.). Karachi, Pakistán: Paramount Books. 2014. págs. 80-81. ISBN 9789696370017.
- ^ Rai P, Shah IA, Narsani AK, Lohana MK, Memon MK, Memon MA (2009). "Presentación demasiado tardía de 53 pacientes con retinoblastoma". Revista Internacional de Oftalmología . 9 (2): 227–230. doi :10.3969/j.issn.1672-5123.2009.02.005.
- ^ Abramson DH, Schefler AC (diciembre de 2004). "Actualización sobre el retinoblastoma". Retina . 24 (6): 828–848. doi :10.1097/00006982-200412000-00002. PMID 15579980. S2CID 26883037.
- ^ Orjuela M, Castaneda VP, Ridaura C, Lecona E, Leal C, Abramson DH, et al. (octubre de 2000). "Presencia del virus del papiloma humano en tejido tumoral de niños con retinoblastoma: un mecanismo alternativo para el desarrollo tumoral". Clinical Cancer Research . 6 (10): 4010–4016. PMID 11051250.
- ^ Abramson DH, Frank CM, Susman M, Whalen MP, Dunkel IJ, Boyd NW (marzo de 1998). "Signos de presentación del retinoblastoma". The Journal of Pediatrics . 132 (3 Pt 1): 505–508. doi :10.1016/s0022-3476(98)70028-9. PMID 9544909.
Enlaces externos
- Información sobre el retinoblastoma en MedlinePlus
- retinoblastoma en NIH / UW GeneTests
- Base de datos de mutaciones del gen RB1
- Registro de pruebas genéticas del NCBI