Electroforesis de proteínas séricas
| Electroforesis de proteínas séricas | |
|---|---|
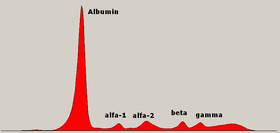 Diagrama de electroforesis de proteínas séricas normales con leyenda de diferentes zonas. | |
| Malla | D001797 |

La electroforesis de proteínas séricas ( SPEP o SPE ) es una prueba de laboratorio que examina proteínas específicas en la sangre llamadas globulinas . [1] Las indicaciones más comunes para una prueba de electroforesis de proteínas séricas son diagnosticar o monitorear el mieloma múltiple , una gammapatía monoclonal de significado incierto (MGUS) o investigar más a fondo una discrepancia entre una albúmina baja y una proteína total relativamente alta. El dolor óseo inexplicable, la anemia, la proteinuria , la enfermedad renal crónica y la hipercalcemia también son signos de mieloma múltiple e indicaciones para SPE. [2] Primero se debe recolectar sangre , generalmente en un vial o jeringa hermética . La electroforesis es una técnica de laboratorio en la que el suero sanguíneo (la porción fluida de la sangre después de que la sangre se ha coagulado) se aplica a una membrana de acetato empapada en un tampón líquido, [3] o a una matriz de gel de agarosa tamponada , o en líquido en un tubo capilar , y se expone a una corriente eléctrica para separar los componentes de la proteína del suero en cinco fracciones principales por tamaño y carga eléctrica: albúmina sérica , globulinas alfa-1 , globulinas alfa-2 , globulinas beta 1 y 2 y globulinas gamma .
Electroforesis en acetato o gel
Las proteínas se separan mediante fuerzas eléctricas y electroendoosmóticas. La carga neta de una proteína se basa en la suma de las cargas de sus aminoácidos y el pH del tampón. Las proteínas se aplican a una matriz sólida, como un gel de agarosa o una membrana de acetato de celulosa en un tampón líquido, y se aplica una corriente eléctrica. Las proteínas con carga negativa migrarán hacia el ánodo con carga positiva. La albúmina tiene la carga más negativa y migrará más lejos hacia el ánodo. El flujo endoosmótico es el movimiento del líquido hacia el cátodo, que hace que las proteínas con una carga más débil se muevan hacia atrás desde el sitio de aplicación. Las proteínas gamma se separan principalmente mediante fuerzas endoosmóticas. [4] El dibujo de las bandas electroforéticas proporcionado por el laboratorio puede ser difícil de recordar, y los estudiantes de medicina, residentes, enfermeras y médicos no especializados pueden encontrar útiles las mnemotecnias visuales para recordar las cinco bandas principales y la forma de la electroforesis sérica normal. [5]

Electroforesis capilar
En la electroforesis capilar no existe una matriz sólida. Las proteínas se separan principalmente por fuertes fuerzas electroendosmóticas. La muestra se inyecta en un capilar con una carga superficial negativa. Se aplica una corriente alta y las proteínas con carga negativa, como la albúmina, intentan moverse hacia el ánodo. El tampón líquido fluye hacia el cátodo y arrastra a las proteínas con una carga más débil. [6] [7]
Fracciones de proteína sérica

Albúmina
La albúmina es la fracción principal en una SPEP normal. Es necesaria una caída del 30% para que la disminución se note en la electroforesis. Por lo general, se ve una sola banda. Los individuos heterocigotos pueden producir bisalbuminemia (dos bandas de tinción igual, producto de dos genes). Algunas variantes dan lugar a una banda ancha o dos bandas de intensidad desigual, pero ninguna de estas variantes está asociada con la enfermedad. [8] La movilidad anódica aumentada resulta de la unión de la bilirrubina , los ácidos grasos no esterificados , la penicilina y el ácido acetilsalicílico , y ocasionalmente de la digestión tríptica en la pancreatitis aguda . [ cita requerida ]
La ausencia de albúmina, conocida como analbuminemia , es poco frecuente. Sin embargo, un nivel reducido de albúmina es común en muchas enfermedades, entre ellas la enfermedad hepática , la desnutrición , la malabsorción, la nefropatía perdedora de proteínas y la enteropatía. [9]
Albúmina – interzona alfa-1
La tinción uniforme en esta zona se debe a la lipoproteína alfa-1 ( lipoproteína de alta densidad – HDL). La disminución se produce en la inflamación grave, hepatitis aguda y cirrosis . Además, el síndrome nefrótico puede provocar una disminución del nivel de albúmina; debido a su pérdida en la orina a través de un glomérulo permeable dañado . Aparece un aumento en alcohólicos graves y en mujeres durante el embarazo y la pubertad. [ cita requerida ]
Los altos niveles de AFP que pueden presentarse en el carcinoma hepatocelular pueden dar lugar a una banda nítida entre la albúmina y la zona alfa-1. [ cita requerida ]
Zona alfa-1
El orosomucoide y la antitripsina migran juntos, pero el orosomucoide se tiñe mal, por lo que la alfa 1 antitripsina (AAT) constituye la mayor parte de la banda alfa-1. La alfa-1 antitripsina tiene un grupo SG y los compuestos tiol pueden estar unidos a la proteína, alterando su movilidad. Se observa una banda disminuida en el estado de deficiencia. Está disminuida en el síndrome nefrótico [10] y la ausencia podría indicar una posible deficiencia de alfa 1-antitripsina. Esto finalmente conduce al enfisema debido a la actividad desregulada de la elastasa de los neutrófilos en el tejido pulmonar. Sin embargo, la fracción alfa-1 no desaparece en la deficiencia de alfa 1-antitripsina, porque otras proteínas, incluidas la alfa- lipoproteína y el orosomucoide, también migran allí. Como reactante de fase aguda positivo, la AAT aumenta en la inflamación aguda. [ cita requerida ]
La proteína de Bence Jones puede unirse a la banda alfa-1 y retardarla. [ cita requerida ]
Interzona alfa-1 – alfa-2
Se pueden observar dos bandas tenues que representan la alfa 1-antiquimotripsina y la proteína de unión a la vitamina D. Estas bandas se fusionan y se intensifican en la inflamación temprana debido a un aumento de la alfa 1-antiquimotripsina, una proteína de fase aguda . [ cita requerida ]
Zona alfa-2
Esta zona está formada principalmente por alfa-2 macroglobulina (AMG o A2M) y haptoglobina . Normalmente, los niveles son bajos en la anemia hemolítica (la haptoglobina es una molécula suicida que se une a la hemoglobina libre liberada por los glóbulos rojos y estos complejos son eliminados rápidamente por los fagocitos ). La haptoglobina aumenta como parte de la respuesta de fase aguda, lo que da lugar a una elevación típica de la zona alfa-2 durante la inflamación. Una zona alfa-2 normal y una zona alfa-1 elevada es un patrón típico en la metástasis hepática y la cirrosis.
Los complejos de haptoglobina/hemoglobina migran más catódicamente que la haptoglobina, como se observa en la interzona alfa-2-beta. Esto se observa típicamente como un ensanchamiento de la zona alfa-2.
La alfa-2 macroglobulina puede estar elevada en niños y ancianos. Esto se observa como un frente agudo en la banda alfa-2. La AMG está marcadamente elevada (aumento de 10 veces o más) en asociación con la pérdida de proteína glomerular, como en el síndrome nefrótico . Debido a su gran tamaño, la AMG no puede pasar a través de los glomérulos, mientras que se pierden otras proteínas de menor peso molecular. La síntesis aumentada de AMG explica su aumento absoluto en el síndrome nefrótico. También se observa un aumento de AMG en ratas sin albúmina, lo que indica que se trata de una respuesta a la baja albúmina en lugar del síndrome nefrótico en sí [11].
La AMG se eleva levemente al comienzo de la nefropatía diabética . [ cita requerida ]
Interzona alfa-2-beta
La globulina insoluble en frío forma una banda aquí que no se ve en el plasma porque se precipita con heparina . Hay niveles bajos en la inflamación y niveles altos en el embarazo. [ cita requerida ]
La lipoproteína beta forma una banda irregular en forma de cresta en esta zona. Se observan niveles elevados en la hipercolesterolemia de tipo II , la hipertrigliceridemia y el síndrome nefrótico.
Zona beta
La transferrina y la lipoproteína beta ( LDL ) comprenden la beta-1. El aumento de la proteína beta-1 debido al aumento del nivel de transferrina libre es típico de la anemia por deficiencia de hierro , el embarazo y la terapia con estrógenos . El aumento de la proteína beta-1 debido a la elevación de LDL ocurre en la hipercolesterolemia . La disminución de la proteína beta-1 ocurre en la inflamación aguda o crónica. [ cita requerida ]
La beta-2 comprende C3 ( proteína 3 del complemento). Se eleva en la respuesta de fase aguda. La depresión de C3 ocurre en trastornos autoinmunes a medida que se activa el sistema del complemento y el C3 se une a complejos inmunes y se elimina del suero. El fibrinógeno, una proteína beta-2, se encuentra en el plasma normal pero está ausente en el suero normal. Ocasionalmente, la sangre extraída de pacientes heparinizados no coagula completamente, lo que da como resultado una banda de fibrinógeno visible entre las globulinas beta y gamma. [ cita requerida ]
Interzona beta-gamma
La proteína C reactiva se encuentra entre las zonas beta y gamma, lo que produce la fusión beta/gamma. La IgA tiene la mayor movilidad anódica y, por lo general, migra en la región entre las zonas beta y gamma, lo que también provoca una fusión beta/gamma en pacientes con cirrosis, infección respiratoria, enfermedad de la piel o artritis reumatoide (aumento de la IgA). El fibrinógeno de las muestras de plasma se observará en la región beta gamma. El fibrinógeno, una proteína beta-2, se encuentra en el plasma normal, pero está ausente en el suero normal. Ocasionalmente, la sangre extraída de pacientes heparinizados no coagula completamente, lo que da como resultado una banda de fibrinógeno visible entre las globulinas beta y gamma. [ cita requerida ]
Zona gamma
Las inmunoglobulinas o anticuerpos son generalmente las únicas proteínas presentes en la región gamma normal. Cabe destacar que cualquier proteína que migre en la región gamma se teñirá y aparecerá en el gel, que puede incluir contaminantes proteicos, artefactos o ciertos medicamentos. Dependiendo de si se utiliza un método de agarosa o capilar, las interferencias varían. Las inmunoglobulinas constan de cadenas pesadas (μ, δ, γ, α y ε) y cadenas ligeras (κ y λ). Una zona gamma normal debe aparecer como un "rubor" suave, o mancha, sin asimetría ni picos agudos. [12] Las gammaglobulinas pueden estar elevadas ( hipergammaglobulinemia ), disminuidas ( hipogammaglobulinemia ) o tener un pico o picos anormales. Tenga en cuenta que las inmunoglobulinas también se pueden encontrar en otras zonas; la IgA normalmente migra en la zona beta-gamma y, en particular, las inmunoglobulinas patógenas pueden migrar a cualquier parte, incluidas las regiones alfa. [ cita requerida ]
La hipogammaglobulinemia se identifica fácilmente como una "caída" o disminución de la zona gamma. Es normal en los lactantes. Se encuentra en pacientes con agammaglobulinemia ligada al cromosoma X. La deficiencia de IgA se presenta en 1:500 de la población, como lo sugiere una palidez en la zona gamma. Cabe destacar que el hipogammaglobulinema puede observarse en el contexto de MGUS o mieloma múltiple. [ cita requerida ]
Si la zona gamma muestra un aumento, el primer paso en la interpretación es establecer si la región es estrecha o ancha. Una forma amplia y "en forma de oleaje" (ancha) indica producción de inmunoglobulina policlonal. Si está elevada de manera asimétrica o con uno o más picos o "picos" estrechos, podría indicar producción clonal de una o más inmunoglobulinas, [13]
La gammapatía policlonal se manifiesta por una elevación en forma de "hinchazón" en la zona gamma, que generalmente indica una afección no neoplásica (aunque no es exclusiva de las afecciones no neoplásicas). Las causas más comunes de hipergammaglobulinemia policlonal detectada por electroforesis son infecciones graves , enfermedad hepática crónica, artritis reumatoide, lupus eritematoso sistémico y otras enfermedades del tejido conectivo. [ cita requerida ]
Una espiga estrecha es sugestiva de una gammapatía monoclonal, también conocida como banda restringida o "espiga M". Para confirmar que la banda restringida es una inmunoglobulina, se realizan pruebas de seguimiento con inmunofijación o inmunodesplazamiento/inmunosutracción (métodos capilares). Los anticuerpos monoclonales terapéuticos (mAb), también migran en esta región y pueden ser malinterpretados como una gammapatía monoclonal, y también pueden identificarse por inmunofijación o inmunodesplazamiento/inmunosutracción ya que son estructuralmente comparables a las inmunoglobulinas humanas. [14] La causa más común de una banda restringida es una MGUS (gammapatía monoclonal de significado incierto), que, aunque es un precursor necesario, solo rara vez progresa a mieloma múltiple. (En promedio, 1%/año). [15] Típicamente, una gammapatía monoclonal es maligna o de origen clonal, siendo el mieloma la causa más común de espigas de IgA e IgG . La leucemia linfática crónica y el linfosarcoma no son infrecuentes y suelen dar lugar a paraproteínas IgM . Cabe señalar que hasta el 8 % de los pacientes geriátricos sanos pueden presentar una espícula monoclonal. [16] La macroglobulinemia de Waldenström (IgM), la gammapatía monoclonal de significado incierto (GMSI), la amiloidosis, la leucemia de células plasmáticas y los plasmocitomas solitarios también producen una espícula M.
La gammapatía oligoclonal está indicada por uno o más clones discretos. [ cita requerida ]
La lisozima puede verse como una banda catódica a gamma en la leucemia mielomonocítica en la que se libera de las células tumorales . [ cita requerida ]
Referencias
- ^ Jenkins, Margaret A. (1999). "Electroforesis de proteínas séricas". Aplicaciones clínicas de la electroforesis capilar . Métodos en medicina molecular. Vol. 27. págs. 11-20. doi :10.1385/1-59259-689-4:11. ISBN 1-59259-689-4. Número de identificación personal 21374283.
- ^ Harris, Neil S.; Winter, William E. (2012). Mieloma múltiple y trastornos relacionados con las proteínas séricas: una guía electroforética . Demos Medical. pág. 5. ISBN 978-1-933864-75-4.
- ^ Kaplan, A; Savory, J (1965). "Evaluación de un sistema de electroforesis de acetato de celulosa para el fraccionamiento de proteínas séricas". Química clínica . 11 (10): 937–42. doi : 10.1093/clinchem/11.10.937 . PMID 4158264.
- ^ Harris 2012, págs. 9-16.Error de sfn: no hay destino: CITEREFHarris2012 ( ayuda )
- ^ Medina-De la Garza CE, García-Hernández M, Castro-Corona MA. Mnemónicos visuales para electroforesis de proteínas séricas https://www.tandfonline.com/doi/full/10.3402/meo.v18i0.22585
- ^ Harris, 2012 y páginas 117–123.Error de sfn: no hay destino: CITEREFHarris2012pages_117–123 ( ayuda )
- ^ Keren, David F. (2003). Electroforesis de proteínas en el diagnóstico clínico . Hodder Arnold. págs. 1–14. ISBN 0340-81213-3.
- ^ Hoang, Mai P; Baskin, Leland B; Wians, Frank H (1999). "Bisalbuminuria en un adulto con bisalbuminemia y síndrome nefrótico". Clinica Chimica Acta . 284 (1): 101–7. doi :10.1016/S0009-8981(99)00054-6. PMID 10437648.
- ^ Peralta, Ruben; Rubery, Brad A (30 de julio de 2012). Pinsky, Michael R; Sharma, Sat; Talavera, Francisco; Manning, Harold L; Rice, Timothy D (eds.). "Hipoalbuminemia". Medscape . Consultado el 2 de octubre de 2013 .
- ^ Longsworth, LG; Macinnes, DA (1 de enero de 1940). "Un estudio electroforético de sueros y orina nefróticos". Revista de medicina experimental . 71 (1): 77–82. doi :10.1084/jem.71.1.77. PMC 2135007 . PMID 19870946.
- ^ Stevenson, FT; Greene, S; Kaysen, GA (enero de 1998). "Las concentraciones séricas de alfa 2-macroglobulina y de alfa 1-inhibidor 3 aumentan en la hipoalbuminemia por mecanismos postranscripcionales". Kidney International . 53 (1): 67–75. doi : 10.1046/j.1523-1755.1998.00734.x . PMID 9453001.
- ^ Keren 2003, págs. 93–97.
- ^ Tuazon, Sherilyn Alvaran; Scarpaci, Anthony P (11 de mayo de 2012). Staros, Eric B (ed.). "Electroforesis de proteínas séricas". Medscape . Consultado el 2 de octubre de 2013 .
- ^ McCudden, C. (2016). "Seguimiento de pacientes con mieloma múltiple tratados con daratumumab: detección de la interferencia de anticuerpos monoclonales". Clin Chem Lab Med . 54 (6): 1095–104. doi : 10.1515/cclm-2015-1031 . hdl : 2066/170995 . PMID 27028734.
- ^ Harris 2012, pág. 60.Error de sfn: no hay destino: CITEREFHarris2012 ( ayuda )
- ^ Wadhera, Rishi K.; Rajkumar, S. Vincent (2010). "Prevalencia de la gammapatía monoclonal de significado incierto: una revisión sistemática". Mayo Clinic Proceedings . 85 (10): 933–42. doi :10.4065/mcp.2010.0337. PMC 2947966 . PMID 20713974.
Enlaces externos
- Electroforesis de proteínas en Lab Tests Online
- Mnemotecnia visual para la electroforesis de proteínas séricas
[1]