Ecología del estuario de San Francisco
El estuario de San Francisco, junto con el delta del río Sacramento-San Joaquín, representa un ecosistema muy alterado . La región ha sido profundamente rediseñada para dar cabida a las necesidades de suministro de agua, transporte marítimo, agricultura y, más recientemente, desarrollo suburbano. Estas necesidades han provocado cambios directos en el movimiento del agua y la naturaleza del paisaje, y cambios indirectos a partir de la introducción de especies no autóctonas . Las nuevas especies han alterado la arquitectura de la red alimentaria , de la misma manera que los diques han alterado el paisaje de las islas y canales que forman el complejo sistema conocido como el delta. [1]
Este artículo trata en particular sobre la ecología de la zona de baja salinidad (LSZ) del estuario. Reconstruir una red alimentaria histórica para la LSZ es difícil por varias razones. En primer lugar, no hay un registro claro de las especies que históricamente han ocupado el estuario. En segundo lugar, el estuario y el delta de San Francisco han estado en transición geológica e hidrológica durante la mayor parte de sus 10.000 años de historia, por lo que describir la condición "natural" del estuario es muy parecido a "darle a un blanco en movimiento". [1] El cambio climático , la ingeniería hidrológica, las necesidades cambiantes de agua y las especies recién introducidas seguirán alterando la configuración de la red alimentaria del estuario. Este modelo proporciona una instantánea del estado actual, con notas sobre los cambios recientes o las introducciones de especies que han alterado la configuración de la red alimentaria. Comprender la dinámica de la red alimentaria actual puede resultar útil para los esfuerzos de restauración para mejorar el funcionamiento y la diversidad de especies del estuario.
Geografía física
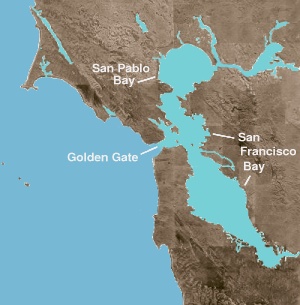
La bahía de San Francisco es a la vez una bahía y un estuario . El primer término se refiere a cualquier entrada o ensenada que proporcione un refugio físico del océano abierto. Un estuario es cualquier característica fisiográfica donde el agua dulce se encuentra con un océano o mar. La parte norte de la bahía es un estuario salobre, que consta de una serie de ensenadas físicas en las que predominan los flujos de agua dulce y marina. Estas entidades geográficas son, pasando de salina a dulce (o de oeste a este): la bahía de San Pablo , inmediatamente al norte de la bahía central; el estrecho de Carquinez , un canal angosto y profundo que conduce a la bahía de Suisun ; y el delta de los ríos Sacramento y San Joaquín .
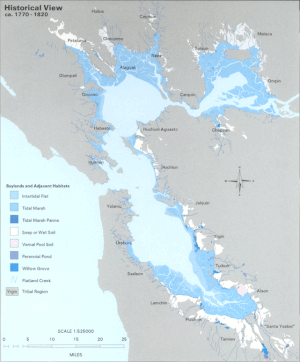
Hasta el siglo XX, la LSZ del estuario estaba bordeada por humedales de agua dulce dominados por tules . Entre el 80 y el 95% de estos humedales históricos se han rellenado para facilitar el uso de la tierra y el desarrollo alrededor del Área de la Bahía. [2] Se cree que la pérdida de hábitat en los bordes de la zona pelágica crea una pérdida de especies de peces pelágicos nativos , al aumentar la vulnerabilidad a la depredación.
El estuario intermareal y bentónico está dominado actualmente por marismas que son en gran parte el resultado de la sedimentación derivada de la minería de oro en Sierra Nevada a fines del siglo XIX. La tendencia hacia altas cargas de sedimentos se revirtió en la década de 1950 con la llegada del Proyecto del Valle Central , que encerró la mayoría de los sedimentos detrás de represas y resultó en una pérdida neta anual de sedimentos del estuario. [3] Por lo tanto, las marismas parecen estar retrocediendo lentamente, aunque la turbidez sigue siendo extremadamente alta. La alta turbidez del agua es responsable de la condición única que existe en el estuario de San Francisco, donde la alta disponibilidad de nutrientes no conduce a una alta producción de fitoplancton. En cambio, la mayoría de los organismos fotosintéticos de las algas están limitados por la luz. [4]
El Delta también ha sufrido grandes alteraciones. A principios del siglo XIX, se reforzaron los diques naturales para proteger las tierras agrícolas de las inundaciones habituales. Muchas de estas granjas se establecieron en islas de turba que se encuentran en medio de los cursos de agua del Delta. La agricultura intensiva oxidó el alto contenido de carbono del suelo, lo que provocó una pérdida considerable de masa de suelo. Como consecuencia, estas islas se han hundido hasta casi 6 metros por debajo del nivel del mar. [5] Hoy en día, el Delta consta de cursos de agua muy enrocados, salpicados de islas que parecen "cuencos flotantes" con sus cuencas muy por debajo de la superficie del agua. [6] Estas islas corren un alto riesgo de inundación debido al colapso de los diques. Se espera que el posterior desplazamiento hacia el este de la salinidad altere drásticamente la ecología de toda la ZLS del estuario de San Francisco. [7]
Hidrodinámica

La LSZ se centra en 2 psu ( unidades prácticas de salinidad , una medida de salinidad) y varía desde aproximadamente 6 psu hasta 0,5 psu. Los principales aportes de agua dulce al estuario derivan de la escorrentía de las precipitaciones regionales, el río Sacramento y el río San Joaquín. [8]
La entrada del río está controlada en gran medida por las liberaciones de los embalses aguas arriba. Una fracción significativa de esta entrada se exporta fuera del Delta por el Proyecto del Valle Central federal y el Proyecto de Agua del Estado al sur de California para uso agrícola y urbano. Estas alteraciones han eliminado gran parte de la variación en el flujo de salida a través del estuario (es decir, el agua dulce que sale del Golden Gate ), creando un flujo de salida menor en el invierno y mayor en el verano que el que se encuentra históricamente en el estuario. En promedio, los flujos de agua dulce hacia el estuario son el 50% de los flujos históricos. [9] El fitoplancton , el zooplancton y los peces larvarios y adultos pueden quedar atrapados en las bombas de exportación, lo que causa un impacto potencialmente significativo pero desconocido en la abundancia de estos organismos. Esto puede ser particularmente cierto en el caso del olfato del delta en peligro de extinción , un pequeño pez endémico; nada excepcional, excepto que se ha descrito como tremendamente abundante en los relatos históricos. [10] Se cree que el olfato del delta migra y desova río arriba en el Delta a principios del verano, lo que pone a sus huevos y larvas en alto riesgo de ser arrastrados. [11] La gestión del olfato es actualmente fuente de controversia ya que su ecología hace que entren en conflicto las dispares necesidades de agua de la conservación, el desarrollo y la agricultura en California.
El movimiento del agua que sale del estuario es complejo y depende de varios factores. Los ciclos de mareas hacen que el agua se desplace hacia el Golden Gate y se aleje de él cuatro veces en un período de 24 horas.
Utilizando 2 psu como marcador para la Zona de Baja Salinidad, la dirección y magnitud de las fluctuaciones se pueden rastrear como su distancia en kilómetros desde el Golden Gate, o X2. Debido a que la posición de X2 depende de una serie de parámetros físicos, incluyendo la entrada, la exportación y las mareas, su posición cambia a lo largo de muchos kilómetros en un ciclo diario y estacional; en el transcurso de un año, puede variar desde la Bahía de San Pablo durante los períodos de alto flujo, hasta el Delta durante la sequía de verano. La posición de X2 se monitorea y se mantiene cuidadosamente liberando agua de los embalses aguas arriba en previsión de la demanda de exportación. Esto es un mandato de la Decisión 1641 de la Junta Estatal del Agua y requiere que se reduzca el bombeo estatal y federal si X2 se desplaza al este de Chipps Island (75 kilómetros de río aguas arriba del Puente Golden Gate) durante los meses de febrero a mayo, o al este de Collinsville (81 kilómetros de río aguas arriba del Puente Golden Gate) durante los meses de enero, junio, julio y agosto. (D-1641 pág. 150)
La circulación gravitacional hace que el agua estratificada de alta salinidad en profundidad fluya hacia la tierra, mientras que el agua de baja salinidad en la parte superior fluye hacia el mar. [12] El efecto de la circulación gravitacional puede ser más pronunciado durante períodos de alto flujo de agua dulce, lo que proporciona una retroalimentación negativa para mantener el campo de sal y la distribución de organismos pelágicos en el estuario.
La mezcla es importante en el borde terrestre de la circulación gravitacional, a menudo alrededor de X2, donde la columna de agua se vuelve menos estratificada. [13] Una zona de mezcla fija ocurre en el "Benicia Bump" en el extremo este del estrecho de Carquinez, donde el canal profundo se vuelve dramáticamente más superficial a medida que ingresa a la bahía de Suisun. [14] La mezcla es fundamental para mantener la salinidad, de modo que se requieren aportes extremadamente grandes de agua dulce para mover X2 una corta distancia hacia el oeste. La mezcla también ayuda a los organismos pelágicos a mantener su posición en el estuario, [1] lo que desacelera la advección de la producción primaria y secundaria fuera del sistema.
Zona pelágica
Los organismos pelágicos pasan toda o parte de su vida en aguas abiertas, donde el hábitat no está definido por los bordes sino por la tolerancia fisiológica a la salinidad y la temperatura. La zona de baja salinidad (LSZ) del estuario de San Francisco constituye un hábitat para un conjunto de organismos que están especializados para sobrevivir en esta confluencia única de influencias terrestres , de agua dulce y marinas . Si bien hay muchos hábitats con ecologías distintas que forman parte del estuario (incluidos los sistemas marinos, de agua dulce, de marismas intermareales y de marismas bentónicas ), cada uno está vinculado a la LSZ por la exportación e importación de agua dulce, nutrientes, carbono y organismos. [1]
La distribución y abundancia de organismos en la ZLS depende de factores tanto abióticos como bióticos. Los factores abióticos incluyen la geografía física y la hidrología del estuario, incluidos los aportes de nutrientes , la carga de sedimentos , la turbidez , la estocasticidad ambiental, el clima y las influencias antropogénicas. [8] Los factores abióticos tienden a impulsar la producción en el entorno estuarino y están mediados por factores bióticos.
Los factores bióticos incluyen la absorción de nutrientes y la producción primaria , la producción secundaria de zooplancton , la red alimentaria y la dinámica trófica , la transferencia energética, la advección y la dispersión dentro y fuera del sistema, la supervivencia y la mortalidad , la depredación y la competencia de las especies introducidas .
Red alimentaria

Es difícil caracterizar la red alimentaria histórica del estuario de San Francisco debido a los dramáticos cambios en la geografía, la hidrología y la composición de especies que han ocurrido en el siglo pasado. Sin embargo, el monitoreo iniciado en la década de 1970 proporciona cierta información sobre la dinámica histórica de la red alimentaria. Antes de la década de 1980, la LSZ estaba dominada por una red alimentaria impulsada por el fitoplancton, una población estable de mesoplancton dominada por el copépodo Eurytemora affinis y un gran macrozooplancton tipificado por el camarón de la bahía de San Francisco y los camarones mísidos . [15] Estos proporcionaban nutrición y energía a los filtradores nativos como la anchoa del norte ( Engraulis mordax ), y a los planctívoros como el olfato del delta y el salmón juvenil .
El cambio en la red alimentaria ha sido impulsado históricamente por el aumento de la turbidez y, más recientemente, por la introducción de especies, como se describe en las secciones sobre producción primaria y secundaria.
Cabe destacar que la alta tasa de eliminación de la población introducida de almeja del río Amur, Potamocorbula amurensis , ha producido una disminución de diez veces en la densidad del plancton, lo que resulta en una trampa de carbono en el bentos y un supuesto aumento en la producción de desechos detríticos. [16] Se plantea la hipótesis de que estos desechos alimentan el ciclo microbiano, lo que resulta en un aumento del microzooplancton, como el copépodo Limnoithona tetraspina , que utiliza rotíferos y ciliados .
Estos cambios son una de las causas de la disminución de las poblaciones de peces. Por ejemplo, la anchoa del norte, Engraulis mordax , fue hasta la década de 1980 bastante abundante en la zona de baja salinidad, hasta que su distribución en el estuario se restringió a las bahías central y sur. [17] Esto probablemente se deba a una respuesta conductual tras la introducción de la almeja del río Amur ( Potamocorbula amurensis ) y la posterior disminución de la disponibilidad de plancton.
Más recientemente, se describió un declive general de los organismos pelágicos (POD), y esto ha sido fuente de mucha preocupación dentro de las comunidades científicas, gerenciales y políticas. [18]
Varias especies clave, entre ellas el olfato del delta , el olfato de aleta larga , la lubina rayada y el sábalo de aleta de hilo han sido declaradas "especies de interés" debido a una disminución gradual de su abundancia a partir de 2001. [19] Esto estuvo acompañado de una disminución similar de la productividad secundaria y actualmente es fuente de mucha investigación. Se han propuesto varias hipótesis para explicar la POD, incluida la disminución de la red alimentaria, las exportaciones de agua del delta y los tóxicos de fuentes urbanas, industriales o agrícolas.
Productores
Producción primaria y absorción de nutrientes
La producción primaria del fitoplancton fija la energía y los nutrientes clave en una forma biológicamente disponible (es decir, alimento), a través de la fotosíntesis . La producción del fitoplancton está estructurada en gran medida por parámetros físicos: disponibilidad de nutrientes, luz solar, turbidez y temperatura.
El estuario de San Francisco tiene numerosas fuentes de nutrientes que pueden usarse para la producción primaria, derivadas en gran parte de instalaciones de tratamiento de aguas residuales, drenaje agrícola y urbano y el océano. [20] [21] A pesar de esto, el estuario es único en el sentido de que tiende a tener una tasa relativamente deprimida de producción primaria. [22] Esto probablemente se debe a dos factores: grandes aportes de nitrógeno en forma de amonio , que suprime la absorción de nitrato por el fitoplancton, que prefiere el NH 4 + metabólicamente más barato, y una alta turbidez, que limita la luz requerida para la fotosíntesis a los primeros centímetros de la columna de agua. [21] Esta turbidez es un legado de la minería de oro hidráulica en Sierra Nevada en la década de 1850. [23]
El alto tiempo de residencia del agua en el estuario tiende a permitir que la biomasa de fitoplancton se acumule, aumentando la densidad, mientras que el bajo tiempo de residencia elimina el fitoplancton del estuario. [1] Esto último es típico de los canales principales del estuario durante períodos de alto flujo, cuando las aguas superficiales tienden a arrastrar partículas y plancton río abajo.
La herbivoría también elimina el fitoplancton de la columna de agua. Si bien la red alimentaria pelágica se basa en la producción de fitoplancton, la mayor parte de esta producción se desvía hacia el bentos a través de la depredación de la almeja del río Amur ( Corbula amurensis ), introducida en el río. Los niveles de biomasa de fitoplancton disminuyeron en un orden de magnitud después de la introducción generalizada de C. amurensis a mediados de la década de 1980, y no se han recuperado. [24]
Producción fotosintética
La principal fuente de energía derivada de la fotosíntesis es el fitoplancton . En términos generales, las diatomeas y los microflagelados producen la mayor parte del carbono biodisponible en el estuario. [25] Otros tipos, en particular los dinoflagelados , pueden producir floraciones de algas nocivas o mareas rojas , que son menos fácilmente asimilables en la red alimentaria. [26]
La producción primaria del fitoplancton es una función de dos factores diferentes: tasas de crecimiento y acumulación (Fig. 1). Aunque la LSZ es un sumidero para altas concentraciones de nutrientes de fuentes urbanas y agrícolas, las tasas de producción del fitoplancton son bastante bajas. [27] El fitoplancton utiliza el nitrato de manera óptima para el crecimiento, pero el amonio (derivado en gran medida de los vertidos de aguas residuales) tiene un efecto supresor sobre la tasa de crecimiento. Por lo tanto, aunque no está limitado por los nutrientes, el fitoplancton tiende a crecer más lentamente debido a los tipos de nitrógeno presentes. [28] Otro factor supresor de la tasa de crecimiento es la alta turbidez del estuario, que limita la capacidad de la radiación fotosintéticamente activa (PAR) para penetrar más allá de los primeros centímetros de la columna de agua. Esto limita la fotosíntesis del fitoplancton a una zona fótica relativamente poco profunda . Por lo tanto, cuando la columna de agua está estratificada, la turbidez es alta y hay amonio presente, la tasa de crecimiento del fitoplancton generalmente se ve suprimida. [29] [30]
La acumulación de fitoplancton es principalmente el resultado del tiempo de residencia . [27] El delta norte y la bahía de Suisun tienen tiempos de residencia relativamente bajos debido al alto volumen de agua que se mueve a través de la región para el flujo descendente y para la exportación al sur de California. Dado que el agua se mueve más rápidamente a través de esta parte del sistema, la tasa de acumulación disminuye a medida que la productividad se transporta fuera del sistema. En contraste, partes del delta sur tienen un tiempo de residencia más alto debido al bajo volumen de agua que se mueve a través del sistema; de hecho, el agua en ocasiones corre en sentido inverso, debido a la falta de entrada del río San Joaquín y al bombeo de exportación. Durante el verano, la densidad de fitoplancton puede ser un orden de magnitud más alta aquí que en otras partes del estuario. [31]
Las floraciones de algas nocivas (FAN) de dinoflagelados o cianobacterias producen subproductos metabólicos tóxicos que las vuelven nocivas para muchos organismos. Fomentadas por una combinación de altas concentraciones de nutrientes y temperaturas, las FAN tienen un efecto doblemente negativo en la cadena alimentaria al excluir competitivamente a las diatomeas y microflagelados, reduciendo aún más la producción primaria biodisponible. Si bien ciertos invertebrados como los bivalvos pueden no verse afectados directamente, pueden propagar toxinas a lo largo de la cadena alimentaria, enfermando o matando a los depredadores . No se entiende bien cómo se ven afectados los copépodos . El alga invasora Microcystis aeruginosa es ahora común en el Delta durante los meses de verano y puede reducir la productividad de los copépodos (además de ser potencialmente cancerígena para los humanos). [32]
Producción detrítica
Enormes cantidades de sedimentos y detritos fluyen a través de la ZLS. Gran parte de ellos son desechos orgánicos en forma de materia orgánica disuelta y particulada (MOD y MOP, respectivamente). Además de las fuentes aguas arriba, la materia orgánica puede acumularse a partir de la mortalidad de organismos locales y la producción de desechos. [33] [34]
Los detritívoros aprovechan esta fuente de energía y crean una red alimentaria alternativa y paralela que podría tener una gran importancia. Esto se debe a que la fijación de carbono en la red alimentaria detrítica no está limitada por la estratificación, la turbidez o la duración del día, factores que limitan la fotosíntesis. La producción detrítica se produce de forma continua, limitada únicamente por los aportes y la advección fuera del sistema del delta. [25] [35]
Las bacterias son los principales agentes de transformación de DOM y POM en carbono biodisponible a través del circuito microbiano . Este mecanismo es particularmente importante en sistemas marinos con nutrientes limitados, donde las bacterias liberan nutrientes de los detritos que se hunden, lo que permite reciclarlos de nuevo en la zona fótica. Se han realizado pocos trabajos sobre la función del circuito microbiano en el estuario de San Francisco, pero es posible que el papel de las bacterias no sea crítico para reciclar nutrientes en un sistema eutrófico . Más bien, pueden proporcionar una cadena alimentaria alternativa a través del pastoreo directo de flagelados , rotíferos y ciliados . [36]
La gran abundancia del copépodo ciclopoide Limnoithona tetraspina puede deberse a su dependencia de los ciliados en lugar del fitoplancton como fuente principal de alimento. [37] Las principales especies de copépodos calanoides también pueden utilizar a los ciliados como fuente de alimento suplementaria o incluso primaria, pero se desconoce en qué grado. [38] [39]
Producción secundaria
La producción secundaria se refiere a los organismos que se alimentan de la producción primaria y transfieren energía a niveles tróficos superiores de la red alimentaria estuarina. Históricamente, la producción secundaria en el estuario de San Francisco estaba dominada por la producción de camarones mísidos . [40] [41] Sin embargo, el mísido nativo Neomysis mercedis ha sido reemplazado en gran medida por el introducido Acanthomysis bowmani , que persiste en densidades más bajas. El anfípodo introducido Gammurus daiberi puede haber tomado parte de este nicho, pero está restringido en gran medida al agua dulce.
Hoy en día, la principal fuente de producción secundaria deriva de los copépodos . Se cree que el copépodo calanoideo nativo naturalizado Eurytemora affinis fue introducido cerca del final del siglo XIX. [42] Dominó el zooplancton de la zona de baja salinidad hasta la década de 1980, cuando fue reemplazado en gran medida por otro copépodo calanoideo introducido, Pseudodiaptomus forbesi . [16] [43] P. forbesi persiste manteniendo una población fuente en regiones de agua dulce de alta residencia del estuario, particularmente en el delta, fuera del rango de tolerancia a la salinidad de la almeja del río Amur. [44] Debido a que el E. affinis, una vez dominante, carece de un rango río arriba, es más vulnerable a la depredación de la almeja y sufre una aparente competencia con P. forbesi.
Otros copépodos calanoides que pueden ser importantes son los recientemente introducidos Sinocalanus doerri y Acartiella sinensis . Se sabe poco sobre las historias de vida de estos organismos, aunque según su morfología pueden depredar a otros copépodos. Aparecen en ciclos irregulares de abundancia, durante los cuales pueden dominar el zooplancton. [45]
Otro copépodo invasor, el diminuto ciclopoide Limnoithona tetraspina , apareció en la zona de baja salinidad en la década de 1990. Desde entonces, L. tetraspina se ha convertido en el copépodo numéricamente dominante, alcanzando densidades del orden de 10 000/m3. Depende del bucle microbiano como fuente de alimento, alimentándose de bacterias, ciliados y rotíferos. [37] Además, parece invulnerable a la depredación de la almeja del río Amur, por razones que se desconocen. Debido a su pequeño tamaño, L. tetraspina generalmente no está disponible para el consumo de depredadores más grandes, en particular peces, lo que lo convierte en un callejón sin salida energético.
Consumidores
Consumidores primarios
Los consumidores primarios dependen de la producción primaria como fuente principal de alimento. Los consumidores más importantes de la red pelágica de la LSZ son los copépodos, junto con los rotíferos, flagelados y ciliados mencionados anteriormente. Todas las especies de copépodos calanoides han disminuido bajo la alta presión de depredación de la almeja del río Amur ( Corbula amurensis ), recientemente introducida. [16] Debido a esto, y debido a que los copépodos dependen tanto de fuentes de alimento fotosintéticas como detríticas, los copépodos en la LSZ tienen una retroalimentación limitada sobre la producción primaria, a diferencia de los sistemas marinos y lénticos donde los copépodos pueden pastar las floraciones en cuestión de días.
Pseudodiaptomus forbesi es el copépodo calanoideo dominante de la ZLS en términos de biomasa. Tiene una tolerancia a la salinidad suficientemente amplia como para persistir tanto en condiciones de baja salinidad como en agua dulce. Esta amplia distribución ayuda a la población a mantener un refugio río arriba contra la depredación, a diferencia de otras especies con tolerancias a la salinidad más estrechas. [44]
Limnoithona tetraspina se ha convertido en el copépodo ciclopoideo numéricamente dominante desde su introducción en 1993. Se alimenta principalmente de ciliados y microflagelados, pero a diferencia de P. forbesi , es relativamente inmune a la depredación por almejas o peces, de ahí su abundancia. Energéticamente, L. tetraspina puede ser un callejón sin salida para la red alimentaria; estos copépodos son expulsados del sistema por las mareas y las corrientes, o mueren y caen al bentos, donde pueden estar disponibles para el circuito microbiano o para los detritívoros. [46]
- Lapa escudete ( Lottia pelta ) que se encuentra en el centro y sur de la bahía de San Francisco [47]
- Caracol turbante negro ( Tegula funebralis ) encontrado en zonas intermareales [47]
- Hermissenda crassicornis se encuentra en muelles, rocas y pilotes. [47]
- Clinocardium nuttallii en zonas intermareales
Copépodos depredadores
Existen varios copépodos depredadores en todo el delta, sobre los cuales se sabe relativamente poco. Sinocalanus doerri , Acartiella sinensis y Tortanus dextrilobatus parecen ser morfológicamente capaces de depredar a otros copépodos. Cada uno fue introducido al estuario, probablemente a través del intercambio de agua de lastre desde la década de 1980. Generalmente, no se encuentran en abundancia suficiente como para afectar negativamente a los consumidores de copépodos; sin embargo, ocurren floraciones periódicas de S. doerri y A. sinensis que no han sido bien estudiadas. [48]
Macroinvertebrados

Aunque son capaces de alimentarse por filtración , los mísidos (pequeñas criaturas parecidas a los camarones) son en gran parte carnívoros y se alimentan de adultos copépodos. Proporcionaban un conducto energético entre el plancton y los peces planctívoros, incluidos los peces juveniles, el esturión , el salmón Chinook y el sábalo americano . Los mísidos alguna vez fueron abundantes hasta que el nativo Neomysis mercedis fue reemplazado a mediados de la década de 1980 por el invasor Acanthomysis bowmani , que es más pequeño y menos abundante. La disminución de los mísidos se ha relacionado con la posterior disminución de varias especies de peces en el estuario en las décadas de 1980 y 1990. [49] [50]
Los camarones son carnívoros generalistas que se alimentan principalmente de mísidos y anfípodos . Crangon franciscorum representa una de las dos pesquerías comerciales restantes en el estuario. Si bien ya no se utilizan para los "cócteles de camarones de la bahía de San Francisco", se capturan como carnada. Otros depredadores incluyen lubina rayada y salmón chinook adultos y salmones jóvenes . [51]
Pez

Debido a que los peces son un grupo taxonómica y morfológicamente diverso, las especies varían en sus ecologías tróficas . En general, los peces pueden dividirse en cuatro grandes categorías de alimentación: filtradores , planctívoros, piscívoros y bentónicos .
Los peces filtradores filtran la columna de agua de forma indiscriminada en busca de presas pequeñas, generalmente fito y zooplancton. Esta categoría de peces incluye al sábalo de aleta de hilo ( Dorosoma petenense ), al sábalo americano ( Alosa sapidissima ), al pejerrey de tierra adentro ( Menidia beryllina ) y a las anchoas ( Engraulis mordax ). Algunas evidencias sugieren que algunas de estas especies tienen una alimentación limitada debido a los niveles deprimidos de plancton después de la introducción de la almeja del río Amur. Las anchoas han abandonado la ZLS en favor de regiones más productivas del estuario en las bahías de San Pablo y Central. [17]
- Pejerrey ( Atherinopsis californiensis ) [47]
- Eperlano del Delta ( Hypomesus transpacificus ) [47]
- Arenque del Pacífico ( Clupea pallasii ), normalmente en alta mar, pero entra en la bahía para desovar entre noviembre y marzo. [47]
- anchoveta del norte ( Engraulis mordax ) encontrada en San Pablo y la bahía de Suisun [47]
- Pez pipa de bahía ( Sygnathus leptorhynchus ) que se encuentra en áreas intermareales comúnmente entre las zosteras marinas [47]
Los planctívoros se alimentan selectivamente de zooplancton individual, como copépodos, misidáceos y gamáridos . Este grupo incluye la mayoría de las larvas de peces, el eperlano del delta ( Hypomesus transpacificus ) y el eperlano de aleta larga ( Spirinchus thaleichthys ), la perca tule ( Hysterocarpus traski ) y los salmones jóvenes . El eperlano del delta es de particular interés debido a su estado de peligro de extinción . Puede tener una alimentación limitada, pero la evidencia es algo contradictoria. Otros factores, como el arrastre de huevos y larvas en el bombeo de exportación de agua dulce desde el Delta también pueden explicar la disminución. [11]
- Perca surfera ( Cymatogaster gregata ) que se encuentra en zonas submareales [47]
- perca tule ( Hysterocarpus traskii )
- Surfperca leucomas ( Hyperprosopon argenteum ) [47]
- Pez roca marrón ( Sebastes auriculatus )
- Pez sapo zumbador ( Porichthys notatus ) que se encuentra en zonas submareales [47]
El principal piscívoro de la ZLS es la lubina rayada ( Morone saxatilis ), que se introdujo en la década de 1890 y se alimenta en gran medida de peces nativos. La lubina rayada es una importante pesquería deportiva en el estuario de San Francisco y, como tal, representa una extracción menor de biomasa del estuario. [52]
Los peces bentónicos, o que habitan en el fondo, incluyen el esturión blanco ( Acipenser transmontanus ), el bagre blanco ( Ameiurus catus ) y el lenguado estrellado ( Platichthys stellatus ). Debido a la orientación de su hábitat , se alimentan principalmente de organismos epibentónicos como anfípodos, camarones de bahía y bivalvos. Se sabe que estos peces se alimentan al menos ocasionalmente de la almeja del río Amur, que representaría uno de los pocos canales para el flujo de energía de esa especie, excepto por la producción de detríticos. [53]
La única pesquería comercial en la LSZ es la de camarones para carnada. Hay una variedad de pesquerías deportivas que representan un flujo menor de carbono, pero flujos significativos de capital para las economías locales alrededor del estuario. La mayoría de las pesquerías recreativas rodean la lubina rayada, el esturión y las lubinas de agua dulce introducidas en el delta de agua dulce. Esta escasez de pesquerías hace que el estuario de San Francisco sea único. Casi todos los estuarios del mundo sustentan al menos remanentes de pesquerías importantes. [54] El estuario de San Francisco alguna vez sustentó pesquerías importantes de salmón, anchoas y cangrejos Dungeness hasta la década de 1950. La desaparición de estas pesquerías probablemente se debió más a la pérdida de hábitat que a la sobreexplotación . [2]
- Tiburón leopardo ( Triakis semifasciata ) [47]
- tiburón de siete branquias ( Notorynchus cepedianus ) [47]
- El tiburón espinoso ( Squalus acanthias ) se encuentra en la zona submareal [47]
- Esturión verde norteamericano ( Acipenser medirostris )
- Esturión blanco ( Acipenser transmontanus )
Pájaros
El estuario de San Francisco es una parada importante en la ruta migratoria del Pacífico para las aves acuáticas migratorias. Sin embargo, se sabe poco sobre el flujo de carbono dentro o fuera del estuario a través de las aves . Millones de aves acuáticas utilizan anualmente las aguas poco profundas de la bahía como refugio. La mayoría de las aves son patos zambullidores que se alimentan de vegetación acuática sumergida. Los patos buceadores (como los porrones ) se alimentan de organismos epibentónicos como C. amurensis, lo que representa un posible flujo de carbono desde ese callejón sin salida. [55] [56] Aquí se encuentran dos especies de aves en peligro de extinción : el charrán mínimo de California y el rascón picudo de California . Los lodos de la bahía expuestos proporcionan importantes áreas de alimentación para las aves playeras , pero las capas subyacentes de lodo de la bahía plantean peligros geológicos para las estructuras cerca de muchas partes del perímetro de la bahía. Las aves piscívoras como el cormorán de doble cresta y los pelícanos pardos también habitan el estuario, pero su impacto trófico sigue siendo poco estudiado.
En enero de 2015, los científicos estaban trabajando para identificar una sustancia gris, espesa, pegajosa e inodora que recubre a las aves a lo largo de las costas de la bahía de San Francisco. Cientos de aves han muerto y cientos más han quedado cubiertas por la sustancia. Los científicos están preocupados por otros animales salvajes que pueden estar en riesgo por la sustancia. [57]
- Pelícano pardo ( Pelecanus occidentalis californicus ) en la bahía de San Francisco
- Rallus obsoletus (Rascón de Ridgway ) en Oakland
- cormorán de doble cresta
- Gaviota de pico anillado ( Larus delawarensis ) en Oakland
Mamíferos
Antes de 1825, españoles, franceses, ingleses, rusos y estadounidenses se sintieron atraídos por el Área de la Bahía para capturar cantidades prodigiosas de castor ( Castor canadensis ), nutria de río, marta, pescador, visón, zorro, comadreja, focas comunes y leones marinos ( Zalophus californianus ) y nutria marina ( Enhydra lutris ). Este temprano comercio de pieles, conocido como la fiebre de pieles de California , fue más que cualquier otro factor individual, responsable de abrir el Oeste y el Área de la Bahía de San Francisco , en particular, al comercio mundial. [58] Para 1817, la nutria marina en el área estaba prácticamente eliminada. [59] Los rusos mantuvieron una estación de focas en las cercanas Islas Farallón desde 1812 hasta 1840, capturando entre 1.200 y 1.500 focas peleteras al año, aunque los barcos estadounidenses ya habían explotado las islas. [60] En 1818 las focas disminuyeron rápidamente hasta que solo se podían capturar unas 500 al año y en los años siguientes, el lobo marino fue extirpado de las islas hasta que comenzaron a recolonizarlas en 1996. [61]
Aunque los naturalistas del siglo XX eran escépticos sobre la existencia histórica de castores en los arroyos costeros o en la bahía misma, [62] registros anteriores muestran que el castor dorado de California ( Castor canadensis ssp. subauratus ) era uno de los animales más valiosos capturados, y aparentemente se encontraba en gran abundancia. [58] Thomas McKay informó que en un año la Compañía de la Bahía de Hudson tomó 4.000 pieles de castor en las orillas de la bahía de San Francisco. Recientemente, los castores han recolonizado el pantano salobre de Napa Sonoma en el norte de la bahía de San Pablo y sus afluentes Sonoma Creek y Napa River . Los castores también están recolonizando South Bay, habiendo sido translocados al arroyo Los Gatos superior en el embalse de Lexington en la década de 1980. Posteriormente migraron río abajo hasta el río Guadalupe , y al llegar al agua salada, la han utilizado para recolonizar al este hasta Coyote Creek y al noroeste hasta Matadero Creek en Palo Alto . [63]
La nutria de río norteamericana ( Lontra canadensis ) también está recolonizando la bahía y sus afluentes. La nutria de río en la bahía se informó por primera vez en Redwood Creek en Muir Beach en 1996, [64] y recientemente en Corte Madera Creek , y en el sur de la bahía en Coyote Creek , [65] así como en 2010 en la propia bahía de San Francisco en Richmond Marina .
Por primera vez en 65 años, la marsopa común del Pacífico ( Phocoena phocoena ) regresó a la bahía en 2009. [66] Golden Gate Cetacean Research, una organización sin fines de lucro centrada en la investigación de cetáceos , ha desarrollado una base de datos de identificación fotográfica que permite a los científicos identificar individuos específicos de marsopa y está tratando de determinar si una bahía más saludable ha traído su regreso. [67] La distribución de la marsopa común del Pacífico va desde Point Conception , California, hasta Alaska y hasta la península de Kamchatka y Japón. Estudios genéticos recientes muestran que existe una población local desde San Francisco hasta el río Ruso y que las poblaciones costeras del Pacífico oriental rara vez migran lejos, a diferencia de la marsopa común del Atlántico occidental. [68]
El delfín mular común ( Tursiops truncatus ) ha estado extendiendo su área de distribución actual hacia el norte desde la bahía del sur de California . El primer delfín mular costero en el área de la bahía de San Francisco en tiempos recientes fue visto en 1983 frente a la costa del condado de San Mateo . En 2001, los delfines mulares fueron vistos por primera vez al este del puente Golden Gate y confirmados por evidencia fotográfica en 2007. Los restos zooarqueológicos de delfines mulares indicaron que los delfines mulares habitaron la bahía de San Francisco en tiempos prehistóricos hasta al menos 700 años antes del presente, y los cráneos de delfines dragados de la bahía sugieren visitantes ocasionales en tiempos históricos. [69]
- Leones marinos ( Zalophus californianus ) en el Muelle 39
- Foca del Pacífico ( Phoca vitulina richardii )
- Nutria de río tomando el sol en las rocas en Richmond Marina
- Humphrey la ballena, una ballena jorobada ( Megaptera novaeangliae ) que entró en la bahía
- Marsopa común ( Phocoena phocoena )
- El ratón cosechero de marismas ( Reithrodontomys raviventris ) es una especie en peligro de extinción endémica de los humedales de la Bahía de San Francisco con una alta tolerancia a la sal.
Medusa
Hasta hace poco, las medusas no eran comunes en el estuario. En los estuarios de la costa este, como la bahía de Chesapeake , suelen ser depredadores de primer nivel y se alimentan indiscriminadamente de peces y zooplancton. Se han identificado varios taxones invasores pequeños en la zona de LSZ y en las regiones de agua dulce. Estas especies se estrobilizan en verano, pero mantienen pólipos en el bentos durante todo el año.
Se desconoce su impacto sobre el plancton , pero se están realizando investigaciones para cuantificarlo. En densidad suficiente, las medusas pueden tener un papel complementario al de C. amurensis en la supresión del zooplancton, al habitar áreas de baja salinidad fuera del área de distribución de las almejas, donde las especies planctónicas han tenido un refugio libre de depredación.
- Corynactis californica se encuentra en muelles y pilotes en las zonas intermareales
Consumidores bentónicos
La comunidad bentónica ha asumido un papel desproporcionadamente grande en la ecología de la red alimentaria del estuario debido a invasiones clave de bivalvos . [16] El uso de estas almejas, la almeja del río Amur ( Corbula amurensis ) tiene una amplia tolerancia a la salinidad que se extiende a la zona de baja salinidad, pero no al agua dulce. Se alimenta por filtración de fitoplancton y zooplancton pequeño, como nauplios de copépodos calanoides . La almeja tiene pocos depredadores en el estuario de San Francisco y esto le permite crecer a altas densidades (del orden de decenas de miles/m2). Debido a sus altas tasas de limpieza, es capaz de limpiar toda la columna de agua de porciones del estuario en unos pocos días, lo que lleva a poblaciones de plancton drásticamente agotadas. [70] Se cree que esta es la principal causa de una disminución en la productividad del ecosistema después de la invasión de las almejas a mediados de la década de 1980. [16] [71] [72]
- Lenguado estrellado ( Platichthys stellatus )
- Lenguado moteado ( Citharichthys stigmaeus ) que se encuentra en zonas submareales con fondos arenosos [47]
- Raya murciélago ( Myliobatis californica ) y una raya grande ( Beringraja binoculata ) en el Acuario de la Bahía, ambas se encuentran en áreas submareales de la bahía [47]
Esta disminución de la productividad se debe esencialmente a la redirección de la red pelágica a una cadena bentónica por esta especie. [16] Debido a que la almeja del río Amur se alimenta de productores primarios, consumidores y depredadores, impacta múltiples niveles tróficos . En consecuencia, casi todo el plancton muestra signos de competencia aparente , en el sentido de que la producción en un nivel trófico impacta a todos los demás al aumentar la abundancia de almejas. Esto da como resultado un ciclo de retroalimentación negativo : C. amurensis limita la biomasa del plancton, que a su vez limita a C. amurensis . Sin embargo, los aportes desde fuera del sistema debido a la advección de mareas o fuentes aguas arriba pueden aumentar la biomasa de C. amurensis , impulsando aún más la limitación del plancton. Este ciclo de retroalimentación se amplifica aún más porque la almeja puede persistir durante más de uno o dos años, lo que pone presión adicional sobre las poblaciones de plancton durante los ciclos de baja productividad.
La redirección del carbono por parte de C. amurensis hacia el bentos ha creado una cadena limitada, lo que ha empobrecido la red pelágica. La producción detrítica a partir de la excreción y muerte de las almejas puede impulsar la producción bacteriana, que puede circular hacia la red alimentaria detrítica o circuito microbiano.
Si bien los nutrientes reciclados pueden sustentar cierto crecimiento del fitoplancton, en última instancia, esto repercute en el aumento de las poblaciones de C. amurensis. El reciente éxito de la invasión de Limnoithona tetraspina puede entenderse en términos de este fenómeno. Se alimenta de ciliados y microflagelados que son demasiado pequeños para que la almeja los paste, evitando así la competencia. Además, L. tetraspina parece inmune a la depredación por parte de la almeja o (casi) de cualquier otra cosa. El auge de la red alimentaria microbiana y la invasión de L. tetraspina son el resultado de una ruta alternativa sin explotar para el flujo de energía en la red alimentaria, facilitada por C. amurensis. Los patrones posteriores de invasión pueden reflejar un patrón similar.
- Cangrejo Dungeness ( Metacarcinus magister ) [47]
- Cangrejo de roca roja ( Cancer productus )
- Cangrejo gracioso ( Metacarcinus gracilis )
- Cangrejo de roca de California ( Romaleon Antennarium )
- Cangrejo de costa amarilla ( Hemigrapsus oregonensis ) que se encuentra en zonas intermareales poco profundas [47]
- Cangrejo araña americano ( Pyromaia tuberculata ) que se encuentra debajo de rocas y cerca de pilotes de muelles [47]
- Cangrejo ermitaño peludo ( Pagurus hirsutiusculus )
- Estrella de mar ocre ( Pisaster ochraceus ) encontrada en la zona intermareal [47]
Especies introducidas

Las introducciones de especies han ido en aumento desde al menos el siglo XIX como consecuencia del aumento del comercio y el tráfico. Las introducciones incluyen numerosos taxones, entre ellos copépodos, camarones , anfípodos , bivalvos , peces y plantas tanto enraizadas como flotantes. Muchas especies pelágicas se han introducido más recientemente a través de liberaciones de agua de lastre desde grandes buques directamente al estuario. [73] Como resultado, muchas de estas especies introducidas son originarias de estuarios alrededor de la Cuenca del Pacífico, en particular copépodos como P. forbesi y L. tetraspina. La almeja del río Amur es originaria de Asia y ha creado cambios significativos y drásticos en la ecología de la ZLS, principalmente al desviar el alimento pelágico al bentos y hacia un circuito microbiano acelerado. [74]
También se han introducido especies a través de su incorporación a embarcaciones deportivas que se remolcan entre regiones. [73] Esta es la fuente probable de una serie de plantas de baja salinidad como Egeria densa y jacinto de agua ( Eichhornia crassipes ). Estas plantas han creado cambios profundos en el Delta al interrumpir el flujo de agua, sombrear el fitoplancton y proporcionar hábitat para peces piscívoros como la lubina rayada , Morone saxatilis , introducida intencionalmente a fines del siglo XIX desde la bahía de Chesapeake . [52] [73] Se espera que el mejillón quagga de agua dulce , originario de Europa, sea introducido por los navegantes dentro de los próximos dos a diez años, a pesar de las medidas de precaución. [75] Además, la corta edad y el entorno aislado del estuario de San Francisco han resultado en el éxito de invertebrados invasores debido a la falta de biodiversidad. [54]
Invasiones futuras
La red alimentaria moderna se deriva de una serie de invasiones y sustituciones tróficas.
Se espera que este proceso continúe, a medida que nuevos organismos lleguen a través de introducciones accidentales o intencionales. Lo que no está tan claro es hasta qué punto las introducciones anteriores allanan el camino para futuras invasiones. Esto puede ocurrir de una de tres maneras.
- Un invasor temprano puede proporcionar un recurso que no se utiliza en el nuevo sistema hasta que se introduce un nuevo depredador ( L. tetraspina y el circuito microbiano, como se describió anteriormente).
- Los primeros invasores pueden facilitar la aparición de otros nuevos alterando el hábitat y haciéndolo adecuado para invasiones posteriores (pólipos medusos que utilizan conchas de almejas del río Amur como sustrato).
- La aparente competencia entre residentes antiguos y nuevos puede aumentar las posibilidades de invasión y asentamiento de nuevos organismos que pueden sacar provecho de recursos no explotados (la subvención de la almeja del río Amur por las poblaciones aguas arriba del copépodo introducido P. forbesi, creando presión sobre los copépodos nativos).
Resumen
La red alimentaria de la LSZ del estuario de San Francisco opera en dos direcciones paralelas y asimétricas. La mayor parte del carbono se asimila en los circuitos bentónicos y microbianos, que representan callejones sin salida energéticos. Una fracción más pequeña se entrega a niveles tróficos pelágicos superiores que pueden sustentar copépodos, peces, aves y pesquerías. Esta redirección de la red alimentaria hacia estos dos circuitos estrechos puede ser responsable de la disminución de macroinvertebrados y peces en el estuario, que operan fuera de estas cadenas. La restauración del estuario a un mayor grado de función depende de la probabilidad de brindar mayores beneficios a la red pelágica sin subsidiar la bentónica.
Ecología del futuro
La ecología de la zona de baja salinidad del estuario de San Francisco es difícil de caracterizar porque es el resultado de una sinergia compleja de factores abióticos y bióticos. Además, continúa experimentando cambios rápidos como resultado de especies recién introducidas, influencias antropogénicas directas y el cambio climático . Los cambios ecológicos futuros serán impulsados a escala de todo el ecosistema, en particular a medida que el aumento del nivel del mar , la inestabilidad tectónica y el deterioro de la infraestructura provoquen fallas en los diques del delta. [76] Se espera que el contragolpe resultante en el flujo de agua fuerce a X2 hacia el delta, poniendo en peligro el hábitat orientado espacialmente (como los pantanos de agua dulce), canalizando la zona de baja salinidad y amenazando el suministro de agua del sur de California, con consecuencias desconocidas e imprevisibles para la ecología natural y humana del estuario más grande de la costa oeste.
Véase también
- Lista de cursos de agua en el área de la Bahía de San Francisco
- Hidrografía del área de la bahía de San Francisco
- El Proyecto de la Cuenca Hidrográfica
- Ciencia del estuario y la cuenca hidrográfica de San Francisco
Notas
- ^ abcde Kimmerer 2004
- ^ de Conomos 1979
- ^ Vayssieres 2006
- ^ Jassby 2000
- ^ Deverel 1998
- ^ Felipe 2007
- ^ Lund 2007
- ^ por Kimmerer 2002
- ^ Gunther, Andrew (2011). "El estado de la bahía de San Francisco 2011, San Francisco Estuary Partnership" (PDF) . El estado de la bahía de San Francisco 2011 . Consultado el 6 de octubre de 2017 .
- ^ Moyle 1992
- ^ por Bennett 2006
- ^ Monismith 1996
- ^ Oficina 1998
- ^ Schoellhamer 2001
- ^ Orsi 1986
- ^ abcdef Kimmerer 1996
- ^ por Kimmerer 2006
- ^ Davis, Jay (septiembre de 2006). "The Pulse of the Estuary 2006" (PDF) . sfei.org . San Francisco Estuary Institute . Consultado el 2 de noviembre de 2016 .
- ^ Taugher 2005
- ^ Smith 2002
- ^ de Dugdale 2003
- ^ Jassby 2002
- ^ Nichols 1986
- ^ Kimmerer 1994
- ^ por Jassby y Cloern 2000
- ^ Anderson y otros, 2002
- ^ de Jassby y otros, 2002
- ^ Dugdale y otros, 2003
- ^ Claro 1987
- ^ Cole y Cloern 1987
- ^ Ball y Arthur 1979
- ^ Lehman y Waller 2003
- ^ Murrell y otros 1999
- ^ Murrell y Hollibaugh 2000
- ^ Jassby y otros 1993
- ^ Hollibaugh y Wong 1996
- ^ por Bouley 2006
- ^ Rollwagen-Bollens y Penry 2003
- ^ Rollwagen-Bollens y otros. 2006
- ^ Modlin 1997
- ^ Kimmerer 1998
- ^ Lee 1999
- ^ Orsi 1991
- ^ por Durand2006
- ^ Orsi 1999
- ^ Bouley y Kimmerer 2006
- ^ abcdefghijklmnopqrst Mooi, Rich (2007). Animales de la bahía de San Francisco: una guía de campo para las especies bentónicas comunes. San Francisco, California: Academia de Ciencias de California. ISBN 978-0-940228-69-6.OCLC 86174077 .
- ^ Orsi y Ohtsuka 1999
- ^ Orsi y Knutson 1979
- ^ Modlin y Orsi 1997
- ^ Sitts y Knight 1979
- ^ por Radovich 1963
- ^ Peterson 1997
- ^ de Nichols y otros 1986
- ^ Poulton y otros, 2002
- ^ Richman y Lovvorn 2004
- ^ Los científicos se apresuran a identificar la sustancia viscosa que se encuentra en las aves a lo largo de las costas de la Bahía de San Francisco (enero de 2015), The Christian Science Monitor
- ^ ab Skinner, John E. (1962). An Historical Review of the Fish and Wildlife Resources of the San Francisco Bay Area (The Mammalian Resources). Departamento de Pesca y Caza de California, Informe de la División de Proyectos Hídricos n.º 1. Sacramento, California: Departamento de Pesca y Caza de California. Archivado desde el original el 26 de julio de 2011.
- ^ Suzanne Stewart y Adrian Praetzellis (noviembre de 2003). Cuestiones de investigación arqueológica en el área de recreación nacional de Point Reyes National Seashore - Golden Gate (PDF) (informe). Centro de Estudios Antropológicos, Universidad Estatal de Sonoma. p. 335. Consultado el 10 de enero de 2010 .
- ^ Thompson, RA (1896). El asentamiento ruso en California conocido como Fort Ross, fundado en 1812... abandonado en 1841: por qué llegaron y por qué se fueron. Santa Rosa, California: Sonoma Democrat Publishing Company. pág. 7. ISBN 0-559-89342-6.
- ^ White, Peter (1995). Las islas Farallón: centinelas del Golden Gate . San Francisco, California: Scottwall Associates. ISBN 0-942087-10-0.
- ^ Tappe, Donald T. (1942). "La situación de los castores en California". Boletín de caza n.º 3. Departamento de Pesca y Caza de California.
- ^ Sue Dremann (4 de noviembre de 2022). «El castor ha vuelto: se avista una pareja de roedores semiacuáticos en Palo Alto». Palo Alto Weekly . Consultado el 18 de enero de 2023 .
- ^ "¡Sal afuera!". San Francisco Chronicle. Abril de 1966. Consultado el 6 de marzo de 2011 .
- ^ "Reserva Blue Oak Ranch". Universidad de California. Archivado desde el original el 12 de mayo de 2011. Consultado el 6 de marzo de 2011 .
- ^ David Perlman (8 de noviembre de 2010). "Las marsopas regresan a la bahía de San Francisco: los científicos estudian por qué". San Francisco Chronicle . Consultado el 25 de julio de 2011 .
- ^ "Harbor Marsoise Project". Golden Gate Cetacean Research . Consultado el 25 de julio de 2011 .
- ^ Marsopa común (Phocoena phocoena): población del río San Francisco-Ruso (PDF) (Informe). Servicio Nacional de Pesca Marina . 15 de octubre de 2009. Consultado el 25 de julio de 2011 .
- ^ William Keener; Marc A. Webber; Tim M. Markowitz; Mark P. Cotter; Daniela Maldini; RH Defrán; Megan Arroz; Amanda J. Debich; Aimée R. Lang; Dennis L. Kelly; Alex G. Kesaris; Magdalena Bearzi; Kayla Causey; David Anderson; Laurie Shuster; David W. Weller (2023). "Expansión de la cordillera norte de los delfines mulares costeros de California (Tursiops truncatus)". Mamíferos acuáticos . 49 (1): 29–43. doi : 10.1578/AM.49.1.2023.29 . S2CID 255918023.
- ^ Werner y Hollibaugh 1993
- ^ Carlton y otros 1990
- ^ Nichols y otros 1990
- ^abc Carlton 1996
- ^ Cole 1992
- ^ Dey 2007
- ^ Epstein 2006
Referencias
- Anderson, DM, PM Gilbert y JM Burkholder. 2002. Floraciones algales nocivas y eutrofización: fuentes de nutrientes, composición y consecuencias. Estuaries 25:704-726.
- Ball, MD y JF Arthur. 1979. Dinámica de la clorofila planctónica en la zona norte de la bahía de San Francisco y el delta. Páginas 265–286 en TJ Conomos, editor. Bahía de San Francisco: el estuario urbanizado. Asociación Estadounidense para el Avance de la Ciencia, División del Pacífico, San Francisco, CA.
- Bennett, WA (2006). Crecimiento y supervivencia del olfato del delta durante la reciente disminución de los organismos pelágicos: ¿qué les causa la tristeza del verano? Conferencia científica CALFED. Sacramento, CA.
- Bouley P., WJK (2006). "Ecología de un copépodo ciclopoideo muy abundante e introducido en un estuario templado". Marine Ecology Progress Series 324: 219–228.
- Burau, JR (1998). "Resultados del elemento hidrodinámico del estudio de la zona de atrapamiento de 1994 en la bahía de Suisun, Sacramento, CA". Informe técnico 56 del Programa ecológico interinstitucional para el estuario de la bahía de San Francisco y el delta del río.
- Carlton, JT, JK Thompson, LE Schemel y FH Nichols. 1990. Notable invasión de la bahía de San Francisco (California, EE. UU.) por la almeja asiática Potamocorbula amurensis. 1. Introducción y dispersión. Marine Ecology Progress Series. 66:81-94.
- Carlton, J. (1996). "Invasiones biológicas y especies criptogénicas". Ecología 77(6).
- Cole, BE y JE Cloern. 1987. Un modelo empírico para estimar la productividad del fitoplancton en los estuarios. Marine Ecology Progress Series. 36:299-305.
- Cole, BE, JK Thompson y JE Cloern (1992). "Medición de las tasas de filtración por bivalvos infaunales en un canal de recirculación". Marine Biology 113: 219–225.
- Cloern, JE 1987. La turbidez como control de la biomasa y productividad del fitoplancton en los estuarios. Continental Shelf Research 7:1367-1381.
- Conomos, TJ, Ed. (1979). Bahía de San Francisco: El estuario urbanizado. San Francisco, CA, División del Pacífico, Asociación Estadounidense para el Avance de la Ciencia.
- Deverel, S. (1998). Mitigación de subsidencia en el Delta del Sacramento-San Joaquín, Programa CALFED Bay-Delta.
- Dey, R. (16 de enero de 2007). "Actualización sobre mejillones invasores en el Área Nacional de Recreación del Lago Mead". Iniciativa 100th Meridian, de http://100thmeridian [ enlace muerto permanente ] .org/mead.asp.
- Dugdale, RC, V. Hogue, A. Marchi, A. Lassiter y F. Wilkerson. 2003. Efectos del aporte y flujo de amonio antropogénico en la producción primaria en la Bahía de San Francisco. Programa Científico CALFED, Sacramento, CA.
- Durand, J. (2006). Determinantes del fracaso del reclutamiento de copépodos calanoides en el Programa Científico de Cría de Cría del Estuario de San Francisco. Sacramento, CA.
- Epstein, E. (2006). Diques crujientes, propicios para el desastre. San Francisco Chronicle. San Francisco.
- Hollibaugh, JT y PS Wong. 1996. Distribución y actividad del bacterioplancton en la bahía de San Francisco. Páginas 263–288 en JT Hollibaugh, editor. Bahía de San Francisco: el ecosistema. Asociación Estadounidense para el Avance de la Ciencia, San Francisco, CA.
- Jassby, AD, JE Cloern y BE Cole. 2002. Producción primaria anual: Patrones y mecanismos de cambio en un ecosistema de marea rico en nutrientes. Limnología y Oceanografía 47:698-712.
- Jassby, AD, JE Cloern y TM Powell. 1993. Fuentes y sumideros de carbono orgánico en la bahía de San Francisco: variabilidad inducida por el caudal del río. Marine Ecology Progress Series. 95.
- Jassby, AD y JE Cloern. 2000. Fuentes de materia orgánica y rehabilitación del delta del Sacramento-San Joaquín (California, EE.UU.). Conservación acuática: ecosistemas marinos y de agua dulce 10:323-352.
- Jassby, AD, JE Cloern y BE Cole. (2002). "Producción primaria anual: Patrones y mecanismos de cambio en un ecosistema de marea rico en nutrientes". Limnología y Oceanografía 47(3): 698–712.
- Kimmerer, WJ, E. Gartside y JJ Orsi (1994). "La depredación por parte de una almeja introducida como causa probable de disminuciones sustanciales del zooplancton en la bahía de San Francisco". Mar. Ecol. Prog. Ser. 113: 81–93.
- Kimmerer, WJ, JJ Orsi. 1996. Cambios en el zooplancton del estuario de la Bahía de San Francisco desde la introducción de la almeja Potamocorbula amurensis. Páginas 403–425 en JT Hollibaugh, editor. Bahía de San Francisco: el ecosistema. Asociación Estadounidense para el Avance de la Ciencia, San Francisco, CA.
- Kimmerer, WJ, JR Burau y WA Bennett. (1998). "Migración vertical orientada por las mareas y mantenimiento de la posición del zooplancton en un estuario templado". Limnol. Oceanogr. 43(7): 1697–1709.
- Kimmerer, WJ (2002). "Respuestas físicas, biológicas y de gestión al flujo variable de agua dulce en el estuario de San Francisco". Estuaries 25: 1275–1290.
- Kimmerer, W. (2004). "Proceso de aguas abiertas del estuario de San Francisco: desde el forzamiento físico hasta las respuestas biológicas". San Francisco Estuary and Watershed Science 2(1).
- Kimmerer, W. (2006). "La respuesta de las anchoas amortigua los efectos del bivalvo invasor Corbula amurensis en la red alimentaria del estuario de San Francisco". Marine Ecology Progress Series 324: 207–218.
- Lee, CE (1999). "Invasiones rápidas y repetidas de agua dulce por el copépodo Eurytermora affinis". Evolution 53(5): 1423–1434.
- Lehman, PW y S. Waller. 2003. Floraciones de Microcystis en el delta. Boletín IEP 16:18-19.
- Lund, J., E. Hanak, W. Fleenor, R. Howitt, J. Mount, P. Moyle (2007). Visualizando el futuro para el delta Sacramento-San Joaquín. San Francisco, Instituto de Políticas Públicas.
- Modlin, RF y JJ Orsi (1997). "Acanthomysis bowmani, una nueva especie, y A. asperali, Mysidacea, recientemente descrita en el estuario Sacramento-San Joaquín, California (Crustacea: Mysidae)". Actas de la Sociedad Biológica de Washington 110(3): 439–446.
- Monismith, SG, JR Burau y M. Stacey (1996). Dinámica de estratificación y circulación gravitacional en el norte de la bahía de San Francisco. Bahía de San Francisco: el ecosistema. JT Hollibaugh. San Francisco, CA, Asociación Estadounidense para el Avance de la Ciencia: 123–153.
- Moyle, PB, B. Herbold, DE Stevens y LW Miller (1992). "Historia de vida y estado del olfato del delta en el estuario Sacramento-San Joaquín, California". Trans. Am. Fish. Soc. 121: 67–77.
- Murrell, MC, JT Hollibaugh, MW Silver y PS Wong. 1999. Dinámica del bacterioplancton en el norte de la bahía de San Francisco: papel de la asociación de partículas y el flujo estacional de agua dulce. Limnología y Oceanografía. 44:295-308.
- Murrell, MC y JT Hollibaugh. 2000. Distribución y composición del carbono orgánico disuelto y particulado en el norte de la bahía de San Francisco durante condiciones de bajo caudal. Estuarine, Coastal and Shelf Science 51:75-90.
- Nichols, FH, JE Cloern, S. Luoma y DH Peterson. 1986. La modificación de un estuario. Science 231:567-573.
- Nichols, FH, JK Thompson y LE Schemel. 1990. Notable invasión de la bahía de San Francisco (California, EE. UU.) por la almeja asiática Potamocorbula amurensis. 2. Desplazamiento de una antigua comunidad. Marine Ecology Progress Series. 66:95-101.
- Orsi, JJ y AC Knutson. 1979. El papel del camarón mísido en el estuario Sacramento-San Joaquín y los factores que afectan su abundancia y distribución. Páginas 401–408 en TJ Conomos, editor. Bahía de San Francisco: el estuario urbanizado. Asociación Estadounidense para el Avance de la Ciencia, División del Pacífico, San Francisco.
- Orsi, JJ y WL Mecum. (1986). "Distribución y abundancia del zooplancton en el Delta del Sacramento-San Joaquín en relación con ciertos factores ambientales". Estuaries 9(4 B): 326–339.
- Orsi, JJ y TC Walter. (1991). "Pseudodiaptomus forbesi y P. marinus (Copepoda: Calanoida), los últimos copépodos inmigrantes en el estuario Sacramento-San Joaquín de California". Bull. Plankton Soc. Japan Spec. Vol. (Actas de la Cuarta Conferencia Internacional sobre Copépodos): 553–562.
- Orsi, JJ y S. Ohtsuka. (1999). "Introducción de los copépodos asiáticos Acartiella sinensis, Tortanus dextrilobatus (Copepoda: Calanoida) y Limnoithona tetraspina (Copepoda: Cyclopoida) en el estuario de San Francisco, California, Estados Unidos". Plank. Biografía. Ecológico. 46: 128-131.
- Peterson, H. 1997. Esturión relleno de almejas. Boletín IEP 9:19-19.
- Philip, T. (2007). Es hora de ofrecer soluciones para el agua. Sacramento Bee. Sacramento, CA.
- Poulton, VK, JR Lovvorn y JY Takekawa. 2002. Densidad de almejas y comportamiento alimentario de los porrones en la bahía de San Pablo, California. The Condor. 104:518-527.
- Radovich, J. (1963). "Efectos de la temperatura del océano en el movimiento hacia el mar de la lubina rayada, Roccus saxatilis, en la costa del Pacífico". Departamento de Pesca y Caza de California 49: 191–205.
- Richman, SE y JR Lovvorn. 2004. Valor relativo de forrajeo para patos porrones menores de almejas nativas y exóticas de la Bahía de San Francisco. Aplicaciones ecológicas 14:1217-1231.
- Rollwagen-Bollens, GC y DL Penry. 2003. Dinámica de alimentación de Acartia sp. en un estuario grande y templado (Bahía de San Francisco, CA). Marine Ecology Progress Series 257:139-158.
- Rollwagen-Bollens, G., S. Gifford, A. Slaughter y SM Bollens. 2006. Protistas en un estuario templado: diversidad, pastoreo y consumo por metazoos. Eos, Transactions of the American Geophysical Union, Suplemento de la reunión de ciencias oceánicas. 87:36 OS11D-05.
- Schoellhamer, DH (2001). Influencia de la salinidad, la topografía del fondo y las mareas en la ubicación de los máximos de turbidez estuarina en el norte de la bahía de San Francisco. Procesos de sedimentación fina en la costa y los estuarios. WH McAnally y AJ Mehta. Ámsterdam, Países Bajos, Elsevier: 343–356.
- Sitts RM, AW Knight. 1979. Depredación por los camarones estuarinos Crangon franciscorum Stimpson y Palaemon macrodactylus Rathbun. Boletín biológico 156:356-368.
- Smith, SV y JT Hollibaugh (2002). "Intercambios de agua, sal y nutrientes en la bahía de San Francisco". Informe técnico n.º 66 del Programa ecológico interinstitucional para el estuario de la bahía de San Francisco y el delta.
- Taugher, Mike (2005). Las sirenas ambientales en el Delta están sonando. Contra Costa Times.
- Trott, JSS, Warren J. Ferguson y Andrew J. Kleinfeld (2006). Central Delta Water Agency v. Bureau of Reclamation. Tribunal de Apelaciones de los Estados Unidos para el Noveno Circuito. San Francisco, CA.
- Vayssieres, MP (2006). Tendencias en el bentos del Esutario superior de San Francisco. Conferencia científica CALFED. Sacramento, California.
- Werner, I., y JT Hollibaugh. 1993. Potamocorbula amurensis (Mollusca, Pelecyopoda): Comparación de las tasas de depuración y eficiencias de asimilación para el fitoplancton y el bacterioplancton. Limnología y Oceanografía 38:949-964.
![Lapa escudete (Lottia pelta) que se encuentra en el centro y sur de la bahía de San Francisco[47]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e9/Lottia_pelta_(23542532150).jpg/440px-Lottia_pelta_(23542532150).jpg)
![Caracol turbante negro (Tegula funebralis) encontrado en zonas intermareales[47]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5b/Tegula_funebralis.jpg/440px-Tegula_funebralis.jpg)
![Hermissenda crassicornis se encuentra en muelles, rocas y pilotes.[47]](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c6/Hermissenda_crassicornis.jpg/440px-Hermissenda_crassicornis.jpg)
.jpg/440px-Polinices_Radula_Hole_(2132260797).jpg)
![Pejerrey (Atherinopsis californiensis)[47]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/dc/Jack_Silverside.jpg/440px-Jack_Silverside.jpg)
![Eperlano del Delta (Hypomesus transpacificus)[47]](http://upload.wikimedia.org/wikipedia/commons/thumb/3/3a/Hypomesus_transpacificus.jpg/440px-Hypomesus_transpacificus.jpg)
![Arenque del Pacífico (Clupea pallasii), normalmente en alta mar, pero entra en la bahía para desovar entre noviembre y marzo.[47]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b0/Clupea_pallasii_by_OpenCage.jpg/440px-Clupea_pallasii_by_OpenCage.jpg)
![anchoveta del norte (Engraulis mordax) encontrada en San Pablo y la bahía de Suisun[47]](http://upload.wikimedia.org/wikipedia/commons/thumb/0/0f/Anchovy_closeup.jpg/440px-Anchovy_closeup.jpg)
![Pez pipa de bahía (Syngnathus leptorhynchus) que se encuentra en áreas intermareales comúnmente entre las zosteras marinas [47]](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c7/Bay_pipefish_(Syngnathus_leptorhynchus)_01.jpg/440px-Bay_pipefish_(Syngnathus_leptorhynchus)_01.jpg)
![La perca surfera (Cymatogaster gregata) se encuentra en zonas submareales[47]](http://upload.wikimedia.org/wikipedia/commons/thumb/8/88/Cymatogaster_aggregata_1zz.jpg/440px-Cymatogaster_aggregata_1zz.jpg)

![Surfperca leucomas (Hyperprosopon argenteum)[47]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b8/Steinhart_Aquarium_13_2013-03-27.jpg/440px-Steinhart_Aquarium_13_2013-03-27.jpg)

![Pez sapo zumbador (Porichthys notatus) que se encuentra en zonas submareales[47]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/db/Plainfin_Midshipman_-_Porichthys_notatus_(43465733001).jpg/440px-Plainfin_Midshipman_-_Porichthys_notatus_(43465733001).jpg)
![Tiburón leopardo (Triakis semifasciata)[47]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/be/Triakis_semifasciata_SI3.jpg/440px-Triakis_semifasciata_SI3.jpg)
![tiburón de siete branquias (Notorynchus cepedianus)[47]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e9/Notorynchus_cepedianus_head3.jpg/440px-Notorynchus_cepedianus_head3.jpg)
![El tiburón espinoso (Squalus acanthias) se encuentra en la zona submareal[47]](http://upload.wikimedia.org/wikipedia/commons/thumb/2/29/Spiny_dogfish_hokitika.jpg/440px-Spiny_dogfish_hokitika.jpg)

.jpg/440px-4774_white_sturgeon_swart_odfw_(4455048986).jpg)




.jpg/440px-California_Least_Tern_adult_&_chick,_Santa_Ynez_estuary,_Vandenberg_AFB,_California_(17323255361).jpg)






,_climbing.jpg/440px-Salt_marsh_harvest_mouse_(Reithrodontomys_raviventris),_climbing.jpg)


![Lenguado moteado (Citharichthys stigmaeus) que se encuentra en zonas submareales con fondos arenosos[47]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/49/Citharichthys_stigmaeus_(Speckled_Sanddab).jpg/440px-Citharichthys_stigmaeus_(Speckled_Sanddab).jpg)
![Raya murciélago (Myliobatis californica) y una raya grande (Beringraja binoculata) en el Acuario de la Bahía, ambas se encuentran en áreas submareales de la bahía[47]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e2/A_Nap_for_Batoids.jpg/440px-A_Nap_for_Batoids.jpg)
![Cangrejo Dungeness (Metacarcinus magister)[47]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/da/2011-08-14_San_Francisco_043_Pier_39,_Aquarium_of_the_Bay_(6092202672).jpg/440px-2011-08-14_San_Francisco_043_Pier_39,_Aquarium_of_the_Bay_(6092202672).jpg)


_(2281653819).jpg/440px-Red_Rock_Crab_(Cancer_antennarius)_(2281653819).jpg)
![Cangrejo de costa amarilla (Hemigrapsus oregonensis) que se encuentra en zonas intermareales poco profundas[47]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5e/Hemigrapsus_oregonensis_6158.JPG/440px-Hemigrapsus_oregonensis_6158.JPG)
![Cangrejo araña americano (Pyromaia tuberculata) que se encuentra debajo de rocas y cerca de pilotes de muelles[47]](http://upload.wikimedia.org/wikipedia/commons/thumb/c/ce/Pyromaia_tuberculata.jpg/440px-Pyromaia_tuberculata.jpg)

![Estrella de mar ocre (Pisaster ochraceus) que se encuentra en la zona intermareal[47]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/dd/Pisaster_ochraceus_(23729798342).jpg/440px-Pisaster_ochraceus_(23729798342).jpg)