Reacción de Gattermann
| Formilación de Gattermann | |
|---|---|
| Llamado en honor a | Ludwig Gattermann |
| Tipo de reacción | Reacción de sustitución |
| Identificadores | |
| Identificación de ontología RSC | Número de receta: 0000139 |
La reacción de Gattermann (también conocida como formilación de Gattermann y síntesis de salicilaldehído de Gattermann ) es una reacción química en la que los compuestos aromáticos se formilan mediante una mezcla de cianuro de hidrógeno (HCN) y cloruro de hidrógeno (HCl) en presencia de un catalizador de ácido de Lewis como el cloruro de aluminio (AlCl 3 ). [1] Lleva el nombre del químico alemán Ludwig Gattermann [2] y es similar a la reacción de Friedel-Crafts .
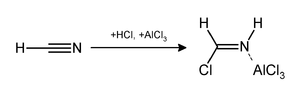

Las modificaciones han demostrado que es posible utilizar cianuro de sodio o bromuro de cianógeno en lugar de cianuro de hidrógeno. [3]
La reacción se puede simplificar reemplazando la combinación HCN/AlCl 3 por cianuro de cinc . [4] Aunque también es muy tóxico, el Zn(CN) 2 es un sólido, lo que lo hace más seguro para trabajar que el HCN gaseoso. [5] El Zn(CN) 2 reacciona con el HCl para formar el reactivo clave HCN y Zn(Cl) 2 que sirve como catalizador de ácido de Lewis in situ . Un ejemplo del método Zn(CN) 2 es la síntesis de mesitaldehído a partir de mesitileno . [6]
Reacción de Gattermann-Koch
| Formilación de Gattermann-Koch | |
|---|---|
| Llamado en honor a | Ludwig Gattermann Julius Arnold Koch |
| Tipo de reacción | Reacción de sustitución |
La reacción de Gattermann-Koch , llamada así en honor a los químicos alemanes Ludwig Gattermann y Julius Arnold Koch , [7] es una variante de la reacción de Gattermann en la que se utiliza monóxido de carbono (CO) en lugar de cianuro de hidrógeno. [8]

A diferencia de la reacción de Gattermann, esta reacción no es aplicable a sustratos de fenol y éter de fenol. [5] Aunque el cloruro de formilo altamente inestable se postuló inicialmente como un intermedio, ahora se cree que el catión formilo (es decir, monóxido de carbono protonado), [HCO] + , reacciona directamente con el areno sin la formación inicial de cloruro de formilo. [9] Además, cuando se utiliza cloruro de zinc como ácido de Lewis en lugar de cloruro de aluminio, por ejemplo, o cuando el monóxido de carbono no se utiliza a alta presión, a menudo es necesaria la presencia de trazas de cocatalizador de cloruro de cobre (I) o cloruro de níquel (II) . El cocatalizador de metal de transición puede servir como "transportador" al reaccionar primero con CO para formar un complejo de carbonilo, que luego se transforma en el electrófilo activo. [10]
Véase también
Referencias
- ^ Smith, Michael B.; March, Jerry (2007), Química orgánica avanzada: reacciones, mecanismos y estructura (6.ª ed.), Nueva York: Wiley-Interscience, pág. 725, ISBN 978-0-471-72091-1
- ^ Gattermann, L .; Berchelmann, W. (1898). "Síntesis de oxialdehído aromático". Berichte der deutschen chemischen Gesellschaft . 31 (2): 1765-1769. doi :10.1002/cber.18980310281.
- ^ Karrer, P. (1919). "Über Oxycarbonylverbindungen I. Eine neue Synthese von" [Compuestos de hidroxicarbonilo. I. Una nueva síntesis de hidroxialdehídos]. Helvetica Chimica Acta (en alemán). 2 (1): 89–94. doi :10.1002/hlca.19190020109.
- ^ Adams R. ; Levine, I. (1923). "Simplificación de la síntesis de Gattermann de hidroxialdehídos". J. Am. Chem. Soc. 45 (10): 2373–77. doi :10.1021/ja01663a020.
- ^ ab Adams, Roger (1957). Reacciones orgánicas, volumen 9. Nueva York: John Wiley & Sons, Inc., págs. 38 y 53-54. doi :10.1002/0471264180.or009.02. ISBN 9780471007265.
- ^ Fuson, RC; Horning, EC; Rowland, SP; Ward, ML (1955). "Mesitaldehído". Síntesis orgánicas . doi :10.15227/orgsyn.023.0057; Volúmenes recopilados , vol. 3, pág. 549.
- ^ Gattermann, L .; Koch, JA (1897). "Una síntesis de aldehídos aromáticos". Chemische Berichte . 30 (2): 1622-1624. doi :10.1002/cber.18970300288.
- ^ Li, Jie Jack (2003). Reacciones de nombres: una colección de mecanismos de reacción detallados (disponible en Google Books ) (2.ª ed.). Springer . pág. 157. ISBN. 3-540-40203-9.
- ^ Kurti, Laszlo. (2005). Aplicaciones estratégicas de reacciones con nombre en síntesis orgánica: antecedentes y mecanismos detallados. Czako, Barbara. Burlington: Elsevier Science. ISBN 978-0-08-057541-4.OCLC 850164343 .
- ^ Dilke, MH; Eley, DD (1949). "550. La reacción de Gattermann–Koch. Parte II. Cinética de la reacción". J. Chem. Soc. : 2613–2620. doi :10.1039/JR9490002613. ISSN 0368-1769.