Química de los organoactínidos

La química de los organoactínidos es la ciencia que explora las propiedades, la estructura y la reactividad de los compuestos organoactínidos , que son compuestos organometálicos que contienen un enlace químico de carbono a actínido .
Como la mayoría de los compuestos organometálicos, los organoactínidos son sensibles al aire y deben manipularse utilizando los métodos adecuados .
Complejos organometálicos con enlaces σ
La mayoría de los complejos organoactínidos más comunes implican enlaces π con ligandos como el ciclopentadienilo , pero hay algunas excepciones con enlaces σ , concretamente en la química del torio y el uranio, ya que estos son los elementos más fácilmente manejables de este grupo.
Compuestos de alquilo y arilo

Los primeros intentos de sintetizar alquilos de uranio se realizaron durante el Proyecto Manhattan por parte de Henry Gilman , inspirado por la volatilidad de los organometálicos del grupo principal. Sin embargo, se dio cuenta de que estos compuestos tienden a ser muy inestables. [1]
Marks y Seyam intentaron sintetizarlos a partir de UCl4 utilizando reactivos de organolitio , pero éstos se descompusieron rápidamente .
En 1989, un grupo finalmente sintetizó un complejo homoléptico con grupos trimetilsililo : U[CH(SiMe 3 ) 2 ] 3 . Desde entonces, también se han sintetizado variantes de números de coordinación más altos como [Li(TMEDA)] 2 [UMe 6 ] . [1]
Por otra parte, sólo se conoce un alquilo de torio homoléptico. [2] El anión heptametiltorato(IV) de siete coordenadas se sintetizó en 1984 utilizando un procedimiento similar al complejo de uranio equivalente.
También se han elaborado complejos de tetrametilos de torio y uranio que contienen fosfina mixta , utilizando dmpe como ligando organofosforado que estabiliza la estructura (las amidas también pueden asumir esta función). [3]
Ciclos metálicos
Tanto el uranio como el torio forman metalociclos con una química diversa. [4] Estos complejos son muy lábiles, por lo que los grupos trimetilsililo vuelven a estar presentes para su protección. Estos compuestos se forman al reaccionar agentes alquilantes más débiles ( LiCH 3 y Mg(CH 3 ) 2 son demasiado fuertes y conducen a la formación de alquilos simples) con ClAn[N(Si(CH 3 ) 2 ] 3 (An = Th, U).

Complejos organometálicos con enlaces π
La gran mayoría de los organoactínidos contienen como ligandos ciclopentadienilo (Cp) o ciclooctatetraeno (COT) y sus derivados, que suelen participar en enlaces η 5 y η 8 , donando densidad electrónica a través de sus orbitales pi.
Complejos de ciclooctatetraeno
Actinocenos

Los actínidos forman complejos sándwich con ciclooctatetraeno de forma análoga a cómo reaccionan los metales de transición con los ligandos de ciclopentadienilo. Los iones de actínidos tienen radios atómicos demasiado grandes para formar compuestos MCp2 , por lo que prefieren reaccionar con iones C8H82- .
El primer ejemplo de este tipo de especie química fue descubierto en 1968 por Andrew Streitwieser , quien preparó uranoceno haciendo reaccionar K(COT) 2 con UCl 4 en tetrahidrofurano a 0 °C. [5] El compuesto en sí es un sólido verde pirofórico que, por lo demás, es bastante poco reactivo. [6]

La mayoría de los actínidos tetravalentes reaccionan de manera similar para formar actinocenos:
El bis(ciclooctatetraeno)protactinio se preparó por primera vez en 1973 convirtiendo el óxido de protactinio(V) en pentacloruro y reduciéndolo con polvo de aluminio antes de hacerlo reaccionar con ciclooctatetraeno de potasio . [7]
- :
El Neptunoceno y el Toroceno se obtuvieron de manera similar utilizando tetracloruros. El Plutonoceno es la excepción: como no se conoce ningún cloruro de plutonio(IV) estable, se tuvo que utilizar ( Hpy ) 2PuCl6 .
Los actínidos posteriores también forman complejos con COT, pero estos no suelen asumir la clásica estructura de sándwich neutra . Los actínidos trivalentes forman compuestos iónicos con ligandos COT; esto se puede ejemplificar mediante la reacción del triyoduro de americio con K 2 COT.
Este compuesto está presente en solución como aducto de THF.
Complejos de ciclooctatetraenos sustituidos
Se han sintetizado muchos uranocenos sustituidos. [8] [9] La metodología seguida fue la misma que para el U(COT) 2 simple , pero se encontró que las propiedades de algunos de los compuestos eran diferentes.
Streitwieser descubrió que el complejo tetrafenilciclooctatetraeno es completamente estable al aire. Esta alta estabilidad se debe probablemente a los efectos inhibidores de los grupos fenilo, que protegen el centro U 4+ de un ataque por oxígeno . [9]
Todos estos derivados son mucho más solubles en disolventes orgánicos como el benceno , en el que forman soluciones verdes más sensibles al aire que los sólidos cristalinos.

El plutonio también forma un complejo sándwich con 1,4-bis(trimetilsilil)ciclooctatetraenilo (1,4-COT'') y su isómero 1,3. Este compuesto se prepara por oxidación del complejo aniónico verde Pu(III) Li(THF) 4 [Pu(1,4-COT'') 2 ] con cloruro de cobalto(II) que conduce a la formación de Pu(1,4-COT'')(1,3-COT''). La reacción se aprecia fácilmente por el cambio de color de la solución de THF a un rojo oscuro, característico del Pu(IV). [10]

También se ha informado del equivalente de neptunio con el COT''' trisustituido [11] y los complejos de los ligandos tri- y di-sustituidos con torio y uranio son bien conocidos. [12] Se sintetizaron de acuerdo con los siguientes esquemas de reacción:

Complejos de ciclopentadieno
Complejos de tris(ciclopentadienil)actínidos

La mayoría de los elementos trivalentes del bloque f forman compuestos con ciclopentadieno con la fórmula M(Cp) 3 . Estos complejos se han aislado hasta el californio , habiéndose observado el equivalente de einstenio [ cita requerida ] en fase gaseosa. [13]

La síntesis del AnCp 3 generalmente sigue el esquema de reacción mostrado anteriormente [4] [14] con algunos pasos adicionales que a veces son necesarios para sintetizar los tricloruros a partir de los óxidos suministrados comercialmente. [13] Sin embargo, algunos autores también utilizan otras síntesis: se pueden utilizar ciclopentadienuros de metales alcalinos en lugar del complejo de berilio, y también se pueden utilizar complejos de An(IV) a través de una reacción de eliminación reductora .
| El | tú | Notario público | Pu | Soy | Centímetro | Libro | Cf |
|---|---|---|---|---|---|---|---|
| verde | marrón | verde pálido | verde | carne | incoloro | ámbar | rojo |
Estos compuestos se conocen desde los años sesenta, pero hasta 2018 solo se había caracterizado estructuralmente el compuesto de neptunio. Kovàcs y sus colaboradores pudieron analizar los complejos de plutonio y uranio y descubrieron que las tres estructuras eran similares, con una distribución asimétrica de los ligandos de ciclopentadienuro y un carácter covalente más elevado en el enlace carbono-actínido que en los compuestos organolantánidos. [16]
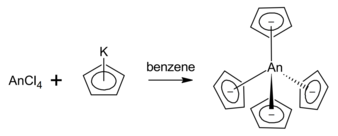
Complejos de tetrakis(ciclopentadienil)actínidos
El torio tetravalente, el uranio y el neptunio forman fácilmente compuestos MCp4 mediante una reacción de metátesis a partir de ciclopentadienuro de potasio utilizando benceno como disolvente. [4]
Véase también
- Química del organouranio
- Química del organoneptunio
- Actinocenos
- Uranoceno , U(C 8 H 8 ) 2
- Neptunoceno , Np(C 8 H 8 ) 2
- Plutonoceno , Pu(C 8 H 8 ) 2
Referencias
- ^ ab Seaman LA, Walensky JR, Wu G, Hayton TW (abril de 2013). "En busca de complejos de alquilo de actínidos homolépticos". Química inorgánica . 52 (7): 3556–64. doi :10.1021/ic300867m. PMID 22716022.
- ^ Lauke H, Swepston PJ, Marks TJ (octubre de 1984). "Síntesis y caracterización de un alquilo actínido homoléptico. El ion heptametiltorato(IV): un complejo con siete enlaces metal-carbono .sigma". Journal of the American Chemical Society . 106 (22): 6841–6843. doi :10.1021/ja00334a062.
- ^ Edwards PG, Andersen RA, Zalkin A (febrero de 1984). "Preparación de complejos de tetraalquilfosfina de los metales del bloque f. Estructura cristalina de Th(CH2Ph)4(Me2PCH2CH2PMe2) y U(CH2Ph)3Me(Me2PCH2CH2PMe2)". Organometallics . 3 (2): 293–298. doi :10.1021/om00080a023.
- ^ abc Behrle AC, Walensky JR (2015), "Actínidos: Química organometálica", Enciclopedia de química inorgánica y bioinorgánica , Sociedad Estadounidense del Cáncer, págs. 1–41, doi :10.1002/9781119951438.eibc0002.pub2, ISBN 9781119951438
- ^ Streitwieser Jr A, Mueller-Westerhoff U (1968-12-01). "Bis(ciclooctatetraenil)uranio (uranoceno). Una nueva clase de complejos sándwich que utilizan orbitales atómicos f". Journal of the American Chemical Society . 90 (26): 7364. doi :10.1021/ja01028a044.
- ^ Cotton, Simon. (2013). Química de los lantánidos y actínidos . John Wiley & Sons. ISBN 9781118681367.OCLC 897575995 .
- ^ Starks DF, Parsons TC, Streitwieser A, Edelstein N (junio de 1974). "Bis(.pi.-ciclooctatetraeno)protactinio". Química inorgánica . 13 (6): 1307–1308. doi :10.1021/ic50136a011.
- ^ Streitwieser A, Harmon CA (1973-05-01). "Uranocenos con sustituyentes de hidrocarburos". Química inorgánica . 12 (5): 1102–1104. doi :10.1021/ic50123a024.
- ^ ab Streitwieser A, Walker R (septiembre de 1975). "Bis-π-(1,3,5,7-tetrafenilciclooctatetraeno)uranio, un uranoceno estable al aire". Journal of Organometallic Chemistry . 97 (3): C41–C42. doi :10.1016/S0022-328X(00)89316-X.
- ^ Apostolidis C, Walter O, Vogt J, Liebing P, Maron L, Edelmann FT (abril de 2017). "Un complejo organometálico de plutonio (IV) caracterizado estructuralmente". Angewandte Chemie . 56 (18): 5066–5070. doi :10.1002/anie.201701858. PMC 5485009 . PMID 28371148.
- ^ Tassell MJ, Kaltsoyannis N (agosto de 2010). "Covalencia en AnCp4 (An = Th-Cm): una comparación de análisis de orbitales moleculares, población natural y átomos en moléculas". Dalton Transactions . 39 (29): 6719–25. doi :10.1039/c000704h. PMID 20631951.
- ^ Rausch J, Apostolidis C, Walter O, Lorenz V, Hrib CG, Hilfert L, Kühling M, Busse S, Edelmann FT (2015). "Un ligando para todos: complejos sándwich de lantánidos y actínidos que comprenden el ligando 1, 4-bis (trimetilsilil) ciclooctatetraenilo (= COT′′)". New Journal of Chemistry . 39 (10): 7656–66. doi : 10.1039/c5nj00991j .
- ^ ab Laubereau PG, Burns JH (mayo de 1970). "Preparación microquímica de compuestos triciclopentadienílicos de berkelio, californio y algunos elementos lantánidos". Química inorgánica . 9 (5): 1091–1095. doi :10.1021/ic50087a018.
- ^ Baumgärtner, F.; Fischer, EO; Kanellakopulos, B.; Laubereau, P. (7 de enero de 1966). "Tri-ciclopentadienil-americio (III)". Angewandte Chemie (en alemán). 78 (1): 112-113. doi : 10.1002/ange.19660780113.
- ^ Marks TJ (septiembre de 1982). "Química organometálica de actínidos". Science . 217 (4564): 989–97. Bibcode :1982Sci...217..989M. doi :10.1126/science.217.4564.989. PMID 17839316.
- ^ Apostolidis C, Dutkiewicz MS, Kovács A, Walter O (febrero de 2018). "Estructura en estado sólido de tris-ciclopentadienuro de uranio(III) y plutonio(III)". Química: una revista europea . 24 (12): 2841–2844. doi :10.1002/chem.201704845. PMC 5861669 . PMID 29193373.
- Marks, Tobin J. (1982). "Química organometálica de actínidos". Science . 217 (4564): 989–997. doi :10.1126/science.217.4564.989.
![{\displaystyle {\ce {Pa2O5 + SOCl2 ->[400C] PaCl5}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c49a38424502d636696eb5b77a0e618cf6990cab)


