Punto isoeléctrico
El punto isoeléctrico ( pI , pH(I) , IEP ), es el pH en el que una molécula no tiene carga eléctrica neta o es eléctricamente neutra en la media estadística . La nomenclatura estándar para representar el punto isoeléctrico es pH(I). [1] Sin embargo, también se utiliza pI. [2] Para abreviar , este artículo utiliza pI. La carga neta de la molécula se ve afectada por el pH de su entorno circundante y puede volverse más positiva o negativamente cargada debido a la ganancia o pérdida, respectivamente, de protones (H + ).
Las superficies se cargan naturalmente para formar una doble capa . En el caso común en que los iones que determinan la carga superficial son H + /HO − , la carga superficial neta se ve afectada por el pH del líquido en el que está sumergido el sólido.
El valor de pI puede afectar la solubilidad de una molécula a un pH determinado. Dichas moléculas tienen una solubilidad mínima en agua o soluciones salinas al pH que corresponde a su pI y a menudo precipitan fuera de la solución . Las moléculas anfóteras biológicas como las proteínas contienen grupos funcionales tanto ácidos como básicos . Los aminoácidos que forman las proteínas pueden ser de naturaleza positiva, negativa, neutra o polar, y juntos dan a una proteína su carga general. A un pH por debajo de su pI, las proteínas tienen una carga neta positiva; por encima de su pI tienen una carga neta negativa. Por lo tanto, las proteínas se pueden separar por carga neta en un gel de poliacrilamida utilizando PAGE nativo preparativo , que utiliza un pH constante para separar las proteínas, o enfoque isoeléctrico , que utiliza un gradiente de pH para separar las proteínas. El enfoque isoeléctrico también es el primer paso en la electroforesis en gel de poliacrilamida en gel 2-D .
En las biomoléculas, las proteínas se pueden separar mediante cromatografía de intercambio iónico . Las proteínas biológicas están formadas por compuestos de aminoácidos zwitteriónicos ; la carga neta de estas proteínas puede ser positiva o negativa según el pH del entorno. El pI específico de la proteína diana se puede utilizar para modelar el proceso y luego el compuesto se puede purificar del resto de la mezcla. Se pueden utilizar tampones de varios pH para este proceso de purificación para cambiar el pH del entorno. Cuando una mezcla que contiene una proteína diana se carga en un intercambiador de iones, la matriz estacionaria puede estar cargada positivamente (para aniones móviles) o negativamente (para cationes móviles). A valores de pH bajos, la carga neta de la mayoría de las proteínas en la mezcla es positiva: en los intercambiadores de cationes, estas proteínas cargadas positivamente se unen a la matriz cargada negativamente. A valores de pH altos, la carga neta de la mayoría de las proteínas es negativa, donde se unen a la matriz cargada positivamente en los intercambiadores de aniones. Cuando el entorno está en un valor de pH igual al pI de la proteína, la carga neta es cero y la proteína no está unida a ningún intercambiador y, por lo tanto, puede eluirse. [3]
Cálculo de valores de pI
Para un aminoácido con solo una amina y un grupo carboxilo , el pI se puede calcular a partir de la media del pKas de esta molécula. [4]
El pH de un gel electroforético está determinado por el tampón utilizado para ese gel. Si el pH del tampón es superior al pI de la proteína que se está analizando, la proteína migrará al polo positivo (la carga negativa es atraída por un polo positivo). Si el pH del tampón es inferior al pI de la proteína que se está analizando, la proteína migrará al polo negativo del gel (la carga positiva es atraída por el polo negativo). Si la proteína se analiza con un pH del tampón que es igual al pI, no migrará en absoluto. Esto también es cierto para los aminoácidos individuales.
Ejemplos
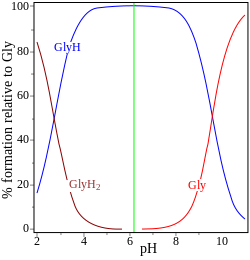 | 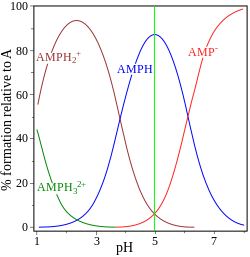 |
| pK de glicina = 2,72, 9,60 | monofosfato de adenosina pK = 0,9, 3,8, 6,1 |
En los dos ejemplos (a la derecha) el punto isoeléctrico se muestra mediante la línea vertical verde. En la glicina , los valores de pK están separados por casi 7 unidades. Por lo tanto, en la fase gaseosa, la concentración de la especie neutra, glicina (GlyH), es efectivamente el 100% de la concentración analítica de glicina. [5] La glicina puede existir como un zwitterión en el punto isoeléctrico, pero la constante de equilibrio para la reacción de isomerización en solución
No se sabe.
El otro ejemplo, el monofosfato de adenosina, se muestra para ilustrar el hecho de que, en principio, puede estar implicada una tercera especie. De hecho, la concentración de (AMP)H2+3En este caso, es despreciable en el punto isoeléctrico. Si el pI es mayor que el pH, la molécula tendrá carga positiva.
Péptidos y proteínas
Se han desarrollado varios algoritmos para estimar los puntos isoeléctricos de péptidos y proteínas . La mayoría de ellos utilizan la ecuación de Henderson-Hasselbalch con diferentes valores de pKa. Por ejemplo, dentro del modelo propuesto por Bjellqvist y colaboradores, los pKa se determinaron entre inmovilinas estrechamente relacionadas enfocando la misma muestra en gradientes de pH superpuestos. [6] También se han propuesto algunas mejoras en la metodología (especialmente en la determinación de los valores de pKa para aminoácidos modificados). [7] [8] Los métodos más avanzados tienen en cuenta el efecto de los aminoácidos adyacentes a ±3 residuos de un ácido aspártico o glutámico cargado , los efectos en el extremo C libre, así como la aplicación de un término de corrección a los valores de pKa correspondientes utilizando un algoritmo genético . [9] Otros enfoques recientes se basan en un algoritmo de máquina de vectores de soporte [10] y la optimización de pKa contra puntos isoeléctricos de proteína/péptido conocidos experimentalmente. [11]
Además, los puntos isoeléctricos de las proteínas medidos experimentalmente se agregaron a las bases de datos. [12] [13] Recientemente, también se desarrolló una base de datos de puntos isoeléctricos para todas las proteínas predichas utilizando la mayoría de los métodos disponibles. [14]
En la práctica, una proteína con un exceso de aminoácidos básicos (arginina, lisina y/o histidina) tendrá un punto isoeléctrico aproximadamente mayor que 7 (básico), mientras que una proteína con un exceso de aminoácidos ácidos (ácido aspártico y/o ácido glutámico) a menudo tendrá un punto isoeléctrico menor que 7 (ácido). La separación electroforética lineal (horizontal) de proteínas por Ip a lo largo de un gradiente de pH en un gel de poliacrilamida (también conocido como isoelectroenfoque ), seguido de una separación lineal (vertical) de peso molecular estándar en un segundo gel de poliacrilamida ( SDS-PAGE ), constituye la llamada electroforesis en gel bidimensional o PAGE 2D. Esta técnica permite una separación completa de proteínas como "puntos" distintos, con proteínas de alto peso molecular y bajo Ip migrando a la parte superior izquierda del gel bidimensional, mientras que las proteínas con bajo peso molecular y alto Ip se ubican en la región inferior derecha del mismo gel.
Materiales cerámicos
Los puntos isoeléctricos (IEP) de las cerámicas de óxido metálico se utilizan ampliamente en la ciencia de los materiales en varios pasos de procesamiento acuoso (síntesis, modificación, etc.). En ausencia de especies quimisorbidas o fisisorbidas, las superficies de las partículas en suspensión acuosa generalmente se supone que están cubiertas con especies de hidroxilo superficiales, M-OH (donde M es un metal como Al, Si, etc.). [15] A valores de pH superiores al IEP, la especie superficial predominante es MO − , mientras que a valores de pH inferiores al IEP, predominan las especies M-OH 2 + . A continuación se enumeran algunos valores aproximados de cerámicas comunes: [16] [17]
| Material | PEI |
|---|---|
| Documento WO 3 [18] | 0,2–0,5 |
| Sb2O5 [ 18 ] | <0,4–1,9 |
| V2O5 [18 ] [ 19 ] | 1–2 (3) |
| delta- MnO2 | 1.5 |
| SiO2 [18 ] | 1,7–3,5 |
| SiC [20] | 2–3,5 |
| Ta2O5 [ 18 ] | 2,7–3,0 |
| TiO2 [21 ] | 2.8–3.8 |
| γ - Fe2O3 [ 18 ] | 3.3–6.7 |
| SnO2 [22 ] | 4–5,5 (7,3) |
| ZrO2 [18 ] | 4–11 |
| OIT [23] | 6 |
| Cr2O3 [18 ] [ 19 ] | 6.2–8.1 (7) |
| Fe3O4 [ 18 ] | 6,5–6,8 |
| CeO2 [18 ] | 6.7–8.6 |
| Y2O3 [ 18 ] | 7,15–8,95 |
| γ - Al2O3 | 7–8 |
| β-MnO2 [ 19] | 7.3 |
| Ti2O [ 24 ] | 8 |
| α - Al2O3 | 8–9 |
| α- Fe2O3 [ 18 ] | 8.4–8.5 |
| óxido de zinc [18] | 8.7–10.3 |
| Si3N4 [ 22 ] | 9 |
| CuO [22] | 9.5 |
| La 2 O 3 | 10 |
| NiO [22] | 10–11 |
| PbO [18] | 10.7–11.6 |
| MgO [18] | 12–13 (9,8·12,7) |
Nota: La siguiente lista muestra el punto isoeléctrico a 25 °C de determinados materiales en agua. El valor exacto puede variar ampliamente, dependiendo de factores del material, como la pureza y la fase, así como de parámetros físicos, como la temperatura. Además, la medición precisa de los puntos isoeléctricos puede resultar difícil, por lo que muchas fuentes suelen citar valores diferentes para los puntos isoeléctricos de estos materiales.
Los óxidos mixtos pueden exhibir valores de punto isoeléctrico que son intermedios a los de los óxidos puros correspondientes. Por ejemplo, un aluminosilicato amorfo preparado sintéticamente (Al2O3-SiO2 ) se midió inicialmente con un IEP de 4,5 (el comportamiento electrocinético de la superficie estaba dominado por especies Si-OH superficiales, lo que explica el valor de IEP relativamente bajo). [ 25 ] Otros han informado valores de IEP significativamente más altos (pH 6 a 8) para 3Al2O3-2SiO2 . [22] De manera similar, también se informó un IEP de titanato de bario , BaTiO3 , en el rango de 5-6 [22] mientras que otros obtuvieron un valor de 3. [ 26] Se estudiaron mezclas de titania (TiO2 ) y zirconia (ZrO2 ) y se encontró que tenían un punto isoeléctrico entre 5,3 y 6,9, que variaba de forma no lineal con %(ZrO2 ) . [27] La carga superficial de los óxidos mixtos se correlacionó con la acidez. Un mayor contenido de titania condujo a una mayor acidez de Lewis, mientras que los óxidos ricos en zirconia mostraron una acidez de Br::onsted. Los diferentes tipos de acidez produjeron diferencias en las tasas y capacidades de adsorción de iones.
Punto de carga cero versus
Los términos punto isoeléctrico (IEP) y punto de carga cero (PZC) a menudo se usan indistintamente, aunque en determinadas circunstancias puede ser productivo hacer la distinción.
En sistemas en los que H + /OH − son los iones determinantes del potencial de interfaz, el punto de carga cero se da en términos de pH. El pH en el que la superficie exhibe una carga eléctrica neta neutra es el punto de carga cero en la superficie. Los fenómenos electrocinéticos generalmente miden el potencial zeta , y un potencial zeta cero se interpreta como el punto de carga neta cero en el plano de corte . Esto se denomina punto isoeléctrico. [28] Por lo tanto, el punto isoeléctrico es el valor de pH en el que la partícula coloidal permanece estacionaria en un campo eléctrico. Se espera que el punto isoeléctrico sea algo diferente del punto de carga cero en la superficie de la partícula, pero esta diferencia a menudo se ignora en la práctica para las llamadas superficies prístinas, es decir, superficies sin cargas positivas o negativas específicamente adsorbidas . [15] En este contexto, la adsorción específica se entiende como la adsorción que ocurre en una capa de Stern o quimisorción . Por tanto, el punto de carga cero en la superficie se toma como igual al punto isoeléctrico en ausencia de adsorción específica en esa superficie.
Según Jolivet, [19] en ausencia de cargas positivas o negativas, la superficie se describe mejor por el punto de carga cero. Si las cargas positivas y negativas están presentes en cantidades iguales, entonces este es el punto isoeléctrico. Por lo tanto, el PZC se refiere a la ausencia de cualquier tipo de carga superficial, mientras que el IEP se refiere a un estado de carga superficial neta neutra. La diferencia entre los dos, por lo tanto, es la cantidad de sitios cargados en el punto de carga neta cero. Jolivet utiliza las constantes intrínsecas de equilibrio superficial, p K − y p K + para definir las dos condiciones en términos del número relativo de sitios cargados:
Para valores elevados de Δp K (>4 según Jolivet), la especie predominante es MOH, mientras que hay relativamente pocas especies cargadas, por lo que el PZC es relevante. Para valores pequeños de Δp K , hay muchas especies cargadas en cantidades aproximadamente iguales, por lo que se habla de IEP.
Véase también
- Deposición electroforética
- Ecuación de Henderson-Hasselbalch
- Enfoque isoeléctrico
- Punto isoiónico
- constante de disociación ácida pK
- PÁGINA nativa preparatoria
- Potencial zeta
Referencias
- ^ Las variantes aceptables de pH(I) incluirían pH I , pH IEP , etc .; el punto principal es que no se puede tomar la "potencia" de I, sino que se mide el pH sujeto a una condición determinada.
- ^ IUPAC , Compendio de terminología química , 2.ª ed. (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "Punto isoeléctrico en electroforesis". doi :10.1351/goldbook.I03275
- ^ Dayton, WR (1983). "Técnicas de separación de proteínas" (PDF) . Actas de la Conferencia Reciprocal Meat . 36 : 98–102.
- ^ Para la derivación de esta expresión, véase la constante de disociación ácida.
- ^ Jensen, Jan H.; Gordon, Mark S. (agosto de 1995). "Sobre el número de moléculas de agua necesarias para estabilizar el zwitterión de glicina". Journal of the American Chemical Society . 117 (31): 8159–8170. doi :10.1021/ja00136a013. ISSN 0002-7863.
- ^ Bjellqvist, B.; Hughes, GJ; Pasquali, C.; Paquet, N.; Ravier, F.; Sanchez, JC; Frutiger, S.; Hochstrasser, D. (1993-10-01). "Las posiciones de enfoque de los polipéptidos en gradientes de pH inmovilizados se pueden predecir a partir de sus secuencias de aminoácidos". Electroforesis . 14 (10): 1023–1031. doi :10.1002/elps.11501401163. ISSN 0173-0835. PMID 8125050. S2CID 38041111.
- ^ Gauci, Sharon; van Breukelen, Bas; Lemeer, Simone M.; Krijgsveld, Jeroen; Heck, Albert JR (1 de diciembre de 2008). "Una calculadora versátil de pI de péptidos para péptidos acetilados fosforilados y N-terminales probados experimentalmente utilizando enfoque isoeléctrico de péptidos". Proteómica . 8 (23–24): 4898–4906. doi :10.1002/pmic.200800295. ISSN 1615-9861. PMID 19003858. S2CID 21527631.
- ^ Gasteiger, Elisabeth; Gattiker, Alexandre; Hoogland, Christine; Ivanyi, Ivan; Appel, Ron D.; Bairoch, Amos (1 de julio de 2003). "ExPASy: el servidor de proteómica para el conocimiento y análisis de proteínas en profundidad". Nucleic Acids Research . 31 (13): 3784–3788. doi :10.1093/nar/gkg563. ISSN 0305-1048. PMC 168970 . PMID 12824418.
- ^ Cargile, Benjamin J.; Sevinsky, Joel R.; Essader, Amal S.; Eu, Jerry P.; Stephenson, James L. (1 de julio de 2008). "Cálculo del punto isoeléctrico de péptidos tripsídicos en el rango de pH 3,5-4,5 basado en efectos de aminoácidos adyacentes". Electroforesis . 29 (13): 2768–2778. doi : 10.1002/elps.200700701 . ISSN 0173-0835. PMID 18615785.
- ^ Perez-Riverol, Yasset; Audain, Enrique; Millan, Aleli; Ramos, Yassel; Sanchez, Aniel; Vizcaíno, Juan Antonio; Wang, Rui; Müller, Markus; Machado, Yoan J. (2012-04-03). "Optimización del punto isoeléctrico usando descriptores de péptidos y máquinas de vectores de soporte". Journal of Proteomics . 75 (7): 2269–2274. doi :10.1016/j.jprot.2012.01.029. ISSN 1876-7737. PMID 22326964.
- ^ Kozlowski, LP. (2016). "IPC - Calculadora del punto isoeléctrico". Biol Direct . 11 (1): 55. doi : 10.1186/s13062-016-0159-9 . PMC 5075173 . PMID 27769290.
- ^ Hoogland, C.; Mostaguir, K.; Sanchez, JC.; Hochstrasser, DF.; Appel, RD. (2004). "SWISS-2DPAGE, diez años después". Proteómica . 4 (8): 2352–6. doi :10.1002/pmic.200300830. PMID 15274128. S2CID 31933242.
- ^ Bunkute, E.; Cummins, C.; Crofts, F.J.; Bunce, G.; Nabney, IT.; Flower, DR. (2015). "PIP-DB: la base de datos del punto isoeléctrico de proteínas". Bioinformática . 31 (2): 295–6. doi : 10.1093/bioinformatics/btu637 . PMID 25252779.
- ^ Kozlowski, LP. (2016). "Proteome-pI: base de datos de puntos isoeléctricos del proteoma". Nucleic Acids Res . 45 (D1): D1112–D1116. doi :10.1093/nar/gkw978. PMC 5210655 . PMID 27789699.
- ^ ab Hanaor, DAH; Michelazzi, M.; Leonelli, C.; Sorrell, CC (2012). "Los efectos de los ácidos carboxílicos en la dispersión acuosa y la deposición electroforética de ZrO 2 ". Revista de la Sociedad Cerámica Europea . 32 (1): 235–244. arXiv : 1303.2754 . doi :10.1016/j.jeurceramsoc.2011.08.015. S2CID 98812224.
- ^ Haruta, M (2004). "Catalizadores de oro nanoparticulados para oxidación de CO a baja temperatura". Revista de nuevos materiales para sistemas electroquímicos . 7 : 163–172.
- ^ Brunelle JP (1978). 'Preparación de catalizadores mediante adsorción de complejos metálicos sobre óxidos minerales'. Química pura y aplicada, vol. 50, págs. 1211-1229.
- ^ abcdefghijklmno Marek Kosmulski, "Propiedades químicas de las superficies de los materiales", Marcel Dekker, 2001.
- ^ abcd Jolivet JP, Química y síntesis de óxidos metálicos. De la solución al estado sólido , John Wiley & Sons Ltd. 2000, ISBN 0-471-97056-5 (traducción al inglés del texto original en francés, De la Solution à l'Oxyde , InterEditions et CNRS Editions, París, 1994).
- ^ Patente de EE. UU. 5.165.996
- ^ Deposición electroforética acuosa anódica de dióxido de titanio utilizando ácidos carboxílicos como agentes dispersantes Journal of the European Ceramic Society, 31(6), 1041-1047, 2011
- ^ abcdef Lewis, JA (2000). "Procesamiento coloidal de cerámica". Revista de la Sociedad Americana de Cerámica . 83 (10): 2341–2359. CiteSeerX 10.1.1.514.1543 . doi :10.1111/j.1151-2916.2000.tb01560.x. S2CID 9513223.
- ^ Daido, T; Akaike, T (1993). "Electroquímica del citocromo c: influencia de la atracción coulombiana con el electrodo de óxido de indio y estaño". Journal of Electroanalytical Chemistry . 344 (1–2): 91–106. doi :10.1016/0022-0728(93)80048-m.
- ^ Kosmulski, M; Saneluta, C (2004). "Punto de carga cero/punto isoeléctrico de óxidos exóticos: Tl2O3". Journal of Colloid and Interface Science . 280 (2): 544–545. Bibcode :2004JCIS..280..544K. doi :10.1016/j.jcis.2004.08.079. PMID 15533430.
- ^ Jara, AA; Goldberg, S.; Mora, ML (2005). "Estudios de la carga superficial de aluminosilicatos amorfos utilizando modelos de complexación superficial". Journal of Colloid and Interface Science . 292 (1): 160–170. Bibcode :2005JCIS..292..160J. doi :10.1016/j.jcis.2005.05.083. hdl : 10533/176403 . PMID 16051258.
- ^ Vamvakaki, Maria; Billingham, Norman C.; Armes, Steven P.; Watts, John F.; Greaves, Stephen J. (2001). "Copolímeros de estructura controlada para la dispersión de cerámicas de alto rendimiento en medios acuosos". Journal of Materials Chemistry . 11 (10): 2437–2444. doi :10.1039/b101728o. ISSN 0959-9428.
- ^ Drisko, Glenna L; Luca, Vittorio; Sizgek, Erden; Scales, Nicolas F.; Caruso, Rachel A. (2009). "Síntesis de plantillas y propiedades de adsorción de óxidos de titanio y circonio porosos jerárquicamente". Langmuir . 25 (9): 5286–5293. doi :10.1021/la804030h. ISSN 0743-7463. PMID 19397363.
- ^ AW Adamson, AP Gast, "Química física de superficies", John Wiley and Sons, 1997.
Lectura adicional
- Nelson DL, Cox MM (2004). Principios de bioquímica de Lehninger . WH Freeman; 4.ª edición (tapa dura). ISBN 0-7167-4339-6
- Kosmulski M. (2009). Carga superficial y puntos de carga cero . CRC Press; 1.ª edición (tapa dura). ISBN 978-1-4200-5188-9
Enlaces externos
- IPC – Calculadora de punto isoeléctrico: calcule el punto isoeléctrico de una proteína utilizando más de 15 métodos
- prot pi – punto isoeléctrico de la proteína: un programa en línea para calcular el pI de las proteínas (incluye múltiples subunidades y modificaciones postraduccionales)
- CurTiPot: un conjunto de hojas de cálculo para calcular equilibrios ácido-base (gráfico de carga versus pH de moléculas anfóteras, por ejemplo, aminoácidos)
- pICalculax: predictor del punto isoeléctrico (pI) para péptidos y proteínas modificados químicamente
- SWISS-2DPAGE Archivado el 10 de diciembre de 2016 en Wayback Machine : una base de datos de puntos isoeléctricos provenientes de electroforesis en gel de poliacrilamida bidimensional (aproximadamente 2000 proteínas)
- PIP-DB: una base de datos de puntos isoeléctricos de proteínas (aproximadamente 5000 proteínas)
- Proteome-pI: una base de datos de puntos isoeléctricos del proteoma (punto isoeléctrico previsto para todas las proteínas)


![{\displaystyle \mathrm {p} K^{-}-\mathrm {p} K^{+}=\Delta \mathrm {p} K=\log {\frac {\left[\mathrm {MOH} \right ]^{2}}{\left[\mathrm {MOH} {_{2}^{+}}\right]\left[\mathrm {MO} ^{-}\right]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1e3191d7ab56090ff3c419b53868c6c52134d80a)