Protón
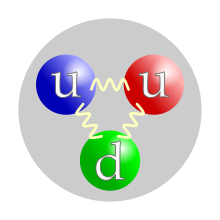 Contenido de quarks de valencia de un protón. La asignación de color a cada quark es arbitraria, pero deben estar presentes los tres colores. Las fuerzas entre quarks están mediadas por gluones . | |
| Clasificación | Barión |
|---|---|
| Composición | 2 quarks up (u), 1 quark down (d) |
| Estadística | Fermiónico |
| Familia | Hadrón |
| Interacciones | Gravedad , electromagnético , débil , fuerte. |
| Símbolo | pag , pag+ , norte+ ,1 1yo+ |
| Antipartícula | Antiprotón |
| Teorizado | William Prout (1815) |
| Descubierto | Eugen Goldstein (1886) lo observó como H + y Ernest Rutherford (1917-1920) lo identificó en otros núcleos y le dio nombre . |
| Masa | 1.672 621 925 95 (52) × 10 −27 kg [ 1] 1.007 276 466 5789 (83) Día [ 2] 938,272 089 43 (29) MeV/ c 2 [3] |
| Vida media | >3,6 × 10 29 años [4] (estable) |
| Carga eléctrica | +1 mi |
| Radio de carga | 0,8414(19) fm [5] |
| Momento dipolar eléctrico | <2,1 × 10 −25 e⋅cm [6 ] |
| Polarizabilidad eléctrica | 0,001 12 (4) de 3 |
| Momento magnético | 1.410 606 795 45 (60) × 10 −26 J⋅T −1 [ 7] 0,001 521 032 202 30 (45) µB [ 8] 2,792 847 344 63 (82) µN [ 9] |
| Polarizabilidad magnética | 1,9 (5) × 10 −4 fm3 |
| Girar | 1/2 ħ |
| Isospín | 1/2 |
| Paridad | +1 |
| Condensado | Yo ( J P ) = 1/2 ( 1/2 + ) |
Un protón es una partícula subatómica estable , símbolo
pag
, H + , o 1 H + con una carga eléctrica positiva de +1 e ( carga elemental ). Su masa es ligeramente menor que la masa de un neutrón y aproximadamente1836 veces la masa de un electrón (la relación de masas entre protones y electrones ). Los protones y neutrones, cada uno con una masa de aproximadamente una unidad de masa atómica , se denominan conjuntamente nucleones (partículas presentes en los núcleos atómicos).
En el núcleo de cada átomo hay uno o más protones , que proporcionan la fuerza central electrostática atractiva que une a los electrones atómicos. El número de protones en el núcleo es la propiedad que define a un elemento y se denomina número atómico (representado por el símbolo Z ). Como cada elemento se identifica por el número de protones en su núcleo, cada elemento tiene su propio número atómico, que determina el número de electrones atómicos y, en consecuencia, las características químicas del elemento.
La palabra protón es griega para "primero", y el nombre fue dado al núcleo de hidrógeno por Ernest Rutherford en 1920. En años anteriores, Rutherford había descubierto que el núcleo de hidrógeno (conocido por ser el núcleo más ligero) podía extraerse de los núcleos de nitrógeno mediante colisiones atómicas. [10] Por lo tanto, los protones eran candidatos a ser una partícula fundamental o elemental y, por lo tanto, un componente básico del nitrógeno y todos los demás núcleos atómicos más pesados.
Aunque originalmente se consideraba que los protones eran partículas elementales, en el Modelo Estándar moderno de física de partículas , se sabe que los protones son partículas compuestas, que contienen tres quarks de valencia , y junto con los neutrones ahora se clasifican como hadrones . Los protones están compuestos por dos quarks up de carga +2/3 e cada uno, y un quark abajo de carga − 1/3 e . Las masas en reposo de los quarks contribuyen solo con alrededor del 1% de la masa de un protón. [11] El resto de la masa de un protón se debe a la energía de enlace de la cromodinámica cuántica , que incluye la energía cinética de los quarks y la energía de los campos de gluones que unen a los quarks. El radio de carga cuadrática media de un protón es de aproximadamente 0,84–0,87 fm (1 fm =10 −15 m ). [12] [13] En 2019, dos estudios diferentes, utilizando técnicas diferentes, encontraron que este radio era 0,833 fm, con una incertidumbre de ±0,010 fm. [14] [15]
Los protones libres se producen ocasionalmente en la Tierra: las tormentas eléctricas pueden producir protones con energías de hasta varias decenas de MeV . [16] [17] A temperaturas y energías cinéticas suficientemente bajas, los protones libres se unirán a los electrones . Sin embargo, el carácter de dichos protones unidos no cambia, y siguen siendo protones. Un protón rápido que se mueve a través de la materia se ralentizará por las interacciones con los electrones y los núcleos, hasta que sea capturado por la nube de electrones de un átomo. El resultado es un ion diatómico o poliatómico que contiene hidrógeno. En el vacío, cuando hay electrones libres, un protón suficientemente lento puede recoger un solo electrón libre, convirtiéndose en un átomo de hidrógeno neutro , que es químicamente un radical libre . Estos "átomos de hidrógeno libre" tienden a reaccionar químicamente con muchos otros tipos de átomos a energías suficientemente bajas. Cuando los átomos de hidrógeno libre reaccionan entre sí, forman moléculas de hidrógeno neutro (H 2 ), que son el componente molecular más común de las nubes moleculares en el espacio interestelar . [18]
Los protones libres se utilizan rutinariamente en aceleradores para la terapia de protones o en diversos experimentos de física de partículas, siendo el ejemplo más poderoso el Gran Colisionador de Hadrones .
Descripción
| Física nuclear |
|---|
 |
Los protones son espín-1/2 fermiones y están compuestos por tres quarks de valencia, [19] lo que los convierte en bariones (un subtipo de hadrones ). Los dos quarks up y un quark down de un protón se mantienen unidos por la fuerza fuerte , mediada por gluones . [20] : 21–22 Una perspectiva moderna tiene un protón compuesto por los quarks de valencia (up, up, down), los gluones y pares transitorios de quarks sea . Los protones tienen una distribución de carga positiva, que se desintegra aproximadamente exponencialmente, con un radio de carga cuadrático mediode aproximadamente 0,8 fm. [21]
Los protones y los neutrones son nucleones , que pueden unirse mediante la fuerza nuclear para formar núcleos atómicos . El núcleo del isótopo más común del átomo de hidrógeno (con el símbolo químico "H") es un protón solitario. Los núcleos de los isótopos pesados del hidrógeno, el deuterio y el tritio, contienen un protón unido a uno y dos neutrones, respectivamente. Todos los demás tipos de núcleos atómicos están compuestos por dos o más protones y varias cantidades de neutrones.
Historia
El concepto de una partícula similar al hidrógeno como constituyente de otros átomos se desarrolló durante un largo período. Ya en 1815, William Prout propuso que todos los átomos están compuestos de átomos de hidrógeno (a los que llamó "prótilos"), basándose en una interpretación simplista de los primeros valores de los pesos atómicos (véase la hipótesis de Prout ), que fue refutada cuando se midieron valores más precisos. [22] : 39–42


En 1886, Eugen Goldstein descubrió los rayos canal (también conocidos como rayos anódicos) y demostró que eran partículas con carga positiva (iones) producidas a partir de gases. Sin embargo, dado que las partículas de diferentes gases tenían diferentes valores de relación carga-masa ( q / m ), no podían identificarse con una sola partícula, a diferencia de los electrones negativos descubiertos por J. J. Thomson . Wilhelm Wien en 1898 identificó al ion hidrógeno como la partícula con la mayor relación carga-masa en los gases ionizados. [23]
Tras el descubrimiento del núcleo atómico por Ernest Rutherford en 1911, Antonius van den Broek propuso que el lugar de cada elemento en la tabla periódica (su número atómico) es igual a su carga nuclear. Esto fue confirmado experimentalmente por Henry Moseley en 1913 utilizando espectros de rayos X (más detalles en Número atómico en el experimento de Moseley de 1913).
En 1917, Rutherford realizó experimentos (publicados en 1919 y 1925) que demostraron que el núcleo de hidrógeno está presente en otros núcleos, un resultado generalmente descrito como el descubrimiento de los protones. [24] Estos experimentos comenzaron después de que Rutherford observara que cuando las partículas alfa chocaban con el aire, Rutherford podía detectar centelleo en una pantalla de sulfuro de zinc producido a una distancia mucho más allá de la distancia del rango de viaje de las partículas alfa, pero que en cambio correspondía al rango de viaje de los átomos de hidrógeno (protones). [25] Después de la experimentación, Rutherford rastreó la reacción hasta el nitrógeno en el aire y descubrió que cuando las partículas alfa se introducían en gas nitrógeno puro, el efecto era mayor. En 1919, Rutherford asumió que la partícula alfa simplemente expulsaba un protón del nitrógeno, convirtiéndolo en carbono. Después de observar las imágenes de la cámara de niebla de Blackett en 1925, Rutherford se dio cuenta de que la partícula alfa era absorbida. Si la partícula alfa no fuera absorbida, entonces arrancaría un protón del nitrógeno creando 3 partículas cargadas (un carbono cargado negativamente, un protón y una partícula alfa). Se puede demostrar [26] que las 3 partículas cargadas crearían tres pistas en la cámara de nubes, pero en cambio solo se observaron 2 pistas en la cámara de nubes. La partícula alfa es absorbida por el átomo de nitrógeno. Después de la captura de la partícula alfa, se expulsa un núcleo de hidrógeno, creando un resultado neto de 2 partículas cargadas (un protón y un oxígeno cargado positivamente) que forman 2 pistas en la cámara de nubes. El oxígeno pesado ( 17 O), no carbono o flúor, es el producto. Esta fue la primera reacción nuclear reportada , 14 N + α → 17 O + p . Rutherford al principio pensó en nuestra "p" moderna en esta ecuación como un ion de hidrógeno, H + .
Dependiendo de la perspectiva de cada uno, se puede considerar que el momento en que se "descubrió" el protón fue 1919 (cuando se consideró experimentalmente que provenía de una fuente distinta del hidrógeno) o 1920 (cuando se lo reconoció y propuso como partícula elemental).
Rutherford sabía que el hidrógeno era el elemento más simple y ligero y estaba influenciado por la hipótesis de Prout de que el hidrógeno era el bloque de construcción de todos los elementos. El descubrimiento de que el núcleo de hidrógeno está presente en otros núcleos como una partícula elemental llevó a Rutherford a darle al núcleo de hidrógeno H + un nombre especial como partícula, ya que sospechaba que el hidrógeno, el elemento más ligero, contenía solo una de estas partículas. Llamó a este nuevo bloque de construcción fundamental del núcleo protón , en honor al singular neutro de la palabra griega para "primero", πρῶτον . Sin embargo, Rutherford también tenía en mente la palabra protilo tal como la usaba Prout. Rutherford habló en la Asociación Británica para el Avance de la Ciencia en su reunión de Cardiff que comenzó el 24 de agosto de 1920. [27] En la reunión, Oliver Lodge le pidió un nuevo nombre para el núcleo de hidrógeno positivo para evitar confusiones con el átomo de hidrógeno neutro. Inicialmente sugirió tanto protón como proutón (en honor a Prout). [28] Rutherford informó más tarde que la reunión había aceptado su sugerencia de que el núcleo de hidrógeno se llamara «protón», siguiendo la palabra «protilo» de Prout. [29] El primer uso de la palabra «protón» en la literatura científica apareció en 1920. [30] [31]
Aparición
En el núcleo de cada átomo hay uno o más protones ligados. Los protones libres se encuentran de forma natural en diversas situaciones en las que las energías o temperaturas son lo suficientemente altas como para separarlos de los electrones, por los que tienen cierta afinidad. Los protones libres existen en plasmas en los que las temperaturas son demasiado altas para permitirles combinarse con los electrones . [32] Los protones libres de alta energía y velocidad constituyen el 90% de los rayos cósmicos , que se propagan a través del medio interestelar . [33] Los protones libres se emiten directamente desde los núcleos atómicos en algunos tipos raros de desintegración radiactiva . [34] Los protones también resultan (junto con los electrones y los antineutrinos ) de la desintegración radiactiva de los neutrones libres , que son inestables. [35]
Estabilidad
Nunca se ha observado la desintegración espontánea de protones libres, por lo que se considera que los protones son partículas estables según el Modelo Estándar. Sin embargo, algunas teorías de gran unificación (GUT) de la física de partículas predicen que la desintegración de protones debería tener lugar con tiempos de vida de entre 10 31 y 10 36 años. Las investigaciones experimentales han establecido límites inferiores para la vida media de un protón para varios productos de desintegración supuestos. [36] [37] [38]
Los experimentos en el detector Super-Kamiokande en Japón dieron límites inferiores para la vida media del protón .6,6 × 10 33 años para la desintegración en un antimuón y un pión neutro , y8,2 × 10 33 años para la desintegración en un positrón y un pión neutro. [39] Otro experimento en el Observatorio de Neutrinos de Sudbury en Canadá buscó rayos gamma resultantes de núcleos residuales resultantes de la desintegración de un protón a partir de oxígeno-16. Este experimento fue diseñado para detectar la desintegración en cualquier producto y estableció un límite inferior para la vida útil del protón de2,1 × 10 29 años . [40]
Sin embargo, se sabe que los protones se transforman en neutrones mediante el proceso de captura de electrones (también llamado desintegración beta inversa ). En el caso de los protones libres, este proceso no se produce de forma espontánea, sino solo cuando se les suministra energía. La ecuación es:
El proceso es reversible; los neutrones pueden volver a convertirse en protones mediante la desintegración beta , una forma común de desintegración radiactiva . De hecho, un neutrón libre se desintegra de esta manera, con una vida media de unos 15 minutos. Un protón también puede transformarse en un neutrón mediante la desintegración beta plus (desintegración β+).
Según la teoría cuántica de campos , la vida media propia de los protones se vuelve finita cuando aceleran con una aceleración propia y disminuye al aumentar . La aceleración da lugar a una probabilidad que no se desvanece para la transición
pag+
→
norte
+
mi+
+
no
miEste fue un tema de preocupación a finales de los años 1990 porque es un escalar que puede ser medido por los observadores inerciales y coacelerados . En el marco inercial , el protón acelerado debería decaer según la fórmula anterior. Sin embargo, según el observador coacelerado, el protón está en reposo y, por lo tanto, no debería decaer. Este rompecabezas se resuelve al darse cuenta de que en el marco coacelerado hay un baño térmico debido al efecto Fulling-Davies-Unruh , un efecto intrínseco de la teoría cuántica de campos. En este baño térmico, experimentado por el protón, hay electrones y antineutrinos con los que el protón puede interactuar según los procesos:
pag+
+
mi−
→
norte
+
no
,
pag+
+
no
→
norte
+
mi+
y
pag+
+
mi−
+
no
→
norte
.
Sumando las contribuciones de cada uno de estos procesos, se debería obtener . [41] [42] [43] [44]
Los quarks y la masa de un protón
En cromodinámica cuántica , la teoría moderna de la fuerza nuclear, la mayor parte de la masa de protones y neutrones se explica por la relatividad especial . La masa de un protón es aproximadamente 80-100 veces mayor que la suma de las masas en reposo de sus tres quarks de valencia , mientras que los gluones tienen masa en reposo cero. La energía adicional de los quarks y gluones en un protón, en comparación con la energía en reposo de los quarks solos en el vacío de QCD , representa casi el 99% de la masa del protón. La masa en reposo de un protón es, por lo tanto, la masa invariante del sistema de quarks y gluones en movimiento que componen la partícula y, en tales sistemas, incluso la energía de partículas sin masa confinadas en un sistema todavía se mide como parte de la masa en reposo del sistema.
Se utilizan dos términos para referirse a la masa de los quarks que forman los protones: la masa actual del quark se refiere a la masa de un quark por sí mismo, mientras que la masa del quark constituyente se refiere a la masa actual del quark más la masa del campo de partículas de gluones que rodea al quark. [45] : 285–286 [46] : 150–151 Estas masas suelen tener valores muy diferentes. La energía cinética de los quarks que es una consecuencia del confinamiento es una contribución (véase Masa en relatividad especial ). Utilizando cálculos de QCD en red , las contribuciones a la masa del protón son el condensado de quarks (~9%, que comprende los quarks up y down y un mar de quarks extraños virtuales), la energía cinética del quark (~32%), la energía cinética del gluón (~37%) y la contribución gluónica anómala (~23%, que comprende las contribuciones de los condensados de todos los sabores de quarks). [47]
La función de onda del modelo de quark constituyente para el protón es
La dinámica interna de los protones es complicada, porque está determinada por el intercambio de gluones de los quarks y la interacción con varios condensados de vacío. La QCD en red proporciona una forma de calcular la masa de un protón directamente a partir de la teoría con cualquier precisión, en principio. Los cálculos más recientes [48] [49] afirman que la masa se determina con una precisión mejor que el 4%, incluso con una precisión del 1% (ver Figura S5 en Dürr et al. [49] ). Estas afirmaciones aún son controvertidas, porque los cálculos aún no se pueden hacer con quarks tan ligeros como lo son en el mundo real. Esto significa que las predicciones se encuentran mediante un proceso de extrapolación , que puede introducir errores sistemáticos. [50] Es difícil decir si estos errores se controlan adecuadamente, porque las cantidades que se comparan con el experimento son las masas de los hadrones , que se conocen de antemano.
Estos cálculos recientes son realizados por supercomputadoras masivas y, como señalan Boffi y Pasquini: "aún falta una descripción detallada de la estructura del nucleón porque... el comportamiento a larga distancia requiere un tratamiento no perturbativo y/o numérico..." [51] Otros enfoques conceptuales para la estructura de los protones son: el enfoque del solitón topológico originalmente debido a Tony Skyrme y el enfoque AdS/QCD más preciso que lo extiende para incluir una teoría de cuerdas de gluones, [52] varios modelos inspirados en QCD como el modelo de bolsa y el modelo de quark constituyente , que fueron populares en la década de 1980, y las reglas de suma SVZ , que permiten cálculos aproximados de masa. [53] Estos métodos no tienen la misma precisión que los métodos QCD de red de fuerza bruta, al menos no todavía.
Radio de carga
El valor recomendado por CODATA del radio de carga de un protón es8,4075(64) × 10 −16 m . [54] El radio del protón se define mediante una fórmula que se puede calcular mediante electrodinámica cuántica y derivar de la espectroscopia atómica o de la dispersión electrón-protón. La fórmula implica un factor de forma relacionado con el diámetro bidimensional del partón del protón. [55]
Un valor anterior a 2010 se basa en la dispersión de electrones de protones seguida de un cálculo complejo que implica la sección eficaz de dispersión basada en la ecuación de Rosenbluth para la sección eficaz de transferencia de momento ), y en estudios de los niveles de energía atómica del hidrógeno y el deuterio. En 2010, un equipo de investigación internacional publicó una medición del radio de carga del protón a través del desplazamiento de Lamb en el hidrógeno muónico (un átomo exótico formado por un protón y un muón con carga negativa ). Como un muón es 200 veces más pesado que un electrón, lo que da como resultado un orbital atómico más pequeño , es mucho más sensible al radio de carga del protón y, por lo tanto, permite una medición más precisa. [56] Las mediciones posteriores mejoradas de dispersión y espectroscopia electrónica concuerdan con el nuevo radio pequeño. El trabajo continúa para refinar y verificar este nuevo valor. [57]
Presión dentro del protón
Como el protón está compuesto de quarks confinados por gluones, se puede definir una presión equivalente que actúa sobre los quarks. La magnitud de esa presión y otros detalles al respecto son controvertidos.
En 2018 se informó que esta presión era del orden de 10 35 Pa, que es mayor que la presión dentro de una estrella de neutrones . Se dijo que era máxima en el centro, positiva (repulsiva) a una distancia radial de aproximadamente 0,6 fm, negativa (atractiva) a distancias mayores y muy débil más allá de aproximadamente 2 fm. Estos números se derivaron mediante una combinación de un modelo teórico y dispersión Compton experimental de electrones de alta energía. [58] [59] [60] Sin embargo, estos resultados han sido cuestionados por ser también consistentes con presión cero [61] y por proporcionar efectivamente la forma del perfil de presión mediante la selección del modelo. [62]
Radio de carga en protón solvatado, hidronio
El radio del protón hidratado aparece en la ecuación de Born para calcular la entalpía de hidratación del hidronio .
Interacción de protones libres con materia ordinaria
Aunque los protones tienen afinidad por los electrones de carga opuesta, se trata de una interacción de energía relativamente baja, por lo que los protones libres deben perder suficiente velocidad (y energía cinética ) para asociarse estrechamente y unirse a los electrones. Los protones de alta energía, al atravesar la materia ordinaria, pierden energía por colisiones con los núcleos atómicos y por ionización de los átomos (eliminación de electrones) hasta que se desaceleran lo suficiente para ser capturados por la nube de electrones en un átomo normal.
Sin embargo, en tal asociación con un electrón, el carácter del protón ligado no cambia, y sigue siendo un protón. La atracción de protones libres de baja energía por cualquier electrón presente en la materia normal (como los electrones en átomos normales) hace que los protones libres se detengan y formen un nuevo enlace químico con un átomo. Tal enlace ocurre a cualquier temperatura suficientemente "fría" (es decir, comparable a las temperaturas en la superficie del Sol) y con cualquier tipo de átomo. Por lo tanto, en interacción con cualquier tipo de materia normal (no plasmática), los protones libres de baja velocidad no permanecen libres sino que son atraídos por los electrones en cualquier átomo o molécula con la que entren en contacto, lo que hace que el protón y la molécula se combinen. Tales moléculas se dice entonces que están " protonadas ", y químicamente son simplemente compuestos de hidrógeno, a menudo con carga positiva. A menudo, como resultado, se convierten en los llamados ácidos de Brønsted . Por ejemplo, un protón capturado por una molécula de agua en el agua se convierte en hidronio , el catión acuoso H 3 O + .
El protón en la química
Número atómico
En química , el número de protones en el núcleo de un átomo se conoce como número atómico , que determina el elemento químico al que pertenece el átomo. Por ejemplo, el número atómico del cloro es 17; esto significa que cada átomo de cloro tiene 17 protones y que todos los átomos con 17 protones son átomos de cloro. Las propiedades químicas de cada átomo están determinadas por el número de electrones (con carga negativa) , que para los átomos neutros es igual al número de protones (positivos) de modo que la carga total es cero. Por ejemplo, un átomo de cloro neutro tiene 17 protones y 17 electrones, mientras que un anión Cl − tiene 17 protones y 18 electrones para una carga total de −1.
Sin embargo, no todos los átomos de un elemento determinado son necesariamente idénticos. El número de neutrones puede variar para formar diferentes isótopos y los niveles de energía pueden diferir, lo que da como resultado diferentes isómeros nucleares . Por ejemplo, hay dos isótopos estables del cloro :35
17Cl
con 35 − 17 = 18 neutrones y37
17Cl
con 37 − 17 = 20 neutrones.
Ion de hidrógeno

) implica que el átomo de H ha perdido su único electrón, por lo que solo queda un protón. Por ello, en química, los términos protón e ion hidrógeno (para el isótopo protio) se utilizan como sinónimos.
El protón es una especie química única, ya que es un núcleo desnudo. Por lo tanto, no tiene existencia independiente en estado condensado y siempre se encuentra unido por un par de electrones a otro átomo.
Ross Stewart, El protón: aplicación a la química orgánica (1985, pág. 1)
En química, el término protón se refiere al ion hidrógeno, H+
Dado que el número atómico del hidrógeno es 1, un ion de hidrógeno no tiene electrones y corresponde a un núcleo desnudo, formado por un protón (y 0 neutrones para el isótopo más abundante, el protio). 1
1yo
). El protón es una "carga desnuda" con sólo alrededor de 1/64.000 del radio de un átomo de hidrógeno, y por lo tanto es extremadamente reactivo químicamente. El protón libre, por lo tanto, tiene una vida útil extremadamente corta en sistemas químicos como los líquidos y reacciona inmediatamente con la nube de electrones de cualquier molécula disponible. En solución acuosa, forma el ion hidronio , H 3 O + , que a su vez es solvatado por moléculas de agua en grupos como [H 5 O 2 ] + y [H 9 O 4 ] + . [63]
La transferencia de H+
En una reacción ácido-base, el movimiento de protones se denomina habitualmente "transferencia de protones". El ácido se considera donante de protones y la base , aceptor de protones. Asimismo, términos bioquímicos como bomba de protones y canal de protones se refieren al movimiento de H hidratado.+
iones.
El ion que se produce al retirar el electrón de un átomo de deuterio se conoce como deuterón , no como protón. Del mismo modo, al retirar un electrón de un átomo de tritio se produce un tritón .
Resonancia magnética nuclear de protones (RMN)
También en química, el término RMN de protón se refiere a la observación de núcleos de hidrógeno-1 en moléculas (principalmente orgánicas ) mediante resonancia magnética nuclear . Este método utiliza el momento magnético de espín cuantizado del protón, que se debe a su momento angular (o espín ), que a su vez tiene una magnitud de la mitad de la constante de Planck reducida . ( ). El nombre se refiere al examen de protones tal como se presentan en el protio (átomos de hidrógeno-1) en compuestos, y no implica que existan protones libres en el compuesto que se está estudiando.
Exposición humana
Los paquetes de experimentos de superficie lunar del Apolo (ALSEP) determinaron que más del 95% de las partículas del viento solar son electrones y protones, en cantidades aproximadamente iguales. [64] [65]
Debido a que el Espectrómetro de Viento Solar realizó mediciones continuas, fue posible medir cómo el campo magnético de la Tierra afecta las partículas de viento solar que llegan. Durante aproximadamente dos tercios de cada órbita, la Luna está fuera del campo magnético de la Tierra. En esos momentos, una densidad típica de protones era de 10 a 20 por centímetro cúbico, y la mayoría de los protones tenían velocidades entre 400 y 650 kilómetros por segundo. Durante aproximadamente cinco días de cada mes, la Luna está dentro de la cola geomagnética de la Tierra y, por lo general, no se detectaron partículas de viento solar. Durante el resto de cada órbita lunar, la Luna se encuentra en una región de transición conocida como magnetosvaina , donde el campo magnético de la Tierra afecta al viento solar, pero no lo excluye por completo. En esta región, el flujo de partículas se reduce, con velocidades típicas de protones de 250 a 450 kilómetros por segundo. Durante la noche lunar, el espectrómetro estaba protegido del viento solar por la Luna y no se midieron partículas de viento solar. [64]
Los protones también tienen un origen extrasolar, provenientes de los rayos cósmicos galácticos , donde constituyen aproximadamente el 90% del flujo total de partículas. Estos protones suelen tener mayor energía que los protones del viento solar, y su intensidad es mucho más uniforme y menos variable que la de los protones provenientes del Sol, cuya producción se ve fuertemente afectada por eventos de protones solares como las eyecciones de masa coronal .
Se han realizado investigaciones sobre los efectos de la tasa de dosis de protones, como los que se encuentran típicamente en los viajes espaciales , sobre la salud humana. [65] [66] Para ser más específicos, hay esperanzas de identificar qué cromosomas específicos están dañados y definir el daño durante el desarrollo del cáncer por la exposición a protones. [65] Otro estudio busca determinar "los efectos de la exposición a la irradiación de protones en los puntos finales neuroquímicos y conductuales, incluido el funcionamiento dopaminérgico , el aprendizaje de aversión condicionada al gusto inducido por anfetaminas y el aprendizaje y la memoria espaciales medidos por el laberinto de agua de Morris " . [66] También se ha propuesto estudiar la carga eléctrica de una nave espacial debido al bombardeo interplanetario de protones. [67] Hay muchos más estudios relacionados con los viajes espaciales, incluidos los rayos cósmicos galácticos y sus posibles efectos sobre la salud , y la exposición a eventos de protones solares .
Los experimentos espaciales Biostack americano y Biorack soviético han demostrado la gravedad del daño molecular inducido por iones pesados en microorganismos , incluidos los quistes de Artemia . [68]
Antiprotón
La simetría CPT impone fuertes restricciones a las propiedades relativas de partículas y antipartículas y, por lo tanto, está abierta a pruebas rigurosas. Por ejemplo, las cargas de un protón y un antiprotón deben sumar exactamente cero. Esta igualdad se ha probado hasta una parte en10 8 . La igualdad de sus masas también ha sido probada con más de una parte en10 8. Manteniendo antiprotones en una trampa de Penning , se ha probado la igualdad de la relación carga-masa de protones y antiprotones hasta una parte en6 × 10 9 . [69] El momento magnético de los antiprotones se ha medido con un error de8 × 10 −3 magnetones nucleares de Bohr , y se descubre que es igual y opuesta a la de un protón. [70]
Véase también
Referencias
- ^ "Valor CODATA 2022: masa del protón". Referencia del NIST sobre constantes, unidades e incertidumbre . NIST . Mayo de 2024. Consultado el 18 de mayo de 2024 .
- ^ "Valor CODATA 2022: masa del protón en u". Referencia del NIST sobre constantes, unidades e incertidumbre . NIST . Mayo de 2024. Consultado el 18 de mayo de 2024 .
- ^ "Valor CODATA 2022: equivalente de energía de masa de protón en MeV". Referencia del NIST sobre constantes, unidades e incertidumbre . NIST . Mayo de 2024. Consultado el 18 de mayo de 2024 .
- ^ The SNO+ Collaboration; Anderson, M.; Andringa, S.; Arushanova, E.; Asahi, S.; Askins, M.; Auty, DJ; Back, AR; Barnard, Z.; Barros, N.; Bartlett, D. (20 de febrero de 2019). "Búsqueda de modos invisibles de desintegración de nucleones en agua con el detector SNO+". Physical Review D . 99 (3): 032008. arXiv : 1812.05552 . Código Bibliográfico :2019PhRvD..99c2008A. doi :10.1103/PhysRevD.99.032008. S2CID 96457175.
- ^ ""Valores recomendados por CODATA para 2018"". Archivado desde el original el 22 de enero de 2018. Consultado el 31 de mayo de 2019 .
- ^ Sahoo, BK (17 de enero de 2017). "Límites mejorados en los parámetros de violación de $CP$ hadrónicos y semihadrónicos y papel de un portador de fuerza oscura en el momento dipolar eléctrico de $^{199}\mathrm{Hg}$". Physical Review D . 95 (1): 013002. arXiv : 1612.09371 . doi :10.1103/PhysRevD.95.013002. S2CID 119344894.
- ^ "Valor CODATA 2022: momento magnético del protón". Referencia del NIST sobre constantes, unidades e incertidumbre . NIST . Mayo de 2024. Consultado el 18 de mayo de 2024 .
- ^ "Valor CODATA 2022: relación entre el momento magnético del protón y el magnetón de Bohr". Referencia del NIST sobre constantes, unidades e incertidumbre . NIST . Mayo de 2024. Consultado el 18 de mayo de 2024 .
- ^ "Valor CODATA 2022: relación entre el momento magnético del protón y el magnetón nuclear". Referencia del NIST sobre constantes, unidades e incertidumbre . NIST . Mayo de 2024. Consultado el 18 de mayo de 2024 .
- ^ "protón | Definición, masa, carga y datos". Enciclopedia Británica . Archivado desde el original el 2023-08-22 . Consultado el 2018-10-20 .
- ^ Cho, Adrian (2 de abril de 2010). «La masa del quark común finalmente se determinó». Revista Science . Asociación Estadounidense para el Avance de la Ciencia . Archivado desde el original el 27 de agosto de 2015. Consultado el 27 de septiembre de 2014 .
- ^ "¡Se refuerza el rompecabezas del tamaño del protón!". Instituto Paul Shearer. 25 de enero de 2013. Archivado desde el original el 4 de octubre de 2018. Consultado el 6 de julio de 2014 .
- ^ Antognini, Aldo; et al. (25 de enero de 2013). "Estructura de protones a partir de la medición de frecuencias de transición 2S-2P del hidrógeno muónico" (PDF) . Science . 339 (6118): 417–420. Bibcode :2013Sci...339..417A. doi :10.1126/science.1230016. hdl : 10316/79993 . PMID 23349284. S2CID 346658. Archivado desde el original (PDF) el 14 de marzo de 2020 . Consultado el 25 de agosto de 2019 .
- ^ Bezginov, N.; Valdez, T.; Horbatsch, M.; Marsman, A.; Vutha, AC; Hessels, EA (6 de septiembre de 2019). "Una medición del desplazamiento Lamb del hidrógeno atómico y el radio de carga del protón". Science . 365 (6457): 1007–1012. Bibcode :2019Sci...365.1007B. doi : 10.1126/science.aau7807 . ISSN 0036-8075. PMID 31488684. S2CID 201845158.
- ^ Xiong, W.; Gasparian, A.; Gao, H.; Dutta, D.; Khandaker, M.; Liyanage, N.; Pasyuk, E.; Peng, C.; Bai, X.; Ye, L.; Gnanvo, K. (noviembre de 2019). "Un pequeño radio de carga de protones a partir de un experimento de dispersión electrón-protón". Nature . 575 (7781): 147–150. Bibcode :2019Natur.575..147X. doi :10.1038/s41586-019-1721-2. ISSN 1476-4687. OSTI 1575200. PMID 31695211. S2CID 207831686.
- ^ Köhn, C.; Ebert, U. (2015). "Cálculo de haces de positrones, neutrones y protones asociados con destellos de rayos gamma terrestres" (PDF) . Journal of Geophysical Research: Atmospheres . 23 (4): 1620–1635. Bibcode :2015JGRD..120.1620K. doi : 10.1002/2014JD022229 . Archivado (PDF) desde el original el 23 de diciembre de 2019 . Consultado el 25 de agosto de 2019 .
- ^ Köhn, C.; Diniz, G.; Harakeh, Muhsin (2017). "Mecanismos de producción de leptones, fotones y hadrones y su posible retroalimentación cerca de los líderes de los rayos". Revista de investigación geofísica: Atmósferas . 122 (2): 1365–1383. Bibcode :2017JGRD..122.1365K. doi :10.1002/2016JD025445. PMC 5349290 . PMID 28357174.
- ^ Schlemmer, Stephan (8 de febrero de 2011). "La generación de H2 en el universo temprano gobierna la formación de las primeras estrellas". Angewandte Chemie International Edition . 50 (10): 2214–2215. doi :10.1002/anie.201005920. ISSN 1433-7851. PMID 21305679.
- ^ Adair, RK (1989). El gran diseño: partículas, campos y creación . Oxford University Press . pág. 214. Bibcode :1988gdpf.book.....A.
- ^ Cottingham, WN; Greenwood, DA (1986). Introducción a la física nuclear . Cambridge University Press . ISBN 978-0-521-65733-4.
- ^ Basdevant, J.-L.; Rich, J.; Spiro, M. (2005). Fundamentos de física nuclear. Springer . p. 155. ISBN 978-0-387-01672-6Archivado desde el original el 30 de diciembre de 2023. Consultado el 19 de noviembre de 2020 .
- ^ Departamento de Química y Bioquímica UCLA Eric R. Scerri Profesor (12/10/2006). La tabla periódica: su historia y su importancia: Su historia y su importancia . Oxford University Press . ISBN 978-0-19-534567-4.
- ^ Viena, Wilhelm (1904). "Über positiv Elektronen und die Existenz hoher Atomgewichte". Annalen der Physik . 318 (4): 669–677. Código bibliográfico : 1904AnP...318..669W. doi : 10.1002/andp.18943180404. Archivado desde el original el 13 de julio de 2020 . Consultado el 13 de julio de 2020 .
- ^ Petrucci, RH; Harwood, WS; Herring, FG (2002). Química general (8.ª ed.). Upper Saddle River, NJ: Prentice Hall. pág. 41. ISBN 978-0-13-033445-9.
- ^ "Cómo Rutherford detecta el protón y la vida de Rutherford". ScienceDirect . Archivado desde el original el 5 de diciembre de 2023. Consultado el 6 de diciembre de 2023 .
- ^ "La cámara de nubes de Blackett". Actas de la Royal Society de Londres. Serie A, que contiene artículos de carácter matemático y físico . 107 (742): 349–360. 2 de febrero de 1925. doi : 10.1098/rspa.1925.0029 .
- ^ Ver informe de la reunión Archivado el 18 de marzo de 2017 en Wayback Machine y anuncio Archivado el 19 de octubre de 2022 en Wayback Machine
- ^ Romer A (1997). "¿Protón o proutón? Rutherford y las profundidades del átomo". American Journal of Physics . 65 (8): 707. Bibcode :1997AmJPh..65..707R. doi :10.1119/1.18640.
- ↑ Rutherford informó de la aceptación por parte de la Asociación Británica en una nota a pie de página de Masson, O. (1921). «XXIV. La constitución de los átomos». Philosophical Magazine . Serie 6. 41 (242): 281–285. doi :10.1080/14786442108636219. Archivado desde el original el 21 de junio de 2019. Consultado el 21 de junio de 2019 .
- ^ OED «protón» . Oxford English Dictionary (edición en línea). Oxford University Press . Consultado el 24 de marzo de 2021 . (Se requiere suscripción o membresía a una institución participante).
- ^ Pais, A. (1986). Inward Bound . Oxford University Press . pág. 296. ISBN 0-19-851997-4.Pais creía que el primer uso de la palabra protón en la literatura científica aparece en "Physics at the British Association". Nature . 106 (2663): 357–358. 1920. Bibcode :1920Natur.106..357.. doi : 10.1038/106357a0 .
- ^ Ebeling, W.; Reinholz, H.; Röpke, G. (2021). "Ecuación de estado de hidrógeno, helio y plasmas solares". Contribuciones a la física del plasma . doi :10.1002/ctpp.202100085.
- ^ "¿Qué son los rayos cósmicos?". Centro de vuelo espacial Goddard. NASA. Archivado desde el original el 28 de octubre de 2012. Consultado el 31 de octubre de 2012 ."copia reflejada, también archivada". Archivado desde el original el 4 de marzo de 2016.
- ^ Poenaru, Dorin N.; Rebel, Heinigerd; Wentz, Jürgen, eds. (2001). Núcleos lejos de la estabilidad y astrofísica. Dordrecht: Springer Netherlands. págs. 79-81. doi :10.1007/978-94-010-0708-5. ISBN . 978-0-7923-6937-0.
- ^ Colaboración UCNτ; Gonzalez, FM; Fries, EM; Cude-Woods, C.; Bailey, T.; Blatnik, M.; Broussard, LJ; Callahan, NB; Choi, JH; Clayton, SM; Currie, SA (13 de octubre de 2021). "Medición mejorada del tiempo de vida de los neutrones con UCNτ". Physical Review Letters . 127 (16): 162501. arXiv : 2106.10375 . Código Bibliográfico :2021PhRvL.127p2501G. doi :10.1103/PhysRevLett.127.162501. PMID 34723594. S2CID 235490073. Archivado desde el original el 1 de abril de 2024 . Recuperado el 1 de abril de 2024 .
- ^ Buccella, F.; Miele, G.; Rosa, L.; Santorelli, P.; Tuzi, T. (1989). "Un límite superior para la vida útil del protón en SO(10)". Physics Letters B . 233 (1–2): 178–182. Código Bibliográfico :1989PhLB..233..178B. doi :10.1016/0370-2693(89)90637-0.
- ^ Lee, DG; Mohapatra, R.; Parida, M.; Rani, M. (1995). "Predicciones para la vida útil del protón en modelos SO(10) mínimos no supersimétricos: una actualización". Physical Review D . 51 (1): 229–235. arXiv : hep-ph/9404238 . Bibcode :1995PhRvD..51..229L. doi :10.1103/PhysRevD.51.229. PMID 10018289. S2CID 119341478.
- ^ "La vida útil del protón es mayor que 1034 años". Observatorio de Kamioka . Noviembre de 2009. Archivado desde el original el 16 de julio de 2011. Consultado el 31 de agosto de 2014 .
- ^ Nishino, H.; et al. (2009). "Búsqueda de desintegración de protones mediante p→e + π 0 y p→μ + π 0 en un gran detector Cherenkov de agua". Physical Review Letters . 102 (14): 141801. arXiv : 0903.0676 . Bibcode :2009PhRvL.102n1801N. doi :10.1103/PhysRevLett.102.141801. PMID 19392425. S2CID 32385768.
- ^ Ahmed, S.; et al. (2004). "Restricciones en la desintegración de nucleones mediante modos invisibles del Observatorio de neutrinos de Sudbury". Physical Review Letters . 92 (10): 102004. arXiv : hep-ex/0310030 . Código Bibliográfico :2004PhRvL..92j2004A. doi :10.1103/PhysRevLett.92.102004. PMID 15089201. S2CID 119336775.
- ^ Vanzella, Daniel AT; Matsas, George EA (25 de septiembre de 2001). "Decaimiento de protones acelerados y la existencia del efecto Fulling–Davies–Unruh". Physical Review Letters . 87 (15): 151301. arXiv : gr-qc/0104030 . Código Bibliográfico :2001PhRvL..87o1301V. doi :10.1103/PhysRevLett.87.151301. hdl :11449/66594. PMID 11580689. S2CID 3202478.
- ^ Matsas, George EA; Vanzella, Daniel AT (16 de marzo de 1999). "Decaimiento de protones y neutrones inducido por aceleración". Physical Review D . 59 (9): 094004. arXiv : gr-qc/9901008 . Código Bibliográfico :1999PhRvD..59i4004M. doi :10.1103/PhysRevD.59.094004. hdl :11449/65768. S2CID 2646123. Archivado desde el original el 30 de diciembre de 2023 . Consultado el 24 de julio de 2022 .
- ^ Vanzella, Daniel AT; Matsas, George EA (6 de diciembre de 2000). "Decaimiento débil de protones uniformemente acelerados y procesos relacionados". Physical Review D . 63 (1): 014010. arXiv : hep-ph/0002010 . Código Bibliográfico :2000PhRvD..63a4010V. doi :10.1103/PhysRevD.63.014010. hdl :11449/66417. S2CID 12735961. Archivado desde el original el 30 de diciembre de 2023 . Consultado el 24 de julio de 2022 .
- ^ Matsas, George EA; Vanzella, Daniel a. T. (1 de diciembre de 2002). "El efecto Fulling-Davies-Unruh es obligatorio: el testimonio del protón". Revista Internacional de Física Moderna D. 11 ( 10): 1573–1577. arXiv : gr-qc/0205078 . doi :10.1142/S0218271802002918. ISSN 0218-2718. S2CID 16555072. Archivado desde el original el 24 de julio de 2022. Consultado el 24 de julio de 2022 .
- ^ Watson, A. (2004). El quark cuántico . Cambridge University Press . Págs. 285-286. ISBN. 978-0-521-82907-6.
- ^ Smith, Timothy Paul (2003). Mundos ocultos: la búsqueda de quarks en la materia ordinaria . Princeton University Press . Bibcode :2003hwhq.book.....S. ISBN 978-0-691-05773-6.
- ^ André Walker-Loud (19 de noviembre de 2018). «Disección de la masa del protón». Física . Vol. 11. pág. 118. Código Bibliográfico :2018PhyOJ..11..118W. doi : 10.1103/Physics.11.118 . Archivado desde el original el 2021-06-05 . Consultado el 2021-06-04 .
- ^ Ver este reportaje archivado el 16 de abril de 2009 en Wayback Machine y enlaces
- ^ ab Durr, S.; Fodor, Z.; Frison, J.; Hoelbling, C.; Hoffmann, R.; Katz, SD; Krieg, S.; Kurth, T.; Lellouch, L.; Lippert, T.; Szabo, KK; Vulvert, G. (2008). "Determinación ab initio de masas de hadrones ligeros". Science . 322 (5905): 1224–1227. arXiv : 0906.3599 . Bibcode :2008Sci...322.1224D. CiteSeerX 10.1.1.249.2858 . doi :10.1126/science.1163233. PMID 19023076. S2CID 14225402.
- ^ Perdrisat, CF; Punjabi, V.; Vanderhaeghen, M. (2007). "Factores de forma electromagnéticos del nucleón". Progreso en física de partículas y nuclear . 59 (2): 694–764. arXiv : hep-ph/0612014 . Código Bibliográfico :2007PrPNP..59..694P. doi :10.1016/j.ppnp.2007.05.001. S2CID 15894572.
- ^ Boffi, Sigfrido; Pasquini, Bárbara (2007). "Distribuciones generalizadas de parton y estructura del nucleón". Rivista del Nuevo Cimento . 30 (9): 387. arXiv : 0711.2625 . Código Bib : 2007NCimR..30..387B. doi :10.1393/ncr/i2007-10025-7. S2CID 15688157.
- ^ Joshua, Erlich (diciembre de 2008). "Resultados recientes en AdS/QCD". Actas de la 8.ª Conferencia sobre confinamiento de quarks y espectro de hadrones, 1–6 de septiembre de 2008, Maguncia, Alemania . arXiv : 0812.4976 . Código Bibliográfico :2008arXiv0812.4976E.
- ^ Pietro, Colangelo; Alex, Khodjamirian (octubre de 2000). "Reglas de suma de QCD, una perspectiva moderna". En M., Shifman (ed.). En la frontera de la física de partículas: manual de QCD . World Scientific Publishing . págs. 1495–1576. arXiv : hep-ph/0010175 . Bibcode :2001afpp.book.1495C. CiteSeerX 10.1.1.346.9301 . doi :10.1142/9789812810458_0033. ISBN . 978-981-02-4445-3.S2CID 16053543 .
- ^ "Valor CODATA 2022: radio de carga rms del protón". Referencia del NIST sobre constantes, unidades e incertidumbre . NIST . Mayo de 2024. Consultado el 18 de mayo de 2024 .
- ^ Miller, Gerald A. (7 de marzo de 2019). "Definición del radio del protón: un tratamiento unificado". Physical Review C . 99 (3): 035202. arXiv : 1812.02714 . Código Bibliográfico :2019PhRvC..99c5202M. doi :10.1103/PhysRevC.99.035202. ISSN 2469-9985.
- ^ Pohl, Randolf; et al. (8 de julio de 2010). "El tamaño del protón". Nature . 466 (7303): 213–216. Bibcode :2010Natur.466..213P. doi :10.1038/nature09250. PMID 20613837. S2CID 4424731.
- ^ Karr, Jean-Philippe; Marchand, Dominique; Voutier, Eric (noviembre de 2020). "El tamaño del protón". Nature Reviews Physics . 2 (11): 601–614. Código Bibliográfico :2020NatRP...2..601K. doi :10.1038/s42254-020-0229-x. ISSN 2522-5820. Archivado desde el original el 28 de marzo de 2024 . Consultado el 28 de marzo de 2024 .
- ^ Burkert, VD; Elouadrhiri, L.; Girod, FX (16 de mayo de 2018). "La distribución de presión dentro del protón". Naturaleza . 557 (7705): 396–399. Código Bib :2018Natur.557..396B. doi :10.1038/s41586-018-0060-z. OSTI 1438388. PMID 29769668. S2CID 21724781.
- ^ "Wood C. Fuerzas de remolino, presiones de aplastamiento medidas en el protón. Revista Quanta, 14 de marzo de 2024". Archivado desde el original el 1 de abril de 2024 . Consultado el 1 de abril de 2024 .
- ^ Burkert, VD; et al. (22 de diciembre de 2023). "Coloquio: Factores de forma gravitacionales del protón". Reseñas de Física Moderna . 95 (4): 041002. arXiv : 2303.08347 . Código Bibliográfico : 2023RvMP...95d1002B. doi : 10.1103/RevModPhys.95.041002. ISSN 0034-6861.
- ^ Kumerički, Krešimir (junio de 2019). "Measurability of pressure inside the proton" (Capacidad de medición de la presión dentro del protón). Nature . 570 (7759): E1–E2. Bibcode :2019Natur.570E...1K. doi :10.1038/s41586-019-1211-6. ISSN 0028-0836. PMID 31168113. Archivado desde el original el 2024-03-27 . Consultado el 2024-03-27 .
- ^ Dutrieux, H.; Lorcé, C.; Moutarde, H.; Sznajder, P.; Trawiński, A.; Wagner, J. (abril de 2021). "Evaluación fenomenológica de las propiedades mecánicas de los protones a partir de la dispersión Compton profundamente virtual". The European Physical Journal C . 81 (4): 300. arXiv : 2101.03855 . Código Bibliográfico :2021EPJC...81..300D. doi :10.1140/epjc/s10052-021-09069-w. ISSN 1434-6044.
- ^ Headrick, JM; Diken, EG; Walters, RS; Hammer, NI; Christie, RA; Cui, J.; Myshakin, EM; Duncan, MA; Johnson, MA; Jordan, KD (2005). "Firmas espectrales de vibraciones de protones hidratados en cúmulos de agua". Science . 308 (5729): 1765–1769. Bibcode :2005Sci...308.1765H. doi :10.1126/science.1113094. PMID 15961665. S2CID 40852810.
- ^ ab "Misión Apolo 11". Instituto Lunar y Planetario . 2009. Archivado desde el original el 7 de agosto de 2012. Consultado el 12 de junio de 2009 .
- ^ abc "¿Viajes espaciales y cáncer vinculados? Investigador de Stony Brook obtiene subvención de la NASA para estudiar los efectos de la radiación espacial". Brookhaven National Laboratory . 12 de diciembre de 2007. Archivado desde el original el 26 de noviembre de 2008. Consultado el 12 de junio de 2009 .
- ^ ab Shukitt-Hale, B.; Szprengiel, A.; Pluhar, J.; Rabin, BM; Joseph, JA (2004). "Los efectos de la exposición a protones en la neuroquímica y el comportamiento". Avances en la investigación espacial . 33 (8): 1334–9. Bibcode :2004AdSpR..33.1334S. doi :10.1016/j.asr.2003.10.038. PMID 15803624. Archivado desde el original el 25 de julio de 2011 . Consultado el 12 de junio de 2009 .
- ^ Green, NW; Frederickson, AR (2006). "Un estudio de la carga de naves espaciales debido a la exposición a protones interplanetarios" (PDF) . Actas de la conferencia AIP . 813 : 694–700. Código bibliográfico :2006AIPC..813..694G. CiteSeerX 10.1.1.541.4495 . doi :10.1063/1.2169250. Archivado desde el original (PDF) el 27 de mayo de 2010 . Consultado el 12 de junio de 2009 .
- ^ Planel, H. (2004). El espacio y la vida: una introducción a la biología y la medicina espaciales. CRC Press . pp. 135–138. ISBN. 978-0-415-31759-7Archivado desde el original el 9 de agosto de 2020. Consultado el 13 de julio de 2020 .
- ^ Gabrielse, G. (2006). "Medidas de masa de antiprotones". Revista internacional de espectrometría de masas . 251 (2–3): 273–280. Código Bibliográfico :2006IJMSp.251..273G. doi :10.1016/j.ijms.2006.02.013.
- ^ "BASE mide con precisión el momento magnético del antiprotón". CERN . Archivado desde el original el 2022-03-04 . Consultado el 2022-03-04 .
Lectura adicional
- Bola, Richard D.; Cándido, Alejandro; Cruz-Martínez, Juan; Fuerte, Stefano; Giani, Tommaso; Hekhorn, Félix; Kudashkin, Kirill; Magni, Giacomo; Rojo, Juan (agosto 2022). "Evidencia de quarks de encanto intrínseco en el protón". Naturaleza . 608 (7923): 483–487. arXiv : 2208.08372 . Código Bib :2022Natur.608..483N. doi :10.1038/s41586-022-04998-2. ISSN 1476-4687. PMC 9385499 . PMID 35978125.
- Gao, H.; Vanderhaeghen, M. (21 de enero de 2022). "El radio de carga del protón". Reseñas de Física Moderna . 94 (1): 015002. arXiv : 2105.00571 . Código Bibliográfico :2022RvMP...94a5002G. doi :10.1103/RevModPhys.94.015002. ISSN 0034-6861.
Enlaces externos
 Medios relacionados con Protones en Wikimedia Commons
Medios relacionados con Protones en Wikimedia Commons- Grupo de datos de partículas en LBL
- Gran Colisionador de Hadrones
- Eaves, Laurence ; Copeland, Ed; Padilla, Antonio (Tony) (2010). "El protón que se encoge". Sesenta símbolos . Brady Haran para la Universidad de Nottingham .
- Proyecto de visualización de protones del MIT:
- Dentro del protón, la cosa más complicada que puedas imaginar, Quanta Magazine , 19 de octubre de 2022
- Visualizando el protón, Arts at MIT, 2022