Polimicrogiria frontoparietal bilateral
| Polimicrogiria frontoparietal bilateral | |
|---|---|
| Otros nombres | BFPP |
La polimicrogiria frontoparietal bilateral es un trastorno genético con herencia autosómica recesiva que causa una malformación cortical. Nuestro cerebro tiene pliegues en la corteza para aumentar la superficie llamada circunvoluciones y los pacientes con polimicrogiria tienen un mayor número de pliegues y pliegues más pequeños de lo habitual. [1] La polimicrogiria se define como una malformación cerebral del desarrollo cortical en la que el patrón normal de circunvoluciones de la superficie del cerebro es reemplazado por un número excesivo de circunvoluciones pequeñas y fusionadas separadas por surcos poco profundos y una laminación cortical anormal. Según investigaciones en curso, la mutación en GPR56, un miembro de la familia del receptor acoplado a proteína G (GPCR), da como resultado BFPP. Estas mutaciones se encuentran en diferentes regiones de la proteína sin ninguna evidencia de una relación entre la posición de la mutación y la gravedad fenotípica. [2] También se encontró que GPR56 desempeña un papel en el patrón cortical. [3]
Presentación

- Síntomas : retraso del desarrollo, retraso psicomotor , retraso mental (moderado a severo), reflejos exagerados y convulsiones (epilepsia).
Condiciones asociadas
La BFPP es una malformación cortical del cerebro en forma de adoquín. Las alteraciones del desarrollo cortical cerebral debidas a la migración y el posicionamiento neuronales anormales suelen dar lugar a trastornos corticales, entre los que se incluye la lisencefalia en adoquín. La lisencefalia en adoquín se observa típicamente en tres síndromes de distrofia muscular congénita humana diferentes: distrofia muscular congénita de Fukuyama , síndrome de Walker-Warburg y enfermedad músculo-ojo-cerebro. [4] En la lisencefalia en adoquín, la superficie del cerebro en realidad tiene un contorno irregular causado por la presencia de acumulaciones de neuronas y células gliales mal ubicadas que han migrado más allá de los límites normales de la superficie del cerebro. A veces, las regiones pobladas por estas células mal ubicadas han causado un diagnóstico radiológico erróneo de polimicrogiria. Sin embargo, la presencia de otras anomalías en estos síndromes de lisencefalia en adoquín, incluidas anomalías oculares, distrofia muscular congénita, ventriculomegalia y displasia cerebelosa, suele distinguir estos trastornos de la polimicrogiria. [5] No existen estudios anatomopatológicos que hayan caracterizado el patrón de alteraciones laminares corticales en pacientes con mutaciones del gen GPR56, pero se ha sugerido que las características de imagen de la BFPP, incluyendo defectos de mielinización y displasia cortical cerebelosa , recuerdan a las de las llamadas malformaciones en empedrado (enfermedad músculo-ojo-cerebro y distrofia muscular congénita de Fukuyama) que también están asociadas con defectos de N-glicosilación en el cerebro en desarrollo. [6]
La lisencefalia ("cerebro liso") es la forma extrema de paquigiria . En la lisencefalia, se observan pocos surcos o ninguno en la superficie cortical, lo que da como resultado una apariencia amplia y lisa en todo el cerebro. La lisencefalia puede confundirse radiológicamente con la polimicrogiria, en particular con imágenes de baja resolución, pero la suavidad y la falta de irregularidad en la unión gris-blanca, junto con un grosor cortical notablemente aumentado, distinguen la lisencefalia.
La mutación GPR56 también puede causar una encefalopatía grave que se asocia con las características electroclínicas del síndrome de Lennox-Gastaut . Esta enfermedad puede ser criptogénica o sintomática, pero las formas sintomáticas se han asociado con múltiples etiologías y desarrollo cortical anormal. La BFPP causada por mutaciones GPR56 es una manifestación de una malformación del desarrollo cortical que causa el síndrome de Lennox-Gastaut. [6]
La polimicrogiria suele confundirse con la paquigiria, por lo que es necesario distinguirla de esta última, una malformación cerebral distinta en la que los pliegues superficiales son excesivamente amplios y escasos. La paquigiria y la polimicrogiria pueden parecer similares en las neuroimágenes de baja resolución, como la TC, porque el grosor cortical puede parecer mayor y las circunvoluciones pueden parecer anchas y lisas en ambas afecciones. Por este motivo, las neuroimágenes de mayor resolución, como la resonancia magnética, son necesarias para un diagnóstico adecuado. [5]
Genética
El GPR56 se agrupa en la familia B de GPCR. Este grupo de GPCR tiene extremos N largos caracterizados por una “caja de cisteína” extracelular e hidrófilos, potencialmente ricos en mucina . La caja de cisteína contiene cuatro cisteínas conservadas y dos triptófanos dispuestos de una manera específica (C-x2-W-x6-16-W-x4-C-x10-22-CxC) justo antes del primer dominio transmembrana y sirve como un sitio de escisión en algunos miembros de este grupo de receptores acoplados a proteína G. [7] Aunque, los mecanismos moleculares y celulares de cómo GPR56 regula el desarrollo cerebral siguen siendo en gran parte desconocidos. [8] Estos tipos de receptores juegan un papel esencial en procesos biológicos que incluyen el desarrollo embrionario, el sistema nervioso central (SNC), el sistema inmunológico y la tumorigénesis . [9]

Modo de herencia
Padres de un probando
- Los padres de un individuo afectado son heterocigotos obligados y, por lo tanto, portan un alelo mutante .
- Los heterocigotos (portadores) son asintomáticos.
Hermanos de un probando
- En el momento de la concepción, cada hermano de un individuo afectado tiene un 25% de posibilidades de estar afectado, un 50% de posibilidades de ser portador asintomático y un 25% de posibilidades de no estar afectado y no ser portador.
- Una vez que se sabe que un hermano en riesgo no está afectado, el riesgo de que sea portador es de 2/3.
- Los heterocigotos (portadores) son asintomáticos .
Descendencia de un probando
- Los descendientes de un probando son heterocigotos obligados y, por lo tanto, portarán un alelo mutante.
- En poblaciones con una alta tasa de consanguinidad, la descendencia de una persona con BFPP relacionada con GPR56 y una pareja reproductiva portadora de BFPP relacionada con GPR56 tienen un 50 % de probabilidades de heredar dos alelos causantes de enfermedad GPR56 y tener BFPP y un 50 % de probabilidades de ser portadores.
Otros miembros de la familia de unprobando
- Cada hermano de los padres del probando tiene un riesgo del 50% de ser portador [5]
Diagnóstico
Los criterios de diagnóstico para un paciente con BFPP implican un genotipo heterocigoto para una deleción de la región del cromosoma 16q12.1-q21, incluido el gen GPR56. [10] Hasta la fecha, el único gen conocido que está asociado con la polimicrogiria es el GPR56. Las pruebas para la polimicrogiria frontoparietal bilateral relacionada con GPR56 están disponibles clínicamente. Las mutaciones en GPR56 impiden que el colágeno III, su ligando específico , se una en un cerebro en desarrollo. Hasta la fecha, se han identificado un total de catorce mutaciones asociadas con BFPP, incluidas una deleción, dos empalmes y once mutaciones sin sentido . Dos mutaciones en el dominio del sitio proteolítico (GPS) de GPCR, C346S y W349S, causan una malformación cerebral al atrapar las proteínas mutadas en el retículo endoplasmático . [11]
Los GPR56 son parte de la clase B de la familia GPCR , la familia de genes de superficie celular más grande del genoma humano . Dentro de esta familia hay diferentes tipos de moléculas bioactivas que transducen su señal al compartimento intracelular a través de la interacción con este tipo de receptor. Los niños a menudo presentan retraso del desarrollo, espasticidad o convulsiones; también suelen ser microcefálicos . Algunos pacientes con polimicrogiria no son diagnosticados hasta que producen hijos con el trastorno que tienen manifestaciones más graves. Retrospectivamente, estos pacientes a menudo informarán alguna dificultad en su historial médico o educativo. [12] Los pacientes con BFPP demuestran retraso mental, deterioro del lenguaje, retraso del desarrollo motor y trastornos convulsivos como la epilepsia. [13] La asociación de epilepsia se da en aproximadamente el 50% al 85% de los pacientes con BFPP afectados.
Las manifestaciones clínicas de la polimicrogiria son déficits neurológicos estables:
En la forma más leve, la polimicrogiria es unilateral y sólo está afectada una pequeña región del cerebro; los problemas neurológicos pueden no ser evidentes.
En las formas más graves, pueden presentarse problemas focales motores, sensoriales, visuales o cognitivos, dependiendo de la ubicación de la región cerebral afectada.
En las formas más graves, la polimicrogiria es bilateral y generalizada, dando lugar a discapacidad intelectual grave, parálisis cerebral y epilepsia refractaria.
Las personas con formas más leves de polimicrogiria sobreviven hasta la edad adulta, mientras que aquellas con formas más graves, como la BFPP, pueden morir a una edad temprana como resultado de complicaciones como convulsiones o neumonía. [5] Se desconoce la prevalencia de la polimicrogiria aislada. Los investigadores creen que puede ser relativamente común en general, aunque la BFPP es probablemente poco común. [14]
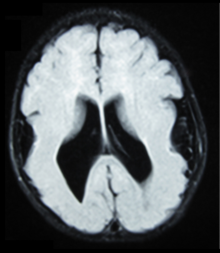
- Los hallazgos radiológicos (RM) demostraron polimicrogiria generalizada simétrica con gradiente anteroposterior decreciente, más prominente en la corteza frontoparietal. [5]
- Numerosos giros en la corteza
- Giros y surcos pequeños
- Corteza delgada
Métodos/pruebas

Existen diferentes pruebas o métodos que se utilizan para determinar la expresión de GPR56 o imágenes del cerebro para analizar las secciones específicas que están afectadas. Estas pruebas, por ejemplo, utilizan animales como ratones, RNAi , análisis de comportamiento, microscopía electrónica, tomografía computarizada o resonancia magnética que muestran diferentes resultados que concluyen que un paciente con BFPP está afectado. [15] Las resonancias magnéticas revelan irregularidades en la superficie cortical que sugieren múltiples pliegues pequeños o una apariencia irregular y festoneada de la unión de materia gris y materia blanca.
Neuroimagen
El diagnóstico de polimicrogiria se realiza generalmente mediante resonancia magnética (RM), ya que la tomografía computarizada (TC) y otros métodos de diagnóstico por imagen generalmente no tienen una resolución lo suficientemente alta o un contraste adecuado para identificar los pequeños pliegues que definen la afección. La corteza cerebral también suele aparecer anormalmente gruesa porque las múltiples circunvoluciones pequeñas están fusionadas, plegadas hacia adentro y superpuestas en apariencia. [5]
Neuropatología
El examen neuropatológico macroscópico revela un patrón de circunvoluciones complejas en la corteza cerebral, con circunvoluciones en miniatura fusionadas y superpuestas, lo que a menudo da como resultado una superficie cerebral irregular. La cinta cortical puede parecer excesivamente gruesa como resultado del repliegue y la fusión de múltiples circunvoluciones pequeñas. [5]
El examen microscópico demuestra que la corteza cerebral es, de hecho, anormalmente delgada y tiene una laminación anormal; por lo general, la corteza no tiene capas o tiene cuatro, en contraste con las seis capas normales. Las capas más superficiales entre las circunvoluciones pequeñas adyacentes parecen fusionadas, con la piamadre (capa de las meninges) formando un puente a través de múltiples circunvoluciones. El diagnóstico prenatal de BFPP también está disponible para embarazos de riesgo si se han identificado las mutaciones de GPR56 en un miembro de la familia afectado. [5]
Tratamiento
Los planes de tratamiento variarán según la gravedad de la afección y sus evidencias en cada paciente. Las áreas que probablemente necesitarán ser evaluadas y valoradas incluyen el habla, la visión, la audición y el electroencefalograma . Las medidas de tratamiento pueden incluir fisioterapia, terapia ocupacional, terapia del habla, medicamentos anticonvulsivos y dispositivos ortopédicos. Puede ser necesaria la cirugía para aliviar los problemas motores espásticos. Varias medidas de apoyo como contracturas articulares podrían prevenir complicaciones. También puede recomendarse asesoramiento genético [16]
Pronóstico
Una vez establecido el diagnóstico de polimicrogiria en un individuo, se puede utilizar el siguiente enfoque para discutir el pronóstico:
Se debe buscar una historia clínica del embarazo, con especial atención a infecciones, traumatismos, gestaciones múltiples y otros problemas documentados. Puede ser adecuado realizar pruebas de detección de infecciones congénitas comunes asociadas con polimicrogiria con la prueba TORCH estándar. Se pueden realizar otras pruebas específicas dirigidas a trastornos neurometabólicos individuales si se sugiere clínicamente.
Lo siguiente puede ayudar a determinar una etiología genética:
Historia familiar
Es importante preguntar por la presencia de problemas neurológicos en los miembros de la familia, incluyendo convulsiones, retraso cognitivo, deterioro motor, signos pseudobulbares y debilidad focal, porque muchos miembros de la familia afectados, en particular los mayores, pueden no haberse realizado una resonancia magnética, incluso si estos problemas llegaron a la atención médica. Además, aunque la mayoría de las personas con polimicrogiria presentan dificultades neurológicas en la infancia, la niñez o la edad adulta, aquellos con formas leves pueden no tener un déficit obvio o solo manifestaciones menores, como un simple ceceo o una discapacidad de aprendizaje aislada. Por lo tanto, si se sospecha un síndrome de polimicrogiria familiar, puede ser razonable realizar una resonancia magnética a los familiares que son asintomáticos o tienen lo que parecen ser hallazgos menores. La presencia de consanguinidad en los padres de un niño puede sugerir un síndrome de polimicrogiria familiar autosómico recesivo.
Examen físico
Un examen físico general del probando puede identificar malformaciones craneofaciales , musculoesqueléticas o viscerales asociadas que podrían indicar un síndrome particular. El examen neurológico debe evaluar las capacidades cognitivas y mentales, la función de los nervios craneales, la función motora, los reflejos tendinosos profundos, la función sensorial, la coordinación y la marcha (si corresponde). [5]
Véase también
Referencias
- ^ Guerrini R (5 de noviembre de 2012). "Polimicrogiria frontoparietal bilateral (BFPP)".
- ^ Bahi-Buisson N, Poirier K, Boddaert N, Fallet-Bianco C, Specchio N, Bertini E, et al. (noviembre de 2010). "Polimicrogiria frontoparietal bilateral relacionada con GPR56: más evidencia de una superposición con el complejo de adoquines". Brain . 133 (11): 3194–3209. doi :10.1093/brain/awq259. PMID 20929962.
- ^ Piao X, Walsh CA (septiembre de 2004). "Un nuevo mecanismo de señalización en el desarrollo cerebral". Investigación pediátrica . 56 (3): 309–310. doi :10.1203/01.PDR.0000139720.67707.D0. PMID 15269343.
- ^ Lin, Dr. Hsi-Hsien. Entrevista personal. 29 de octubre de 2012.
- ^ abcdefghi Stutterd CA, Dobyns WB, Jansen A, Mirzaa G, Leventer RJ (1993). "Descripción general de la polimicrogiria". En Adam MP, Feldman J, Mirzaa GM, Pagon RA, Wallace SE, Bean LJ, Gripp KW, Amemiya A (eds.). GeneReviews. Universidad de Washington, Seattle. PMID 20301504.
Capítulo retirado, solo como referencia histórica .
- ^ ab Parrini E, Ferrari AR, Dorn T, Walsh CA, Guerrini R (junio de 2009). "Polimicrogiria frontoparietal bilateral, síndrome de Lennox-Gastaut y mutaciones del gen GPR56". Epilepsia . 50 (6): 1344–1353. doi :10.1111/j.1528-1167.2008.01787.x. PMC 4271835 . PMID 19016831.
- ^ Piao X, Chang BS, Bodell A, Woods K, Benzeev B, Topcu M, et al. (noviembre de 2005). "Análisis genotipo-fenotipo de síndromes de polimicrogiria frontoparietal humana". Anales de neurología . 58 (5): 680–687. doi :10.1002/ana.20616. PMID 16240336.
- ^ Luo R, Jeong SJ, Jin Z, Strokes N, Li S, Piao X (agosto de 2011). "El receptor 56 acoplado a proteína G y el colágeno III, un par receptor-ligando, regulan el desarrollo y la laminación cortical". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 108 (31): 12925–12930. Bibcode :2011PNAS..10812925L. doi : 10.1073/pnas.1104821108 . PMC 3150909 . PMID 21768377.
- ^ Chiang NY, Hsiao CC, Huang YS, Chen HY, Hsieh IJ, Chang GW, et al. (abril de 2011). "Las mutaciones de GPR56 asociadas a la enfermedad causan polimicrogiria frontoparietal bilateral a través de múltiples mecanismos". The Journal of Biological Chemistry . 286 (16): 14215–14225. doi : 10.1074/jbc.M110.183830 . PMC 3077623 . PMID 21349848.
- ^ Borgatti R, Marelli S, Bernardini L, Novelli A, Cavallini A, Tonelli A, et al. (Diciembre de 2009). "Síndrome de polimicrogiria frontoparietal bilateral (BFPP) secundario a una deleción del cromosoma 16q12.1-q21 que involucra el gen GPR56". Genética Clínica . 76 (6): 573–576. doi :10.1111/j.1399-0004.2009.01262.x. PMID 19807741.
- ^ Singer K, Luo R, Jeong SJ, Piao X (febrero de 2013). "GPR56 y la corteza cerebral en desarrollo: células, matriz y migración neuronal". Neurobiología molecular . 47 (1): 186–196. doi :10.1007/s12035-012-8343-0. PMC 3538897 . PMID 23001883.
- ^ Sarnat HB. "Polimicrogiria". MedLink .
- ^ Jeong SJ, Luo R, Li S, Strokes N, Piao X (septiembre de 2012). "Caracterización de la expresión de la proteína del receptor 56 acoplado a proteína G en el neocórtex en desarrollo del ratón". The Journal of Comparative Neurology . 520 (13): 2930–2940. doi :10.1002/cne.23076. PMC 3908671 . PMID 22351047.
- ^ "Polimicrogiria". Genetics Home Reference . Biblioteca Nacional de Medicina de EE. UU.
- ^ Koirala S, Jin Z, Piao X, Corfas G (junio de 2009). "La adhesión de células granulares regulada por GPR56 es esencial para el desarrollo del cerebelo rostral". The Journal of Neuroscience . 29 (23): 7439–7449. doi :10.1523/JNEUROSCI.1182-09.2009. PMC 2744696 . PMID 19515912.
- ^ Guerrini R, Dobyns WB, Barkovich AJ (marzo de 2008). "Desarrollo anormal de la corteza cerebral humana: genética, consecuencias funcionales y opciones de tratamiento". Tendencias en neurociencias . 31 (3): 154–162. doi :10.1016/j.tins.2007.12.004. PMID 18262290.
Enlaces externos
- Polimicrogiria frontoparietal bilateral en la Oficina de Enfermedades Raras del NIH