Polifosfato de amonio
 | |
| Nombres | |
|---|---|
Otros nombres
| |
| Identificadores | |
| |
| EBICh |
|
| Tarjeta informativa de la ECHA | 100.063.425 |
| Número E | E452(v) (espesantes, ...) |
Panel de control CompTox ( EPA ) |
|
| Propiedades | |
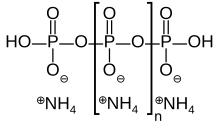
| [ NH4PO3 ] n ( OH ) 2 | |
| Masa molar | 97,01 g/mol |
| Apariencia | polvo blanco |
| Densidad | 1,9 g/cm 3 ; densidad aparente = 0,7 g/cm 3 |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El polifosfato de amonio es una sal inorgánica de ácido polifosfórico y amoníaco que contiene ambas cadenas y posiblemente ramificaciones. Su fórmula química es H(NH4PO3 ) nOH , lo que demuestra que cada monómero consta de un radical ortofosfato de un átomo de fósforo con tres oxígenos y una carga negativa neutralizada por un catión amonio, dejando dos enlaces libres para polimerizar . En los casos ramificados, a algunos monómeros les falta el anión amonio y, en su lugar, se unen a otros tres monómeros.
Las propiedades del polifosfato de amonio dependen de la cantidad de monómeros en cada molécula y, en cierta medida, de la frecuencia con la que se ramifica. Las cadenas más cortas ( n < 100) son más sensibles al agua y menos estables térmicamente que las cadenas más largas ( n > 1000), [1] pero las cadenas de polímero cortas ( por ejemplo , piro-, tripoli- y tetrapoli-) son más solubles y muestran una solubilidad creciente con el aumento de la longitud de la cadena. [2]
El polifosfato de amonio se puede preparar haciendo reaccionar ácido fosfórico concentrado con amoníaco. Sin embargo, las impurezas de hierro y aluminio, solubles en ácido fosfórico concentrado, forman precipitados gelatinosos o "lodos" en el polifosfato de amonio a un pH entre 5 y 7. [3] Otras impurezas metálicas como el cobre, el cromo, el magnesio y el cinc forman precipitados granulares. [4] Sin embargo, dependiendo del grado de polimerización, el polifosfato de amonio puede actuar como un agente quelante para mantener ciertos iones metálicos disueltos en la solución. [5]
El polifosfato de amonio se utiliza como aditivo alimentario, emulsionante ( número E : E545) y como fertilizante .
El polifosfato de amonio (APP) también se utiliza como retardante de llama en muchas aplicaciones, como pinturas y revestimientos, y en una variedad de polímeros: los más importantes son las poliolefinas , y en particular el polipropileno, donde el APP forma parte de los sistemas intumescentes. [6] La combinación de retardantes de llama basados en APP en polipropileno se describe en. [7] Otras aplicaciones son los termoendurecibles, donde el APP se utiliza en poliésteres insaturados y capas de gel (mezclas de APP con sinergistas), epoxis y fundiciones de poliuretano (sistemas intumescentes). El APP también se aplica a las espumas de poliuretano retardantes de llama .
Los polifosfatos de amonio utilizados como retardantes de llama en polímeros tienen cadenas largas y una cristalinidad específica (Forma II). Comienzan a descomponerse a 240 °C para formar amoníaco y ácido fosfórico. El ácido fosfórico actúa como catalizador ácido en la deshidratación de polialcoholes a base de carbono, como la celulosa en la madera. El ácido fosfórico reacciona con grupos de alcohol para formar ésteres de fosfato inestables al calor . Los ésteres se descomponen para liberar dióxido de carbono y regenerar el catalizador de ácido fosfórico [ cita requerida ] . En la fase gaseosa, la liberación de dióxido de carbono no inflamable ayuda a diluir el oxígeno del aire y los productos de descomposición inflamables del material que se está quemando. En la fase condensada, el carbón carbonoso resultante ayuda a proteger el polímero subyacente del ataque del oxígeno y el calor radiante. [8] El uso como intumescente se logra cuando se combina con materiales a base de almidón como pentaeritritol y melamina como agentes expansivos. Los mecanismos de intumescencia y el modo de acción de la APP se describen en una serie de publicaciones. [9] [10]
Referencias
- ^ [1] Archivado el 22 de mayo de 2010 en Wayback Machine.
- ^ US 4041133, Young, Donald C., "Producción de polifosfato de amonio", publicado el 9 de agosto de 1977, asignado a Union Oil Co. de California
- ^ US 4721519, Thomas, William P. y Lawton, William S., "Fertilizante líquido de polifosfato de amonio estable a partir de ácido fosfórico de calidad comercial", publicado el 26 de enero de 1988, asignado a American Petro Mart Inc.
- ^ US 3044851, Young, Donald C., "Producción de fosfatos de amonio y productos derivados", publicada el 17 de julio de 1962, asignada a Collier Carbon & Chemical Co.
- ^ Gowariker, Vasant; Krishnamurthy, VN; Gowariker, Sudha; Dhanorkar, Manik; Paranjape, Kalyani (8 de abril de 2009). La enciclopedia de fertilizantes. John Wiley e hijos. ISBN 9780470431764. Recuperado el 30 de junio de 2018 – vía Google Books.
- ^ Weil, ED, Levchik, SV Retardantes de llama para plásticos y textiles, p. 16. Hanser Publishers, Munich, Alemania, 2009
- ^ "Como retardante de llama". Mindfully.org . Archivado desde el original el 13 de septiembre de 2007. Consultado el 30 de junio de 2018 .
- ^ US 4515632, Maurer, Alexander & Staendeke, Horst, "Polifosfato de amonio activado, un proceso para su fabricación y su uso", publicado el 7 de mayo de 1985, asignado a Hoechst AG
- ^ Camino, G.; Luda, MP Estudio mecanicista de la intumescencia, pág. 48 y sig., en Le Bras, M.; Camino, G.; Bourbigot, S.; Delobel, R. Eds., Retardancia del fuego de los polímeros; El uso de la intumescencia, The Royal Society of Chemistry, Cambridge, Reino Unido, 1998
- ^ Bourbigot, S.; Le Bras, M. Retardantes de llama por intumescencia y formación de carbón, pág. 139 y sig., en Troitzsch, J. Ed. Plastics flammability handbook, 3.ª ed., Hanser Publishers, Munich, 2004
Enlaces externos
- US 2950961, Striplin Jr., Marcus M.; Stinson, John M. y Potts, John M., "Producción de fertilizantes líquidos", publicado el 30 de agosto de 1960, asignado a Tennessee Valley Authority
- US 4211546, Jensen, William C., "Proceso para la preparación de polifosfato de amonio", publicada el 8 de julio de 1980, asignada a Western Farm Services Inc.