Ejército Popular de Liberación (PLGA)
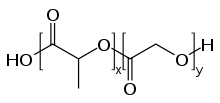
El PLGA , PLG o ácido poli(láctico- co -glicólico) ( CAS : 26780-50-7) es un copolímero que se utiliza en una serie de dispositivos terapéuticos aprobados por la Administración de Alimentos y Medicamentos (FDA), debido a su biodegradabilidad y biocompatibilidad . [1] El PLGA se sintetiza mediante copolimerización por apertura de anillo de dos monómeros diferentes , los dímeros cíclicos (1,4-dioxano-2,5-dionas) de ácido glicólico y ácido láctico . Los polímeros se pueden sintetizar como copolímeros aleatorios o en bloque, lo que imparte propiedades poliméricas adicionales. Los catalizadores comunes utilizados en la preparación de este polímero incluyen 2-etilhexanoato de estaño (II) , alcóxidos de estaño (II) o isopropóxido de aluminio . Durante la polimerización, las unidades monoméricas sucesivas (de ácido glicólico o láctico) se unen entre sí en el PLGA mediante enlaces éster , lo que produce un poliéster alifático lineal como producto. [2]
Copolímero
Dependiendo de la relación de lactida a glicolida utilizada para la polimerización, se pueden obtener diferentes formas de PLGA: estas generalmente se identifican con respecto a la relación molar de los monómeros utilizados (por ejemplo, PLGA 75:25 identifica un copolímero cuya composición es 75% de ácido láctico y 25% de ácido glicólico). La cristalinidad de los PLGA variará de completamente amorfo a completamente cristalino dependiendo de la estructura del bloque y la relación molar. Los PLGA generalmente muestran una temperatura de transición vítrea en el rango de 40-60 °C. El PLGA se puede disolver con una amplia gama de solventes , dependiendo de la composición. Los polímeros con mayor contenido de lactida se pueden disolver utilizando solventes clorados , mientras que los materiales con mayor contenido de glicolida requerirán el uso de solventes fluorados como HFIP .
El PLGA se degrada por hidrólisis de sus enlaces éster en presencia de agua . Se ha demostrado que el tiempo necesario para la degradación del PLGA está relacionado con la proporción de monómeros utilizados en la producción: cuanto mayor sea el contenido de unidades de glicólido, menor será el tiempo necesario para la degradación en comparación con los materiales predominantemente láctidos. Una excepción a esta regla es el copolímero con una proporción de monómeros de 50:50 que exhibe la degradación más rápida (alrededor de dos meses). Además, los polímeros que están protegidos con ésteres (a diferencia del ácido carboxílico libre ) muestran vidas medias de degradación más largas. [3] Esta flexibilidad en la degradación lo ha hecho conveniente para la fabricación de muchos dispositivos médicos , como injertos , suturas , implantes , dispositivos protésicos , películas de sellado quirúrgico, micro y nanopartículas . [4]
El PLGA sufre hidrólisis en el cuerpo para producir los monómeros originales: ácido láctico y ácido glicólico. Estos dos monómeros, en condiciones fisiológicas normales, son subproductos de varias vías metabólicas en el cuerpo. El ácido láctico se metaboliza en el ciclo del ácido tricarboxílico y se elimina a través del dióxido de carbono y el agua . El ácido glicólico se metaboliza de la misma manera y también se excreta a través del riñón. [5] El cuerpo también puede metabolizar los dos monómeros, lo que en el caso del ácido glicólico produce pequeñas cantidades del tóxico ácido oxálico , aunque las cantidades producidas a partir de aplicaciones típicas son minúsculas y existe una toxicidad sistémica mínima asociada con el uso de PLGA para aplicaciones de biomateriales . Sin embargo, se ha informado de que la degradación ácida del PLGA reduce el pH local lo suficiente como para crear un entorno autocatalítico . [6] Se ha demostrado que el pH dentro de una microesfera puede llegar a ser tan ácido como pH 1,5. [7]
Biocompatibilidad
En general, se considera que el PLGA es bastante biocompatible. Su alta biocompatibilidad resulta de su composición, debida a la fermentación del ácido láctico y glicólico a partir de azúcares, lo que lo hace ecológico y menos reactivo en el cuerpo. [8] El PLGA también se degrada en productos no tóxicos y no reactivos, lo que lo hace bastante útil para diversas aplicaciones médicas y farmacéuticas.
La biocompatibilidad del PLGA se ha probado tanto in vivo como in vitro. [9] La biocompatibilidad de este polímero está determinada generalmente por los productos en los que se degrada, así como por la velocidad de degradación en productos de degradación. La forma en que se degrada el PLGA es por medio de una enzima conocida como esterasa , que forma ácido láctico y ácido glicólico. Estos ácidos luego pasan por el ciclo de Krebs para degradarse como dióxido de carbono (CO 2 ) y agua ( H 2 O ). [10] Estos subproductos luego se eliminan del cuerpo a través de la respiración celular y del proceso digestivo.
Si bien los subproductos generalmente no se acumulan en el cuerpo, hay casos en los que estos subproductos (ácido láctico y glicólico) pueden ser peligrosos para el cuerpo cuando se acumulan en altas concentraciones locales. [11] También puede haber pequeños trozos de los polímeros a medida que el polímero se degrada, lo que provoca una respuesta inmunitaria por parte de los macrófagos . Estos efectos adversos se pueden reducir utilizando concentraciones más bajas del polímero, de modo que se libere de forma natural en todo el cuerpo.
Otro aspecto que se debe tener en cuenta en relación con la biocompatibilidad del PLGA es el lugar en el que se implanta o coloca el polímero en el cuerpo. Existen diferentes respuestas inmunitarias que el cuerpo puede tener según el lugar en el que se coloque el polímero. Por ejemplo, en los sistemas de administración de fármacos (DDS), los implantes de PLGA y PLA con una gran superficie y un bajo volumen de inyección pueden aumentar las posibilidades de que se produzca una respuesta inmunitaria a medida que los polímeros se degradan en el cuerpo.
Biodegradabilidad
La biodegradación del PLGA lo hace útil para muchas prácticas médicas. El PLGA sufre una degradación en masa, que es cuando un catalizador como el agua se inserta en toda la matriz del polímero. [12] Se puede obtener una proporción de PLGA de 75:25 de lactida a glicólido en forma de microesferas que se degradan mediante erosión en masa. [12] Esto permite que la degradación en todo el polímero se produzca de manera uniforme.
Se desarrolló otra forma inyectable de PLGA para tener sistemas de erosión. Esta forma se puede utilizar en Lupron Depot . Para lograr esto, el PLGA se mezcla con un solvente orgánico miscible en agua aprobado por la Administración de Alimentos y Medicamentos (FDA). Una vez que el PLGA se mezcla en el solvente con el fármaco de elección para crear una solución o suspensión homogénea. Cuando se inyecta esta mezcla, el PLGA se solidifica debido a la insolubilidad en agua y es reemplazado por el agua. Lentamente, el fármaco se libera desde la solución. Un problema que puede ocurrir es que durante la inyección inicial, el fármaco puede liberarse en una ráfaga rápida en lugar de gradualmente. [12]
Ejemplos
Algunos ejemplos específicos del uso del PLGA incluyen:
- Membrana de barrera sintética de Powerbone: este dispositivo es una membrana sintética reabsorbible que actúa como una alternativa al politetrafluoroetileno (PTFE), que es un polímero sintético que se utiliza a menudo en implantes dentales y muchas otras aplicaciones. [13] La membrana de barrera sintética se utiliza específicamente en implantes dentales y para la regeneración tisular guiada (GTR), así como para la regeneración ósea guiada (GBE). [14] Algunas son membranas biodegradables, mientras que otras no lo son, y suelen estar correlacionadas con más complicaciones quirúrgicas. En general, estas membranas son importantes para proporcionar biocompatibilidad, bioseguridad, función de barrera y propiedades mecánicas al implante. También suelen ser bioactivas, lo que promueve la regeneración de los tejidos alrededor del sitio de implantación.
- Lupron Depot: Este es un dispositivo de administración de medicamentos que ayuda a tratar el cáncer de próstata y se ha utilizado para tratar otros tipos de cánceres similares. También se conoce como leuprorelina o leuprolida. El PLGA se utiliza como un componente clave en este medicamento, en forma de micropartículas para administrar el medicamento al cuerpo durante un período de 1 semana a 6 meses. [15] Este medicamento se usa típicamente como una alternativa a la radioterapia y se considera bastante eficaz ya que reduce los niveles de testosterona en el cuerpo, lo que ralentiza los efectos del cáncer. [16] Hay muchos efectos secundarios de este medicamento, que incluyen pérdida muscular, sofocos, fatiga, osteoporosis , crecimiento del tejido mamario y muchos otros.
- Administración profiláctica: se refiere a la atención médica preventiva que tiene como objetivo evitar infecciones u otras enfermedades. Un caso de administración profiláctica que involucra PLGA es el del antibiótico vancomicina, que generalmente se inyecta después de una cirugía cerebral para prevenir infecciones causadas por bacterias, incluido el Staphylococcus aureus . [17]
Véase también
Referencias
- ^ Abulateefeh SR (febrero de 2023). "Depósitos de PLGA/PLA inyectables de acción prolongada para acetato de leuprolida: traducción exitosa del laboratorio a la clínica". Administración de fármacos e investigación traslacional . 13 (2): 520–530. doi :10.1007/s13346-022-01228-0. PMID 35976565. S2CID 251622670.
- ^ Astete CE, Sabliov CM (2006). "Síntesis y caracterización de nanopartículas de PLGA". Revista de ciencia de biomateriales. Edición de polímeros . 17 (3): 247–289. doi :10.1163/156856206775997322. PMID 16689015. S2CID 7607080.
- ^ Samadi N, Abbadessa A, Di Stefano A, van Nostrum CF, Vermonden T, Rahimian S, et al. (diciembre de 2013). "El efecto del grupo de recubrimiento de laurilo en la liberación de proteínas y la degradación de partículas de poli(ácido D,L-láctico-co-glicólico)". Journal of Controlled Release . 172 (2): 436–443. doi :10.1016/j.jconrel.2013.05.034. PMID 23751568.
- ^ Pavot V, Berthet M, Rességuier J, Legaz S, Handké N, Gilbert SC, et al. (diciembre de 2014). "Partículas de ácido poli(láctico) y ácido poli(láctico-co-glicólico) como plataformas transportadoras versátiles para la administración de vacunas". Nanomedicina . 9 (17): 2703–2718. doi :10.2217/nnm.14.156. PMID 25529572.
- ^ Crotts G, Park TG (2 de julio de 1998). "Entrega de proteínas a partir de microesferas biodegradables de poli(ácido láctico-co-glicólico): cinética de liberación y cuestiones de estabilidad". Journal of Microencapsulation . 15 (6): 699–713. doi :10.3109/02652049809008253. PMID 9818948.
- ^ Zolnik BS, Burgess DJ (octubre de 2007). "Efecto del pH ácido en la degradación y liberación de microesferas de PLGA". Journal of Controlled Release . 122 (3): 338–344. doi :10.1016/j.jconrel.2007.05.034. PMID 17644208.
- ^ Fu K, Pack DW, Klibanov AM, Langer R (enero de 2000). "Evidencia visual de un entorno ácido dentro de microesferas degradantes de poli(ácido láctico-co-glicólico) (PLGA)". Pharmaceutical Research . 17 (1): 100–106. doi :10.1023/A:1007582911958. PMID 10714616. S2CID 22378621.
- ^ Elmowafy EM, Tiboni M, Soliman ME (julio de 2019). "Biocompatibilidad, biodegradación y aplicaciones biomédicas de micro y nanopartículas de poli(ácido láctico)/poli(ácido láctico-co-glicólico)". Revista de investigación farmacéutica . 49 (4): 347–380. doi : 10.1007/s40005-019-00439-x . ISSN 2093-6214. S2CID 256338815.
- ^ Mir M, Ahmed N, Rehman AU (noviembre de 2017). "Aplicaciones recientes de nanoestructuras basadas en PLGA en la administración de fármacos". Coloides y superficies B: biointerfaces . 159 : 217–231. doi :10.1016/j.colsurfb.2017.07.038. PMID 28797972.
- ^ Machatschek R, Lendlein A (marzo de 2020). "Información fundamental sobre la degradación de PLGA a partir de estudios de películas delgadas". Journal of Controlled Release . 319 : 276–284. doi : 10.1016/j.jconrel.2019.12.044 . PMID 31884098. S2CID 209511941.
- ^ Ramot Y, Haim-Zada M, Domb AJ, Nyska A (diciembre de 2016). "Biocompatibilidad y seguridad del PLA y sus copolímeros". Advanced Drug Delivery Reviews . Polímeros biodegradables de PLA. 107 : 153–162. doi :10.1016/j.addr.2016.03.012. PMID 27058154.
- ^ abc Wnek GE, Bowlin GL (28 de mayo de 2008). Enciclopedia de biomateriales e ingeniería biomédica. CRC Press. ISBN 978-1-4987-6143-7.
- ^ "Membrana de barrera sintética de Powerbone (reabsorbible)". Restore Surgical . Consultado el 30 de abril de 2023 .
- ^ Sasaki JI, Abe GL, Li A, Thongthai P, Tsuboi R, Kohno T, Imazato S (mayo de 2021). "Membranas de barrera para la regeneración tisular en odontología". Investigaciones de biomateriales en odontología . 8 (1): 54–63. doi :10.1080/26415275.2021.1925556. PMC 8158285 . PMID 34104896.
- ^ Park K, Skidmore S, Hadar J, Garner J, Park H, Otte A, et al. (junio de 2019). "Fórmulas de PLGA inyectables de acción prolongada: análisis de PLGA y comprensión de la formación de micropartículas". Journal of Controlled Release . 304 : 125–134. doi :10.1016/j.jconrel.2019.05.003. PMID 31071374. S2CID 149444044.
- ^ Fletcher J (6 de marzo de 2023). Walton A (ed.). "Lupron (acetato de leuprolida) para el cáncer de próstata: qué esperar". www.medicalnewstoday.com . Consultado el 30 de abril de 2023 .
- ^ Xiao Q, Zhang H, Wu X, Qu J, Qin L, Wang C (2022). "Aumento del aclaramiento renal en infecciones graves: una consideración importante en la dosificación de vancomicina: una revisión narrativa". Frontiers in Pharmacology . 13 : 835557. doi : 10.3389/fphar.2022.835557 . PMC 8979486 . PMID 35387348.
