Imágenes por resonancia magnética
| Imágenes por resonancia magnética | |
|---|---|
Resonancia magnética parasagital de la cabeza, con artefactos de aliasing (la nariz y la frente aparecen en la parte posterior de la cabeza) | |
| Sinónimos | Imágenes por resonancia magnética nuclear (IRMN), tomografía por resonancia magnética (TRM) |
| CIE-9-CM | 88,91 |
| Malla | D008279 |
| MedlinePlus | 003335 |
La resonancia magnética ( RM ) es una técnica de obtención de imágenes médicas que se utiliza en radiología para formar imágenes de la anatomía y los procesos fisiológicos dentro del cuerpo. Los escáneres de RM utilizan campos magnéticos fuertes , gradientes de campo magnético y ondas de radio para generar imágenes de los órganos del cuerpo. La RM no implica rayos X ni el uso de radiación ionizante , lo que la distingue de la tomografía computarizada (TC) y la tomografía por emisión de positrones (PET). La RM es una aplicación médica de la resonancia magnética nuclear (RMN) que también se puede utilizar para obtener imágenes en otras aplicaciones de RMN , como la espectroscopia de RMN . [1]
La resonancia magnética se utiliza ampliamente en hospitales y clínicas para el diagnóstico médico , la estadificación y el seguimiento de enfermedades. En comparación con la TC, la resonancia magnética proporciona un mejor contraste en las imágenes de tejidos blandos, por ejemplo, en el cerebro o el abdomen. Sin embargo, los pacientes pueden percibirla como menos cómoda, debido a que las mediciones suelen ser más largas y ruidosas con el sujeto dentro de un tubo largo y confinado, aunque los diseños de resonancia magnética "abiertos" generalmente alivian este problema. Además, los implantes y otros metales no removibles en el cuerpo pueden representar un riesgo y pueden excluir a algunos pacientes de someterse a un examen de resonancia magnética de manera segura.
La resonancia magnética se llamó originalmente NMRI (resonancia magnética nuclear), pero se eliminó el término "nuclear" para evitar asociaciones negativas . [2] Ciertos núcleos atómicos pueden absorber energía de radiofrecuencia (RF) cuando se colocan en un campo magnético externo ; la polarización de espín en evolución resultante puede inducir una señal de RF en una bobina de radiofrecuencia y, por lo tanto, detectarse. [3] En otras palabras, el espín magnético nuclear de los protones en los núcleos de hidrógeno resuena con las ondas incidentes de RF y emite radiación coherente con dirección, energía (frecuencia) y fase compactas. Esta radiación amplificada coherente se detecta fácilmente mediante antenas de RF cercanas al sujeto que se examina. Es un proceso similar a los máseres . En la resonancia magnética clínica y de investigación, los átomos de hidrógeno se utilizan con mayor frecuencia para generar una radiación polarizada macroscópica que es detectada por las antenas. [3] Los átomos de hidrógeno son naturalmente abundantes en los humanos y otros organismos biológicos, particularmente en el agua y la grasa . Por esta razón, la mayoría de las exploraciones de resonancia magnética esencialmente mapean la ubicación del agua y la grasa en el cuerpo. Los pulsos de ondas de radio excitan la transición de energía del espín nuclear y los gradientes del campo magnético localizan la polarización en el espacio. Al variar los parámetros de la secuencia de pulsos , se pueden generar diferentes contrastes entre los tejidos en función de las propiedades de relajación de los átomos de hidrógeno que se encuentran en ellos.
Desde su desarrollo en los años 1970 y 1980, la resonancia magnética ha demostrado ser una técnica de imagen versátil. Si bien la resonancia magnética se utiliza principalmente en la medicina diagnóstica y la investigación biomédica, también puede utilizarse para formar imágenes de objetos no vivos, como momias . La resonancia magnética de difusión y la resonancia magnética funcional amplían la utilidad de la resonancia magnética para capturar tractos neuronales y flujo sanguíneo respectivamente en el sistema nervioso, además de imágenes espaciales detalladas. El aumento sostenido de la demanda de resonancia magnética dentro de los sistemas de salud ha generado inquietudes sobre la relación costo-eficacia y el sobrediagnóstico . [4] [5] [ dudoso – discutir ]
Mecanismo
Construcción y física

En la mayoría de las aplicaciones médicas, los núcleos de hidrógeno , que consisten únicamente en un protón , que se encuentran en los tejidos crean una señal que se procesa para formar una imagen del cuerpo en términos de la densidad de esos núcleos en una región específica. Dado que los protones se ven afectados por los campos de otros átomos a los que están unidos, es posible separar las respuestas del hidrógeno en compuestos específicos. Para realizar un estudio, la persona se coloca dentro de un escáner de resonancia magnética que forma un fuerte campo magnético alrededor del área que se va a fotografiar. Primero, se aplica temporalmente al paciente energía de un campo magnético oscilante a la frecuencia de resonancia adecuada . El escaneo con bobinas de gradiente X e Y hace que una región seleccionada del paciente experimente el campo magnético exacto requerido para que se absorba la energía. Los átomos se excitan con un pulso de RF y la señal resultante se mide mediante una bobina receptora . La señal de RF se puede procesar para deducir información de posición al observar los cambios en el nivel y la fase de RF causados por la variación del campo magnético local utilizando bobinas de gradiente . Como estas bobinas se conmutan rápidamente durante la excitación y la respuesta para realizar un escaneo de línea móvil, crean el ruido repetitivo característico de una resonancia magnética a medida que los devanados se mueven ligeramente debido a la magnetostricción . El contraste entre los diferentes tejidos está determinado por la velocidad a la que los átomos excitados vuelven al estado de equilibrio . Se pueden administrar agentes de contraste exógenos a la persona para que la imagen sea más clara. [6]
Los componentes principales de un escáner de resonancia magnética son el imán principal , que polariza la muestra, las bobinas de compensación para corregir los cambios en la homogeneidad del campo magnético principal, el sistema de gradiente que se utiliza para localizar la región que se va a escanear y el sistema de radiofrecuencia, que excita la muestra y detecta la señal de RMN resultante. Todo el sistema está controlado por una o más computadoras.

La resonancia magnética requiere un campo magnético que sea fuerte y uniforme a unas pocas partes por millón en todo el volumen de exploración. La intensidad del campo magnético se mide en teslas y, aunque la mayoría de los sistemas funcionan a 1,5 T, hay sistemas comerciales disponibles entre 0,2 y 7 T. Los sistemas de resonancia magnética de 3 T , también llamados resonancias magnéticas de 3 Tesla, tienen imanes más fuertes que los sistemas de 1,5 y se consideran mejores para imágenes de órganos y tejidos blandos. [7] Los sistemas de resonancia magnética de cuerpo entero para aplicaciones de investigación funcionan en, por ejemplo, 9,4 T, [8] [9] 10,5 T, [10] 11,7 T. [11] Los sistemas de resonancia magnética de cuerpo entero con campos aún más altos, por ejemplo, 14 T y más, están en propuesta conceptual [12] o en diseño de ingeniería. [13] La mayoría de los imanes clínicos son imanes superconductores , que requieren helio líquido para mantenerlos a bajas temperaturas. Se pueden lograr intensidades de campo más bajas con imanes permanentes, que a menudo se utilizan en escáneres de resonancia magnética "abiertos" para pacientes claustrofóbicos . [14] También se utilizan intensidades de campo más bajas en un escáner de resonancia magnética portátil aprobado por la FDA en 2020. [15] Recientemente, la resonancia magnética también se ha demostrado en campos ultrabajos, es decir, en el rango de microtesla a militesla, donde se hace posible una calidad de señal suficiente mediante la prepolarización (del orden de 10-100 mT) y midiendo los campos de precesión de Larmor a aproximadamente 100 microtesla con dispositivos de interferencia cuántica superconductores de alta sensibilidad ( SQUID ). [16] [17] [18]
T1 y T2



Cada tejido vuelve a su estado de equilibrio después de la excitación por los procesos de relajación independientes de T 1 ( spin-lattice ; es decir, magnetización en la misma dirección que el campo magnético estático) y T 2 ( spin-spin ; transversal al campo magnético estático). Para crear una imagen ponderada en T 1 , se permite que la magnetización se recupere antes de medir la señal de RM cambiando el tiempo de repetición (TR). Esta ponderación de la imagen es útil para evaluar la corteza cerebral, identificar tejido graso, caracterizar lesiones hepáticas focales y, en general, obtener información morfológica, así como para la obtención de imágenes posteriores al contraste .Para crear una imagen ponderada en T2 , se permite que la magnetización disminuya antes de medir la señal de RM modificando el tiempo de eco (TE). Esta ponderación de la imagen es útil para detectar edemas e inflamaciones, revelar lesiones de la sustancia blanca y evaluar la anatomía zonal en la próstata y el útero .
La información de las exploraciones por resonancia magnética llega en forma de contrastes de imágenes basados en las diferencias en la tasa de relajación de los espines nucleares luego de su perturbación por un campo magnético oscilante (en forma de pulsos de radiofrecuencia a través de la muestra). [19] Las tasas de relajación son una medida del tiempo que tarda una señal en decaer nuevamente a un estado de equilibrio desde el plano longitudinal o transversal.
La magnetización se acumula a lo largo del eje z en presencia de un campo magnético, B 0 , de modo que los dipolos magnéticos en la muestra, en promedio, se alinearán con el eje z sumando una magnetización total M z . Esta magnetización a lo largo de z se define como la magnetización de equilibrio; la magnetización se define como la suma de todos los dipolos magnéticos en una muestra. Después de la magnetización de equilibrio, un pulso de radiofrecuencia (RF) de 90° invierte la dirección del vector de magnetización en el plano xy y luego se apaga. Sin embargo, el campo magnético inicial B 0 todavía se aplica. Por lo tanto, el vector de magnetización de espín regresará lentamente desde el plano xy al estado de equilibrio. El tiempo que tarda el vector de magnetización en regresar a su valor de equilibrio, M z , se conoce como el tiempo de relajación longitudinal, T 1 . [20] Posteriormente, la velocidad a la que esto sucede es simplemente el recíproco del tiempo de relajación: . De manera similar, el tiempo que tarda M xy en volver a cero es T 2 , con una tasa . [21] La magnetización en función del tiempo se define mediante las ecuaciones de Bloch .
Los valores de T1 y T2 dependen del entorno químico de la muestra, de ahí su utilidad en la resonancia magnética. El tejido blando y el tejido muscular se relajan a ritmos diferentes, lo que produce el contraste de imagen en una exploración típica.
La representación estándar de las imágenes de RM es representar las características del fluido en imágenes en blanco y negro , donde los diferentes tejidos aparecen de la siguiente manera:
| Señal | Ponderado en T1 | Ponderado en T2 |
|---|---|---|
| Alto |
|
|
| Intermedio | La materia gris es más oscura que la materia blanca [24] | La materia blanca es más oscura que la materia gris [24] |
| Bajo |
|
|
Diagnóstico
Uso por órgano o sistema

La resonancia magnética tiene una amplia gama de aplicaciones en el diagnóstico médico y se estima que hay alrededor de 50.000 escáneres en uso en todo el mundo. [25] La resonancia magnética afecta el diagnóstico y el tratamiento en muchas especialidades, aunque su efecto sobre la mejora de los resultados de salud es discutido en ciertos casos. [26] [27]

La resonancia magnética es la investigación de elección en la estadificación preoperatoria del cáncer de recto y próstata y tiene un papel en el diagnóstico, estadificación y seguimiento de otros tumores, [28] así como para determinar áreas de tejido para muestreo en biobancos. [29] [30]
Neuroimagen

La resonancia magnética es la herramienta de investigación de elección para los cánceres neurológicos sobre la TC, ya que ofrece una mejor visualización de la fosa craneal posterior , que contiene el tronco encefálico y el cerebelo . El contraste proporcionado entre la materia gris y blanca hace que la resonancia magnética sea la mejor opción para muchas afecciones del sistema nervioso central , incluidas las enfermedades desmielinizantes , la demencia , la enfermedad cerebrovascular , las enfermedades infecciosas , la enfermedad de Alzheimer y la epilepsia . [31] [32] [33] Dado que muchas imágenes se toman con milisegundos de diferencia, muestra cómo responde el cerebro a diferentes estímulos, lo que permite a los investigadores estudiar las anomalías cerebrales funcionales y estructurales en los trastornos psicológicos. [34] La resonancia magnética también se utiliza en la cirugía estereotáctica guiada y la radiocirugía para el tratamiento de tumores intracraneales, malformaciones arteriovenosas y otras afecciones tratables quirúrgicamente utilizando un dispositivo conocido como N-localizador . [35] [36] [37] Las nuevas herramientas que implementan inteligencia artificial en el cuidado de la salud han demostrado una mayor calidad de imagen y análisis morfométrico en neuroimagen con la aplicación de un sistema de eliminación de ruido. [38]
El récord de resolución espacial más alta de un cerebro intacto (post mortem) es de 100 micrones, del Hospital General de Massachusetts. Los datos se publicaron en NATURE el 30 de octubre de 2019. [39] [40]
Aunque la resonancia magnética se utiliza ampliamente en la investigación sobre discapacidades mentales, según una revisión sistemática de la literatura y un metanálisis de 2024 encargados por el Patient-Centered Outcomes Research Institute (PCORI), la investigación disponible que utiliza exploraciones de resonancia magnética para diagnosticar el TDAH mostró una gran variabilidad. [41] Los autores concluyen que la resonancia magnética no se puede utilizar de forma fiable para ayudar a realizar un diagnóstico clínico del TDAH. [41]
Cardiovascular
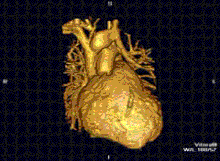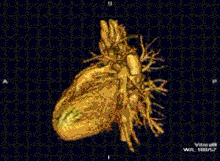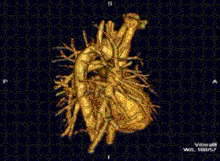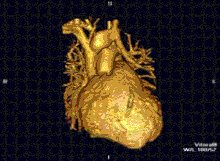
La resonancia magnética cardíaca es complementaria a otras técnicas de diagnóstico por imagen, como la ecocardiografía , la tomografía computarizada cardíaca y la medicina nuclear . Puede utilizarse para evaluar la estructura y la función del corazón. [42] Sus aplicaciones incluyen la evaluación de la isquemia y viabilidad miocárdicas , miocardiopatías , miocarditis , sobrecarga de hierro , enfermedades vasculares y cardiopatías congénitas . [43]
Músculoesquelético
Las aplicaciones en el sistema musculoesquelético incluyen imágenes de la columna vertebral , evaluación de enfermedades articulares y tumores de tejidos blandos . [44] Además, las técnicas de resonancia magnética se pueden utilizar para el diagnóstico por imágenes de enfermedades musculares sistémicas , incluidas las enfermedades musculares genéticas. [45] [46]
El movimiento de deglución de la garganta y el esófago puede causar artefactos de movimiento sobre la columna vertebral en la que se están realizando las imágenes. Por lo tanto, un pulso de saturación [ aclaración necesaria ] aplicado sobre esta región de la garganta y el esófago puede ayudar a evitar este artefacto. El artefacto de movimiento que surge debido al bombeo del corazón se puede reducir cronometrando el pulso de la resonancia magnética de acuerdo con los ciclos cardíacos. [47] Los artefactos de flujo de los vasos sanguíneos se pueden reducir aplicando pulsos de saturación por encima y por debajo de la región de interés. [48]
Hígado y tracto gastrointestinal
La RM hepatobiliar se utiliza para detectar y caracterizar lesiones del hígado , páncreas y conductos biliares . Los trastornos focales o difusos del hígado pueden evaluarse utilizando imágenes de fase opuesta ponderadas por difusión y secuencias de realce de contraste dinámico . Los agentes de contraste extracelular se utilizan ampliamente en la RM del hígado, y los agentes de contraste hepatobiliares más nuevos también brindan la oportunidad de realizar imágenes biliares funcionales. La obtención de imágenes anatómicas de los conductos biliares se logra utilizando una secuencia fuertemente ponderada en T2 en la colangiopancreatografía por resonancia magnética (CPRM). La obtención de imágenes funcionales del páncreas se realiza después de la administración de secretina . La enterografía por RM proporciona una evaluación no invasiva de la enfermedad inflamatoria intestinal y los tumores del intestino delgado. La colonografía por RM puede desempeñar un papel en la detección de pólipos grandes en pacientes con mayor riesgo de cáncer colorrectal. [49] [50] [51] [52]
Angiografía

La angiografía por resonancia magnética (ARM) genera imágenes de las arterias para evaluar si presentan estenosis (estrechamiento anormal) o aneurismas (dilatación de las paredes de los vasos, con riesgo de ruptura). La ARM se utiliza a menudo para evaluar las arterias del cuello y el cerebro, la aorta torácica y abdominal, las arterias renales y las piernas (lo que se denomina "escurrimiento"). Se pueden utilizar diversas técnicas para generar las imágenes, como la administración de un agente de contraste paramagnético ( gadolinio ) o el uso de una técnica conocida como "mejora relacionada con el flujo" (p. ej., secuencias de tiempo de vuelo 2D y 3D), donde la mayor parte de la señal en una imagen se debe a la sangre que se movió recientemente hacia ese plano (ver también FLASH MRI ). [53]
También se pueden utilizar técnicas que implican acumulación de fases (conocidas como angiografía de contraste de fases) para generar mapas de velocidad de flujo de forma fácil y precisa. La venografía por resonancia magnética (MRV) es un procedimiento similar que se utiliza para obtener imágenes de las venas. En este método, el tejido se excita ahora inferiormente, mientras que la señal se recoge en el plano inmediatamente superior al plano de excitación, obteniendo así imágenes de la sangre venosa que recientemente se movió desde el plano excitado. [54]
Agentes de contraste
La resonancia magnética para obtener imágenes de estructuras anatómicas o del flujo sanguíneo no requiere agentes de contraste, ya que las diferentes propiedades de los tejidos o de la sangre proporcionan contrastes naturales. Sin embargo, para tipos de imágenes más específicos, se pueden administrar agentes de contraste exógenos por vía intravenosa , oral o intraarticular . [6] La mayoría de los agentes de contraste son paramagnéticos (p. ej.: gadolinio, manganeso, europio) y se utilizan para acortar T1 en el tejido en el que se acumulan, o superparamagnéticos (SPION), y se utilizan para acortar T2 y T2* en tejido sano reduciendo su intensidad de señal (agentes de contraste negativos). Los agentes de contraste intravenosos más utilizados se basan en quelatos de gadolinio , que es altamente paramagnético. [55] En general, estos agentes han demostrado ser más seguros que los agentes de contraste yodados utilizados en radiografías de rayos X o TC. Las reacciones anafilactoides son raras y ocurren en aproximadamente el 0,03-0,1 %. [56] De particular interés es la menor incidencia de nefrotoxicidad, en comparación con los agentes yodados, cuando se administran en dosis habituales; esto ha hecho que la resonancia magnética con contraste sea una opción para los pacientes con insuficiencia renal, que de otro modo no podrían someterse a una tomografía computarizada con contraste . [57]
Los reactivos de contraste a base de gadolinio son típicamente complejos octadentados de gadolinio(III) . El complejo es muy estable (log K > 20) de modo que, en uso, la concentración de iones Gd 3+ no complejados debería estar por debajo del límite de toxicidad. El noveno lugar en la esfera de coordinación del ion metálico está ocupado por una molécula de agua que intercambia rápidamente con moléculas de agua en el entorno inmediato de la molécula del reactivo, lo que afecta el tiempo de relajación de la resonancia magnética . [58]
En diciembre de 2017, la Administración de Alimentos y Medicamentos (FDA) de los Estados Unidos anunció en un comunicado de seguridad de medicamentos que se incluirían nuevas advertencias en todos los agentes de contraste a base de gadolinio (GBCA). La FDA también pidió una mayor educación de los pacientes y exigió a los proveedores de contraste de gadolinio que realizaran estudios clínicos y en animales adicionales para evaluar la seguridad de estos agentes. [59] Aunque los agentes de gadolinio han demostrado ser útiles para pacientes con insuficiencia renal, en pacientes con insuficiencia renal grave que requieren diálisis existe el riesgo de una enfermedad rara pero grave, la fibrosis sistémica nefrogénica , que puede estar relacionada con el uso de ciertos agentes que contienen gadolinio. El más frecuentemente relacionado es la gadodiamida , pero también se han relacionado otros agentes. [60] Aunque no se ha establecido definitivamente un vínculo causal, las pautas actuales en los Estados Unidos son que los pacientes en diálisis solo deben recibir agentes de gadolinio cuando sea esencial y que la diálisis debe realizarse lo antes posible después de la exploración para eliminar el agente del cuerpo rápidamente. [61] [62]
En Europa, donde hay más agentes que contienen gadolinio disponibles, se ha publicado una clasificación de agentes según los riesgos potenciales. [63] [64] En 2008, se aprobó un nuevo agente de contraste llamado gadoxetato , de marca Eovist (EE. UU.) o Primovist (UE), para uso diagnóstico: este tiene el beneficio teórico de una vía de excreción dual. [65]
Secuencias
Una secuencia de MRI es una configuración particular de pulsos de radiofrecuencia y gradientes, que da como resultado una apariencia de imagen particular. [66] La ponderación T1 y T2 también se pueden describir como secuencias de MRI.
Tabla de descripción general
Esta tabla no incluye secuencias poco comunes y experimentales .
| Grupo | Secuencia | Abr. | Física | Principales distinciones clínicas | Ejemplo |
|---|---|---|---|---|---|
| Eco de giro | Ponderado en T1 | T1 | Medición de la relajación espín-red mediante el uso de un tiempo de repetición corto (TR) y un tiempo de eco (TE). |
Fundamento estándar y comparación con otras secuencias |  |
| Ponderado en T2 | T2 | Medición de la relajación espín-espín mediante tiempos TR y TE largos |
Fundamento estándar y comparación con otras secuencias |  | |
| Densidad de protones ponderada | PD | TR largo (para reducir T1) y TE corto (para minimizar T2). [70] | Enfermedades y lesiones articulares. [71]
|  | |
| Eco de gradiente (GRE) | Precesión libre en estado estacionario | SFP-S | Mantenimiento de una magnetización transversal residual constante a lo largo de ciclos sucesivos. [73] | Creación de vídeos de resonancia magnética cardíaca (en la imagen). [73] |  |
| T2 efectivo o "T2-estrella" | T2* | Eco de gradiente deteriorado (GRE) con un tiempo de eco largo y un ángulo de giro pequeño [74] | Baja señal de depósitos de hemosiderina (en la imagen) y hemorragias. [74] |  | |
| Ponderada por susceptibilidad | ISL | Eco de gradiente recuperado estropeado (GRE), flujo totalmente compensado, tiempo de eco largo, combina imagen de fase con imagen de magnitud [75] | Detección de pequeñas cantidades de hemorragia ( lesión axonal difusa en la imagen) o calcio. [75] | _in_diffuse_axonal_injury.jpg/440px-Susceptibility_weighted_imaging_(SWI)_in_diffuse_axonal_injury.jpg) | |
| Recuperación de inversión | Recuperación de inversión de tau corta | REMOVER | Supresión de grasa mediante el establecimiento de un tiempo de inversión donde la señal de grasa es cero. [76] | Señal alta en caso de edema , como en una fractura por estrés más grave . [77] Periostitis tibial en la imagen: | .jpg/440px-Shinsplint-mri_(crop).jpg) |
| Recuperación de inversión atenuada por fluido | INSTINTO | Supresión de fluidos mediante el establecimiento de un tiempo de inversión que anula los fluidos. | Señal alta en infarto lacunar , placas de esclerosis múltiple (EM) , hemorragia subaracnoidea y meningitis (en la imagen). [78] |  | |
| Recuperación de doble inversión | Dirección | Supresión simultánea del líquido cefalorraquídeo y de la sustancia blanca mediante dos tiempos de inversión. [79] | Alta señal de las placas de esclerosis múltiple (en la imagen). [79] |  | |
| Ponderación de difusión ( DWI ) | Convencional | Conducir en estado de ebriedad (DWI) | Medida del movimiento browniano de las moléculas de agua. [80] | Señal alta a los pocos minutos del infarto cerebral (en la imagen). [81] |  |
| Coeficiente de difusión aparente | Conductor adverso | Se redujo la ponderación T2 al tomar múltiples imágenes DWI convencionales con diferente ponderación DWI, y el cambio corresponde a la difusión. [82] | Minutos de baja señal después del infarto cerebral (en la imagen). [83] |  | |
| Tensor de difusión | DTI | Principalmente tractografía (en la imagen) por un mayor movimiento browniano general de las moléculas de agua en las direcciones de las fibras nerviosas. [84] |
| 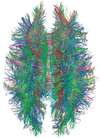 | |
| Perfusión ponderada ( PWI ) | Contraste de susceptibilidad dinámica | DSC | Mide los cambios a lo largo del tiempo en la pérdida de señal inducida por susceptibilidad debido a la inyección de contraste de gadolinio . [86] |
|  |
| Marcado de espín arterial | Lenguaje de señas americano | Marcaje magnético de la sangre arterial debajo de la placa de imagen, que posteriormente ingresa a la región de interés. [88] No necesita contraste de gadolinio. [89] | |||
| Contraste dinámico mejorado | DCE | Mide los cambios a lo largo del tiempo en el acortamiento de la relajación spin-lattice (T1) inducida por un bolo de contraste de gadolinio . [90] | La captación más rápida del contraste Gd junto con otras características es indicativa de malignidad (en la imagen). [91] |  | |
| Resonancia magnética funcional ( fMRI ) | Imágenes dependientes del nivel de oxígeno en sangre | ATREVIDO | Los cambios en el magnetismo de la hemoglobina dependiente de la saturación de oxígeno reflejan la actividad tisular. [92] | Localización de la actividad cerebral al realizar una tarea asignada (por ejemplo, hablar, mover los dedos) antes de la cirugía, también se utiliza en la investigación de la cognición. [93] |  |
| Angiografía por resonancia magnética ( ARM ) y venografía | Tiempo de vuelo | Todo el día | La sangre que ingresa al área fotografiada aún no está saturada magnéticamente , lo que le otorga una señal mucho más alta cuando se utiliza un tiempo de eco corto y compensación de flujo. | Detección de aneurisma , estenosis o disección [94] |  |
| Resonancia magnética de contraste de fases | PC-MRA | Se utilizan dos gradientes con magnitud igual, pero dirección opuesta, para codificar un cambio de fase, que es proporcional a la velocidad de los espines . [95] | Detección de aneurisma , estenosis o disección (en la imagen). [94] | _Phase_Contrast_(PC)_sequence_MRI_of_arterial_dissections.jpg/440px-Vastly_undersampled_Isotropic_Projection_Reconstruction_(VIPR)_Phase_Contrast_(PC)_sequence_MRI_of_arterial_dissections.jpg) ( VIPR ) |
Configuraciones especializadas
Espectroscopia de resonancia magnética
La espectroscopia de resonancia magnética (MRS) se utiliza para medir los niveles de diferentes metabolitos en los tejidos corporales, lo que se puede lograr a través de una variedad de técnicas basadas en imágenes o en un solo vóxel. [96] La señal de RM produce un espectro de resonancias que corresponde a diferentes disposiciones moleculares del isótopo que se está "excitando". Esta firma se utiliza para diagnosticar ciertos trastornos metabólicos, especialmente los que afectan al cerebro, [97] y para proporcionar información sobre el metabolismo tumoral . [98]
La espectroscopia de resonancia magnética (MRSI) combina métodos espectroscópicos y de imagen para producir espectros localizados espacialmente desde dentro de la muestra o el paciente. La resolución espacial es mucho menor (limitada por la relación señal-ruido (SNR ) disponible ), pero los espectros en cada vóxel contienen información sobre muchos metabolitos. Debido a que la señal disponible se utiliza para codificar información espacial y espectral, la MRSI requiere una relación señal-ruido (SNR) alta que solo se puede lograr con intensidades de campo más altas (3 T y más). [99] Los altos costos de adquisición y mantenimiento de la resonancia magnética con intensidades de campo extremadamente altas [100] inhiben su popularidad. Sin embargo, se han propuesto algoritmos de software recientes basados en detección comprimida ( por ejemplo , SAMV [101] ) para lograr una súper resolución sin requerir intensidades de campo tan altas.
En tiempo real
La resonancia magnética en tiempo real (RT-MRI) se refiere al monitoreo continuo de objetos en movimiento en tiempo real. Tradicionalmente, la resonancia magnética en tiempo real solo era posible con baja calidad de imagen o baja resolución temporal. Un algoritmo de reconstrucción iterativa eliminó las limitaciones. La resonancia magnética radial FLASH (en tiempo real) produce una resolución temporal de 20 a 30 milisegundos para imágenes con una resolución en el plano de 1,5 a 2,0 mm. [103] La resonancia magnética en tiempo real agrega información sobre enfermedades de las articulaciones y el corazón . En muchos casos, los exámenes de resonancia magnética se vuelven más fáciles y cómodos para los pacientes, especialmente para los pacientes que no pueden calmar su respiración [104] o que tienen arritmia .
La obtención de imágenes de precesión libre en estado estable balanceado (bSSFP) brinda un mejor contraste de imagen entre el depósito de sangre y el miocardio que la MRI FLASH, a costa de un artefacto de bandas severo cuando la falta de homogeneidad de B0 es fuerte. [104]Resonancia magnética intervencionista
La ausencia de efectos nocivos para el paciente y el operador hace que la resonancia magnética sea adecuada para la radiología intervencionista , en la que las imágenes producidas por un escáner de resonancia magnética guían procedimientos mínimamente invasivos. Dichos procedimientos no utilizan instrumentos ferromagnéticos . [105]
Un subconjunto especializado y en crecimiento de la resonancia magnética intervencionista es la resonancia magnética intraoperatoria , en la que se utiliza una resonancia magnética durante la cirugía. Algunos sistemas de resonancia magnética especializados permiten obtener imágenes simultáneamente con el procedimiento quirúrgico. Lo más habitual es que el procedimiento quirúrgico se interrumpa temporalmente para que la resonancia magnética pueda evaluar el éxito del procedimiento o guiar el trabajo quirúrgico posterior. [106]
Ultrasonido focalizado guiado por resonancia magnética
En la terapia guiada, los rayos de ultrasonidos focalizados de alta intensidad (HIFU) se enfocan en un tejido, que se controla mediante imágenes térmicas de RM. Debido a la alta energía en el foco, la temperatura aumenta a más de 65 °C (150 °F), lo que destruye completamente el tejido. Esta tecnología puede lograr una ablación precisa del tejido enfermo. Las imágenes de RM proporcionan una vista tridimensional del tejido objetivo, lo que permite el enfoque preciso de la energía de ultrasonido. Las imágenes de RM proporcionan imágenes térmicas cuantitativas en tiempo real del área tratada. Esto permite al médico asegurarse de que la temperatura generada durante cada ciclo de energía de ultrasonido sea suficiente para provocar la ablación térmica dentro del tejido deseado y, en caso contrario, adaptar los parámetros para garantizar un tratamiento eficaz. [107]
Imágenes multinucleares
El hidrógeno tiene el núcleo que se visualiza con mayor frecuencia en la resonancia magnética porque está presente en los tejidos biológicos en gran abundancia y porque su alta relación giromagnética proporciona una señal potente. Sin embargo, cualquier núcleo con un espín nuclear neto podría potencialmente visualizarse con la resonancia magnética. Dichos núcleos incluyen helio-3 , litio-7 , carbono-13 , flúor -19, oxígeno-17 , sodio -23, fósforo -31 y xenón-129 . 23 Na y 31 P son naturalmente abundantes en el cuerpo, por lo que se pueden visualizar directamente. Los isótopos gaseosos como 3 He o 129 Xe deben hiperpolarizarse y luego inhalarse ya que su densidad nuclear es demasiado baja para producir una señal útil en condiciones normales. 17 O y 19 F se pueden administrar en cantidades suficientes en forma líquida (por ejemplo, 17 O -agua) para que la hiperpolarización no sea una necesidad. [108] El uso de helio o xenón tiene la ventaja de reducir el ruido de fondo y, por lo tanto, aumentar el contraste de la imagen en sí, porque estos elementos normalmente no están presentes en los tejidos biológicos. [109]
Además, el núcleo de cualquier átomo que tenga un espín nuclear neto y que esté unido a un átomo de hidrógeno podría potencialmente ser fotografiado mediante una resonancia magnética de transferencia de magnetización heteronuclear que visualizaría el núcleo de hidrógeno de alta relación giromagnética en lugar del núcleo de baja relación giromagnética que está unido al átomo de hidrógeno. [110] En principio, la resonancia magnética de transferencia de magnetización heteronuclear podría utilizarse para detectar la presencia o ausencia de enlaces químicos específicos. [111] [112]
En la actualidad, la obtención de imágenes multinucleares es principalmente una técnica de investigación. Sin embargo, las posibles aplicaciones incluyen la obtención de imágenes funcionales y la obtención de imágenes de órganos que no se ven bien en la resonancia magnética de 1H (por ejemplo, pulmones y huesos) o como agentes de contraste alternativos. El 3He hiperpolarizado inhalado se puede utilizar para obtener imágenes de la distribución de los espacios de aire dentro de los pulmones. Se han estudiado soluciones inyectables que contienen 13C o burbujas estabilizadas de 129Xe hiperpolarizado como agentes de contraste para la angiografía y la obtención de imágenes de perfusión. El 31P puede proporcionar potencialmente información sobre la densidad y la estructura ósea, así como imágenes funcionales del cerebro. La obtención de imágenes multinucleares tiene el potencial de trazar la distribución del litio en el cerebro humano, elemento que se utiliza como un fármaco importante para quienes padecen afecciones como el trastorno bipolar. [113]
Imágenes moleculares por resonancia magnética
La resonancia magnética tiene la ventaja de tener una resolución espacial muy alta y es muy adecuada para la obtención de imágenes morfológicas y funcionales. Sin embargo, la resonancia magnética tiene varias desventajas. En primer lugar, la resonancia magnética tiene una sensibilidad de alrededor de 10 −3 mol/L a 10 −5 mol/L, lo que, en comparación con otros tipos de imágenes, puede ser muy limitante. Este problema se debe al hecho de que la diferencia de población entre los estados de espín nuclear es muy pequeña a temperatura ambiente. Por ejemplo, a 1,5 teslas , una intensidad de campo típica para la resonancia magnética clínica, la diferencia entre los estados de alta y baja energía es de aproximadamente 9 moléculas por 2 millones. Las mejoras para aumentar la sensibilidad de la resonancia magnética incluyen el aumento de la intensidad del campo magnético y la hiperpolarización mediante bombeo óptico o polarización nuclear dinámica. También hay una variedad de esquemas de amplificación de señales basados en el intercambio químico que aumentan la sensibilidad. [114]
Para lograr imágenes moleculares de biomarcadores de enfermedades mediante resonancia magnética, se requieren agentes de contraste de resonancia magnética dirigidos con alta especificidad y alta relaxividad (sensibilidad). Hasta la fecha, se han dedicado muchos estudios al desarrollo de agentes de contraste de resonancia magnética dirigidos para lograr imágenes moleculares mediante resonancia magnética. Comúnmente, se han aplicado péptidos, anticuerpos o ligandos pequeños y dominios proteicos pequeños, como los aficuerpos HER-2, para lograr la focalización. Para mejorar la sensibilidad de los agentes de contraste, estas fracciones de focalización generalmente se vinculan a agentes de contraste de resonancia magnética de alta carga útil o agentes de contraste de resonancia magnética con altas relaxividades. [115] Se ha introducido una nueva clase de agentes de contraste de RM dirigidos a genes para mostrar la acción genética de proteínas de factores de transcripción genética y ARNm únicos. [116] [117] Estos nuevos agentes de contraste pueden rastrear células con ARNm, microARN y virus únicos; respuesta tisular a la inflamación en cerebros vivos. [118] La RM informa cambios en la expresión genética con correlación positiva con el análisis TaqMan, la microscopía óptica y electrónica. [119]
Resonancia magnética paralela
La obtención de datos de resonancia magnética mediante aplicaciones secuenciales de gradientes de campo magnético requiere tiempo. Incluso en las secuencias de resonancia magnética más simplificadas , existen límites físicos y fisiológicos a la velocidad de cambio de gradiente. La resonancia magnética paralela evita estos límites al recopilar una parte de los datos simultáneamente, en lugar de hacerlo de forma secuencial tradicional. Esto se logra utilizando conjuntos de bobinas detectoras de radiofrecuencia (RF), cada una con una "visión" diferente del cuerpo. Se aplica un conjunto reducido de pasos de gradiente y la información espacial restante se completa combinando señales de varias bobinas, en función de sus patrones de sensibilidad espacial conocidos. La aceleración resultante está limitada por el número de bobinas y por la relación señal/ruido (que disminuye al aumentar la aceleración), pero es común lograr aceleraciones de dos a cuatro veces con configuraciones de conjuntos de bobinas adecuadas, y se han demostrado aceleraciones sustancialmente más altas con conjuntos de bobinas especializados. La resonancia magnética paralela se puede utilizar con la mayoría de las secuencias de resonancia magnética .
Después de que varias sugerencias iniciales para el uso de conjuntos de detectores para acelerar la obtención de imágenes pasaran en gran medida desapercibidas en el campo de la resonancia magnética, la obtención de imágenes en paralelo se desarrolló y aplicó ampliamente tras la introducción de la técnica de adquisición simultánea de armónicos espaciales (SMASH) en 1996-7. [120] Las técnicas de codificación de sensibilidad (SENSE) [121] y de adquisición parcialmente paralela con calibración automática generalizada (GRAPPA) [122] son los métodos de obtención de imágenes en paralelo más utilizados en la actualidad. La llegada de la resonancia magnética paralela dio lugar a una amplia investigación y desarrollo en la reconstrucción de imágenes y el diseño de bobinas de RF, así como a una rápida expansión del número de canales receptores disponibles en los sistemas de resonancia magnética comerciales. La resonancia magnética paralela se utiliza ahora de forma rutinaria para exámenes de resonancia magnética en una amplia gama de áreas corporales y aplicaciones clínicas o de investigación.
Resonancia magnética cuantitativa
La mayoría de las resonancias magnéticas se centran en la interpretación cualitativa de los datos de resonancia magnética mediante la adquisición de mapas espaciales de variaciones relativas en la intensidad de la señal que están "ponderadas" por ciertos parámetros. [123] Los métodos cuantitativos, en cambio, intentan determinar mapas espaciales de valores precisos de parámetros de relaxometría tisular o del campo magnético, o medir el tamaño de ciertas características espaciales.
Ejemplos de métodos de resonancia magnética cuantitativa son:
- Mapeo T1 (especialmente utilizado en imágenes por resonancia magnética cardíaca [124] )
- Mapeo T2 [125]
- Mapeo cuantitativo de susceptibilidad (QSM)
- Resonancia magnética cuantitativa del flujo de líquido (es decir, algunas resonancias magnéticas del flujo de líquido cefalorraquídeo [126] )
- Elastografía por resonancia magnética (ERM) [127]
La resonancia magnética cuantitativa tiene como objetivo aumentar la reproducibilidad de las imágenes y las interpretaciones de la resonancia magnética, pero históricamente ha requerido tiempos de exploración más prolongados. [123]
La resonancia magnética cuantitativa (o qMRI) a veces se refiere más específicamente a la resonancia magnética cuantitativa multiparamétrica, el mapeo de múltiples parámetros de relaxometría tisular en una sola sesión de imágenes. [128] Los esfuerzos para hacer que la resonancia magnética cuantitativa multiparamétrica sea más rápida han producido secuencias que mapean múltiples parámetros simultáneamente, ya sea mediante la creación de métodos de codificación separados para cada parámetro en la secuencia, [129] o ajustando la evolución de la señal de RM a un modelo multiparamétrico. [130] [131]
Resonancia magnética de gas hiperpolarizado
La resonancia magnética tradicional genera imágenes deficientes del tejido pulmonar porque hay menos moléculas de agua con protones que puedan ser excitadas por el campo magnético. Mediante el uso de gas hiperpolarizado, una resonancia magnética puede identificar defectos de ventilación en los pulmones. Antes de la exploración, se le pide al paciente que inhale xenón hiperpolarizado mezclado con un gas amortiguador de helio o nitrógeno. Las imágenes pulmonares resultantes son de mucha mayor calidad que con la resonancia magnética tradicional.
Seguridad
La resonancia magnética es, en general, una técnica segura, aunque pueden producirse lesiones como resultado de procedimientos de seguridad fallidos o de un error humano. [132] Las contraindicaciones para la resonancia magnética incluyen la mayoría de los implantes cocleares y marcapasos cardíacos , metralla y cuerpos extraños metálicos en los ojos . La resonancia magnética en el embarazo parece ser segura, al menos durante el segundo y tercer trimestre si se realiza sin agentes de contraste. [133] Dado que la resonancia magnética no utiliza ninguna radiación ionizante, su uso generalmente se favorece en lugar de la TC cuando cualquiera de las dos modalidades podría proporcionar la misma información. [134] Algunos pacientes experimentan claustrofobia y pueden requerir sedación o protocolos de resonancia magnética más cortos. [135] [136] La amplitud y el cambio rápido de las bobinas de gradiente durante la adquisición de imágenes pueden causar estimulación de los nervios periféricos. [137]
La resonancia magnética utiliza imanes potentes y, por lo tanto, puede hacer que los materiales magnéticos se muevan a gran velocidad, lo que supone un riesgo de proyectil y puede causar accidentes fatales. [138] Sin embargo, como se realizan millones de resonancias magnéticas en todo el mundo cada año, [139] las muertes son extremadamente raras. [140]
Las máquinas de resonancia magnética pueden producir un ruido fuerte, de hasta 120 dB(A) . [141] Esto puede causar pérdida de audición , tinnitus e hiperacusia , por lo que es esencial una protección auditiva adecuada para cualquier persona dentro de la sala del escáner de resonancia magnética durante el examen.
Uso excesivo
Las sociedades médicas publican pautas sobre cuándo los médicos deben utilizar la resonancia magnética en los pacientes y recomiendan no abusar de ella. La resonancia magnética puede detectar problemas de salud o confirmar un diagnóstico, pero las sociedades médicas a menudo recomiendan que la resonancia magnética no sea el primer procedimiento para crear un plan para diagnosticar o tratar la queja de un paciente. Un caso común es el uso de la resonancia magnética para buscar una causa de dolor lumbar ; el Colegio Americano de Médicos , por ejemplo, recomienda no realizar imágenes (incluida la resonancia magnética) ya que es poco probable que produzcan un resultado positivo para el paciente. [26] [27]
Artefactos

Un artefacto de resonancia magnética es un artefacto visual , es decir, una anomalía durante la representación visual. Pueden ocurrir muchos artefactos diferentes durante la resonancia magnética (RM), algunos afectan la calidad del diagnóstico, mientras que otros pueden confundirse con patología. Los artefactos pueden clasificarse como relacionados con el paciente, dependientes del procesamiento de la señal y relacionados con el hardware (máquina). [142]
Uso no médico
La resonancia magnética se utiliza en la industria principalmente para el análisis rutinario de sustancias químicas. La técnica de resonancia magnética nuclear también se utiliza, por ejemplo, para medir la relación entre agua y grasa en los alimentos, para controlar el flujo de fluidos corrosivos en tuberías o para estudiar estructuras moleculares como los catalizadores. [1]
Al no ser invasiva ni dañina, la resonancia magnética se puede utilizar para estudiar la anatomía de las plantas, sus procesos de transporte de agua y el equilibrio hídrico. [143] También se aplica a la radiología veterinaria con fines diagnósticos. Fuera de esto, su uso en zoología es limitado debido al alto costo; pero se puede utilizar en muchas especies. [144]
En paleontología se utiliza para examinar la estructura de los fósiles. [145]
Las imágenes forenses proporcionan documentación gráfica de una autopsia , algo que no ocurre con la autopsia manual. La tomografía computarizada proporciona imágenes rápidas de todo el cuerpo de alteraciones esqueléticas y parenquimatosas , mientras que la resonancia magnética proporciona una mejor representación de la patología de los tejidos blandos . [146] Dicho todo esto, la resonancia magnética es más cara y requiere más tiempo de uso. [146] Además, la calidad de la resonancia magnética se deteriora por debajo de los 10 °C. [147]
Historia
En 1971, en la Universidad Stony Brook , Paul Lauterbur aplicó gradientes de campo magnético en las tres dimensiones y una técnica de retroproyección para crear imágenes de RMN. Publicó las primeras imágenes de dos tubos de agua en 1973 en la revista Nature , [148] seguidas por la imagen de un animal vivo, una almeja, y en 1974 por la imagen de la cavidad torácica de un ratón. Lauterbur llamó a su método de obtención de imágenes zeugmatografía, un término que fue reemplazado por imágenes de RMN. [1] A fines de la década de 1970, los físicos Peter Mansfield y Paul Lauterbur desarrollaron técnicas relacionadas con la resonancia magnética, como la técnica de imágenes ecoplanares (EPI). [149]
El trabajo de Raymond Damadian sobre resonancia magnética nuclear (RMN) se ha incorporado a la resonancia magnética, habiéndose construido uno de los primeros escáneres. [150]
Los avances en la tecnología de semiconductores fueron cruciales para el desarrollo de la resonancia magnética práctica, que requiere una gran cantidad de potencia computacional . Esto fue posible gracias al rápido aumento del número de transistores en un solo chip de circuito integrado . [151] Mansfield y Lauterbur recibieron el Premio Nobel de Fisiología o Medicina de 2003 por sus "descubrimientos relacionados con la resonancia magnética". [152]
Véase también
- Resonancia magnética amplificada
- Resonancia magnética del flujo del líquido cefalorraquídeo
- Resonancia paramagnética electrónica
- Seguimiento de fibra de alta definición
- Tomografía computarizada de alta resolución
- Historia de la neuroimagen
- Sociedad Internacional de Resonancia Magnética en Medicina
- Jemris
- Lista de software de neuroimagen
- Inmunoensayo magnético
- Imágenes de partículas magnéticas
- Elastografía por resonancia magnética
- Resonancia magnética (revista)
- Microscopía de resonancia magnética
- Controversias sobre el Premio Nobel: ¿fisiología o medicina?
- Ciclo de Rabi
- Oscilador Robinson
- Resonancia magnética de sodio
- Virtopsia
Referencias
- ^ abc Rinck, Peter A. (2024). Resonancia magnética en medicina. Una introducción crítica. Libro de texto electrónico (14.ª ed.). TRTF – The Round Table Foundation: TwinTree Media."Resonancia magnética en medicina". www.magnetic-resonance.org .
- ^ McRobbie DW, Moore EA, Graves MJ, Prince MR (2007). Resonancia magnética de la imagen al protón . Cambridge University Press. pág. 1. ISBN 978-1-139-45719-4.
- ^ ab Hoult DI, Bahkar B (1998). "Recepción de señales de RMN: fotones virtuales y emisión espontánea coherente". Conceptos en resonancia magnética . 9 (5): 277–297. doi :10.1002/(SICI)1099-0534(1997)9:5<277::AID-CMR1>3.0.CO;2-W.
- ^ [ cita irrelevante ] Smith-Bindman R, Miglioretti DL , Johnson E, Lee C, Feigelson HS, Flynn M, et al. (junio de 2012). "Uso de estudios de diagnóstico por imágenes y exposición a radiación asociada para pacientes inscritos en grandes sistemas integrados de atención médica, 1996-2010". JAMA . 307 (22): 2400–9. doi :10.1001/jama.2012.5960. PMC 3859870 . PMID 22692172.
- ^ Panorama de la salud 2009 Indicadores de la OCDE . 2009. doi :10.1787/health_glance-2009-en. ISBN 978-92-64-07555-9.
- ^ de McRobbie DW (2007). Resonancia magnética de la imagen al protón . Cambridge, Reino Unido; Nueva York: Cambridge University Press. ISBN 978-0-521-68384-5.
- ^ "Instituto Nacional del Cáncer". Cancer.gov . Consultado el 16 de septiembre de 2024 .
- ^ "Tesla Engineering Ltd - Magnet Division - MRI Supercon" (Tesla Ingeniería Ltd - División de imanes - MRI Supercon) www.tesla.co.uk . Consultado el 16 de agosto de 2022 .
- ^ Qiuliang, Wang (enero de 2022). "Desarrollo exitoso de un imán superconductor de resonancia magnética de cuerpo entero de 9,4 T/800 mm en el Instituto de Ciencias Atmosféricas de IEEE" (PDF) . snf.ieeecsc.org . Archivado (PDF) del original el 22 de marzo de 2023.
- ^ Nowogrodzki, Anna (31 de octubre de 2018). "Las máquinas de resonancia magnética más potentes del mundo están llevando la obtención de imágenes humanas a nuevos límites". Nature . 563 (7729): 24–26. Bibcode :2018Natur.563...24N. doi :10.1038/d41586-018-07182-7. PMID 30382222. S2CID 53153608.
- ^ CEA (7 de octubre de 2021). "¡El escáner de resonancia magnética más potente del mundo ofrece sus primeras imágenes!". CEA/Portal en inglés . Consultado el 16 de agosto de 2022 .
- ^ Budinger, Thomas F.; Bird, Mark D. (1 de marzo de 2018). "Resonancia magnética y resonancia magnética del cerebro humano en campos magnéticos de 14 T a 20 T: viabilidad técnica, seguridad y horizontes de la neurociencia". NeuroImage . Neuroimagen con resonancia magnética de campo ultraalto: presente y futuro. 168 : 509–531. doi : 10.1016/j.neuroimage.2017.01.067 . ISSN 1053-8119. PMID 28179167. S2CID 4054160.
- ^ Li, Yi; Roell, Stefan (1 de diciembre de 2021). "Diseños clave de un sistema de imán superconductor de alta temperatura de diámetro corto y sin criógeno para resonancia magnética de cuerpo entero de 14 T". Ciencia y tecnología de superconductores . 34 (12): 125005. Código Bibliográfico :2021SuScT..34l5005L. doi :10.1088/1361-6668/ac2ec8. ISSN 0953-2048. S2CID 242194782.
- ^ Sasaki M, Ehara S, Nakasato T, Tamakawa Y, Kuboya Y, Sugisawa M, Sato T (abril de 1990). "RM de hombro con unidad de imán permanente de 0,2 T". AJR. Revista Estadounidense de Roentgenología . 154 (4): 777–8. doi :10.2214/ajr.154.4.2107675. PMID 2107675.
- ^ "La compañía de Guildford obtiene la aprobación de la FDA para la resonancia magnética en la cama del paciente". New Haven Register . 12 de febrero de 2020. Archivado desde el original el 3 de abril de 2020 . Consultado el 15 de abril de 2020 .
- ^ McDermott R, Lee S, ten Haken B, Trabesinger AH, Pines A, Clarke J (mayo de 2004). "Resonancia magnética de microtesla con un dispositivo superconductor de interferencia cuántica". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 101 (21): 7857–61. Bibcode :2004PNAS..101.7857M. doi : 10.1073/pnas.0402382101 . PMC 419521 . PMID 15141077.
- ^ Zotev VS, Matlashov AN, Volegov PL, Urbaitis AV, Espy MA, Kraus RH (2007). "Instrumentación basada en SQUID para resonancia magnética de campo ultrabajo". Superconductor Science and Technology . 20 (11): S367–73. arXiv : 0705.0661 . Código Bibliográfico :2007SuScT..20S.367Z. doi :10.1088/0953-2048/20/11/S13. S2CID 119160258.
- ^ Vesanen PT, Nieminen JO, Zevenhoven KC, Dabek J, Parkkonen LT, Zhdanov AV, et al. (junio de 2013). "Sistema híbrido de resonancia magnética de campo ultrabajo y magnetoencefalografía basado en un neuromagnetómetro comercial de cabeza completa". Resonancia magnética en medicina . 69 (6): 1795–804. doi : 10.1002/mrm.24413 . PMID 22807201. S2CID 40026232.
- ^ De Leon-Rodriguez, LM (2015). "Mecanismos básicos de relajación en RM y diseño de agentes de contraste". Revista de imágenes por resonancia magnética . 42 (3): 545–565. doi :10.1002/jmri.24787. PMC 4537356 . PMID 25975847.
- ^ "Experimento de relajación T1" (PDF) .
- ^ McHale, J. (2017). Espectroscopia molecular . CRC Press/Taylor and Francis Group. págs. 73–80.
- ^ abcdefg «Imágenes por resonancia magnética». Universidad de Wisconsin . Archivado desde el original el 10 de mayo de 2017. Consultado el 14 de marzo de 2016 .
- ^ abcdefghijklmn Johnson KA. "Imágenes básicas de resonancia magnética de protones. Características de la señal tisular".[¿ Fuente médica poco confiable? ]
- ^ ab Patil T (18 de enero de 2013). "Secuencias de resonancia magnética" . Consultado el 14 de marzo de 2016 .
- ^ "Resonancia magnética, una introducción crítica revisada por pares". Foro Europeo de Resonancia Magnética . Consultado el 17 de noviembre de 2014 .
- ^ ab Consumer Reports ; American College of Physicians . "Cinco cosas que los médicos y los pacientes deberían cuestionar" (PDF) . Choosing Wisely . presentado por ABIM Foundation . Archivado desde el original (PDF) el 24 de junio de 2012 . Consultado el 14 de agosto de 2012 .
- ^ ab Consumer Reports ; American College of Physicians (abril de 2012). "Pruebas de diagnóstico por imágenes para el dolor lumbar: por qué probablemente no las necesite" (PDF) . High Value Care . Archivado desde el original (PDF) el 15 de enero de 2013 . Consultado el 14 de agosto de 2012 .
- ^ Husband J (2008). Recomendaciones para la obtención de imágenes transversales en el tratamiento del cáncer: tomografía computarizada (TC), resonancia magnética (RM), tomografía por emisión de positrones (PET-TC) (PDF) . Royal College of Radiologists. ISBN 978-1-905034-13-0Archivado desde el original (PDF) el 7 de septiembre de 2012. Consultado el 29 de mayo de 2014 .
- ^ Heavey S, Costa H, Pye H, Burt EC, Jenkinson S, Lewis GR, et al. (mayo de 2019). "PEOPLE: muestras de próstata de pacientes para investigación, una vía de recolección de tejido que utiliza datos de imágenes por resonancia magnética para identificar tumores y tejido benigno en muestras de prostatectomía radical reciente". The Prostate . 79 (7): 768–777. doi :10.1002/pros.23782. PMC 6618051 . PMID 30807665.
- ^ Heavey S, Haider A, Sridhar A, Pye H, Shaw G, Freeman A, Whitaker H (octubre de 2019). "Uso de imágenes por resonancia magnética y datos de biopsia para guiar los procedimientos de muestreo para el biobanco de cáncer de próstata". Journal of Visualized Experiments (152). doi : 10.3791/60216 . PMID 31657791.
- ^ Sociedad Estadounidense de Neurorradiología (2013). "Guía práctica de la ACR-ASNR para la realización e interpretación de imágenes por resonancia magnética (IRM) del cerebro" (PDF) . Archivado desde el original (PDF) el 2017-07-12 . Consultado el 2013-11-10 .
- ^ Rowayda AS (mayo de 2012). "Una segmentación de resonancia magnética mejorada para la evaluación de la atrofia". Revista internacional de cuestiones de informática (IJCSI) . 9 (3).
- ^ Rowayda AS (febrero de 2013). "Análisis de atrofia regional de la resonancia magnética para la detección temprana de la enfermedad de Alzheimer". Revista internacional de procesamiento de señales, procesamiento de imágenes y reconocimiento de patrones . 6 (1): 49–53.
- ^ Nolen-Hoeksema S (2014). Psicología anormal (sexta edición). Nueva York: McGraw-Hill Education. pág. 67.
- ^ Brown RA, Nelson JA (junio de 2016). "La invención y la historia temprana del localizador N para la neurocirugía estereotáctica". Cureus . 8 (6): e642. doi : 10.7759/cureus.642 . PMC 4959822 . PMID 27462476.
- ^ Leksell L, Leksell D, Schwebel J (enero de 1985). "Estereotaxis y resonancia magnética nuclear". Revista de neurología, neurocirugía y psiquiatría . 48 (1): 14–8. doi :10.1136/jnnp.48.1.14. PMC 1028176 . PMID 3882889.
- ^ Heilbrun MP, Sunderland PM, McDonald PR, Wells TH, Cosman E, Ganz E (1987). "Modificaciones del marco estereotáctico de Brown-Roberts-Wells para lograr la guía de imágenes por resonancia magnética en tres planos". Neurofisiología aplicada . 50 (1–6): 143–52. doi :10.1159/000100700. PMID 3329837.
- ^ Kanemaru, Noriko; Takao, Hidemasa; Amemiya, Shiori; Abe, Osamu (2 de diciembre de 2021). "El efecto de un sistema de eliminación de ruido de procesamiento posterior al escaneo en la calidad de la imagen y el análisis morfométrico". Revista de neurorradiología . 49 (2): 205–212. doi : 10.1016/j.neurad.2021.11.007 . PMID 34863809. S2CID 244907903.
- ^ "Una resonancia magnética del cerebro humano de 100 horas de duración produce las imágenes 3D más detalladas hasta la fecha". 10 de julio de 2019.
- ^ "El equipo publica una resonancia magnética cerebral de máxima resolución".
- ^ ab Peterson, Bradley S.; Vagabundo, Joey; Maglione, Margarita; Bolshakova, María; Marrón, Mora; Rozelle, María; Motala, Aneesa; Yagyu, Sachi; Millas, Jeremy; Pakdaman, Sheila; Gastélum, Mario; Nguyen, Bich Thuy (Becky); Tokutomi, Erin; Lee, Esther; Aseguramiento, Jerusalén Z.; Schaefer, Coleman; Coughlin, Benjamín; Celosse, Karin; Molakalapalli, Sreya; Shaw, Bretaña; Sazmin, Tanzina; Onyekwuluje, Anne N.; Tolentino, Dánica; Hempel, Susanne (2024). "Diagnóstico y tratamiento del TDAH en niños y adolescentes". eficazhealthcare.ahrq.gov . doi : 10.23970/ahrqepccer267. PMID 38657097 . Consultado el 19 de junio de 2024 .
- ^ Petersen SE, Aung N, Sanghvi MM, Zemrak F, Fung K, Paiva JM, et al. (febrero de 2017). "Rangos de referencia para la estructura y función cardíacas mediante resonancia magnética cardiovascular (RMC) en caucásicos de la cohorte de población del Biobanco del Reino Unido". Revista de resonancia magnética cardiovascular . 19 (1). Springer Science and Business Media LLC: 18. doi : 10.1186/s12968-017-0327-9 . PMC 5304550 . PMID 28178995.
- ^ Colegio Americano de Radiología; Sociedad de Tomografía Computarizada Cardiovascular; Sociedad de Resonancia Magnética Cardiovascular; Sociedad Americana de Cardiología Nuclear; Sociedad Norteamericana de Imágenes Cardíacas; Sociedad de Intervenciones de Angiografía Cardiovascular; Sociedad de Radiología Intervencionista (octubre de 2006). "ACCF/ACR/SCCT/SCMR/ASNC/NASCI/SCAI/SIR 2006 criterios de idoneidad para la tomografía computarizada cardíaca y la resonancia magnética cardíaca. Un informe del Grupo de Trabajo de Criterios de Idoneidad del Comité de Direcciones Estratégicas de Calidad de la Fundación del Colegio Americano de Cardiología". Revista del Colegio Americano de Radiología . 3 (10): 751–71. doi :10.1016/j.jacr.2006.08.008. PMID 17412166.
- ^ Helms C (2008). Resonancia magnética musculoesquelética . Saunders. ISBN 978-1-4160-5534-1.
- ^ Aivazoglou, LU; Guimarães, JB; Enlace, TM; Costa, MAF; Cardoso, FN; de Mattos Lombardi Badia, B; Farías, IB; de Rezende Pinto, WBV; de Souza, PVS; Oliveira, ASB; de Siqueira Carvalho, AA; Aihara, AY; da Rocha Corrêa Fernandes, A (21 de abril de 2021). "Resonancia magnética de miopatías hereditarias: revisión y propuesta de algoritmos de imagen". Radiología Europea . 31 (11): 8498–8512. doi :10.1007/s00330-021-07931-9. PMID 33881569. S2CID 233314102.
- ^ Schmidt GP, Reiser MF, Baur-Melnyk A (diciembre de 2007). "Imágenes de cuerpo entero del sistema musculoesquelético: el valor de las imágenes por RM". Radiología esquelética . 36 (12). Springer Nature: 1109–19. doi : 10.1007/s00256-007-0323-5 . PMC 2042033 . PMID 17554538.
- ^ Havsteen I, Ohlhues A, Madsen KH, Nybing JD, Christensen H, Christensen A (2017). "¿Son los artefactos de movimiento en la resonancia magnética un problema real? - Una revisión narrativa". Frontiers in Neurology . 8 : 232. doi : 10.3389/fneur.2017.00232 . PMC 5447676 . PMID 28611728.
- ^ Taber, KH; Herrick, RC; Weathers, SW; Kumar, AJ; Schomer, DF; Hayman, LA (noviembre de 1998). "Errores y artefactos encontrados en la resonancia magnética clínica de la columna vertebral". RadioGraphics . 18 (6): 1499–1521. doi :10.1148/radiographics.18.6.9821197. ISSN 0271-5333. PMID 9821197.
- ^ Frydrychowicz A, Lubner MG, Brown JJ, Merkle EM, Nagle SK, Rofsky NM, Reeder SB (marzo de 2012). "Imágenes por resonancia magnética hepatobiliares con agentes de contraste a base de gadolinio". Journal of Magnetic Resonance Imaging . 35 (3): 492–511. doi :10.1002/jmri.22833. PMC 3281562 . PMID 22334493.
- ^ Sandrasegaran K, Lin C, Akisik FM, Tann M (julio de 2010). "Resonancia magnética pancreática de última generación". AJR. American Journal of Roentgenology . 195 (1): 42–53. doi :10.2214/ajr.195.3_supplement.0s42. PMID 20566796.
- ^ Masselli G, Gualdi G (agosto de 2012). "Imágenes por resonancia magnética del intestino delgado". Radiología . 264 (2): 333–48. doi :10.1148/radiol.12111658. PMID 22821694.
- ^ Zijta FM, Bipat S, Stoker J (mayo de 2010). "Colonografía por resonancia magnética (RM) en la detección de lesiones colorrectales: una revisión sistemática de estudios prospectivos". Radiología europea . 20 (5): 1031–46. doi :10.1007/s00330-009-1663-4. PMC 2850516 . PMID 19936754.
- ^ Wheaton AJ, Miyazaki M (agosto de 2012). "Angiografía por resonancia magnética sin contraste: principios físicos". Revista de imágenes por resonancia magnética . 36 (2). Wiley: 286–304. doi : 10.1002/jmri.23641 . PMID 22807222. S2CID 24048799.
- ^ Haacke EM, Brown RF, Thompson M, Venkatesan R (1999). Imágenes por resonancia magnética: principios físicos y diseño de secuencias . Nueva York: J. Wiley & Sons. ISBN 978-0-471-35128-3.[ página necesaria ]
- ^ Rinck PA (2014). "Capítulo 13: Agentes de contraste". Resonancia magnética en medicina .
- ^ Murphy KJ, Brunberg JA, Cohan RH (octubre de 1996). "Reacciones adversas a los medios de contraste con gadolinio: una revisión de 36 casos". AJR. Revista Estadounidense de Roentgenología . 167 (4): 847–9. doi : 10.2214/ajr.167.4.8819369 . PMID 8819369.
- ^ "Directriz del ACR". guideline.gov . 2005. Archivado desde el original el 29 de septiembre de 2006 . Consultado el 22 de noviembre de 2006 .
- ^ Shugaev, Sergey; Caravan, Peter (2021). "Iones metálicos en técnicas de bioimagen: una breve descripción general". En Sigel, Astrid; Freisinger, Eva; Sigel, Roland KO (eds.). Iones metálicos en técnicas de bioimagen . Berlín: Walter de Gruyter. págs. 1–37. doi :10.1515/9783110685701-007. ISBN 978-3-11-068570-1.
- ^ "Comunicado de seguridad de medicamentos de la FDA: la FDA advierte que los agentes de contraste a base de gadolinio (GBCA) se retienen en el cuerpo; requiere nuevas advertencias de clase". FDA de EE. UU . . 16 de mayo de 2018.
- ^ Thomsen HS, Morcos SK, Dawson P (noviembre de 2006). "¿Existe una relación causal entre la administración de medios de contraste a base de gadolinio y el desarrollo de fibrosis sistémica nefrogénica (FSN)?". Radiología clínica . 61 (11): 905–6. doi :10.1016/j.crad.2006.09.003. PMID 17018301.
- ^ "Comunicado de seguridad de medicamentos de la FDA: Nuevas advertencias para el uso de agentes de contraste a base de gadolinio en pacientes con disfunción renal". Información sobre agentes de contraste a base de gadolinio . Administración de Alimentos y Medicamentos de los Estados Unidos. 23 de diciembre de 2010. Consultado el 12 de marzo de 2011 .
- ^ "Aviso de salud pública de la FDA: agentes de contraste que contienen gadolinio para la resonancia magnética". fda.gov . Archivado desde el original el 28 de septiembre de 2006.
- ^ "Agentes de contraste que contienen gadolinio: nuevas recomendaciones para minimizar el riesgo de fibrosis sistémica nefrogénica". Drug Safety Update . 3 (6): 3. Enero de 2010.
- ^ "Preguntas y respuestas sobre resonancia magnética" (PDF) . Concord, CA: Sociedad Internacional de Resonancia Magnética en Medicina . Consultado el 2 de agosto de 2010 .
- ^ "Respuesta a la actualización de la FDA sobre fibrosis sistémica nefrogénica del 23 de mayo de 20071 — Radiología". Radiological Society of North America. 12 de septiembre de 2007. Archivado desde el original el 19 de julio de 2012. Consultado el 2 de agosto de 2010 .
- ^ Jones J, Gaillard F. "Secuencias de resonancia magnética (descripción general)". Radiopaedia . Consultado el 15 de octubre de 2017 .
- ^ abcd «Imágenes por resonancia magnética». Universidad de Wisconsin . Archivado desde el original el 10 de mayo de 2017. Consultado el 14 de marzo de 2016 .
- ^ abcd Johnson KA. "Imágenes básicas de resonancia magnética de protones. Características de la señal tisular". Facultad de Medicina de Harvard . Archivado desde el original el 5 de marzo de 2016. Consultado el 14 de marzo de 2016 .
- ^ "Preguntas sobre resonancia magnética, ecografía de espín rápido". MRIQuestions.com . Consultado el 18 de mayo de 2021 .
- ^ Graham D, Cloke P, Vosper M (31 de mayo de 2011). Principios y aplicaciones de la física radiológica. Libro electrónico (6.ª edición). Elsevier Health Sciences. pág. 292. ISBN 978-0-7020-4614-8.}
- ^ du Plessis V, Jones J. "Secuencias de resonancia magnética (descripción general)". Radiopaedia . Consultado el 13 de enero de 2017 .
- ^ Lefevre N, Naouri JF, Herman S, Gerometta A, Klouche S, Bohu Y (2016). "Una revisión actual de la imagenología del menisco: propuesta de una herramienta útil para su análisis radiológico". Investigación y práctica radiológica . 2016 : 8329296. doi : 10.1155/2016/8329296 . PMC 4766355. PMID 27057352 .
- ^ ab Luijkx T, Weerakkody Y. "Resonancia magnética de precesión libre en estado estacionario". Radiopedia . Consultado el 13 de octubre de 2017 .
- ^ ab Chavhan GB, Babyn PS, Thomas B, Shroff MM, Haacke EM (2009). "Principios, técnicas y aplicaciones de la obtención de imágenes por RM basadas en T2* y sus aplicaciones especiales". Radiographics . 29 (5): 1433–49. doi :10.1148/rg.295095034. PMC 2799958 . PMID 19755604.
- ^ ab Di Muzio B, Gaillard F. "Imágenes ponderadas por susceptibilidad" . Consultado el 15 de octubre de 2017 .
- ^ Sharma R, Taghi Niknejad M. "Recuperación de inversión de tau corta". Radiopaedia . Consultado el 13 de octubre de 2017 .
- ^ Berger F, de Jonge M, Smithuis R, Maas M. "Fracturas por estrés". Asistente de radiología . Sociedad de radiología de los Países Bajos . Consultado el 13 de octubre de 2017 .
- ^ Hacking C, Taghi Niknejad M, et al. "Recuperación de la inversión de atenuación de fluidos". radiopaedia.org . Consultado el 3 de diciembre de 2015 .
- ^ ab Di Muzio B, Abd Rabou A. "Secuencia de recuperación de doble inversión". Radiopaedia . Consultado el 13 de octubre de 2017 .
- ^ Lee M, Bashir U. "Imágenes ponderadas por difusión". Radiopedia . Consultado el 13 de octubre de 2017 .
- ^ Weerakkody Y, Gaillard F. "Accidente cerebrovascular isquémico". Radiopedia . Consultado el 15 de octubre de 2017 .
- ^ Hammer M. "MRI Physics: Diffusion-Weighted Imaging". XRayPhysics . Consultado el 15 de octubre de 2017 .
- ^ An H, Ford AL, Vo K, Powers WJ, Lee JM, Lin W (mayo de 2011). "La evolución de la señal y el riesgo de infarto para las lesiones de coeficiente de difusión aparente en el accidente cerebrovascular isquémico agudo dependen tanto del tiempo como de la perfusión". Stroke . 42 (5): 1276–81. doi :10.1161/STROKEAHA.110.610501. PMC 3384724 . PMID 21454821.
- ^ ab Smith D, Bashir U. "Imágenes con tensor de difusión". Radiopaedia . Consultado el 13 de octubre de 2017 .
- ^ Chua TC, Wen W, Slavin MJ, Sachdev PS (febrero de 2008). "Imágenes con tensor de difusión en el deterioro cognitivo leve y la enfermedad de Alzheimer: una revisión". Current Opinion in Neurology . 21 (1): 83–92. doi :10.1097/WCO.0b013e3282f4594b. PMID 18180656. S2CID 24731783.
- ^ Gaillard F. "Perfusión por RM con contraste de susceptibilidad dinámica (DSC)". Radiopaedia . Consultado el 14 de octubre de 2017 .
- ^ Chen F, Ni YC (marzo de 2012). "Desajuste de difusión-perfusión por resonancia magnética en el accidente cerebrovascular isquémico agudo: una actualización". Revista mundial de radiología . 4 (3): 63–74. doi : 10.4329/wjr.v4.i3.63 . PMC 3314930 . PMID 22468186.
- ^ "Etiquetado de espín arterial". Universidad de Michigan . Consultado el 27 de octubre de 2017 .
- ^ Gaillard F. "Arterial spin labelling (ASL) MR perfusion" (Marcaje de espín arterial (ASL) perfusión por RM). Radiopaedia . Consultado el 15 de octubre de 2017 .
- ^ Gaillard F. "Perfusión por RM con contraste dinámico mejorado (DCE)". Radiopaedia . Consultado el 15 de octubre de 2017 .
- ^ Turnbull LW (enero de 2009). "Resonancia magnética con contraste dinámico en el diagnóstico y tratamiento del cáncer de mama". RMN en biomedicina . 22 (1): 28–39. doi :10.1002/nbm.1273. PMID 18654999. S2CID 5305422.
- ^ Chou Ih. «Milestone 19: (1990) Functional MRI» (Hito 19: (1990) Resonancia magnética funcional). Nature . Consultado el 9 de agosto de 2013 .
- ^ Luijkx T, Gaillard F. "Resonancia magnética funcional". Radiopedia . Consultado el 16 de octubre de 2017 .
- ^ ab "Angiografía por resonancia magnética (ARM)". Hospital Johns Hopkins . Consultado el 15 de octubre de 2017 .
- ^ Keshavamurthy J, Ballinger R et al. "Imágenes con contraste de fase". Radiopaedia . Consultado el 15 de octubre de 2017 .
- ^ Landheer K, Schulte RF, Treacy MS, Swanberg KM, Juchem C (abril de 2020). "Descripción teórica de secuencias de pulsos espectroscópicos de resonancia magnética in vivo de 1 H modernos". Revista de imágenes por resonancia magnética . 51 (4): 1008–1029. doi :10.1002/jmri.26846. PMID 31273880. S2CID 195806833.
- ^ Rosen Y, Lenkinski RE (julio de 2007). "Avances recientes en neuroespectroscopia por resonancia magnética". Neurotherapeutics . 4 (3): 330–45. doi : 10.1016/j.nurt.2007.04.009 . PMC 7479727 . PMID 17599700.
- ^ Golder W (junio de 2004). "Espectroscopia de resonancia magnética en oncología clínica". Onkologie . 27 (3): 304–9. doi :10.1159/000077983. PMID 15249722. S2CID 20644834.
- ^ Chakeres DW, Abduljalil AM, Novak P, Novak V (2002). "Comparación de imágenes por resonancia magnética de alta resolución de 1,5 y 8 teslas de infartos lacunares". Revista de tomografía asistida por ordenador . 26 (4): 628–32. doi :10.1097/00004728-200207000-00027. PMID 12218832. S2CID 32536398.
- ^ "MRI-scanner van 7 miljoen in gebruik" [Escáner de resonancia magnética de 7 millones de euros en uso] (en holandés). Contacto médico. 5 de diciembre de 2007.
- ^ Abeida H, Zhang Q, Li J, Merabtine N (2013). "Enfoques iterativos dispersos asintóticos basados en varianza mínima para procesamiento de matrices". IEEE Transactions on Signal Processing . 61 (4): 933–44. arXiv : 1802.03070 . Bibcode :2013ITSP...61..933A. doi :10.1109/tsp.2012.2231676. S2CID 16276001.
- ^ S Zhang, M Uecker, D Voit, KD Merboldt, J Frahm (2010a) Resonancia magnética cardiovascular en tiempo real con alta resolución temporal: FLASH radial con reconstrucción inversa no lineal. J Cardiovasc Magn Reson 12, 39, [1] doi :10.1186/1532-429X-12-39
- ^ M Uecker, S Zhang, D Voit, A Karaus, KD Merboldt, J Frahm (2010a) Resonancia magnética en tiempo real con una resolución de 20 ms. RMN Biomed 23: 986-994, [2] doi :10.1002/nbm.1585
- ^ ab Uyanik I, Lindner P, Tsiamyrtzis P, Shah D, Tsekos NV, Pavlidis IT (2013). "Aplicación de un método de conjunto de niveles para resolver movimientos fisiológicos en resonancia magnética cardíaca sin compuerta y con respiración libre". Imágenes funcionales y modelado del corazón . Apuntes de clase en informática. Vol. 7945. págs. 466–473. doi :10.1007/978-3-642-38899-6_55. ISBN 978-3-642-38898-9. ISSN 0302-9743. S2CID 16840737.
- ^ Lewin JS (mayo de 1999). "Imágenes por resonancia magnética intervencionistas: conceptos, sistemas y aplicaciones en neurorradiología". AJNR. American Journal of Neuroradiology . 20 (5): 735–48. PMC 7056143 . PMID 10369339.
- ^ Sisk JE (2013). La enciclopedia Gale de enfermería y salud afines (3.ª ed.). Farmington, MI: Gale. ISBN 9781414498881– vía Credo Reference.
- ^ Cline HE, Schenck JF, Hynynen K, Watkins RD, Souza SP, Jolesz FA (1992). "Cirugía ultrasónica focalizada guiada por RM". Revista de tomografía asistida por computadora . 16 (6): 956–65. doi :10.1097/00004728-199211000-00024. PMID 1430448. S2CID 11944489.
- ^ Gore JC, Yankeelov TE, Peterson TE, Avison MJ (junio de 2009). "¿Imágenes moleculares sin radiofármacos?". Journal of Nuclear Medicine . 50 (6). Sociedad de Medicina Nuclear: 999–1007. doi :10.2967/jnumed.108.059576. PMC 2719757 . PMID 19443583.
- ^ "Laboratorio de resonancia magnética con gases nobles hiperpolarizados: imágenes de resonancia magnética con xenón hiperpolarizado del cerebro". Facultad de Medicina de Harvard. Archivado desde el original el 20 de septiembre de 2018. Consultado el 26 de julio de 2017 .
- ^ Hurd RE, John BK (1991). "Espectroscopia de coherencia cuántica múltiple heteronuclear detectada por protones y potenciada por gradiente". Journal of Magnetic Resonance . 91 (3): 648–53. Bibcode :1991JMagR..91..648H. doi :10.1016/0022-2364(91)90395-a.
- ^ Brown RA, Venters RA, Tang PP, Spicer LD (1995). "Una prueba para el acoplamiento de escaladores entre heteronúcleos utilizando espectroscopia HMQC detectada por protones y potenciada por gradiente". Revista de resonancia magnética, serie A . 113 (1): 117–19. Código Bibliográfico :1995JMagR.113..117B. doi :10.1006/jmra.1995.1064.
- ^ Miller AF, Egan LA, Townsend CA (marzo de 1997). "Medición del grado de enriquecimiento isotópico acoplado de diferentes posiciones en un péptido antibiótico por RMN". Journal of Magnetic Resonance . 125 (1): 120–31. Bibcode :1997JMagR.125..120M. doi : 10.1006/jmre.1997.1107 . PMID 9245367. S2CID 14022996.
- ^ Necus J, Sinha N, Smith FE, Thelwall PE, Flowers CJ, Taylor PN, et al. (junio de 2019). "Propiedades microestructurales de la materia blanca en el trastorno bipolar en relación con la distribución espacial del litio en el cerebro". Journal of Affective Disorders . 253 : 224–231. doi : 10.1016/j.jad.2019.04.075 . PMC 6609924 . PMID 31054448.
- ^ Gallagher FA (julio de 2010). "Introducción a la imagenología funcional y molecular con resonancia magnética". Radiología clínica . 65 (7): 557–66. doi :10.1016/j.crad.2010.04.006. PMID 20541655.
- ^ Xue S, Qiao J, Pu F, Cameron M, Yang JJ (2013). "Diseño de una nueva clase de agentes de contraste de resonancia magnética basados en proteínas para la obtención de imágenes moleculares de biomarcadores de cáncer". Wiley Interdisciplinary Reviews. Nanomedicina y nanobiotecnología . 5 (2): 163–79. doi :10.1002/wnan.1205. PMC 4011496 . PMID 23335551.
- ^ Liu CH, Kim YR, Ren JQ, Eichler F, Rosen BR, Liu PK (enero de 2007). "Obtención de imágenes de las transcripciones de genes cerebrales en animales vivos". The Journal of Neuroscience . 27 (3): 713–22. doi :10.1523/JNEUROSCI.4660-06.2007. PMC 2647966 . PMID 17234603.
- ^ Liu CH, Ren J, Liu CM, Liu PK (enero de 2014). "Resonancia magnética guiada por proteína del factor de transcripción génica intracelular mediante aptámeros de ADN in vivo". FASEB Journal . 28 (1): 464–73. doi : 10.1096/fj.13-234229 . PMC 3868842 . PMID 24115049.
- ^ Liu CH, You Z, Liu CM, Kim YR, Whalen MJ, Rosen BR, Liu PK (marzo de 2009). "Reversión de la resonancia magnética ponderada por difusión mediante la supresión génica de las actividades de la metaloproteinasa de matriz-9 en cerebros de animales vivos". The Journal of Neuroscience . 29 (11): 3508–17. doi :10.1523/JNEUROSCI.5332-08.2009. PMC 2726707 . PMID 19295156.
- ^ Liu CH, Yang J, Ren JQ, Liu CM, You Z, Liu PK (febrero de 2013). "La resonancia magnética revela efectos diferenciales de la exposición a la anfetamina en la neuroglia in vivo". Revista FASEB . 27 (2): 712–24. doi : 10.1096/fj.12-220061 . PMC 3545538 . PMID 23150521.
- ^ Sodickson DK, Manning WJ (octubre de 1997). "Adquisición simultánea de armónicos espaciales (SMASH): obtención rápida de imágenes con conjuntos de bobinas de radiofrecuencia". Resonancia magnética en medicina . 38 (4): 591–603. doi :10.1002/mrm.1910380414. PMID 9324327. S2CID 17505246.
- ^ Pruessmann KP, Weiger M, Scheidegger MB, Boesiger P (noviembre de 1999). "SENSE: codificación de sensibilidad para resonancia magnética rápida". Resonancia magnética en medicina . 42 (5): 952–62. doi : 10.1002/(SICI)1522-2594(199911)42:5<952::AID-MRM16>3.0.CO;2-S . PMID: 10542355. S2CID : 16046989 .
- ^ Griswold MA, Jakob PM, Heidemann RM, Nittka M, Jellus V, Wang J, Kiefer B, Haase A (junio de 2002). "Adquisiciones parcialmente paralelas con autocalibración generalizada (GRAPPA)". Resonancia magnética en medicina . 47 (6): 1202–10. doi : 10.1002/mrm.10171 . PMID 12111967. S2CID 14724155 .
- ^ ab Gulani, Vikas y Nicole, Sieberlich (2020). "Resonancia magnética cuantitativa: fundamento y desafíos". Imágenes por resonancia magnética cuantitativa . Academic Press. pág. xxxvii-li. doi : 10.1016/B978-0-12-817057-1.00001-9 . ISBN . 9780128170571.S2CID234995365 .
- ^ Captur, G; Manisty, C; Moon, JC (2016). "Evaluación de la enfermedad miocárdica mediante resonancia magnética cardíaca". Heart . 102 (18): 1429–35. doi :10.1136/heartjnl-2015-309077. PMID 27354273. S2CID 23647168.
- ^ Cobianchi Bellisari, F; De Marino, L; Arrigoni, F; Mariani, S; Bruno, F; Palumbo, P; et al. (2021). "Evaluación mediante resonancia magnética con mapeo T2 del cartílago patelofemoral en pacientes sometidos a inyecciones intraarticulares de plasma rico en plaquetas (PRP)". Radiol Med . 126 (8): 1085–1094. doi : 10.1007/s11547-021-01372-6 . PMC 8292236 . PMID 34008045.
- ^ Gaillard, Frank; Knipe, Henry (13 de octubre de 2021). "Estudios del flujo del LCR | Artículo de referencia sobre radiología". Radiopaedia . doi : 10.53347/rID-37401 . Consultado el 24 de noviembre de 2021 .
- ^ Hirsch, Sebastián; Braun, Jürgen; Saco, Ingolf (2016). Elastografía por Resonancia Magnética | Libros en línea de Wiley. doi :10.1002/9783527696017. ISBN 9783527696017Archivado desde el original el 5 de marzo de 2022. Consultado el 6 de marzo de 2022 .
- ^ Seiler A, Nöth U, Hok P, Reiländer A, Maiworm M, Baudrexel S; et al. (2021). "Resonancia magnética cuantitativa multiparamétrica en enfermedades neurológicas". Front Neurol . 12 : 640239. doi : 10.3389/fneur.2021.640239 . PMC 7982527 . PMID 33763021.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Warntjes JB, Leinhard OD, West J, Lundberg P (2008). "Cuantificación rápida por resonancia magnética en el cerebro: optimización para uso clínico". Magn Reson Med . 60 (2): 320–9. doi : 10.1002/mrm.21635 . PMID 18666127. S2CID 11617224.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Ehses P, Seiberlich N, Ma D, Breuer FA, Jakob PM, Griswold MA; et al. (2013). "IR TrueFISP con una lectura radial basada en la proporción áurea: cuantificación rápida de T1, T2 y densidad de protones". Magn Reson Med . 69 (1): 71–81. doi : 10.1002/mrm.24225 . PMID 22378141. S2CID 24244167.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Ma D, Gulani V, Seiberlich N, Liu K, Sunshine JL, Duerk JL; et al. (2013). "Huellas digitales por resonancia magnética". Nature . 495 (7440): 187–92. Bibcode :2013Natur.495..187M. doi :10.1038/nature11971. PMC 3602925 . PMID 23486058.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Watson RE (2015). "Lecciones aprendidas de los eventos de seguridad relacionados con la resonancia magnética". Current Radiology Reports . 3 (10). doi :10.1007/s40134-015-0122-z. S2CID 57880401.
- ^ Mervak BM, Altun E, McGinty KA, Hyslop WB, Semelka RC, Burke LM (marzo de 2019). "Resonancia magnética en el embarazo: indicaciones y consideraciones prácticas". Revista de imágenes por resonancia magnética . 49 (3): 621–631. doi :10.1002/jmri.26317. PMID 30701610. S2CID 73412175.
- ^ "iRefer". Royal College of Radiologists. Archivado desde el original el 3 de febrero de 2014. Consultado el 10 de noviembre de 2013 .
- ^ Murphy KJ, Brunberg JA (1997). "Claustrofobia, ansiedad y sedación en adultos en la resonancia magnética". Imágenes por resonancia magnética . 15 (1). Elsevier BV: 51–4. doi :10.1016/s0730-725x(96)00351-7. PMID 9084025.
- ^ Shahrouki, Puja; Nguyen, Kim-Lien; Moriarty, John M.; Plotnik, Adam N.; Yoshida, Takegawa; Finn, J. Paul (1 de septiembre de 2021). "Minimización del tiempo en la mesa en pacientes con claustrofobia mediante angiografía por resonancia magnética focalizada con ferumoxitol (f-FEMRA): un estudio de viabilidad". The British Journal of Radiology . 94 (1125): 20210430. doi :10.1259/bjr.20210430. ISSN 0007-1285. PMC 9327752 . PMID 34415199.
- ^ Klein V, Davids M, Schad LR, Wald LL, Guérin B (febrero de 2021). "Investigación de los límites de estimulación cardíaca de las bobinas de gradiente de resonancia magnética mediante simulaciones electromagnéticas y electrofisiológicas en modelos corporales humanos y caninos". Resonancia magnética en medicina . 85 (2): 1047–1061. doi :10.1002/mrm.28472. PMC 7722025 . PMID 32812280.
- ^ Agence France-Presse (30 de enero de 2018). «Un hombre muere tras ser absorbido por un escáner de resonancia magnética en un hospital de la India». The Guardian .
- ^ "Exámenes de resonancia magnética (IRM) por cada 1.000 habitantes, 2014". OCDE . 2016.
- ^ Mansouri M, Aran S, Harvey HB, Shaqdan KW, Abujudeh HH (abril de 2016). "Tasas de notificación de incidentes de seguridad en la resonancia magnética en un gran centro médico académico". Revista de imágenes por resonancia magnética . 43 (4). John Wiley and Sons : 998–1007. doi : 10.1002/jmri.25055 . PMID 26483127. S2CID 25245904.
- ^ Price, DL; De Wilde, JP; Papadaki, AM; Curran, JS; Kitney, RI (febrero de 2001). "Investigación del ruido acústico en 15 escáneres de resonancia magnética de 0,2 T a 3 T". Revista de imágenes por resonancia magnética . 13 (2): 288–293. doi : 10.1002/1522-2586(200102)13:2<288::aid-jmri1041>3.0.co;2-p . ISSN 1053-1807. PMID 11169836. S2CID 20684100.
- ^ ab Erasmus LJ, Hurter D, Naude M, Kritzinger HG, Acho S (2004). "Una breve descripción de los artefactos de resonancia magnética". Revista Sudafricana de Radiología . 8 (2): 13. doi : 10.4102/sajr.v8i2.127 .
- ^ Van As H (30 de noviembre de 2006). "Resonancia magnética de plantas intactas para el estudio de las relaciones hídricas entre células, la permeabilidad de la membrana y el transporte de agua de célula a célula y a larga distancia". Journal of Experimental Botany . 58 (4). Oxford University Press (OUP): 743–56. doi : 10.1093/jxb/erl157 . PMID 17175554.
- ^ Ziegler A, Kunth M, Mueller S, Bock C, Pohmann R, Schröder L, Faber C, Giribet G (13 de octubre de 2011). "Aplicación de la resonancia magnética en zoología". Zoomorfología . 130 (4). Springer Science and Business Media LLC: 227–254. doi :10.1007/s00435-011-0138-8. hdl : 11858/00-001M-0000-0013-B8B0-B . ISSN 0720-213X. S2CID 43555012.
- ^ Giovannetti G, Guerrini A, Salvadori PA (julio de 2016). "Espectroscopia e imágenes por resonancia magnética para el estudio de fósiles". Imágenes por resonancia magnética . 34 (6). Elsevier BV: 730–742. doi :10.1016/j.mri.2016.03.010. PMID 26979538.
- ^ ab Filograna L, Pugliese L, Muto M, Tatulli D, Guglielmi G, Thali MJ, Floris R (febrero de 2019). "Una guía práctica para la autopsia virtual: por qué, cuándo y cómo". Seminarios en ecografía, TC y RM . 40 (1): 56–66. doi :10.1053/j.sult.2018.10.011. PMID 30686369. S2CID 59304740.
- ^ Ruder TD, Thali MJ, Hatch GM (abril de 2014). "Aspectos básicos de la obtención de imágenes por resonancia magnética post mortem forense en adultos". The British Journal of Radiology . 87 (1036): 20130567. doi :10.1259/bjr.20130567. PMC 4067017 . PMID 24191122.
- ^ LAUTERBUR, PC (1973). "Formación de imágenes por interacciones locales inducidas: ejemplos que emplean resonancia magnética nuclear". Nature . 242 (5394). Springer Science and Business Media LLC: 190–191. Bibcode :1973Natur.242..190L. doi :10.1038/242190a0. ISSN 0028-0836. S2CID 4176060.
- ^ Mansfield P, Grannell PK (1975). ""Difracción" y microscopía en sólidos y líquidos por RMN". Physical Review B . 12 (9): 3618–34. Bibcode :1975PhRvB..12.3618M. doi :10.1103/physrevb.12.3618.
- ^ Sandomir, Richard (17 de agosto de 2022). "Raymond Damadian, creador del primer escáner de resonancia magnética, muere a los 86 años". The New York Times – vía NYTimes.com.
- ^ Rosenblum B, Kuttner F (2011). Enigma cuántico: la física se encuentra con la conciencia. Oxford University Press . pág. 127. ISBN 9780199792955.
- ^ "El Premio Nobel de Fisiología o Medicina 2003". Fundación Nobel. Archivado desde el original el 18 de julio de 2007. Consultado el 28 de julio de 2007 .
Lectura adicional
- Blümer P (1998). Blümler P, Blümich B, Botto RE, Fukushima E (eds.). Resonancia magnética resuelta espacialmente: métodos, materiales, medicina, biología, reología, geología, ecología, hardware . Wiley-VCH. ISBN 978-3-527-29637-8.
- Blümich B, Kuhn W (1992). Microscopía de resonancia magnética: métodos y aplicaciones en ciencia de materiales, agricultura y biomedicina . Wiley. ISBN 978-3-527-28403-0.
- Blümich B (2000). Imágenes de materiales por RMN . Clarendon Press. ISBN 978-0-19-850683-6.
- Eustace SJ, Nelson E (junio de 2004). "Resonancia magnética de cuerpo entero". BMJ . 328 (7453): 1387–8. doi :10.1136/bmj.328.7453.1387. PMC 421763 . PMID 15191954.
- Farhat IA, Belton P, Webb GA (2007). Resonancia magnética en la ciencia de los alimentos: de las moléculas al hombre . Royal Society of Chemistry. ISBN 978-0-85404-340-8.
- Fukushima E (1989). RMN en biomedicina: la base física . Springer Science & Business Media. ISBN 978-0-88318-609-1.
- Haacke EM, Brown RF, Thompson M, Venkatesan R (1999). Imágenes por resonancia magnética: principios físicos y diseño de secuencias . Nueva York: J. Wiley & Sons. ISBN 978-0-471-35128-3.
- Jin (1998). Análisis y diseño electromagnético en imágenes por resonancia magnética . CRC Press. ISBN 978-0-8493-9693-9.
- Kuperman V (2000). Imágenes por resonancia magnética: principios físicos y aplicaciones . Academic Press. ISBN 978-0-08-053570-8.
- Lee SC, Kim K, Kim J, Lee S, Han Yi J, Kim SW, et al. (junio de 2001). "Microscopía de RMN con resolución de un micrómetro". Journal of Magnetic Resonance . 150 (2): 207–13. Bibcode :2001JMagR.150..207L. doi :10.1006/jmre.2001.2319. PMID 11384182.
- Liang ZP, Lauterbur PC (1999). Principios de la resonancia magnética: una perspectiva de procesamiento de señales. Wiley. ISBN 978-0-7803-4723-6.
- Mansfield P (1982). Imágenes por RMN en biomedicina: Suplemento 2 Avances en resonancia magnética . Elsevier. ISBN 978-0-323-15406-2.
- Pykett IL (mayo de 1982). "Imágenes por RMN en medicina". Scientific American . 246 (5): 78–88. Bibcode :1982SciAm.246e..78P. doi :10.1038/scientificamerican0582-78. PMID 7079720.
- Rinck PA (ed.). "La historia de la resonancia magnética". TRTF/EMRF .
- Sakr, HM; Fahmy, N; Elsayed, NS; Abdulhady, H; El-Sobky, TA; Saadawy, AM; Beroud, C; Udd, B (1 de julio de 2021). "Características de la resonancia magnética de los músculos de todo el cuerpo de los niños con distrofia muscular congénita relacionada con LAMA2: un patrón emergente". Trastornos neuromusculares . 31 (9): 814–823. doi :10.1016/j.nmd.2021.06.012. PMID 34481707. S2CID 235691786.
- Schmitt F, Stehling MK, Turner R (1998). Imágenes ecoplanares: teoría, técnica y aplicación. Springer Berlin Heidelberg. ISBN 978-3-540-63194-1.
- Simon M, Mattson JS (1996). Los pioneros de la RMN y la resonancia magnética en medicina: la historia de la RMN. Ramat Gan, Israel: Bar-Ilan University Press. ISBN 978-0-9619243-1-7.
- Sprawls P (2000). Imágenes por resonancia magnética: principios, métodos y técnicas. Medical Physics Publishing. ISBN 978-0-944838-97-6.
Enlaces externos
- Rinck PA (ed.). "MRI: Una introducción crítica revisada por pares". Foro Europeo de Resonancia Magnética (EMRF)/The Round Table Foundation (TRTF) .
- Visita guiada a la resonancia magnética: una introducción para laicos Laboratorio Nacional de Altos Campos Magnéticos
- Fundamentos de la resonancia magnética. Física subyacente y aspectos técnicos .
- Vídeo: Qué esperar durante su examen de resonancia magnética del Instituto para la seguridad, la educación y la investigación en resonancia magnética (IMRSER)
- Conferencia de la Royal Institution – Resonancia magnética: una ventana al cuerpo humano
- Breve historia de la resonancia magnética desde un punto de vista europeo
- Cómo funciona la resonancia magnética explicado de forma sencilla mediante diagramas
- Vídeos de resonancia magnética en tiempo real: Biomedizinische NMR Forschungs GmbH.
- Paul C. Lauterbur, Cuaderno sobre la génesis de la resonancia magnética (MRI), septiembre de 1971 (todas las páginas están disponibles para su descarga gratuita en una variedad de formatos desde las colecciones digitales del Science History Institute en digital.sciencehistory.org)




