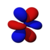
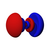
Orbital atómico

En mecánica cuántica , un orbital atómico ( / ˈɔːrbɪtəl / ) es una función que describe la ubicación y el comportamiento ondulatorio de un electrón en un átomo . [1] Esta función describe la distribución de carga de un electrón alrededor del núcleo del átomo y se puede utilizar para calcular la probabilidad de encontrar un electrón en una región específica alrededor del núcleo. [2]
Cada orbital de un átomo se caracteriza por un conjunto de valores de tres números cuánticos n , ℓ y m ℓ , que corresponden respectivamente a la energía del electrón, su momento angular orbital y su momento angular orbital proyectado a lo largo de un eje elegido ( número cuántico magnético ). Los orbitales con un número cuántico magnético bien definido son generalmente de valor complejo. Los orbitales de valor real se pueden formar como combinaciones lineales de orbitales m ℓ y −m ℓ , y a menudo se etiquetan utilizando polinomios armónicos asociados (por ejemplo, xy , x 2 − y 2 ) que describen su estructura angular.
Un orbital puede estar ocupado por un máximo de dos electrones, cada uno con su propia proyección de espín . Los nombres simples orbital s , orbital p , orbital d y orbital f se refieren a orbitales con número cuántico de momento angular ℓ = 0, 1, 2 y 3 respectivamente. Estos nombres, junto con sus valores n, se utilizan para describir las configuraciones electrónicas de los átomos. Se derivan de la descripción de los primeros espectroscopistas de ciertas series de líneas espectroscópicas de metales alcalinos como aguda , principal , difusa y fundamental . Los orbitales para ℓ > 3 continúan alfabéticamente (g, h, i, k, ...), [3] omitiendo j [4] [5] porque algunos idiomas no distinguen entre las letras "i" y "j". [6]
Los orbitales atómicos son los bloques básicos del modelo orbital atómico (o modelo de nube de electrones o de mecánica ondulatoria), un marco moderno para visualizar el comportamiento submicroscópico de los electrones en la materia. En este modelo, la nube de electrones de un átomo puede verse como construida (en aproximación) en una configuración electrónica que es un producto de orbitales atómicos más simples similares al hidrógeno . La periodicidad repetitiva de bloques de 2, 6, 10 y 14 elementos dentro de las secciones de la tabla periódica surge naturalmente del número total de electrones que ocupan un conjunto completo de orbitales s, p, d y f, respectivamente, aunque para valores más altos del número cuántico n , particularmente cuando el átomo tiene una carga positiva, las energías de ciertas subcapas se vuelven muy similares y, por lo tanto, el orden en el que se dice que están pobladas por electrones (por ejemplo, Cr = [Ar]4s 1 3d 5 y Cr 2+ = [Ar]3d 4 ) solo se puede racionalizar de manera algo arbitraria.

Propiedades de los electrones
Con el desarrollo de la mecánica cuántica y los hallazgos experimentales (como la difracción de electrones por dos rendijas), se descubrió que los electrones que orbitan alrededor de un núcleo no podían describirse completamente como partículas, sino que era necesario explicarlos mediante la dualidad onda-partícula . En este sentido, los electrones tienen las siguientes propiedades:
Propiedades ondulatorias:
- Los electrones no orbitan alrededor de un núcleo como un planeta orbita alrededor de una estrella, sino que existen como ondas estacionarias . Por lo tanto, la energía más baja posible que puede tomar un electrón es similar a la frecuencia fundamental de una onda en una cuerda. Los estados de energía más altos son similares a los armónicos de esa frecuencia fundamental.
- Los electrones nunca se encuentran en un único punto, aunque la probabilidad de interacción con el electrón en un único punto se puede encontrar a partir de la función de onda del electrón . La carga del electrón actúa como si estuviera esparcida en el espacio en una distribución continua, proporcional en cualquier punto al cuadrado de la magnitud de la función de onda del electrón.
Propiedades similares a partículas:
- El número de electrones que orbitan alrededor del núcleo sólo puede ser un número entero.
- Los electrones saltan entre orbitales como las partículas. Por ejemplo, si un fotón choca con los electrones, solo uno de ellos cambia de estado.
- Los electrones conservan propiedades similares a las de las partículas, como por ejemplo: cada estado de onda tiene la misma carga eléctrica que su partícula electrónica. Cada estado de onda tiene un único espín discreto (espín hacia arriba o hacia abajo) según su superposición .
Por lo tanto, los electrones no pueden describirse simplemente como partículas sólidas. Una analogía podría ser la de una "atmósfera" grande y a menudo de forma extraña (el electrón), distribuida alrededor de un planeta relativamente pequeño (el núcleo). Los orbitales atómicos describen exactamente la forma de esta "atmósfera" solo cuando hay un electrón presente. Cuando se agregan más electrones, los electrones adicionales tienden a llenar de manera más uniforme un volumen de espacio alrededor del núcleo de modo que la colección resultante ("nube de electrones" [7] ) tiende hacia una zona de probabilidad generalmente esférica que describe la ubicación del electrón, debido al principio de incertidumbre .
Hay que recordar que estos "estados" orbitales, como se describen aquí, son meramente estados propios de un electrón en su órbita. Un electrón real existe en una superposición de estados, que es como un promedio ponderado , pero con pesos de números complejos . Así, por ejemplo, un electrón podría estar en un estado propio puro (2, 1, 0), o en un estado mixto .1/2 (2, 1, 0) + 1/2 (2, 1, 1), o incluso el estado mixto 2/5 (2, 1, 0) + 3/5 (2, 1, 1). Para cada estado propio, una propiedad tiene un valor propio . Por lo tanto, para los tres estados que acabamos de mencionar, el valor de es 2 y el valor de es 1. Para el segundo y tercer estado, el valor de es una superposición de 0 y 1. Como superposición de estados, es ambigua (o exactamente 0 o exactamente 1), no un valor intermedio o promedio como la fracción 1/2 . Una superposición de los estados propios (2, 1, 1) y (3, 2, 1) tendría un y ambiguo , pero definitivamente sería 1. Los estados propios facilitan el manejo de las matemáticas. Puedes elegir una base diferente de estados propios superponiendo estados propios de cualquier otra base (ver Orbitales reales a continuación).
Definición formal de mecánica cuántica
Los orbitales atómicos pueden definirse con mayor precisión en el lenguaje formal de la mecánica cuántica . Son soluciones aproximadas a la ecuación de Schrödinger para los electrones ligados al átomo por el campo eléctrico del núcleo del átomo . Específicamente, en la mecánica cuántica, el estado de un átomo, es decir, un estado propio del hamiltoniano atómico , se aproxima mediante una expansión (ver expansión de interacción de configuración y conjunto base ) en combinaciones lineales de productos antisimetrizados ( determinantes de Slater ) de funciones de un electrón. Los componentes espaciales de estas funciones de un electrón se denominan orbitales atómicos. (Cuando se considera también su componente de espín , se habla de orbitales de espín atómicos ). Un estado es en realidad una función de las coordenadas de todos los electrones, de modo que su movimiento está correlacionado, pero esto a menudo se aproxima mediante este modelo de partículas independientes de productos de funciones de onda de un solo electrón. [8] (La fuerza de dispersión de London , por ejemplo, depende de las correlaciones del movimiento de los electrones).
En física atómica , las líneas espectrales atómicas corresponden a transiciones ( saltos cuánticos ) entre estados cuánticos de un átomo. Estos estados están etiquetados por un conjunto de números cuánticos resumidos en el símbolo del término y generalmente asociados con configuraciones electrónicas particulares, es decir, por esquemas de ocupación de orbitales atómicos (por ejemplo, 1s 2 2s 2 2p 6 para el estado fundamental del neón -símbolo del término: 1 S 0 ).
Esta notación significa que los determinantes de Slater correspondientes tienen un peso claramente superior en la expansión de interacción de configuración . Por lo tanto, el concepto de orbital atómico es un concepto clave para visualizar el proceso de excitación asociado con una transición dada . Por ejemplo, se puede decir que para una transición dada corresponde a la excitación de un electrón desde un orbital ocupado a un orbital desocupado dado. Sin embargo, hay que tener en cuenta que los electrones son fermiones regidos por el principio de exclusión de Pauli y no se pueden distinguir entre sí. [9] Además, a veces ocurre que la expansión de interacción de configuración converge muy lentamente y que no se puede hablar en absoluto de una función de onda simple de un determinante. Este es el caso cuando la correlación electrónica es grande.
En esencia, un orbital atómico es una función de onda de un electrón, aunque no haya muchos electrones en átomos de un electrón, por lo que la visión de un electrón es una aproximación. Cuando pensamos en orbitales, a menudo nos ofrecen una visualización orbital muy influenciada por la aproximación de Hartree-Fock , que es una forma de reducir las complejidades de la teoría de orbitales moleculares .
Tipos de orbitales

Los orbitales atómicos pueden ser los "orbitales" similares al hidrógeno que son soluciones exactas a la ecuación de Schrödinger para un "átomo" similar al hidrógeno (es decir, átomo con un electrón). Alternativamente, los orbitales atómicos se refieren a funciones que dependen de las coordenadas de un electrón (es decir, orbitales) pero se utilizan como puntos de partida para aproximar funciones de onda que dependen de las coordenadas simultáneas de todos los electrones en un átomo o molécula. Los sistemas de coordenadas elegidos para los orbitales son generalmente coordenadas esféricas ( r , θ , φ ) en átomos y cartesianas ( x , y , z ) en moléculas poliatómicas. La ventaja de las coordenadas esféricas aquí es que una función de onda orbital es un producto de tres factores, cada uno dependiente de una sola coordenada: ψ ( r , θ , φ ) = R ( r ) Θ( θ ) Φ( φ ) . Los factores angulares de los orbitales atómicos Θ( θ ) Φ( φ ) generan funciones s, p, d, etc. como combinaciones reales de armónicos esféricos Y ℓm ( θ , φ ) (donde ℓ y m son números cuánticos). Existen típicamente tres formas matemáticas para las funciones radiales R ( r ) que pueden elegirse como punto de partida para el cálculo de las propiedades de átomos y moléculas con muchos electrones:
- Los orbitales similares al hidrógeno se derivan de las soluciones exactas de la ecuación de Schrödinger para un electrón y un núcleo, para un átomo similar al hidrógeno . La parte de la función que depende de la distancia r desde el núcleo tiene nodos radiales y se desintegra como .
- El orbital tipo Slater (STO) es una forma sin nodos radiales pero que se desintegra desde el núcleo como lo hace un orbital similar al hidrógeno.
- La forma del orbital de tipo gaussiano (Gaussianos) no tiene nodos radiales y se desintegra como .
Aunque los orbitales similares al hidrógeno todavía se utilizan como herramientas pedagógicas, la llegada de las computadoras ha hecho que los orbitales de tipo STO sean preferibles para átomos y moléculas diatómicas, ya que las combinaciones de orbitales de tipo STO pueden reemplazar los nodos en orbitales similares al hidrógeno. Las gaussianas se utilizan típicamente en moléculas con tres o más átomos. Aunque no son tan precisas por sí mismas como los orbitales de tipo STO, las combinaciones de muchas gaussianas pueden alcanzar la precisión de los orbitales similares al hidrógeno.
Historia
El término orbital fue introducido por Robert S. Mulliken en 1932 como abreviatura de función de onda orbital de un electrón . [10] [11] Niels Bohr explicó alrededor de 1913 que los electrones podrían girar alrededor de un núcleo compacto con un momento angular definido. [12] El modelo de Bohr fue una mejora de las explicaciones de 1911 de Ernest Rutherford , la del electrón moviéndose alrededor de un núcleo. El físico japonés Hantaro Nagaoka publicó una hipótesis basada en órbitas para el comportamiento de los electrones ya en 1904. [13] Cada una de estas teorías se construyó sobre nuevas observaciones que comenzaron con una comprensión simple y se volvieron más correctas y complejas. Explicar el comportamiento de estas "órbitas" de electrones fue una de las fuerzas impulsoras detrás del desarrollo de la mecánica cuántica . [14]
Primeros modelos
Con el descubrimiento del electrón por parte de J. J. Thomson en 1897, [15] quedó claro que los átomos no eran los bloques de construcción más pequeños de la naturaleza , sino más bien partículas compuestas. La estructura recién descubierta dentro de los átomos tentó a muchos a imaginar cómo las partes constituyentes del átomo podrían interactuar entre sí. Thomson teorizó que múltiples electrones giran en anillos similares a órbitas dentro de una sustancia gelatinosa con carga positiva, [16] y entre el descubrimiento del electrón y 1909, este " modelo de pudín de pasas " fue la explicación más ampliamente aceptada de la estructura atómica.
Poco después del descubrimiento de Thomson, Hantaro Nagaoka predijo un modelo diferente para la estructura electrónica. [13] A diferencia del modelo del pudín de pasas, la carga positiva en el "modelo saturniano" de Nagaoka estaba concentrada en un núcleo central, atrayendo a los electrones hacia órbitas circulares que recordaban a los anillos de Saturno. Pocas personas tomaron nota del trabajo de Nagaoka en ese momento, [17] y el propio Nagaoka reconoció un defecto fundamental en la teoría incluso en su concepción, a saber, que un objeto cargado clásico no puede mantener el movimiento orbital porque está acelerando y, por lo tanto, pierde energía debido a la radiación electromagnética. [18] Sin embargo, el modelo saturniano resultó tener más en común con la teoría moderna que cualquiera de sus contemporáneos.
Átomo de Bohr
En 1909, Ernest Rutherford descubrió que la mayor parte de la masa atómica estaba fuertemente condensada en un núcleo, que también se encontró que estaba cargado positivamente. Quedó claro a partir de su análisis en 1911 que el modelo del pudín de pasas no podía explicar la estructura atómica. En 1913, el estudiante de posdoctorado de Rutherford, Niels Bohr , propuso un nuevo modelo del átomo, en el que los electrones orbitaban el núcleo con períodos clásicos, pero se les permitía tener solo valores discretos de momento angular, cuantizados en unidades ħ . [12] Esta restricción permitía automáticamente solo ciertas energías de los electrones. El modelo de Bohr del átomo solucionó el problema de la pérdida de energía por radiación desde un estado fundamental (al declarar que no había ningún estado por debajo de este) y, lo que es más importante, explicó el origen de las líneas espectrales.

Después de que Bohr utilizara la explicación de Einstein del efecto fotoeléctrico para relacionar los niveles de energía de los átomos con la longitud de onda de la luz emitida, la conexión entre la estructura de los electrones en los átomos y los espectros de emisión y absorción de los átomos se convirtió en una herramienta cada vez más útil para la comprensión de los electrones en los átomos. La característica más destacada de los espectros de emisión y absorción (conocidos experimentalmente desde mediados del siglo XIX) era que estos espectros atómicos contenían líneas discretas. La importancia del modelo de Bohr era que relacionaba las líneas de los espectros de emisión y absorción con las diferencias de energía entre las órbitas que podían tomar los electrones alrededor de un átomo. Sin embargo, Bohr no logró esto al otorgarles a los electrones algún tipo de propiedades ondulatorias, ya que la idea de que los electrones podían comportarse como ondas de materia no se sugirió hasta once años después. Aun así, el uso de momentos angulares cuantificados y, por lo tanto, niveles de energía cuantificados en el modelo de Bohr fue un paso significativo hacia la comprensión de los electrones en los átomos, y también un paso significativo hacia el desarrollo de la mecánica cuántica al sugerir que las restricciones cuantificadas deben dar cuenta de todos los niveles de energía y espectros discontinuos en los átomos.
Con la sugerencia de De Broglie de la existencia de ondas de materia de electrones en 1924, y durante un corto tiempo antes del tratamiento completo de la ecuación de Schrödinger de 1926 de los átomos similares al hidrógeno , se pudo ver que la "longitud de onda" de un electrón de Bohr era una función de su momento; por lo que se vio que un electrón en órbita de Bohr orbitaba en un círculo a un múltiplo de su mitad de longitud de onda. El modelo de Bohr durante un corto tiempo pudo verse como un modelo clásico con una restricción adicional proporcionada por el argumento de la "longitud de onda". Sin embargo, este período fue inmediatamente reemplazado por la mecánica de ondas tridimensional completa de 1926. En nuestra comprensión actual de la física, el modelo de Bohr se llama modelo semiclásico debido a su cuantificación del momento angular, no principalmente por su relación con la longitud de onda del electrón, que apareció en retrospectiva una docena de años después de que se propusiera el modelo de Bohr.
El modelo de Bohr fue capaz de explicar los espectros de emisión y absorción del hidrógeno . Las energías de los electrones en los estados n = 1, 2, 3, etc. en el modelo de Bohr coinciden con las de la física actual. Sin embargo, esto no explicaba las similitudes entre diferentes átomos, como se expresa en la tabla periódica, como el hecho de que el helio (dos electrones), el neón (10 electrones) y el argón (18 electrones) exhiben una inercia química similar. La mecánica cuántica moderna explica esto en términos de capas y subcapas de electrones que pueden albergar cada una un número de electrones determinado por el principio de exclusión de Pauli . Así, el estado n = 1 puede albergar uno o dos electrones, mientras que el estado n = 2 puede albergar hasta ocho electrones en las subcapas 2s y 2p. En el helio, todos los estados n = 1 están completamente ocupados; lo mismo es cierto para n = 1 y n = 2 en el neón. En el argón, las subcapas 3s y 3p están igualmente ocupadas por ocho electrones; la mecánica cuántica también permite una subcapa 3d pero ésta tiene mayor energía que las 3s y 3p en el argón (contrariamente a la situación del hidrógeno) y permanece vacía.
Concepciones modernas y conexiones con el principio de incertidumbre de Heisenberg
Inmediatamente después de que Heisenberg descubriera su principio de incertidumbre , [19] Bohr observó que la existencia de cualquier tipo de paquete de ondas implica incertidumbre en la frecuencia y longitud de onda de la onda, ya que se necesita una dispersión de frecuencias para crear el propio paquete. [20] En mecánica cuántica, donde todos los momentos de las partículas están asociados con ondas, es la formación de dicho paquete de ondas lo que localiza la onda, y por lo tanto la partícula, en el espacio. En los estados en los que una partícula mecánica cuántica está ligada, debe localizarse como un paquete de ondas, y la existencia del paquete y su tamaño mínimo implica una dispersión y un valor mínimo en la longitud de onda de la partícula, y por lo tanto también en el momento y la energía. En mecánica cuántica, a medida que una partícula se localiza en una región más pequeña en el espacio, el paquete de ondas comprimido asociado requiere un rango cada vez mayor de momentos, y por lo tanto una energía cinética mayor. Por lo tanto, la energía de enlace para contener o atrapar una partícula en una región más pequeña del espacio aumenta sin límite a medida que la región del espacio se hace más pequeña. Las partículas no se pueden restringir a un punto geométrico en el espacio, ya que esto requeriría un momento de partícula infinito.
En química, Erwin Schrödinger , Linus Pauling , Mulliken y otros observaron que la consecuencia de la relación de Heisenberg era que el electrón, como paquete de ondas, no podía considerarse que tuviera una ubicación exacta en su orbital. Max Born sugirió que la posición del electrón necesitaba ser descrita por una distribución de probabilidad que estaba relacionada con encontrar el electrón en algún punto en la función de onda que describía su paquete de ondas asociado. La nueva mecánica cuántica no dio resultados exactos, sino solo las probabilidades de ocurrencia de una variedad de posibles resultados de ese tipo. Heisenberg sostuvo que la trayectoria de una partícula en movimiento no tiene significado si no podemos observarla, como no podemos hacerlo con los electrones en un átomo.
En la imagen cuántica de Heisenberg, Schrödinger y otros, el número atómico de Bohr n para cada orbital llegó a ser conocido como una n-esfera [ cita requerida ] en un átomo tridimensional y fue representado como la energía más probable de la nube de probabilidad del paquete de ondas del electrón que rodeaba el átomo.
Nombres orbitales
Notación orbital y subcapas
A los orbitales se les han dado nombres, que generalmente se dan en la forma:
donde X es el nivel de energía correspondiente al número cuántico principal n ; tipo es una letra minúscula que denota la forma o subcapa del orbital, correspondiente al número cuántico del momento angular ℓ .
Por ejemplo, el orbital 1s (pronunciado como los números y letras individuales: "'one' 'ess'") es el nivel de energía más bajo ( n = 1 ) y tiene un número cuántico angular de ℓ = 0 , denotado como s. Los orbitales con ℓ = 1, 2 y 3 se denotan como p, d y f respectivamente.
El conjunto de orbitales para un n y ℓ dados se llama subcapa , denotada
- .
El superíndice y muestra el número de electrones en la subcapa. Por ejemplo, la notación 2p 4 indica que la subcapa 2p de un átomo contiene 4 electrones. Esta subcapa tiene 3 orbitales, cada uno con n = 2 y ℓ = 1.
Notación de rayos X
Existe también otro sistema menos común que todavía se utiliza en la ciencia de los rayos X, conocido como notación de rayos X , que es una continuación de las notaciones utilizadas antes de que se comprendiera bien la teoría orbital. En este sistema, al número cuántico principal se le asigna una letra asociada. Para n = 1, 2, 3, 4, 5, ... , las letras asociadas a esos números son K, L, M, N, O, ... respectivamente.
Orbitales similares al hidrógeno
Los orbitales atómicos más simples son aquellos que se calculan para sistemas con un solo electrón, como el átomo de hidrógeno . Un átomo de cualquier otro elemento ionizado hasta un solo electrón (He + , Li2 + , etc.) es muy similar al hidrógeno, y los orbitales toman la misma forma. En la ecuación de Schrödinger para este sistema de una partícula negativa y una positiva, los orbitales atómicos son los estados propios del operador hamiltoniano para la energía. Se pueden obtener analíticamente, lo que significa que los orbitales resultantes son productos de una serie polinómica y funciones exponenciales y trigonométricas . (ver átomo de hidrógeno ).
En el caso de átomos con dos o más electrones, las ecuaciones que rigen la ecuación sólo pueden resolverse mediante métodos de aproximación iterativa. Los orbitales de los átomos con varios electrones son cualitativamente similares a los del hidrógeno y, en los modelos más simples, se considera que tienen la misma forma. Para un análisis más riguroso y preciso, se deben utilizar aproximaciones numéricas.
Un orbital atómico determinado (similar al hidrógeno) se identifica mediante valores únicos de tres números cuánticos: n , ℓ y m ℓ . Las reglas que restringen los valores de los números cuánticos y sus energías (ver más abajo) explican la configuración electrónica de los átomos y la tabla periódica .
Los estados estacionarios ( estados cuánticos ) de un átomo similar al hidrógeno son sus orbitales atómicos. Sin embargo, en general, el comportamiento de un electrón no se describe completamente mediante un solo orbital. Los estados electrónicos se representan mejor mediante "mezclas" ( combinaciones lineales ) de múltiples orbitales dependientes del tiempo. Véase Combinación lineal de orbitales atómicos método de orbitales moleculares .
El número cuántico n apareció por primera vez en el modelo de Bohr , donde determina el radio de cada órbita circular del electrón. Sin embargo, en la mecánica cuántica moderna, n determina la distancia media del electrón al núcleo; todos los electrones con el mismo valor de n se encuentran a la misma distancia media. Por esta razón, se dice que los orbitales con el mismo valor de n forman una " capa ". Los orbitales con el mismo valor de n y también el mismo valor de ℓ están aún más estrechamente relacionados y se dice que forman una " subcapa ".
Números cuánticos
Debido a la naturaleza mecánico-cuántica de los electrones que rodean un núcleo, los orbitales atómicos pueden definirse de forma única mediante un conjunto de números enteros conocidos como números cuánticos. Estos números cuánticos se dan solo en determinadas combinaciones de valores y su interpretación física cambia según se empleen versiones reales o complejas de los orbitales atómicos.
Orbitales complejos
En física, las descripciones orbitales más comunes se basan en las soluciones del átomo de hidrógeno, donde los orbitales están dados por el producto entre una función radial y un armónico esférico puro . Los números cuánticos, junto con las reglas que rigen sus posibles valores, son los siguientes:
El número cuántico principal n describe la energía del electrón y siempre es un entero positivo . De hecho, puede ser cualquier entero positivo, pero por las razones que se explican a continuación, rara vez se encuentran números grandes. Cada átomo tiene, en general, muchos orbitales asociados con cada valor de n ; estos orbitales en conjunto a veces se denominan capas electrónicas .
El número cuántico azimutal ℓ describe el momento angular orbital de cada electrón y es un número entero no negativo. Dentro de una capa donde n es un número entero n 0 , ℓ abarca todos los valores (enteros) que satisfacen la relación . Por ejemplo, la capa n = 1 tiene solo orbitales con , y la capa n = 2 tiene solo orbitales con , y . El conjunto de orbitales asociados con un valor particular de ℓ a veces se denomina colectivamente subcapa .
El número cuántico magnético , , describe la proyección del momento angular orbital a lo largo de un eje elegido. Determina la magnitud de la corriente que circula alrededor de ese eje y la contribución orbital al momento magnético de un electrón a través del modelo de bucle de Ampère . [21] Dentro de una subcapa , obtiene los valores enteros en el rango .
Los resultados anteriores se pueden resumir en la siguiente tabla. Cada celda representa una subcapa y enumera los valores disponibles en esa subcapa. Las celdas vacías representan subcapas que no existen.
| ℓ = 0 (s) | ℓ = 1 (p) | ℓ = 2 (d) | ℓ = 3 (f) | ℓ = 4 (g) | ... | |
|---|---|---|---|---|---|---|
| n = 1 | ... | |||||
| n = 2 | 0 | -1, 0, 1 | ... | |||
| n = 3 | 0 | -1, 0, 1 | -2, -1, 0, 1, 2 | ... | ||
| n = 4 | 0 | -1, 0, 1 | -2, -1, 0, 1, 2 | -3, -2, -1, 0, 1, 2, 3 | ... | |
| n = 5 | 0 | -1, 0, 1 | -2, -1, 0, 1, 2 | -3, -2, -1, 0, 1, 2, 3 | −4, −3, −2, −1, 0, 1, 2, 3, 4 | ... |
| ... | ... | ... | ... | ... | ... | ... |
Los subniveles se identifican generalmente por sus valores - y -. se representa por su valor numérico, pero se representa por una letra de la siguiente manera: 0 se representa por 's', 1 por 'p', 2 por 'd', 3 por 'f' y 4 por 'g'. Por ejemplo, se puede hablar del subnivel con y como un 'subnivel 2s'.
Cada electrón también tiene un momento angular en forma de espín mecánico cuántico dado por espín s = 1/2 . Su proyección a lo largo de un eje específico está dada por el número cuántico magnético de espín , m s , que puede ser + 1/2 o − 1/2 . Estos valores también se denominan "spin up" o "spin down" respectivamente.
El principio de exclusión de Pauli establece que no puede haber dos electrones en un átomo que tengan los mismos valores de los cuatro números cuánticos. Si hay dos electrones en un orbital con valores dados para tres números cuánticos ( n , ℓ , m ), estos dos electrones deben diferir en su proyección de espín m s .
Las convenciones anteriores implican un eje preferido (por ejemplo, la dirección z en coordenadas cartesianas), y también implican una dirección preferida a lo largo de este eje preferido. De lo contrario, no tendría sentido distinguir m = +1 de m = −1 . Como tal, el modelo es más útil cuando se aplica a sistemas físicos que comparten estas simetrías. El experimento de Stern-Gerlach , donde un átomo se expone a un campo magnético, proporciona un ejemplo de ello. [22]
Orbitales reales

En lugar de los orbitales complejos descritos anteriormente, es común, especialmente en la literatura de química, utilizar orbitales atómicos reales . Estos orbitales reales surgen de combinaciones lineales simples de orbitales complejos. Utilizando la convención de fases de Condon-Shortley , los orbitales reales se relacionan con los orbitales complejos de la misma manera que los armónicos esféricos reales se relacionan con los armónicos esféricos complejos. Si denotamos un orbital complejo con números cuánticos , , y , los orbitales reales pueden definirse por [23]
Si , con la parte radial del orbital, esta definición es equivalente a donde es el armónico esférico real relacionado con la parte real o imaginaria del armónico esférico complejo .
Los armónicos esféricos reales son físicamente relevantes cuando un átomo está incrustado en un sólido cristalino, en cuyo caso hay múltiples ejes de simetría preferidos pero ninguna dirección preferida. [ cita requerida ] Los orbitales atómicos reales también se encuentran con mayor frecuencia en los libros de texto introductorios de química y se muestran en visualizaciones orbitales comunes. [24] En orbitales reales similares al hidrógeno, los números cuánticos y tienen la misma interpretación y significado que sus contrapartes complejas, pero ya no es un buen número cuántico (pero su valor absoluto sí lo es).
A algunos orbitales reales se les dan nombres específicos más allá de la simple designación. Los orbitales con número cuántico igual a se llaman orbitales. Con esto ya se pueden asignar nombres a orbitales complejos como ; el primer símbolo es el número cuántico, el segundo carácter es el símbolo para ese número cuántico en particular y el subíndice es el número cuántico.
Como ejemplo de cómo se generan los nombres orbitales completos para orbitales reales, se puede calcular . A partir de la tabla de armónicos esféricos , con . Entonces
Del mismo modo . Como ejemplo más complicado:
En todos estos casos, generamos una etiqueta cartesiana para el orbital examinando y abreviando el polinomio en , , y que aparece en el numerador. Ignoramos todos los términos del polinomio, excepto el término con el exponente más alto en . Luego, utilizamos el polinomio abreviado como etiqueta de subíndice para el estado atómico, utilizando la misma nomenclatura que antes para indicar los números cuánticos y . [ cita requerida ]
La expresión anterior utiliza la convención de fase de Condon-Shortley que es la preferida por los físicos cuánticos. [25] [26] Existen otras convenciones para la fase de los armónicos esféricos. [27] [28] Bajo estas diferentes convenciones, los orbitales y pueden aparecer, por ejemplo, como la suma y diferencia de y , al contrario de lo que se muestra arriba.
A continuación se muestra una lista de estos nombres de polinomios cartesianos para los orbitales atómicos. [29] [30] No parece haber referencias en la literatura sobre cómo abreviar los polinomios armónicos esféricos cartesianos largos, por lo que no parece haber consenso sobre la denominación de orbitales o superiores de acuerdo con esta nomenclatura. [ cita requerida ]
Formas de los orbitales

Las imágenes simples que muestran formas orbitales tienen como objetivo describir las formas angulares de las regiones del espacio donde es probable que se encuentren los electrones que ocupan el orbital. Los diagramas no pueden mostrar toda la región donde se puede encontrar un electrón, ya que según la mecánica cuántica existe una probabilidad distinta de cero de encontrar el electrón (casi) en cualquier lugar del espacio. En cambio, los diagramas son representaciones aproximadas de superficies de contorno o límite donde la densidad de probabilidad | ψ( r , θ , φ ) | 2 tiene un valor constante, elegido de modo que exista una cierta probabilidad (por ejemplo, 90%) de encontrar el electrón dentro del contorno. Aunque | ψ | 2 como el cuadrado de un valor absoluto es en todas partes no negativo, el signo de la función de onda ψ( r , θ , φ ) a menudo se indica en cada subregión de la imagen orbital.
A veces, la función ψ se grafica para mostrar sus fases, en lugar de | ψ( r , θ , φ ) | 2 que muestra la densidad de probabilidad pero no tiene fase (que se pierde al tomar el valor absoluto, ya que ψ( r , θ , φ ) es un número complejo ). Los gráficos orbitales | ψ( r , θ , φ ) | 2 tienden a tener lóbulos menos esféricos y más delgados que los gráficos ψ( r , θ , φ ) , pero tienen la misma cantidad de lóbulos en los mismos lugares y, por lo demás, son reconocibles. Este artículo, para mostrar la fase de la función de onda, muestra principalmente gráficos ψ( r , θ , φ ) .
Los lóbulos pueden verse como patrones de interferencia de ondas estacionarias entre los dos modos de onda viajera contrarrotatoria y resonante en anillo m y − m ; la proyección del orbital sobre el plano xy tiene una longitud de onda resonante m alrededor de la circunferencia. Aunque rara vez se muestran, las soluciones de ondas viajeras pueden verse como toros bandeados giratorios; las bandas representan información de fase. Para cada m hay dos soluciones de ondas estacionarias ⟨ m ⟩ + ⟨− m ⟩ y ⟨ m ⟩ − ⟨− m ⟩ . Si m = 0 , el orbital es vertical, se desconoce la información de contrarrotación y el orbital es simétrico respecto del eje z . Si ℓ = 0 no hay modos contrarrotatorios. Solo hay modos radiales y la forma es esféricamente simétrica.
Los planos nodales y las esferas nodales son superficies en las que la densidad de probabilidad se desvanece. El número de superficies nodales está controlado por los números cuánticos n y ℓ . Un orbital con número cuántico azimutal ℓ tiene ℓ planos nodales radiales que pasan por el origen. Por ejemplo, los orbitales s ( ℓ = 0 ) son esféricamente simétricos y no tienen planos nodales, mientras que los orbitales p ( ℓ = 1 ) tienen un solo plano nodal entre los lóbulos. El número de esferas nodales es igual a n-ℓ-1 , consistente con la restricción ℓ ≤ n-1 en los números cuánticos. El número cuántico principal controla el número total de superficies nodales que es n-1 . [31] En términos generales, n es energía, ℓ es análogo a excentricidad y m es orientación.
En general, n determina el tamaño y la energía del orbital de un núcleo determinado; a medida que n aumenta, el tamaño del orbital aumenta. La mayor carga nuclear Z de los elementos más pesados hace que sus orbitales se contraigan en comparación con los más ligeros, de modo que el tamaño del átomo permanece aproximadamente constante, incluso cuando aumenta el número de electrones.

También en términos generales, ℓ determina la forma de un orbital y m ℓ su orientación. Sin embargo, dado que algunos orbitales se describen mediante ecuaciones en números complejos , la forma a veces depende también de m ℓ . En conjunto, el conjunto completo de orbitales para un ℓ y n dados llena el espacio de la forma más simétrica posible, aunque con conjuntos de lóbulos y nodos cada vez más complejos.
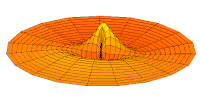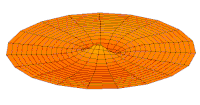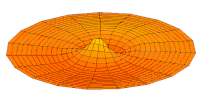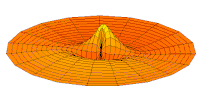
Los orbitales s individuales ( ) tienen forma de esferas. Para n = 1 es aproximadamente una bola sólida (más densa en el centro y se desvanece hacia afuera exponencialmente), pero para n ≥ 2 , cada orbital s individual está hecho de superficies esféricamente simétricas que son capas anidadas (es decir, la "estructura de onda" es radial, siguiendo también un componente radial sinusoidal). Vea la ilustración de una sección transversal de estas capas anidadas, a la derecha. Los orbitales s para todos los números n son los únicos orbitales con un antinodo (una región de alta densidad de función de onda) en el centro del núcleo. Todos los demás orbitales (p, d, f, etc.) tienen momento angular y, por lo tanto, evitan el núcleo (que tiene un nodo de onda en el núcleo). Recientemente, ha habido un esfuerzo para obtener imágenes experimentales de los orbitales 1s y 2p en un cristal de SrTiO 3 utilizando microscopía electrónica de transmisión de barrido con espectroscopia de rayos X de energía dispersiva. [32] Debido a que la obtención de imágenes se realizó utilizando un haz de electrones, la interacción haz-orbital de Coulomb, a menudo denominada efecto del parámetro de impacto, se incluye en el resultado (ver la figura a la derecha).
Las formas de los orbitales p, d y f se describen verbalmente aquí y se muestran gráficamente en la tabla de orbitales a continuación. Los tres orbitales p para n = 2 tienen la forma de dos elipsoides con un punto de tangencia en el núcleo (la forma de dos lóbulos a veces se denomina " mancuerna "; hay dos lóbulos que apuntan en direcciones opuestas entre sí). Los tres orbitales p en cada capa están orientados en ángulos rectos entre sí, como lo determina su respectiva combinación lineal de valores de m ℓ . El resultado general es un lóbulo que apunta a lo largo de cada dirección de los ejes primarios.
Cuatro de los cinco orbitales d para n = 3 parecen similares, cada uno con cuatro lóbulos en forma de pera, cada lóbulo tangente en ángulo recto a otros dos, y los centros de los cuatro se encuentran en un plano. Tres de estos planos son los planos xy, xz e yz (los lóbulos están entre los pares de ejes primarios) y el cuarto tiene el centro a lo largo de los ejes x e y. El quinto y último orbital d consta de tres regiones de alta densidad de probabilidad: un toro entre dos regiones en forma de pera ubicadas simétricamente en su eje z. El total general de 18 lóbulos direccionales apunta en cada dirección del eje primario y entre cada par.
Hay siete orbitales f, cada uno con formas más complejas que las de los orbitales d.
Además, como sucede con los orbitales s, los orbitales p, d, f y g individuales con valores n superiores al valor más bajo posible, presentan una estructura de nodo radial adicional que recuerda a las ondas armónicas del mismo tipo, en comparación con el modo más bajo (o fundamental) de la onda. Al igual que con los orbitales s, este fenómeno proporciona orbitales p, d, f y g en el siguiente valor más alto posible de n (por ejemplo, orbitales 3p frente al valor fundamental 2p), un nodo adicional en cada lóbulo. Valores aún más altos de n aumentan aún más el número de nodos radiales, para cada tipo de orbital.
Las formas de los orbitales atómicos en un átomo de un electrón están relacionadas con los armónicos esféricos tridimensionales . Estas formas no son únicas y cualquier combinación lineal es válida, como una transformación a armónicos cúbicos ; de hecho, es posible generar conjuntos donde todas las d tienen la misma forma, al igual que p x , p y y p z tienen la misma forma. [33] [34]

Aunque los orbitales individuales se muestran con mayor frecuencia independientes entre sí, los orbitales coexisten alrededor del núcleo al mismo tiempo. Además, en 1927, Albrecht Unsöld demostró que si se suma la densidad electrónica de todos los orbitales de un número cuántico azimutal particular ℓ de la misma capa n (por ejemplo, los tres orbitales 2p o los cinco orbitales 3d) donde cada orbital está ocupado por un electrón o cada uno está ocupado por un par de electrones, entonces desaparece toda dependencia angular; es decir, la densidad total resultante de todos los orbitales atómicos en esa subcapa (aquellos con el mismo ℓ ) es esférica. Esto se conoce como el teorema de Unsöld .
Tabla de orbitales
Esta tabla muestra las funciones de onda reales similares al hidrógeno para todos los orbitales atómicos hasta 7s y, por lo tanto, cubre los orbitales ocupados en el estado fundamental de todos los elementos de la tabla periódica hasta el radio y algunos más allá. Los gráficos "ψ" se muestran con las fases de función de onda − y + mostradas en dos colores diferentes (arbitrariamente rojo y azul). El orbital p z es el mismo que el orbital p 0 , pero p x y p y se forman tomando combinaciones lineales de los orbitales p +1 y p −1 (por eso se enumeran bajo la etiqueta m = ±1 ). Además, p +1 y p −1 no tienen la misma forma que p 0 , ya que son armónicos esféricos puros .
* Aún no se han descubierto elementos con electrones 6f, 7d o 7f.
† Se han descubierto elementos con electrones 7p, pero sus configuraciones electrónicas sólo se han predicho, salvo el excepcional Lr , que llena 7p 1 en lugar de 6d 1 .
‡ Para los elementos cuyo orbital ocupado más alto es un orbital 6d, sólo se han confirmado algunas configuraciones electrónicas. ( Aún faltan Mt , Ds , Rg y Cn ).
Estos son los orbitales de valor real que se usan comúnmente en química. Solo los orbitales donde son estados propios del operador de momento angular orbital, . Las columnas con son combinaciones de dos estados propios. Vea la comparación en la siguiente imagen :

Comprensión cualitativa de las formas
Las formas de los orbitales atómicos se pueden entender cualitativamente considerando el caso análogo de las ondas estacionarias en un tambor circular . [35] Para ver la analogía, el desplazamiento vibracional medio de cada parte de la membrana del tambor desde el punto de equilibrio a lo largo de muchos ciclos (una medida de la velocidad y el momento promedio de la membrana del tambor en ese punto) debe considerarse en relación con la distancia de ese punto desde el centro del parche del tambor. Si este desplazamiento se toma como análogo a la probabilidad de encontrar un electrón a una distancia dada del núcleo, entonces se verá que los muchos modos del disco vibratorio forman patrones que trazan las diversas formas de los orbitales atómicos. La razón básica de esta correspondencia radica en el hecho de que la distribución de la energía cinética y el momento en una onda de materia predice dónde estará la partícula asociada con la onda. Es decir, la probabilidad de encontrar un electrón en un lugar determinado también es una función del momento promedio del electrón en ese punto, ya que un momento electrónico alto en una posición determinada tiende a "localizar" al electrón en esa posición, a través de las propiedades de los paquetes de ondas de electrones (véase el principio de incertidumbre de Heisenberg para obtener detalles del mecanismo).
Esta relación significa que se pueden observar ciertas características clave tanto en los modos de membrana del tambor como en los orbitales atómicos. Por ejemplo, en todos los modos análogos a los orbitales s (la fila superior en la ilustración animada que aparece a continuación), se puede ver que el centro mismo de la membrana del tambor vibra con mayor fuerza, lo que corresponde al antinodo en todos los orbitales s de un átomo. Este antinodo significa que es más probable que el electrón se encuentre en la posición física del núcleo (por el que pasa directamente sin dispersarse ni chocar con él), ya que se está moviendo (en promedio) más rápido en ese punto, lo que le otorga un impulso máximo.
Una imagen mental de "órbita planetaria" más cercana al comportamiento de los electrones en orbitales s , todos los cuales no tienen momento angular, podría tal vez ser la de una órbita kepleriana con una excentricidad orbital de 1 pero un eje mayor finito, no físicamente posible (porque las partículas colisionarían), pero puede imaginarse como un límite de órbitas con ejes mayores iguales pero con excentricidad creciente.
A continuación, se muestran varios modos de vibración de la membrana de un tambor y las respectivas funciones de onda del átomo de hidrógeno. Se puede considerar una correspondencia en la que las funciones de onda de un parche de tambor vibrante son para un sistema de dos coordenadas ψ( r , θ ) y las funciones de onda para una esfera vibrante son de tres coordenadas ψ( r , θ , φ ) .
- Modos de batería tipo s y funciones de onda
- Modo de batería
- Modo de batería
- Modo de batería
- Función de onda del orbital 1s (parte real, corte 2D )
- Función de onda del orbital 2s (parte real, corte 2D )
- Función de onda del orbital 3s (parte real, corte 2D )
Ninguno de los otros conjuntos de modos en una membrana de tambor tiene un antinodo central, y en todos ellos el centro del tambor no se mueve. Estos corresponden a un nodo en el núcleo para todos los orbitales no s en un átomo. Todos estos orbitales tienen cierto momento angular, y en el modelo planetario, corresponden a partículas en órbita con excentricidad menor que 1.0, de modo que no pasan directamente a través del centro del cuerpo primario, sino que se mantienen algo alejadas de él.
Además, los modos de tambor análogos a los modos p y d en un átomo muestran irregularidad espacial a lo largo de las diferentes direcciones radiales desde el centro del tambor, mientras que todos los modos análogos a los modos s son perfectamente simétricos en la dirección radial. Las propiedades de no simetría radial de los orbitales no s son necesarias para localizar una partícula con momento angular y naturaleza ondulatoria en un orbital donde debe tender a mantenerse alejada de la fuerza de atracción central, ya que cualquier partícula localizada en el punto de atracción central podría no tener momento angular. Para estos modos, las ondas en el parche del tambor tienden a evitar el punto central. Tales características enfatizan nuevamente que las formas de los orbitales atómicos son una consecuencia directa de la naturaleza ondulatoria de los electrones.
- Modos de batería y funciones de onda de tipo p
- Modo de batería
- Modo de batería
- Modo de batería
- Función de onda del orbital 2p (parte real, corte 2D )
- Función de onda del orbital 3p (parte real, corte 2D )
- Función de onda del orbital 4p (parte real, corte 2D )
- modos de batería tipo d
- Modo de batería
- Modo de batería
- Modo de batería
Energía orbital
En átomos con un electrón ( átomo similar al hidrógeno ), la energía de un orbital (y, en consecuencia, cualquier electrón en el orbital) está determinada principalmente por . El orbital tiene la energía más baja posible en el átomo. Cada valor sucesivamente más alto de tiene una energía más alta, pero la diferencia disminuye a medida que aumenta. Para alto , la energía se vuelve tan alta que el electrón puede escapar fácilmente del átomo. En átomos de un solo electrón, todos los niveles con diferentes dentro de un dado están degenerados en la aproximación de Schrödinger y tienen la misma energía. Esta aproximación se rompe ligeramente en la solución de la ecuación de Dirac (donde la energía depende de n y otro número cuántico j ), y por el efecto del campo magnético del núcleo y los efectos de la electrodinámica cuántica . Estos últimos inducen pequeñas diferencias de energía de enlace especialmente para los electrones s que se acercan al núcleo, ya que estos sienten una carga nuclear muy ligeramente diferente, incluso en átomos de un solo electrón; consulte desplazamiento de Lamb .
En átomos con múltiples electrones, la energía de un electrón depende no solo de su orbital, sino también de sus interacciones con otros electrones. Estas interacciones dependen del detalle de su distribución de probabilidad espacial, y por lo tanto los niveles de energía de los orbitales dependen no solo de sino también de . Los valores más altos de están asociados con valores más altos de energía; por ejemplo, el estado 2p es más alto que el estado 2s. Cuando , el aumento en la energía del orbital se vuelve tan grande como para empujar la energía del orbital por encima de la energía del orbital s en la siguiente capa superior; cuando la energía es empujada hacia la capa dos pasos más arriba. El llenado de los orbitales 3d no ocurre hasta que se hayan llenado los orbitales 4s.
El aumento de energía en subcapas con un momento angular creciente en átomos más grandes se debe a los efectos de interacción electrón-electrón, y está específicamente relacionado con la capacidad de los electrones de bajo momento angular de penetrar más eficazmente hacia el núcleo, donde están sujetos a un menor apantallamiento por parte de la carga de los electrones intermedios. Por lo tanto, en átomos con un número atómico más alto, la cantidad de electrones se convierte cada vez más en un factor determinante de su energía, y los números cuánticos principales de los electrones se vuelven cada vez menos importantes en su distribución energética.
La secuencia de energía de los primeros 35 subniveles (por ejemplo, 1s, 2p, 3d, etc.) se muestra en la siguiente tabla. Cada celda representa un subnivel con y dados por sus índices de fila y columna, respectivamente. El número en la celda es la posición del subnivel en la secuencia. Para obtener una lista lineal de los subniveles en términos de energías crecientes en átomos multielectrónicos, consulte la sección siguiente.
yo norte | s | pag | d | F | gramo | yo |
|---|---|---|---|---|---|---|
| 1 | 1 | |||||
| 2 | 2 | 3 | ||||
| 3 | 4 | 5 | 7 | |||
| 4 | 6 | 8 | 10 | 13 | ||
| 5 | 9 | 11 | 14 | 17 | 21 | |
| 6 | 12 | 15 | 18 | 22 | 26 | 31 |
| 7 | 16 | 19 | 23 | 27 | 32 | 37 |
| 8 | 20 | 24 | 28 | 33 | 38 | 44 |
| 9 | 25 | 29 | 34 | 39 | 45 | 51 |
| 10 | 30 | 35 | 40 | 46 | 52 | 59 |
Nota: las celdas vacías indican subniveles inexistentes, mientras que los números en cursiva indican subniveles que podrían (potencialmente) existir, pero que no contienen electrones en ningún elemento conocido actualmente.
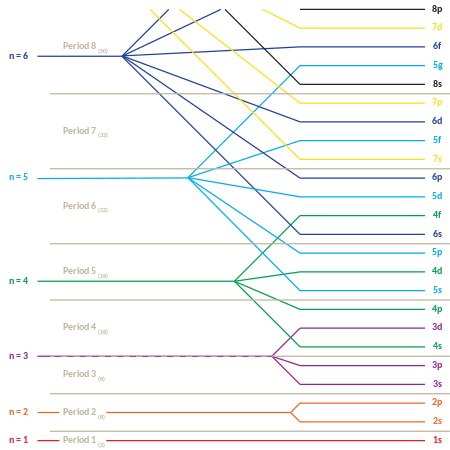
La ubicación de los electrones y la tabla periódica

Varias reglas gobiernan la colocación de los electrones en orbitales ( configuración electrónica ). La primera dicta que no puede haber dos electrones en un átomo que tengan el mismo conjunto de valores de números cuánticos (este es el principio de exclusión de Pauli ). Estos números cuánticos incluyen los tres que definen los orbitales, así como el número cuántico magnético de espín m s . Por lo tanto, dos electrones pueden ocupar un solo orbital, siempre que tengan diferentes valores de m s . Debido a que m s toma uno de solo dos valores ( 1/2 o -1/2 ), como máximo dos electrones pueden ocupar cada orbital.
Además, un electrón siempre tiende a caer al estado de energía más bajo posible. Es posible que ocupe cualquier orbital siempre que no viole el principio de exclusión de Pauli, pero si hay orbitales de energía más baja disponibles, esta condición es inestable. El electrón eventualmente perderá energía (liberando un fotón ) y caerá al orbital más bajo. Por lo tanto, los electrones llenan los orbitales en el orden especificado por la secuencia de energía dada anteriormente.
Este comportamiento es responsable de la estructura de la tabla periódica . La tabla puede dividirse en varias filas (llamadas "períodos"), numeradas comenzando con 1 en la parte superior. Los elementos conocidos actualmente ocupan siete períodos. Si un cierto período tiene número i , consiste en elementos cuyos electrones más externos caen en la capa i . Niels Bohr fue el primero en proponer (1923) que la periodicidad en las propiedades de los elementos podría explicarse por el llenado periódico de los niveles de energía de los electrones, lo que resulta en la estructura electrónica del átomo. [36]
La tabla periódica también puede dividirse en varios " bloques " rectangulares numerados. Los elementos que pertenecen a un bloque dado tienen esta característica común: sus electrones de mayor energía pertenecen todos al mismo estado ℓ (pero el n asociado con ese estado ℓ depende del período). Por ejemplo, las dos columnas más a la izquierda constituyen el "bloque s". Los electrones más externos de Li y Be pertenecen respectivamente al subnivel 2s, y los de Na y Mg al subnivel 3s.
El siguiente es el orden de llenado de los orbitales de "subcapa", que también da el orden de los "bloques" en la tabla periódica:
- 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p
La naturaleza "periódica" del llenado de los orbitales, así como la aparición de los "bloques" s , p , d y f , es más obvia si este orden de llenado se da en forma de matriz, con números cuánticos principales crecientes que comienzan las nuevas filas ("períodos") en la matriz. Luego, cada subcapa (compuesta por los dos primeros números cuánticos) se repite tantas veces como sea necesario para cada par de electrones que pueda contener. El resultado es una tabla periódica comprimida, donde cada entrada representa dos elementos sucesivos:
| 1s | |||||||||||||||
| 2s | 2p | 2p | 2p | ||||||||||||
| 3s | 3p | 3p | 3p | ||||||||||||
| 4s | 3 dimensiones | 3 dimensiones | 3 dimensiones | 3 dimensiones | 3 dimensiones | 4p | 4p | 4p | |||||||
| 5s | 4d | 4d | 4d | 4d | 4d | 5p | 5p | 5p | |||||||
| 6s | 4f | 4f | 4f | 4f | 4f | 4f | 4f | 5d | 5d | 5d | 5d | 5d | 6p | 6p | 6p |
| 7s | 5f | 5f | 5f | 5f | 5f | 5f | 5f | 6d | 6d | 6d | 6d | 6d | 7p | 7p | 7p |
Aunque este es el orden general de llenado orbital según la regla de Madelung, hay excepciones y las energías electrónicas reales de cada elemento también dependen de detalles adicionales de los átomos (ver Configuración electrónica § Átomos: principio de Aufbau y regla de Madelung ).
La cantidad de electrones en un átomo eléctricamente neutro aumenta con el número atómico . Los electrones en la capa más externa, o electrones de valencia , tienden a ser responsables del comportamiento químico de un elemento. Los elementos que contienen la misma cantidad de electrones de valencia se pueden agrupar y mostrar propiedades químicas similares.
Efectos relativistas
Para los elementos con un número atómico alto Z , los efectos de la relatividad se vuelven más pronunciados, y especialmente para los electrones s, que se mueven a velocidades relativistas a medida que penetran los electrones de protección cerca del núcleo de los átomos de alto Z. Este aumento relativista en el momento de los electrones de alta velocidad causa una disminución correspondiente en la longitud de onda y la contracción de los orbitales 6s en relación con los orbitales 5d (en comparación con los electrones s y d correspondientes en elementos más ligeros en la misma columna de la tabla periódica); esto da como resultado que los electrones de valencia 6s se reduzcan en energía.
Entre los ejemplos de resultados físicos significativos de este efecto se incluyen la temperatura de fusión más baja del mercurio (que resulta de que los electrones 6s no están disponibles para la unión de metales) y el color dorado del oro y el cesio . [37]
En el modelo de Bohr , un electrón n = 1 tiene una velocidad dada por , donde Z es el número atómico, es la constante de estructura fina y c es la velocidad de la luz. Por lo tanto, en la mecánica cuántica no relativista, cualquier átomo con un número atómico mayor que 137 requeriría que sus electrones 1s viajen más rápido que la velocidad de la luz. Incluso en la ecuación de Dirac , que tiene en cuenta los efectos relativistas, la función de onda del electrón para átomos con es oscilatoria e ilimitada . La importancia del elemento 137, también conocido como untriseptio , fue señalada por primera vez por el físico Richard Feynman . El elemento 137 a veces se llama informalmente feynmanium (símbolo Fy). [38] Sin embargo, la aproximación de Feynman no predice el valor crítico exacto de Z debido a la naturaleza de carga no puntual del núcleo y al radio orbital muy pequeño de los electrones internos, lo que resulta en un potencial visto por los electrones internos que es efectivamente menor que Z. El valor crítico Z , que hace que el átomo sea inestable con respecto a la ruptura del vacío en campos altos y la producción de pares electrón-positrón, no ocurre hasta que Z es aproximadamente 173. Estas condiciones no se ven excepto transitoriamente en colisiones de núcleos muy pesados, como el plomo o el uranio en aceleradores, donde se ha afirmado que se ha observado dicha producción de electrones y positrones a partir de estos efectos.
No hay nodos en las densidades orbitales relativistas, aunque los componentes individuales de la función de onda tendrán nodos. [39]
hibridación pp (conjeturada)
En los elementos del periodo tardío 8 , se espera que exista un híbrido de 8p 3/2 y 9p 1/2 , [40] donde "3/2" y "1/2" se refieren al número cuántico del momento angular total . Este híbrido "pp" puede ser responsable del bloque p del periodo debido a propiedades similares a las subcapas p en las capas de valencia ordinarias . Los niveles de energía de 8p 3/2 y 9p 1/2 se acercan debido a los efectos relativistas de espín-órbita ; la subcapa 9s también debería participar, ya que se espera que estos elementos sean análogos a los respectivos elementos 5p del indio al xenón .
Transiciones entre orbitales
Los estados cuánticos ligados tienen niveles de energía discretos. Cuando se aplica a los orbitales atómicos, esto significa que las diferencias de energía entre los estados también son discretas. Por lo tanto, una transición entre estos estados (es decir, un electrón que absorbe o emite un fotón) solo puede ocurrir si el fotón tiene una energía que se corresponde con la diferencia de energía exacta entre dichos estados.
Consideremos dos estados del átomo de hidrógeno:
- Estado n = 1 , ℓ = 0 , m ℓ = 0 y m s = + 1/2
- Estado n = 2 , ℓ = 0 , m ℓ = 0 y m s = − 1/2
Según la teoría cuántica, el estado 1 tiene una energía fija de E 1 y el estado 2 tiene una energía fija de E 2. Ahora bien, ¿qué ocurriría si un electrón en el estado 1 se moviera al estado 2? Para que esto ocurriera, el electrón necesitaría ganar una energía de exactamente E 2 − E 1. Si el electrón recibe energía menor o mayor que este valor, no puede saltar del estado 1 al estado 2. Ahora bien, supongamos que irradiamos el átomo con un amplio espectro de luz. Los fotones que llegan al átomo que tienen una energía de exactamente E 2 − E 1 serán absorbidos por el electrón en el estado 1, y ese electrón saltará al estado 2. Sin embargo, los fotones que son mayores o menores en energía no pueden ser absorbidos por el electrón, porque el electrón solo puede saltar a uno de los orbitales, no puede saltar a un estado entre orbitales. El resultado es que solo los fotones de una frecuencia específica serán absorbidos por el átomo. Esto crea una línea en el espectro, conocida como línea de absorción, que corresponde a la diferencia de energía entre los estados 1 y 2.
El modelo orbital atómico predice espectros de líneas que se observan experimentalmente. Esta es una de las principales validaciones del modelo orbital atómico.
El modelo orbital atómico es, no obstante, una aproximación a la teoría cuántica completa, que sólo reconoce muchos estados electrónicos. Las predicciones de los espectros de líneas son cualitativamente útiles, pero no cuantitativamente precisas para átomos e iones distintos de los que contienen un solo electrón.
Véase también
Referencias
- ^ Orchin, Milton; Macomber, Roger S.; Pinhas, Allan; Wilson, R. Marshall (2005). "1. Teoría de los orbitales atómicos" (PDF) . El vocabulario y los conceptos de la química orgánica (2.ª ed.). Wiley. Archivado (PDF) desde el original el 9 de octubre de 2022.
- ^ Daintith, J. (2004). Diccionario Oxford de Química. Nueva York: Oxford University Press. pp. 407–409. ISBN 978-0-19-860918-6.
- ^ Griffiths, David (1995). Introducción a la mecánica cuántica . Prentice Hall. pp. 190-191. ISBN 978-0-13-124405-4.
- ^ Levine, Ira (2000). Química cuántica (5.ª ed.). Prentice Hall. pp. 144-145. ISBN 978-0-13-685512-5.
- ^ Laidler, Keith J.; Meiser, John H. (1982). Química física . Benjamin/Cummings. pág. 488. ISBN 978-0-8053-5682-3.
- ^ Atkins, Peter; de Paula, Julio; Friedman, Ronald (2009). Quanta, materia y cambio: un enfoque molecular de la química física. Oxford University Press. pág. 106. ISBN 978-0-19-920606-3.
- ^ Feynman, Richard; Leighton, Robert B.; Sands, Matthew (2006). Las conferencias Feynman sobre física: la edición definitiva, vol. 1, lect. 6. Pearson PLC, Addison Wesley. pág. 11. ISBN 978-0-8053-9046-9.
- ^ Roger Penrose , El camino hacia la realidad
- ^ Levine, Ira N. (1991). Química cuántica (4.ª ed.). Prentice-Hall. pág. 262. ISBN 0-205-12770-3.
Por lo tanto, la función de onda de un sistema de partículas idénticas que interactúan no debe distinguir entre las partículas.
- ^ Mulliken, Robert S. (julio de 1932). "Estructuras electrónicas de moléculas poliatómicas y valencia. II. Consideraciones generales". Physical Review . 41 (1): 49–71. Bibcode :1932PhRv...41...49M. doi :10.1103/PhysRev.41.49.
- ^ Murrell, John N (5 de septiembre de 2012). "Los orígenes y desarrollos posteriores de la teoría de orbitales moleculares". Revista internacional de química cuántica . 112 (17): 2875–2879. doi :10.1002/qua.23293. ISSN 0020-7608.
- ^ ab Bohr, Niels (1913). "Sobre la constitución de átomos y moléculas". Revista filosófica . 26 (1): 476. Bibcode :1914Natur..93..268N. doi :10.1038/093268a0. S2CID 3977652.
- ^ ab Nagaoka, Hantaro (mayo de 1904). «Cinética de un sistema de partículas que ilustra el espectro de líneas y bandas y los fenómenos de la radiactividad». Philosophical Magazine . 7 (41): 445–455. doi :10.1080/14786440409463141. Archivado desde el original el 27 de noviembre de 2017 . Consultado el 30 de mayo de 2009 .
- ^ Bryson, Bill (2003). Una breve historia de casi todo . Broadway Books. págs. 141-143. ISBN 978-0-7679-0818-4.
- ^ Thomson, JJ (1897). "Rayos catódicos". Revista filosófica . 44 (269): 293. doi :10.1080/14786449708621070.
- ^ Thomson, JJ (1904). "Sobre la estructura del átomo: una investigación de la estabilidad y los períodos de oscilación de varios corpúsculos dispuestos a intervalos iguales alrededor de la circunferencia de un círculo; con aplicación de los resultados a la teoría de la estructura atómica" (extracto del artículo) . Philosophical Magazine . Serie 6. 7 (39): 237–265. doi :10.1080/14786440409463107.
- ^ Rhodes, Richard (1995). La fabricación de la bomba atómica. Simon & Schuster. Págs. 50-51. ISBN. 978-0-684-81378-3.
- ^ Nagaoka, Hantaro (mayo de 1904). «Cinética de un sistema de partículas que ilustra el espectro de líneas y bandas y los fenómenos de la radiactividad». Philosophical Magazine . 7 (41): 446. doi :10.1080/14786440409463141. Archivado desde el original el 27 de noviembre de 2017 . Consultado el 30 de mayo de 2009 .
- ^ Heisenberg, W. (marzo de 1927). "Über den anschaulichen Inhalt der quantentheoretischen Kinematik und Mechanik". Zeitschrift für Physik A. 43 (3–4): 172–198. Código Bib : 1927ZPhy...43..172H. doi :10.1007/BF01397280. S2CID 122763326.
- ^ Bohr, Niels (abril de 1928). "El postulado cuántico y el desarrollo reciente de la teoría atómica". Nature . 121 (3050): 580–590. Código Bibliográfico :1928Natur.121..580B. doi : 10.1038/121580a0 .
- ^ Greiner, Walter (1994). Mecánica cuántica: Introducción (2.ª edición corregida). Nueva York, Berlín, Heidelberg: Springer-Verlag. pág. 163. ISBN 978-0-387-58080-7.
- ^ Gerlach, W.; Popa, O. (1922). "Das magnetische Moment des Silberatoms". Zeitschrift für Physik . 9 (1): 353–355. Código Bib : 1922ZPhy....9..353G. doi :10.1007/BF01326984. S2CID 126109346.
- ^ Thaller, Bernd (2004). Mecánica cuántica visual avanzada . Nueva York: Springer/TELOS. ISBN 978-0387207773.
- ^ Petrucci, Ralph; Herring, F.; Madura, Jeffry; Bissonnette, Carey (2016). Química general: principios y aplicaciones modernas (11.ª ed.). [Lugar de publicación no identificado]: Prentice Hall. ISBN 978-0133897319.
- ^ Messiah, Albert (1999). Mecánica cuántica: dos volúmenes encuadernados como uno solo (Dos volúmenes encuadernados como uno solo, reimpresión íntegra). Mineola, NY: Dover. ISBN 978-0-486-40924-5.
- ^ Claude Cohen-Tannoudji; Bernard Diu; Franck Laloë; et al. (1996). Mecánica cuántica . Traducido del francés por Susan Reid Hemley. Wiley-Interscience. ISBN 978-0-471-56952-7.
- ^ Levine, Ira (2014). Química cuántica (7.ª ed.). Pearson Education. pp. 141-2. ISBN 978-0-321-80345-0.
- ^ Blanco, Miguel A.; Flórez, M.; Bermejo, M. (diciembre de 1997). "Evaluación de las matrices de rotación en base a armónicos esféricos reales". Journal of Molecular Structure: THEOCHEM . 419 (1–3): 19–27. doi :10.1016/S0166-1280(97)00185-1.
- ^ Química general: principios y aplicaciones modernas . [Lugar de publicación no identificado]: Prentice Hall. 2016. ISBN 978-0133897319.
- ^ Friedman (1964). "Las formas de los orbitales f". J. Chem. Educ . 41 (7): 354. Bibcode :1964JChEd..41..354F. doi :10.1021/ed041p354.
- ^ Stanley Raimes (1963). Mecánica ondulatoria de los electrones en los metales. North-Holland Publishing Company - Ámsterdam. pág. 39.
- ^ ab Jeong, Jong Seok; Odlyzko, Michael L.; Xu, Peng; Jalan, Bharat; Mkhoyan, K. Andre (26 de abril de 2016). "Sondeo de orbitales de electrones centrales mediante microscopía electrónica de transmisión de barrido y medición de la deslocalización de excitaciones a nivel del núcleo". Physical Review B . 93 (16): 165140. Bibcode :2016PhRvB..93p5140J. doi : 10.1103/PhysRevB.93.165140 .
- ^ Powell, Richard E. (1968). "Los cinco orbitales d equivalentes". Revista de Educación Química . 45 (1): 45. Bibcode :1968JChEd..45...45P. doi :10.1021/ed045p45.
- ^ Kimball, George E. (1940). "Valencia dirigida". Revista de Física Química . 8 (2): 188. Código Bibliográfico :1940JChPh...8..188K. doi :10.1063/1.1750628.
- ^ Cazenave, Lions, T., P.; Lions, PL (1982). "Estabilidad orbital de ondas estacionarias para algunas ecuaciones no lineales de Schrödinger". Communications in Mathematical Physics . 85 (4): 549–561. Bibcode :1982CMaPh..85..549C. doi :10.1007/BF01403504. S2CID 120472894.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Bohr, Niels (1923). "Über die Anwendung der Quantumtheorie auf den Atombau. I". Zeitschrift für Physik . 13 (1): 117. Código bibliográfico : 1923ZPhy...13..117B. doi :10.1007/BF01328209. S2CID 123582460.
- ^ Lower, Stephen. "Introducción a la teoría cuántica del átomo".
- ^ Poliakoff, Martyn; Tang, Samantha (9 de febrero de 2015). "La tabla periódica: icono e inspiración". Philosophical Transactions of the Royal Society A . 373 (2037): 20140211. Bibcode :2015RSPTA.37340211P. doi : 10.1098/rsta.2014.0211 . PMID 25666072.
- ^ Szabo, Attila (1969). "Diagramas de contorno para orbitales relativistas". Revista de Educación Química . 46 (10): 678. Bibcode :1969JChEd..46..678S. doi :10.1021/ed046p678.
- ^ Fricke, Burkhard (1975). Elementos superpesados: una predicción de sus propiedades químicas y físicas. Estructura y enlace. Vol. 21. págs. 89-144. doi :10.1007/BFb0116498. ISBN 978-3-540-07109-9. Recuperado el 4 de octubre de 2013 .
{{cite book}}:|journal=ignorado ( ayuda )
- McCaw, Charles S. (2015). Orbitales: con aplicaciones en espectros atómicos. Singapur: World Scientific Publishing Company. ISBN 9781783264162.
- Tipler, Paul; Llewellyn, Ralph (2003). Física moderna (4.ª ed.). Nueva York: WH Freeman and Company. ISBN 978-0-7167-4345-3.
- Scerri, Eric (2007). La tabla periódica, su historia y su importancia . Nueva York: Oxford University Press. ISBN 978-0-19-530573-9.
- Levine, Ira (2014). Química cuántica (7.ª ed.). Pearson Education. ISBN 978-0-321-80345-0.
- Griffiths, David (2000). Introducción a la mecánica cuántica (2.ª edición). Benjamin Cummings. ISBN 978-0-13-111892-8.
- Cohen, Irwin; Bustard, Thomas (1966). "Orbitales atómicos: limitaciones y variaciones". J. Chem. Educ . 43 (4): 187. Bibcode :1966JChEd..43..187C. doi :10.1021/ed043p187.
Enlaces externos
- Representación 3D de orbitales hidrogénicos
- El Orbitrón, una visualización de todos los orbitales atómicos comunes y no comunes, desde 1s hasta 7g
- Gran mesa Imágenes fijas de muchos orbitales