Receptor opioide
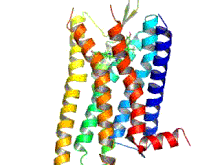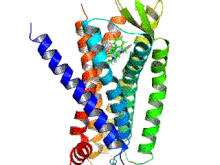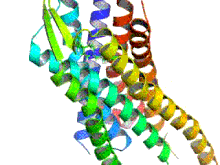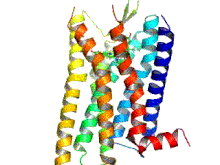
Los receptores opioides son un grupo de receptores inhibidores acoplados a proteína G con opioides como ligandos . [1] [2] [3] Los opioides endógenos son dinorfinas , encefalinas , endorfinas , endomorfinas y nociceptina . Los receptores opioides son ~40% idénticos a los receptores de somatostatina (SSTR). Los receptores opioides se distribuyen ampliamente en el cerebro , en la médula espinal , en las neuronas periféricas y en el tracto digestivo .
Descubrimiento
A mediados de la década de 1960, los estudios farmacológicos habían demostrado que era probable que los opioides ejercieran sus acciones en sitios receptores específicos y que era probable que existieran múltiples sitios de ese tipo. [4] Los primeros estudios habían indicado que los opiáceos parecían acumularse en el cerebro. [5] Los receptores se identificaron por primera vez como moléculas específicas mediante el uso de estudios de unión, en los que se descubrió que los opiáceos que habían sido marcados con radioisótopos se unían a homogeneizados de membrana cerebral . El primer estudio de este tipo se publicó en 1971, utilizando 3 H - levorfanol . [6] En 1973, Candace Pert y Solomon H. Snyder publicaron el primer estudio de unión detallado de lo que resultaría ser el receptor opioide μ , utilizando 3 H - naloxona . [7] Ese estudio ha sido ampliamente reconocido como el primer hallazgo definitivo de un receptor opioide, aunque otros dos estudios siguieron poco después. [8] [9]
Purificación
La purificación del receptor verificó aún más su existencia. El primer intento de purificar el receptor implicó el uso de un nuevo antagonista opioide llamado clornaltrexamina , que demostró unirse al receptor opioide. [10] Más tarde, Caruso purificó el componente extraído con detergente de la membrana del cerebro de rata que eluyó con la 3 H -clornaltrexamina específicamente unida. [11]
Subtipos principales
Existen cuatro subtipos principales de receptores opioides. [12] El OGFr fue descubierto originalmente y denominado como un nuevo receptor opioide zeta (ζ). Sin embargo, posteriormente se descubrió que comparte poca similitud de secuencia con los otros receptores opioides y tiene una función bastante diferente.
| Receptor | Subtipos | Ubicación [13] [14] | Función [13] [14] | Subunidad de proteína G |
|---|---|---|---|---|
| delta (δ) DOR OP 1 (I) | δ 1 , [15] δ 2 |
|
| Soldado americano |
| kappa (κ) KOR OP 2 (I) | k1 , k2 , k3 | Soldado americano | ||
| mu (μ) MOR OP 3 (I) | μ1 , μ2 , μ3 | μ1 : μ2 : μ3 :
| Soldado americano | |
| Receptor de nociceptina NOR OP 4 (I) | ORL1 |
| ||
| zeta (ζ) ZOR |
|
(I) Nombre basado en el orden de descubrimiento
Evolución
La familia de receptores opioides (OR) se originó a partir de dos eventos de duplicación de un único receptor opioide ancestral en las primeras etapas de la evolución de los vertebrados. El análisis filogenético demuestra que la familia de receptores opioides ya estaba presente en el origen de los vertebrados con mandíbulas hace más de 450 millones de años. En los humanos, este paralogón resultante de un doble evento de tetraploidización dio como resultado que los genes del receptor se ubicaran en los cromosomas 1, 6, 8 y 20. Los eventos de tetraploidización a menudo resultan en la pérdida de uno o más de los genes duplicados , pero en este caso, casi todas las especies conservan los cuatro receptores opioides, lo que indica la importancia biológica de estos sistemas. Stefano rastreó la coevolución de OR y el sistema inmunológico que subyace al hecho de que estos receptores ayudaron a los animales anteriores a sobrevivir al dolor y al choque inflamatorio en entornos agresivos. [16]
Las familias de receptores delta, kappa y mu muestran una identidad entre el 55 y el 58 % y una homología del 48 al 49 % con el receptor de nociceptina . En conjunto, esto indica que el gen del receptor NOP, OPRL1, tiene un origen evolutivo igual, pero una tasa de mutación más alta, que los otros genes del receptor. [17]
Aunque las familias de receptores opioides comparten muchas similitudes, sus diferencias estructurales conducen a diferencias funcionales. Por lo tanto, los receptores opioides mu inducen relajación, confianza, satisfacción y analgesia. [18] [19] Este sistema también puede ayudar a mediar relaciones estables y emocionalmente comprometidas. Los experimentos con cobayas jóvenes mostraron que el apego social está mediado por el sistema opioide. El papel evolutivo de la señalización opioide en estos comportamientos se confirmó en perros, polluelos y ratas. [18] Los receptores opioides también tienen un papel en los comportamientos de apareamiento. [20] Sin embargo, los receptores opioides mu no solo controlan el comportamiento social, sino que también hacen que los individuos se sientan relajados en una amplia gama de otras situaciones. [ cita requerida ]
Los receptores opioides kappa y delta pueden estar menos asociados con la relajación y la analgesia porque el receptor opioide kappa suprime la activación del receptor opioide mu, y el receptor opioide delta interactúa de manera diferente con los agonistas y antagonistas. Los receptores opioides kappa están involucrados en la movilización perceptiva de la ansiedad crónica, mientras que los receptores opioides delta inducen el inicio de la acción, la impulsividad y la movilización conductual. [19] [21] Estas diferencias llevaron a algunas investigaciones a sugerir que las regulaciones al alza o a la baja dentro de tres familias de receptores opioides son la base de la diferente emocionalidad disposicional observada en los trastornos psiquiátricos. [22] [23] [24]
Las características cognitivas moduladas por opioides específicas de los humanos no son atribuibles a diferencias en la codificación de receptores o ligandos, que comparten un 99% de similitud con los primates, sino a cambios regulatorios en los niveles de expresión. [25] [26]
Nomenclatura
Los receptores se nombraron utilizando la primera letra del primer ligando que se encontró que se unía a ellos. La morfina fue la primera sustancia química que se demostró que se unía a los receptores "mu". La primera letra del fármaco morfina es m , que se traduce como la letra griega correspondiente μ. De manera similar, se demostró por primera vez que un fármaco conocido como cetociclazocina se unía a los receptores "κ" (kappa), [ 27] mientras que el receptor "δ" (delta) recibió su nombre del tejido del conducto deferente del ratón en el que se caracterizó por primera vez el receptor. [28] Más tarde se identificó y clonó un receptor opioide adicional basándose en la homología con el ADNc . Este receptor se conoce como receptor de nociceptina u ORL1 (receptor opioide similar a 1).
Los tipos de receptores opioides son casi un 70% idénticos, con diferencias localizadas en los extremos N y C. El receptor μ es quizás el más importante. Se cree que la proteína G se une al tercer bucle intracelular de todos los receptores opioides. Tanto en ratones como en humanos , los genes de los distintos subtipos de receptores se encuentran en cromosomas separados.
Se han identificado subtipos separados de receptores opioides en el tejido humano. Hasta ahora, las investigaciones no han logrado identificar la evidencia genética de los subtipos, y se cree que surgen de la modificación postraduccional de tipos de receptores clonados. [29]
Un subcomité de la IUPHAR [30] [31] ha recomendado que la terminología apropiada para los 3 receptores clásicos (μ, δ, κ) y el receptor no clásico (nociceptina) debería ser MOP (" receptor de M u OP "), DOP, KOP y NOP respectivamente.
Receptores adicionales
Los receptores sigma (σ) alguna vez fueron considerados receptores opioides debido a que las acciones antitusivas de muchos fármacos opioides están mediadas por receptores σ, y los primeros agonistas σ selectivos fueron derivados de fármacos opioides (por ejemplo, alilnormetazocina ). Sin embargo, se descubrió que los receptores σ no son activados por péptidos opioides endógenos , y son bastante diferentes de los otros receptores opioides tanto en función como en secuencia genética, por lo que ahora no se los suele clasificar con los receptores opioides.
También se ha sugerido la existencia de otros receptores opioides (o subtipos de receptores) debido a la evidencia farmacológica de acciones producidas por péptidos opioides endógenos, pero se ha demostrado que no están mediadas por ninguno de los cuatro subtipos de receptores opioides conocidos. La existencia de subtipos de receptores o receptores adicionales distintos de los receptores opioides clásicos (μ, δ, κ) se ha basado en evidencia limitada, ya que solo se han identificado tres genes para los tres receptores principales. [32] [33] [34] El único de estos receptores adicionales que se ha identificado definitivamente es el receptor opioide zeta (ζ), que ha demostrado ser un modulador del factor de crecimiento celular con met-encefalina como ligando endógeno. Este receptor ahora se conoce más comúnmente como el receptor del factor de crecimiento opioide (OGFr) . [35] [36]
Receptor opioide épsilon (ε)
Otro receptor opioide postulado es el receptor opioide ε. La existencia de este receptor se sospechó después de que se demostró que el péptido opioide endógeno beta-endorfina producía acciones adicionales que no parecían estar mediadas por ninguno de los receptores opioides conocidos. [37] [38] La activación de este receptor produce una fuerte analgesia y liberación de met-encefalina ; se ha demostrado que varios agonistas opioides ampliamente utilizados, como el agonista μ etorfina y el agonista κ bremazocina , actúan como agonistas para este efecto (incluso en presencia de antagonistas de sus objetivos más conocidos), [39] mientras que se ha demostrado que la buprenorfina actúa como un antagonista épsilon. Ahora hay varios agonistas y antagonistas selectivos disponibles para el supuesto receptor épsilon; [40] [41] Sin embargo, los esfuerzos para localizar un gen para este receptor no han tenido éxito, y los efectos mediados por épsilon estuvieron ausentes en ratones "triple knock-out" μ/δ/κ , [42] lo que sugiere que es probable que el receptor épsilon sea una variante de empalme derivada de una modificación postraduccional alternativa, o un heterómero derivado de la hibridación de dos o más de los receptores opioides conocidos.
Mecanismo de activación
Los receptores opioides son un tipo de receptor acoplado a proteína G (GPCR). Estos receptores se distribuyen por todo el sistema nervioso central y dentro del tejido periférico de origen neuronal y no neuronal. También se encuentran en altas concentraciones en la sustancia gris periacueductal , el locus coeruleus y la médula ventromedial rostral . [43] Los receptores constan de un extremo N de aminoácidos extracelular , siete bucles helicoidales transmembrana, tres bucles extracelulares, tres bucles intracelulares y un extremo C carboxilo intracelular. Tres bucles extracelulares de GPCR proporcionan un compartimento donde las moléculas de señalización pueden unirse para generar una respuesta. La proteína G heterotrimérica contiene tres subunidades diferentes, que incluyen una subunidad alfa (α), una subunidad beta (β) y una subunidad gamma (γ). [44] Las subunidades gamma y beta están unidas permanentemente entre sí, produciendo una única subunidad Gβγ. Las proteínas G heterotriméricas actúan como "interruptores moleculares" que desempeñan un papel clave en la transducción de señales, ya que transmiten información de los receptores activados a las proteínas efectoras adecuadas. Todas las subunidades α de la proteína G contienen palmitato, que es un ácido graso saturado de 16 carbonos, que está unido cerca del extremo N a través de un enlace tioéster reversible y lábil a un aminoácido cisteína. Es esta palmitoilación la que permite que la proteína G interactúe con los fosfolípidos de la membrana debido a la naturaleza hidrofóbica de las subunidades alfa. La subunidad gamma también está modificada por lípidos y también puede unirse a la membrana plasmática. Estas propiedades de las dos subunidades permiten que la proteína G del receptor opioide interactúe permanentemente con la membrana a través de anclajes lipídicos. [45]
Cuando un ligando agonista se une al receptor opioide, se produce un cambio conformacional y la molécula de GDP se libera de la subunidad Gα. Este mecanismo es complejo y es una etapa importante de la vía de transducción de señales. Cuando se une la molécula de GDP, la subunidad Gα está en su estado inactivo y el bolsillo de unión de nucleótidos se cierra dentro del complejo proteico. Sin embargo, tras la unión del ligando, el receptor cambia a una conformación activa, y esto es impulsado por la reorganización intermolecular entre las hélices transmembrana. La activación del receptor libera un "bloqueo iónico" que mantiene unidos los lados citoplasmáticos de las hélices transmembrana tres y seis, lo que hace que roten. Este cambio conformacional expone los dominios intracelulares del receptor en el lado citosólico, lo que conduce a la activación de la proteína G. Cuando la molécula de GDP se disocia de la subunidad Gα, una molécula de GTP se une al bolsillo de unión de nucleótidos libre y la proteína G se activa. Se forma un complejo Gα(GTP), que tiene una afinidad más débil por la subunidad Gβγ que el complejo Gα(GDP), lo que hace que la subunidad Gα se separe de la subunidad Gβγ, formando dos secciones de la proteína G. Las subunidades ahora son libres de interactuar con las proteínas efectoras; sin embargo, todavía están unidas a la membrana plasmática mediante anclajes lipídicos. [46] Después de la unión, las subunidades activas de la proteína G se difunden dentro de la membrana y actúan sobre varias vías efectoras intracelulares. Esto incluye la inhibición de la actividad de la adenilato ciclasa neuronal, así como el aumento de la hiperpolarización de la membrana. Cuando se estimula el complejo enzimático de la adenilato ciclasa , da como resultado la formación de adenosina cíclica 3', 5'-monofosfato (AMPc), a partir de adenosina 5' trifosfato (ATP). El AMPc actúa como un mensajero secundario, ya que se mueve desde la membrana plasmática hacia la célula y transmite la señal. [47]
El AMPc se une a la proteína quinasa A dependiente de AMPc (PKA), que se encuentra intracelularmente en la neurona y la activa. La PKA consiste en una holoenzima , es decir, un compuesto que se activa debido a la combinación de una enzima con una coenzima. La enzima PKA también contiene dos subunidades catalíticas PKS-Cα y un dímero de subunidad reguladora PKA-R. La holoenzima PKA es inactiva en condiciones normales, sin embargo, cuando las moléculas de AMPc que se producen anteriormente en el mecanismo de transducción de señales se combinan con la enzima, la PKA sufre un cambio conformacional. Esto la activa, dándole la capacidad de catalizar la fosforilación del sustrato. [48] CREB (proteína de unión al elemento de respuesta al AMPc) pertenece a una familia de factores de transcripción y se encuentra en el núcleo de la neurona. Cuando la PKA se activa, fosforila la proteína CREB (añade un grupo fosfato de alta energía) y la activa. La proteína CREB se une a los elementos de respuesta de cAMP CRE y puede aumentar o disminuir la transcripción de ciertos genes. La vía de señalización cAMP/PKA/CREB descrita anteriormente es crucial en la formación de la memoria y la modulación del dolor. [49] También es importante en la inducción y el mantenimiento de la potenciación a largo plazo , que es un fenómeno que subyace a la plasticidad sináptica : la capacidad de las sinapsis de fortalecerse o debilitarse con el tiempo.
Los canales de calcio dependientes de voltaje (VDCC) son clave en la despolarización de las neuronas y desempeñan un papel importante en la promoción de la liberación de neurotransmisores. Cuando los agonistas se unen a los receptores opioides, las proteínas G se activan y se disocian en sus subunidades constituyentes Gα y Gβγ. La subunidad Gβγ se une al bucle intracelular entre las dos hélices transmembrana del VDCC. Cuando la subunidad se une al canal de calcio dependiente de voltaje, produce un bloqueo dependiente de voltaje, que inhibe el canal, impidiendo el flujo de iones de calcio hacia la neurona. El canal de potasio rectificador interno acoplado a la proteína G también está incrustado en la membrana celular . Cuando una molécula de Gβγ o Gα(GTP) se une al extremo C del canal de potasio, se activa y los iones de potasio se bombean fuera de la neurona. [50] La activación del canal de potasio y la posterior desactivación del canal de calcio provoca la hiperpolarización de la membrana . Esto es cuando hay un cambio en el potencial de la membrana, de modo que se vuelve más negativo. La reducción de los iones de calcio provoca una reducción de la liberación de neurotransmisores porque el calcio es esencial para que se produzca este evento. [51] Esto significa que los neurotransmisores como el glutamato y la sustancia P no pueden liberarse desde la terminal presináptica de las neuronas. Estos neurotransmisores son vitales en la transmisión del dolor, por lo que la activación del receptor opioide reduce la liberación de estas sustancias, creando así un fuerte efecto analgésico.
Patología
Algunas formas de mutaciones en los receptores opioides δ han dado lugar a una activación constante del receptor. [52]
Interacciones proteína-proteína
Heterómeros receptores
- δ-κ [53]
- delta-μ
- k-μ
- μ-ORL1
- delta- CB1
- μ-CB1
- k-CB1
- δ- α2A
- delta -beta2
- k- β2
- μ-α2A
- delta- CXCR4
- delta- SNSR4
- k- APJ
- μ- CCR5
- μ1D- GRPR
- μ- mGlu5
- μ- 5-HT1A
- μ- NK1
- μ- sst2A
Véase también
Referencias
- ^ Dhawan BN, Cesselin F, Raghubir R, Reisine T, Bradley PB, Portoghese PS, Hamon M (diciembre de 1996). "Unión Internacional de Farmacología. XII. Clasificación de los receptores opioides". Pharmacological Reviews . 48 (4): 567–92. PMID 8981566.

- ^ Janecka A, Fichna J, Janecki T (2004). "Receptores opioides y sus ligandos". Temas actuales en química medicinal . 4 (1): 1–17. doi :10.2174/1568026043451618. PMID 14754373.

- ^ Waldhoer M, Bartlett SE, Whistler JL (2004). "Receptores opioides". Revisión anual de bioquímica . 73 : 953–90. doi :10.1146/annurev.biochem.73.011303.073940. PMID 15189164.

- ^ Martin WR (diciembre de 1967). "Antagonistas opioides". Revisiones farmacológicas . 19 (4): 463–521. PMID 4867058.

- ^ Ingoglia NA, Dole VP (octubre de 1970). "Localización de d- y l-metadona después de la inyección intraventricular en cerebros de ratas". The Journal of Pharmacology and Experimental Therapeutics . 175 (1): 84–7. PMID 5471456.

- ^ Goldstein A, Lowney LI, Pal BK (agosto de 1971). "Interacciones estereoespecíficas y no específicas del congénere de la morfina levorfanol en fracciones subcelulares del cerebro de ratón". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 68 (8): 1742–7. Bibcode :1971PNAS...68.1742G. doi : 10.1073/pnas.68.8.1742 . PMC 389284 . PMID 5288759.

- ^ Pert CB, Snyder SH (marzo de 1973). "Receptor de opiáceos: demostración en el tejido nervioso". Science . 179 (4077): 1011–4. Bibcode :1973Sci...179.1011P. doi :10.1126/science.179.4077.1011. PMID 4687585. S2CID 21783674.

- ^ Terenius L (1973). "Interacción estereoespecífica entre analgésicos narcóticos y una fracción de membrana plasmática sináptica de la corteza cerebral de la rata". Acta Pharmacologica et Toxicologica . 32 (3): 317–20. doi :10.1111/j.1600-0773.1973.tb01477.x. PMID 4801733.
- ^ Simon EJ, Hiller JM, Edelman I (julio de 1973). "Unión estereoespecífica del potente analgésico narcótico (3H) etorfina al homogeneizado de cerebro de rata". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 70 (7): 1947–9. Bibcode :1973PNAS...70.1947S. doi : 10.1073/pnas.70.7.1947 . PMC 433639 . PMID 4516196.
- ^ Caruso TP, Takemori AE, Larson DL, Portoghese PS (abril de 1979). "Cloroximorfamina y agente alquilante dirigido al sitio del receptor opioide con actividad agonista narcótica". Science . 204 (4390): 316–8. Bibcode :1979Sci...204..316C. doi :10.1126/science.86208. PMID 86208.
- ^ Caruso TP, Larson DL, Portoghese PS, Takemori AE (diciembre de 1980). "Aislamiento de complejos selectivos unidos a 3H-clornaltrexamina, posibles componentes del receptor opioide en cerebros de ratones". Ciencias de la vida . 27 (22): 2063–9. doi :10.1016/0024-3205(80)90485-3. PMID 6259471.
- ^ Corbett AD, Henderson G, McKnight AT, Paterson SJ (enero de 2006). "75 años de investigación sobre opioides: la emocionante pero vana búsqueda del Santo Grial". British Journal of Pharmacology . 147 (Supl 1): S153-62. doi :10.1038/sj.bjp.0706435. PMC 1760732 . PMID 16402099.
- ^ ab Stein C, Schäfer M, Machelska H (agosto de 2003). "Atacar el dolor en su origen: nuevas perspectivas sobre los opioides". Nature Medicine . 9 (8): 1003–8. doi :10.1038/nm908. PMID 12894165. S2CID 25453057.
- ^ ab Fine PG, Portenoy RK (2004). "Capítulo 2: El sistema opioide endógeno" (PDF) . Una guía clínica para la analgesia con opioides . McGraw Hill. Archivado desde el original (PDF) el 19 de julio de 2011.
- ^ Portoghese PS, Lunzer MM (abril de 2003). "Identidad del supuesto receptor opioide delta1 como heterómero delta-kappa en la médula espinal del ratón". Revista Europea de Farmacología . 467 (1–3): 233–4. doi :10.1016/s0014-2999(03)01599-1. PMID 12706480.
- ^ Stefano GB, Kream RM (junio de 2010). "Péptidos opioides y alcaloides opiáceos en procesos inmunorreguladores". Archivos de la ciencia médica . 6 (3): 456–60. doi :10.5114/aoms.2010.14271. PMC 3282526 . PMID 22371785.
- ^ Stevens CW (enero de 2009). "La evolución de los receptores opioides de vertebrados". Frontiers in Bioscience . 14 (14): 1247–69. doi :10.2741/3306. PMC 3070387 . PMID 19273128.
- ^ ab Furay AR, Neumaier JF (octubre de 2011). "Receptores opioides: unión que une". Neuropsicofarmacología . 36 (11): 2157–8. doi :10.1038/npp.2011.147. PMC 3176578 . PMID 21918519.
- ^ ab Bodnar RJ (enero de 2016). "Opiáceos endógenos y comportamiento: 2014". Péptidos . 75 : 18–70. doi :10.1016/j.peptides.2015.10.009. PMID 26551874. S2CID 34578840.
- ^ Burkett JP, Spiegel LL, Inoue K, Murphy AZ, Young LJ (octubre de 2011). "La activación de los receptores μ-opioides en el cuerpo estriado dorsal es necesaria para el apego social adulto en ratones de campo monógamos". Neuropsicofarmacología . 36 (11): 2200–10. doi :10.1038/npp.2011.117. PMC 3176565 . PMID 21734650.
- ^ Olmstead MC, Ouagazzal AM, Kieffer BL (2009). "Los receptores opioides mu y delta regulan de forma opuesta la impulsividad motora en la tarea de tocarse la nariz con una señal". PLOS ONE . 4 (2): e4410. Bibcode :2009PLoSO...4.4410O. doi : 10.1371/journal.pone.0004410 . PMC 2635474 . PMID 19198656.
- ^ Akil H, Owens C, Gutstein H, Taylor L, Curran E, Watson S (1999). "Opiáceos endógenos: descripción general y cuestiones actuales". Dependencia de drogas y alcohol . 51 (1–2): 127–40. doi :10.1016/s0376-8716(98)00071-4. PMID 9716935.
- ^ Trofimova I (abril de 2018). "Funcionalidad versus dimensionalidad en taxonomías psicológicas y un rompecabezas de valencia emocional". Philosophical Transactions of the Royal Society of London. Serie B, Ciencias Biológicas . 373 (1744): 20170167. doi :10.1098/rstb.2017.0167. PMC 5832691 . PMID 29483351.
- ^ Tuominen L, Salo J, Hirvonen J, Någren K, Laine P, Melartin T, et al. (julio de 2012). "El rasgo de temperamento Evitación del daño se asocia con la disponibilidad del receptor μ-opioide en la corteza frontal: un estudio PET utilizando [(11)C]carfentanil". NeuroImage . 61 (3): 670–6. doi :10.1016/j.neuroimage.2012.03.063. PMID 22484309. S2CID 26046363.
- ^ Cruz-Gordillo P, Fedrigo O, Wray GA, Babbitt CC (2010). "Cambios extensos en la expresión de los genes opioides entre humanos y chimpancés". Cerebro, comportamiento y evolución . 76 (2): 154–62. doi :10.1159/000320968. PMID 21079395. S2CID 252466.
- ^ Rockman MV, Hahn MW, Soranzo N, Zimprich F, Goldstein DB, Wray GA (diciembre de 2005). "La selección positiva antigua y reciente transformó la cisregulación de opioides en humanos". PLOS Biology . 3 (12): e387. doi : 10.1371/journal.pbio.0030387 . PMC 1283535 . PMID 16274263.

- ^ Aggrawal A (1 de mayo de 1995). «Opio: el rey de los narcóticos». Opiáceos: pasado, presente y futuro . BLTC Research. Archivado desde el original el 26 de mayo de 2012. Consultado el 29 de diciembre de 2013 .
- ^ Lord JA, Waterfield AA, Hughes J, Kosterlitz HW (junio de 1977). "Péptidos opioides endógenos: múltiples agonistas y receptores". Nature . 267 (5611): 495–9. Bibcode :1977Natur.267..495L. doi :10.1038/267495a0. PMID 195217. S2CID 4160761.
- ^ Lemke, Thomas L.; Williams, David H.; Foye, William O. (2002). "Analgésicos opioides; Fries, DS". Principios de química medicinal de Foye . Hagerstown, MD: Lippincott Williams & Wilkins. ISBN 978-0-683-30737-5.
- ^ Girdlestone D (octubre de 2000). "Receptores opioides; Cox BM, Chavkin C, Christie MJ, Civelli O, Evans C, Hamon MD, et al." Compendio de caracterización y clasificación de receptores de la IUPHAR (2.ª ed.). Londres: IUPHAR Media. págs. 321–333.
- ^ "Receptores opioides". Base de datos IUPHAR. Unión Internacional de Farmacología (1 de agosto de 2008).
- ^ Grevel J, Yu V, Sadée W (mayo de 1985). "Caracterización de un sitio de unión lábil de naloxona (sitio lambda) en el cerebro de la rata". Journal of Neurochemistry . 44 (5): 1647–56. doi :10.1111/j.1471-4159.1985.tb08808.x. PMID 2985759. S2CID 84330114.
- ^ Mizoguchi H, Narita M, Nagase H, Tseng LF (octubre de 2000). "La activación de las proteínas G en la protuberancia y el bulbo raquídeo del ratón por beta-endorfina está mediada por la estimulación de los receptores mu y épsilon putativos". Ciencias de la vida . 67 (22): 2733–43. doi :10.1016/S0024-3205(00)00852-3. PMID 11105989.
- ^ Wollemann M, Benyhe S (junio de 2004). "Acciones no opioides de los péptidos opioides". Ciencias de la vida . 75 (3): 257–70. doi :10.1016/j.lfs.2003.12.005. PMID 15135648.
- ^ Zagon IS, Verderame MF, Allen SS, McLaughlin PJ (febrero de 2000). "Clonación, secuenciación, ubicación cromosómica y función de los ADNc que codifican un receptor del factor de crecimiento opioide (OGFr) en humanos". Brain Research . 856 (1–2): 75–83. doi :10.1016/S0006-8993(99)02330-6. PMID 10677613. S2CID 37516655.
- ^ Zagon IS, Verderame MF, McLaughlin PJ (febrero de 2002). "La biología del receptor del factor de crecimiento opioide (OGFr)". Investigación cerebral. Reseñas de investigación cerebral . 38 (3): 351–76. doi :10.1016/S0165-0173(01)00160-6. PMID 11890982. S2CID 37812525.
- ^ Wüster M, Schulz R, Herz A (diciembre de 1979). "Especificidad de los opioides hacia los receptores opiáceos mu, delta y épsilon". Neuroscience Letters . 15 (2–3): 193–8. doi :10.1016/0304-3940(79)96112-3. PMID 231238. S2CID 53251283.
- ^ Schulz R, Wüster M, Herz A (marzo de 1981). "Caracterización farmacológica del receptor épsilon-opiáceo". Revista de farmacología y terapéutica experimental . 216 (3): 604–6. PMID 6259326.
- ^ Narita M, Tseng LF (marzo de 1998). "Evidencia de la existencia del "receptor opioide épsilon" sensible a las beta-endorfinas en el cerebro: los mecanismos de la antinocicepción mediada por épsilon". Revista Japonesa de Farmacología . 76 (3): 233–53. doi : 10.1254/jjp.76.233 . PMID 9593217.
- ^ Fujii H, Narita M, Mizoguchi H, Murachi M, Tanaka T, Kawai K, et al. (agosto de 2004). "Diseño de fármacos y síntesis de agonistas del receptor opioide épsilon: 17-(ciclopropilmetil)-4,5alfa-epoxi-3,6beta-dihidroxi-6,14-endoetenomorfinan-7alfa-(N-metil-N-fenetil)carboxamida (TAN-821) que induce antinocicepción mediada por el supuesto receptor opioide épsilon". Química bioorgánica y medicinal . 12 (15): 4133–45. doi :10.1016/j.bmc.2004.05.024. PMID 15246090.
- ^ Fujii H, Nagase H (2006). "Diseño racional de fármacos a partir del agonista selectivo del receptor opioide épsilon TAN-821 y del antagonista TAN-1014". Química medicinal actual . 13 (10): 1109–18. doi :10.2174/092986706776360851. PMID 16719773.
- ^ Contet C, Matifas A, Kieffer BL (mayo de 2004). "No hay evidencia de receptor épsilon acoplado a proteína G en el cerebro de ratones con inactivación del receptor opioide triple". Revista Europea de Farmacología . 492 (2–3): 131–6. doi :10.1016/j.ejphar.2004.03.056. PMID 15178356.
- ^ Al-Hasani R, Bruchas MR (diciembre de 2011). "Mecanismos moleculares de la señalización y el comportamiento dependientes del receptor opioide". Anestesiología . 115 (6): 1363–81. doi :10.1097/ALN.0b013e318238bba6. PMC 3698859 . PMID 22020140.
- ^ "Introducción a los conceptos básicos de biología celular | Aprenda ciencias en Scitable". www.nature.com . Consultado el 8 de noviembre de 2017 .
- ^ Wedegaertner PB, Wilson PT, Bourne HR (enero de 1995). "Modificaciones lipídicas de proteínas G triméricas". The Journal of Biological Chemistry . 270 (2): 503–6. doi : 10.1074/jbc.270.2.503 . PMID 7822269.
- ^ Philip F, Sengupta P, Scarlata S (junio de 2007). "La señalización a través de un receptor acoplado a proteína G y su proteína G correspondiente sigue un modelo estequiométricamente limitado". The Journal of Biological Chemistry . 282 (26): 19203–16. doi : 10.1074/jbc.M701558200 . PMID 17420253.
- ^ Steer ML (noviembre de 1975). "Adenil ciclasa". Anales de Cirugía . 182 (5): 603–9. doi :10.1097/00000658-197511000-00012. PMC 1344045 . PMID 172034.
- ^ Keshwani MM, Kanter JR, Ma Y, Wilderman A, Darshi M, Insel PA, Taylor SS (octubre de 2015). "Mecanismos de apoptosis mediada por AMP cíclico/proteína quinasa A y glucocorticoides utilizando células de linfoma S49 como sistema modelo". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 112 (41): 12681–6. Bibcode :2015PNAS..11212681K. doi : 10.1073/pnas.1516057112 . PMC 4611605 . PMID 26417071.
- ^ Shao XM, Sun J, Jiang YL, Liu BY, Shen Z, Fang F, et al. (2016). "La inhibición de la vía cAMP/PKA/CREB contribuye a los efectos analgésicos de la electroacupuntura en la corteza cingulada anterior en un modelo de memoria del dolor en ratas". Plasticidad neuronal . 2016 : 5320641. doi : 10.1155/2016/5320641 . PMC 5206448. PMID 28090359 .
- ^ Yamada M, Inanobe A, Kurachi Y (diciembre de 1998). "Regulación de los canales de iones de potasio por la proteína G". Pharmacological Reviews . 50 (4): 723–60. PMID 9860808.
- ^ Kosten TR, George TP (julio de 2002). "La neurobiología de la dependencia de opioides: implicaciones para el tratamiento". Science & Practice Perspectives . 1 (1): 13–20. doi :10.1151/spp021113. PMC 2851054 . PMID 18567959.
- ^ Befort K, Zilliox C, Filliol D, Yue S, Kieffer BL (junio de 1999). "Activación constitutiva del receptor opioide delta por mutaciones en los dominios transmembrana III y VII". The Journal of Biological Chemistry . 274 (26): 18574–81. doi : 10.1074/jbc.274.26.18574 . PMID 10373467.
- ^ Fujita W, Gomes I, Devi LA (septiembre de 2014). "Revolución en la señalización de GPCR: heterómeros de receptores opioides como nuevos objetivos terapéuticos: revisión de la IUPHAR 10". British Journal of Pharmacology . 171 (18): 4155–76. doi :10.1111/bph.12798. PMC 4241085 . PMID 24916280.
Lectura adicional
- Stein C (2016). "Receptores opioides". Revista Anual de Medicina . 67 : 433–51. doi : 10.1146/annurev-med-062613-093100 . PMID 26332001.
- Valentino RJ, Volkow ND (diciembre de 2018). "Descifrando la complejidad de la función del receptor opioide". Neuropsicofarmacología . 43 (13): 2514–2520. doi :10.1038/s41386-018-0225-3. PMC 6224460 . PMID 30250308.
Enlaces externos
- Receptores de opioides en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- "Cómo los fármacos opioides activan los receptores". Instituto Nacional de Salud .
- "Receptores opioides". Base de datos de receptores y canales iónicos de la IUPHAR . Unión Internacional de Farmacología Básica y Clínica.
- Corbett A, McKnight S, Henderson G. "Receptores opioides". BLTC Research . Consultado el 21 de marzo de 2008 .
- Guzman F. "Videoconferencias sobre receptores opioides". Rincón de la farmacología . Consultado el 30 de julio de 2012 .
- Lomize A, Lomize M, Pogozheva I. "Base de datos Orientations of Proteins in Membranes (OPM)". Universidad de Michigan. Archivado desde el original el 2014-01-03 . Consultado el 2008-03-21 .

