Proteína O-GlcNAcase
| OGA | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificadores | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Alias | OGA , MEA5, NCOAT, antígeno expresado en meningioma 5 (hialuronidasa), MGEA5, O-GlcNAcase | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificaciones externas | OMIM : 604039; MGI : 1932139; HomoloGene : 8154; Tarjetas genéticas : OGA; OMA :OGA - ortólogos | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidatos | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
La proteína O -GlcNAcase ( EC 3.2.1.169, OGA, glicósido hidrolasa O -GlcNAcase, O -GlcNAcase, BtGH84, O -GlcNAc hidrolasa) es una enzima con el nombre sistemático (proteína)-3- O- ( N -acetil- D -glucosaminil) -L -serina/treonina N -acetilglucosaminil hidrolasa . [5] [6] [7] [8] [9] La OGA está codificada por el gen OGA . Esta enzima cataliza la eliminación de la modificación postraduccional de O -GlcNAc en la siguiente reacción química :
- [proteína]-3- O -( N -acetil-β- D -glucosaminil)- L -serina + H 2 O ⇌ [proteína]- L -serina + N -acetil- D -glucosamina
- [proteína]-3- O -( N -acetil-β- D -glucosaminil)- L -treonina + H 2 O ⇌ [proteína]- L -treonina + N -acetil- D -glucosamina
Nomenclatura
| Proteína O -GlcNAcase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identificadores | |||||||||
| N.º CE | 3.2.1.169 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista de IntEnz | ||||||||
| BRENDA | Entrada de BRENDA | ||||||||
| Expasí | Vista de NiceZyme | ||||||||
| BARRIL | Entrada de KEGG | ||||||||
| MetaCiclo | vía metabólica | ||||||||
| PRIAMO | perfil | ||||||||
| Estructuras del PDB | RCSB AP APBE APSUMA | ||||||||
| |||||||||
Otros nombres incluyen:
- O -GlcNAcasa citoplasmática nuclear y acetiltransferasa
Isoformas
El gen humano OGA es capaz de producir dos transcripciones diferentes, cada una capaz de codificar una isoforma de OGA diferente. La isoforma larga L-OGA, una enzima bifuncional que posee una actividad de glicósido hidrolasa y un dominio pseudohistona-acetil transferasa, reside principalmente en el citoplasma y el núcleo. La isoforma corta S-OGA, que solo presenta el dominio de glicósido hidrolasa, se describió inicialmente como residente dentro del núcleo. Sin embargo, trabajos más recientes demostraron que S-OGA se encuentra en las mitocondrias y regula la producción reactiva de oxígeno en este orgánulo. [10] También se ha descrito otra isoforma, resultante de la escisión proteolítica de L-OGA. Las tres isoformas presentan actividad de glicósido hidrolasa. [11]
Homólogos
Las O -GlcNAcases de la proteína pertenecen a la familia 84 de las glicósidos hidrolasas de la clasificación de enzimas activas de carbohidratos. [12] Existen homólogos en otras especies, ya que la O -GlcNAcase se conserva en especies eucariotas superiores. En una alineación por pares, los humanos comparten un 55% de homología con Drosophila y un 43% con C. elegans . Drosophila y C. elegans comparten un 43% de homología. Entre los mamíferos, la secuencia OGA está aún más conservada. El ratón y el humano tienen un 97,8% de homología. Sin embargo, OGA no comparte una homología significativa con otras proteínas. Sin embargo, tramos cortos de unos 200 aminoácidos en OGA tienen homología con algunas proteínas como la hialuronidasa, una acetiltransferasa putativa, el factor de elongación de la traducción eucariota-1γ y el polipéptido 11-1. [13]
Reacción
ProteínaOh-GlcNAcilación

La O -GlcNAcilación es una forma de glicosilación , la adición enzimática específica de sacáridos a proteínas y lípidos. Esta forma de glicosilación es con β -N -acetilglucosamina O -enlazada o β - O -2-acetamido-2-desoxi -D - glicopiranosa ( O -GlcNAc) enlazada. En esta forma, se agrega un solo azúcar (β- N -acetilglucosamina) a los residuos de serina y treonina de las proteínas nucleares o citoplasmáticas. Dos enzimas conservadas controlan esta glicosilación de serina y treonina: la O -GlcNAc transferasa (OGT) y la O -GlcNAcasa (OGA). Mientras que la OGT cataliza la adición de O -GlcNAc a serina y treonina, la OGA cataliza la escisión hidrolítica de la O -GlcNAc a partir de proteínas modificadas post-transicionalmente. [14]
La OGA es un miembro de la familia de las hexosaminidasas . Sin embargo, a diferencia de las hexosaminidasas lisosomales, la actividad de la OGA es más alta a pH neutro (aproximadamente 7) y se localiza principalmente en el citosol. La OGA y la OGT se sintetizan a partir de dos genes conservados y se expresan en todo el cuerpo humano con altos niveles en el cerebro y el páncreas. Los productos de la O -GlcNAc y el proceso en sí desempeñan un papel en el desarrollo embrionario, la actividad cerebral, la producción de hormonas y una gran cantidad de otras actividades. [15] [16]
Más de 600 proteínas son dianas de la O -GlcNAcilación. Si bien no se conocen por completo los efectos funcionales de la modificación de la O -GlcNAc, se sabe que la modificación de la O -GlcNAc afecta a muchas actividades celulares, como el metabolismo de lípidos y carbohidratos y la biosíntesis de hexosaminas. Las proteínas modificadas pueden modular varias vías de señalización posteriores al influir en las actividades proteómicas y de transcripción. [17]
Mecanismo e inhibición

La OGA cataliza la hidrólisis de O -GlcNAc a través de un intermediario de reacción de oxazolina . [18] Los compuestos estables que imitan el intermediario de reacción pueden actuar como inhibidores selectivos de enzimas. Los derivados de tiazolina de GlcNAc se pueden utilizar como intermediario de reacción. Un ejemplo de esto incluye Thiamet-G como se muestra a la derecha. Una segunda forma de inhibición puede ocurrir a partir de la imitación del estado de transición . La familia de inhibidores de GlcNAcstatina explota este mecanismo para inhibir la actividad de OGA. Para ambos tipos de inhibidores, OGA se puede seleccionar aparte de las hexosaminidasas lisosomales genéricas al alargar el sustituyente C2 en su estructura química. Esto aprovecha un bolsillo profundo en el sitio activo de OGA que le permite unirse a análogos de GlcNAc. [19]
Existe potencial para la regulación de la O -GlcNAcase para el tratamiento de la enfermedad de Alzheimer . [20] Cuando la proteína tau en el cerebro está hiperfosforilada, se forman ovillos neurofibrilares , que son un sello patológico de enfermedades neurodegenerativas como la enfermedad de Alzheimer. Para tratar esta afección, se utilizan inhibidores como Thiamet-G para prevenir que la O -GlcNAc se elimine de la tau, lo que ayuda a prevenir que la tau se fosforile. [21]
Estructura
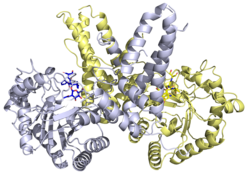
Existen estructuras de rayos X disponibles para una variedad de proteínas O -GlcNAcase. La estructura de rayos X de la O -GlcNAcase humana en complejo con Thiamet-G identificó la base estructural de la inhibición enzimática. [22]
Véase también
Referencias
- ^ abc GRCh38: Lanzamiento de Ensembl 89: ENSG00000198408 – Ensembl , mayo de 2017
- ^ abc GRCm38: Lanzamiento de Ensembl 89: ENSMUSG00000025220 – Ensembl , mayo de 2017
- ^ "Referencia de PubMed humana:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ "Referencia PubMed de ratón:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU . .
- ^ Wells L, Gao Y, Mahoney JA, Vosseller K, Chen C, Rosen A, Hart GW (enero de 2002). "O-glicosilación dinámica de proteínas nucleares y citosólicas: caracterización adicional de la beta-N-acetilglucosaminidasa nucleocitoplasmática, O-GlcNAcase". The Journal of Biological Chemistry . 277 (3): 1755–61. doi : 10.1074/jbc.M109656200 . PMID 11788610.
- ^ Cetinbaş N, Macauley MS, Stubbs KA, Drapala R, Vocadlo DJ (marzo de 2006). "Identificación de Asp174 y Asp175 como residuos catalíticos clave de la O-GlcNAcase humana mediante análisis funcional de mutantes dirigidos al sitio". Bioquímica . 45 (11): 3835–44. doi :10.1021/bi052370b. PMID 16533067.
- ^ Dennis RJ, Taylor EJ, Macauley MS, Stubbs KA, Turkenburg JP, Hart SJ, et al. (abril de 2006). "Estructura y mecanismo de una beta-glucosaminidasa bacteriana con actividad de O-GlcNAcase". Nature Structural & Molecular Biology . 13 (4): 365–71. doi :10.1038/nsmb1079. PMID 16565725. S2CID 9239755.
- ^ Kim EJ, Kang DO, Love DC, Hanover JA (junio de 2006). "Caracterización enzimática de isoformas de O-GlcNAcase utilizando un sustrato GlcNAc fluorogénico". Investigación de carbohidratos . 341 (8): 971–82. doi :10.1016/j.carres.2006.03.004. PMC 10561171 . PMID 16584714.
- ^ Dong DL, Hart GW (julio de 1994). "Purificación y caracterización de una N-acetil-beta-D-glucosaminidasa selectiva de O-GlcNAc del citosol del bazo de rata". The Journal of Biological Chemistry . 269 (30): 19321–30. doi : 10.1016/S0021-9258(17)32170-1 . PMID 8034696.
- ^ Pagesy P, Bouaboud A, Feng Z, Hulin P, Issad T (junio de 2022). "La O-GlcNAcase corta se dirige a las mitocondrias y regula el nivel de especies reactivas de oxígeno mitocondriales". Cells . 11 (11): 1827. doi : 10.3390/cells11111827 . PMC 9180253 . PMID 35681522. S2CID 9180253.
- ^ Li J, Huang CL, Zhang LW, Lin L, Li ZH, Zhang FW, Wang P (julio de 2010). "Las isoformas de la O-GlcNAcase humana muestran distintas eficiencias catalíticas". Bioquímica. Biokhimiia . 75 (7): 938–43. doi :10.1134/S0006297910070175. PMID 20673219. S2CID 2414800.
- ^ Greig, Ian; Vocadlo, David. "Glycoside Hydrolase Family 84". Cazypedia . Consultado el 28 de marzo de 2017 .
- ^ Gao Y, Wells L, Comer FI, Parker GJ, Hart GW (marzo de 2001). "O-glicosilación dinámica de proteínas nucleares y citosólicas: clonación y caracterización de una beta-N-acetilglucosaminidasa neutra y citosólica del cerebro humano". The Journal of Biological Chemistry . 276 (13): 9838–45. doi : 10.1074/jbc.M010420200 . PMID 11148210.
- ^ Lima VV, Rigsby CS, Hardy DM, Webb RC, Tostes RC (2009). "O-GlcNAcylation: un nuevo mecanismo postraduccional para alterar la señalización celular vascular en la salud y la enfermedad: enfoque en la hipertensión". Journal of the American Society of Hypertension . 3 (6): 374–87. doi :10.1016/j.jash.2009.09.004. PMC 3022480 . PMID 20409980.
- ^ Förster S, Welleford AS, Triplett JC, Sultana R, Schmitz B, Butterfield DA (septiembre de 2014). "Los niveles elevados de O-GlcNAc se correlacionan con niveles reducidos de O-GlcNAcase en el cerebro con enfermedad de Alzheimer". Biochimica et Biophysica Acta (BBA) - Bases moleculares de la enfermedad . 1842 (9): 1333–9. doi :10.1016/j.bbadis.2014.05.014. PMC 4140188 . PMID 24859566.
- ^ Shafi R, Iyer SP, Ellies LG, O'Donnell N, Marek KW, Chui D, et al. (mayo de 2000). "El gen de la transferasa O-GlcNAc reside en el cromosoma X y es esencial para la viabilidad de las células madre embrionarias y la ontogenia del ratón". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 97 (11): 5735–9. Bibcode :2000PNAS...97.5735S. doi : 10.1073/pnas.100471497 . PMC 18502 . PMID 10801981.
- ^ Love DC, Ghosh S, Mondoux MA, Fukushige T, Wang P, Wilson MA, et al. (abril de 2010). "Ciclado dinámico de O-GlcNAc en promotores de genes de Caenorhabditis elegans que regulan la longevidad, el estrés y la inmunidad". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 107 (16): 7413–8. Bibcode :2010PNAS..107.7413L. doi : 10.1073/pnas.0911857107 . PMC 2867743 . PMID 20368426.
- ^ Dennis RJ, Taylor EJ, Macauley MS, Stubbs KA, Turkenburg JP, Hart SJ, et al. (abril de 2006). "Estructura y mecanismo de una beta-glucosaminidasa bacteriana con actividad de O-GlcNAcase". Nature Structural & Molecular Biology . 13 (4): 365–71. doi :10.1038/nsmb1079. PMID 16565725. S2CID 9239755.
- ^ Alonso J, Schimpl M, van Aalten DM (diciembre de 2014). "O-GlcNAcase: ¿hexosaminidasa promiscua o regulador clave de la señalización de O-GlcNAc?". The Journal of Biological Chemistry . 289 (50): 34433–9. doi : 10.1074/jbc.R114.609198 . PMC 4263850 . PMID 25336650.
- ^ Cheng, Steven S.; Mody, Alison C.; Woo, Christina M. (7 de noviembre de 2024). "Oportunidades para la modulación terapéutica de O-GlcNAc". Chemical Reviews . doi :10.1021/acs.chemrev.4c00417. ISSN 0009-2665.
- ^ Lim S, Haque MM, Nam G, Ryoo N, Rhim H, Kim YK (agosto de 2015). "Monitoreo de la agregación intracelular de tau regulada por inhibidores de OGA/OGT". Revista internacional de ciencias moleculares . 16 (9): 20212–24. doi : 10.3390/ijms160920212 . PMC 4613198 . PMID 26343633.
- ^ Roth C, Chan S, Offen WA, Hemsworth GR, Willems LI, King DT, et al. (junio de 2017). "Información estructural y funcional sobre la O-GlcNAcase humana". Nature Chemical Biology . 13 (6): 610–612. doi :10.1038/nchembio.2358. PMC 5438047 . PMID 28346405.
Lectura adicional
- Nakajima D, Okazaki N, Yamakawa H, Kikuno R, Ohara O, Nagase T (junio de 2002). "Construcción de clones de ADNc listos para expresión para genes KIAA: curación manual de 330 clones de ADNc de KIAA". Investigación del ADN . 9 (3): 99-106. doi : 10.1093/dnares/9.3.99 . PMID 12168954.
- Ishikawa K, Nagase T, Suyama M, Miyajima N, Tanaka A, Kotani H, et al. (junio de 1998). "Predicción de las secuencias codificantes de genes humanos no identificados. X. Las secuencias completas de 100 nuevos clones de ADNc del cerebro que pueden codificar proteínas grandes in vitro". DNA Research . 5 (3): 169–76. doi : 10.1093/dnares/5.3.169 . PMID 9734811.
- Gao Y, Wells L, Comer FI, Parker GJ, Hart GW (marzo de 2001). "O-glicosilación dinámica de proteínas nucleares y citosólicas: clonación y caracterización de una beta-N-acetilglucosaminidasa neutra y citosólica del cerebro humano". The Journal of Biological Chemistry . 276 (13): 9838–45. doi : 10.1074/jbc.M010420200 . PMID 11148210.
- Comtesse N, Maldener E, Meese E (mayo de 2001). "Identificación de una variante nuclear de MGEA5, una hialuronidasa citoplasmática y una beta-N-acetilglucosaminidasa". Comunicaciones de investigación bioquímica y biofísica . 283 (3): 634–40. doi :10.1006/bbrc.2001.4815. PMID 11341771.
- Wells L, Gao Y, Mahoney JA, Vosseller K, Chen C, Rosen A, Hart GW (enero de 2002). "O-glicosilación dinámica de proteínas nucleares y citosólicas: caracterización adicional de la beta-N-acetilglucosaminidasa nucleocitoplasmática, O-GlcNAcase". The Journal of Biological Chemistry . 277 (3): 1755–61. doi : 10.1074/jbc.M109656200 . PMID 11788610.
- Farook VS, Bogardus C, Prochazka M (2003). "Análisis de MGEA5 en 10q24.1-q24.3 que codifica la N-acetilglucosaminidasa beta-O-ligada como gen candidato para la diabetes mellitus tipo 2 en los indios Pima". Genética molecular y metabolismo . 77 (1–2): 189–93. doi :10.1016/S1096-7192(02)00127-0. PMID 12359146.
- Beausoleil SA, Jedrychowski M, Schwartz D, Elias JE, Villén J, Li J, et al. (agosto de 2004). "Caracterización a gran escala de las fosfoproteínas nucleares de células HeLa". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 101 (33): 12130–5. Bibcode :2004PNAS..10112130B. doi : 10.1073/pnas.0404720101 . PMC 514446 . PMID 15302935.
- Ballif BA, Villén J, Beausoleil SA, Schwartz D, Gygi SP (noviembre de 2004). "Análisis fosfoproteómico del cerebro de ratón en desarrollo". Molecular & Cellular Proteomics . 3 (11): 1093–101. doi : 10.1074/mcp.M400085-MCP200 . PMID 15345747.
- Toleman C, Paterson AJ, Whisenhunt TR, Kudlow JE (diciembre de 2004). "Caracterización del dominio de la acetiltransferasa de histonas (HAT) de una proteína bifuncional con actividades de O-GlcNAcase y HAT activables". The Journal of Biological Chemistry . 279 (51): 53665–73. doi : 10.1074/jbc.M410406200 . PMID 15485860.
- Whisenhunt TR, Yang X, Bowe DB, Paterson AJ, Van Tine BA, Kudlow JE (junio de 2006). "La interrupción del complejo enzimático que regula la O-GlcNAcylation bloquea la señalización y el desarrollo". Glycobiology . 16 (6): 551–63. doi : 10.1093/glycob/cwj096 . PMID 16505006.
- Toleman C, Paterson AJ, Kudlow JE (mayo de 2006). "Ubicación y caracterización del sitio activo de la O-GlcNAcase". Biochimica et Biophysica Acta (BBA) - Temas generales . 1760 (5): 829–39. doi :10.1016/j.bbagen.2006.01.017. PMID 16517082.
- Cameron EA, Martinez-Marignac VL, Chan A, Valladares A, Simmonds LV, Wacher N, et al. (2007). "Polimorfismo MGEA5-14 y diabetes tipo 2 en la Ciudad de México". Revista Americana de Biología Humana . 19 (4): 593–6. doi :10.1002/ajhb.20639. PMID 17546623. S2CID 13712358.
Enlaces externos
- Protein+O-GlcNAcase en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.