Novobiocina
 | |
 | |
| Datos clínicos | |
|---|---|
| AHFS / Drogas.com | Nombres internacionales de medicamentos |
| Vías de administración | intravenoso |
| Código ATCvet |
|
| Datos farmacocinéticos | |
| Biodisponibilidad | biodisponibilidad oral insignificante |
| Metabolismo | excretado sin cambios |
| Vida media de eliminación | 6 horas |
| Excreción | renal |
| Identificadores | |
| |
| Número CAS | |
| Identificador de centro de PubChem |
|
| Banco de medicamentos | |
| Araña química | |
| UNIVERSIDAD |
|
| BARRIL | |
| Química biológica | |
| Panel de control CompTox ( EPA ) |
|
| Tarjeta informativa de la ECHA | 100.005.589 |
| Datos químicos y físicos | |
| Fórmula | C31H36N2O11 |
| Masa molar | 612,632 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| Punto de fusión | 152 a 156 °C (306 a 313 °F) (descenso) |
| |
| (verificar) | |
La novobiocina , también conocida como albamicina , es un antibiótico aminocumarina producido por el actinomiceto Streptomyces niveus , que recientemente se ha identificado como sinónimo subjetivo de S. spheroides [1], un miembro de la clase Actinomycetia . Otros antibióticos aminocumarinas incluyen clorobiocina y cumermicina A1. [2] La novobiocina se informó por primera vez a mediados de la década de 1950 (entonces llamada estreptonivicina ). [3] [4]
Uso clínico
Es activo contra Staphylococcus epidermidis y puede utilizarse para diferenciarlo de otro Staphylococcus saprophyticus coagulasa negativo , que es resistente a la novobiocina, en cultivo. [ cita requerida ]
La novobiocina fue autorizada para uso clínico bajo el nombre comercial Albamycin ( Upjohn ) en la década de 1960. Su eficacia ha sido demostrada en ensayos preclínicos y clínicos . [5] [6] La forma oral del fármaco ha sido retirada del mercado debido a la falta de eficacia. [7] Un producto combinado de novobiocina y tetraciclina, vendido por Upjohn bajo marcas comerciales como Panalba y Albamycin-T, fue en particular objeto de un intenso escrutinio de la FDA antes de que finalmente fuera retirado del mercado. [8] [9] La novobiocina es un agente antiestafilocócico eficaz utilizado en el tratamiento del SAMR . [10]
Mecanismo de acción
Se ha examinado la base molecular de la acción de la novobiocina y otros fármacos relacionados, como la clorobiocina y la cumermicina A1 . [2] [11] [12] [13] [14] Las aminocumarinas son inhibidores muy potentes de la ADN girasa bacteriana y actúan dirigiéndose a la subunidad GyrB de la enzima implicada en la transducción de energía. La novobiocina, así como los demás antibióticos aminocumarinas , actúan como inhibidores competitivos de la reacción de la ATPasa catalizada por GyrB. La potencia de la novobiocina es considerablemente mayor que la de las fluoroquinolonas que también se dirigen a la ADN girasa , pero en un sitio diferente de la enzima. La subunidad GyrA está implicada en la actividad de corte y ligadura del ADN. [ cita requerida ]
Se ha demostrado que la novobiocina inhibe débilmente el extremo C de la proteína eucariota Hsp90 (IC50 micromolar elevado). La modificación de la estructura de la novobiocina ha dado lugar a inhibidores más selectivos de la Hsp90. [15] También se ha demostrado que la novobiocina se une y activa el transportador de lipopolisacáridos gramnegativos LptBFGC. [16] [17]
La novobiocina bloquea el bolsillo de unión de ATP de la polimerasa theta, lo que da como resultado una pérdida de la actividad de la ATPasa. Esto da como resultado la pérdida de la unión de extremos mediada por microhomología como una vía para que las células deficientes en recombinación homóloga eviten los agentes que dañan el ADN. La acción de la novobiocina es sinérgica con los inhibidores de PARP para reducir el tamaño del tumor en un modelo de ratón. [18]
Estructura
La novobiocina es una aminocumarina. La novobiocina puede dividirse en tres entidades: un derivado del ácido benzoico, un residuo de cumarina y el azúcar novobiosa. [11] Los estudios cristalográficos de rayos X han descubierto que el complejo fármaco-receptor de la novobiocina y la ADN girasa muestra que el ATP y la novobiocina tienen sitios de unión superpuestos en la molécula de girasa. [19] La superposición de los sitios de unión de la cumarina y el ATP es consistente con el hecho de que las aminocumarinas sean inhibidores competitivos de la actividad de la ATPasa. [20]
Relación estructura-actividad
En experimentos de relación estructura-actividad se encontró que la eliminación del grupo carbamoilo ubicado en el azúcar novobiosa condujo a una disminución drástica en la actividad inhibitoria de la novobiocina. [20]
Biosíntesis
Este antibiótico aminocumarina consta de tres sustituyentes principales. La fracción de ácido 3-dimetilalil-4-hidroxibenzoico, conocida como anillo A, se deriva del prefenato y del pirofosfato de dimetilalilo . La fracción de aminocumarina, conocida como anillo B, se deriva de la L -tirosina. El componente final de la novobiocina es el derivado del azúcar L -noviosa, conocido como anillo C, que se deriva de la glucosa-1-fosfato. El grupo de genes biosintéticos para la novobiocina fue identificado por Heide y colaboradores en 1999 (publicado en 2000) a partir de Streptomyces spheroides NCIB 11891. [21] Identificaron 23 supuestos marcos de lectura abiertos (ORF) y más de otros 11 ORF que pueden desempeñar un papel en la biosíntesis de la novobiocina. [ cita requerida ]
La biosíntesis del anillo A (ver Fig. 1 ) comienza con prefenato que es un derivado de la vía biosintética del ácido shikímico . La enzima NovF cataliza la descarboxilación de prefenato mientras reduce simultáneamente el fosfato de dinucleótido de nicotinamida y adenina (NADP + ) para producir NADPH . Después de esto, NovQ cataliza la sustitución electrofílica del anillo de fenilo con pirofosfato de dimetilalilo (DMAPP), también conocido como prenilación. [22] El DMAPP puede provenir de la vía del ácido mevalónico o de la vía biosintética de la desoxixilulosa. A continuación, la molécula de 3-dimetilalil-4-hidroxibenzoato se somete a dos descarboxilaciones oxidativas por NovR y oxígeno molecular. [23] NovR es una oxigenasa de hierro no hemo con una catálisis bifuncional única. En la primera etapa, ambos oxígenos se incorporan del oxígeno molecular, mientras que en el segundo paso solo se incorpora uno según lo determinado por estudios de etiquetado isotópico. Esto completa la formación del anillo A.

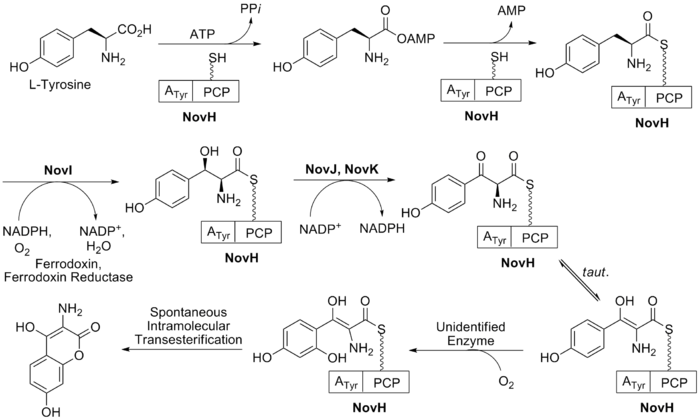
La biosíntesis del anillo B (ver Fig. 2 ) comienza con el aminoácido natural L -tirosina . Este es luego adenilado y tioesterificado en la proteína transportadora de peptidilos (PCP) de NovH por ATP y NovH mismo. [24] NovI luego modifica aún más esta molécula unida a PCP oxidando la posición β usando NADPH y oxígeno molecular. NovJ y NovK forman un heterodímero de J2K2 que es la forma activa de esta oxigenasa bencílica. [25] Este proceso usa NADP + como un aceptor de hidruro en la oxidación del β-alcohol. Esta cetona preferirá existir en su tautómero enólico en solución. A continuación, una proteína aún no identificada cataliza la oxidación selectiva del benceno (como se muestra en la Fig. 2). Tras la oxidación, este intermediario se lactonizará espontáneamente para formar el anillo aromático B y perderá NovH en el proceso.
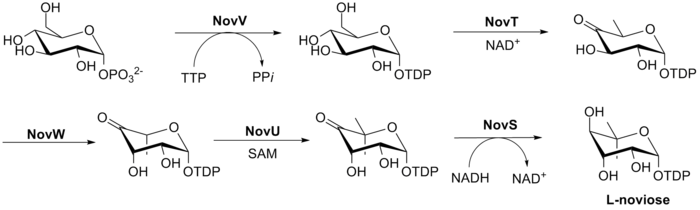
La biosíntesis de L -noviosa (anillo C) se muestra en la Fig. 3. Este proceso comienza a partir de glucosa-1-fosfato donde NovV toma dTTP y reemplaza el grupo fosfato con un grupo dTDP. Luego NovT oxida el grupo 4-hidroxi usando NAD + . NovT también logra una deshidroxilación de la posición 6 del azúcar. Luego NovW epimeriza la posición 3 del azúcar. [26] La metilación de la posición 5 se logra mediante NovU y S-adenosil metionina (SAM). Finalmente NovS reduce la posición 4 nuevamente para lograr la epimerización de esa posición a partir de la glucosa-1-fosfato inicial usando NADH .
Los anillos A, B y C se acoplan entre sí y se modifican para dar la molécula de novobiocina terminada. Los anillos A y B se acoplan entre sí mediante la enzima NovL utilizando ATP para difosforilar el grupo carboxilato del anillo A de modo que el carbonilo pueda ser atacado por el grupo amina del anillo B. El compuesto resultante es metilado por NovO y SAM antes de la glicosilación. [27] NovM agrega el anillo C ( L -noviosa) al grupo hidroxilo derivado de la tirosina con la pérdida de dTDP. NovP y SAM realizan otra metilación en la posición 4 del azúcar L -noviosa. [28] Esta metilación permite que NovN carbamile la posición 3 del azúcar como se muestra en la Fig. 4, completando la biosíntesis de la novobiocina.

Referencias
- ^ Lanoot B, Vancanneyt M, Cleenwerck I, Wang L, Li W, Liu Z, Swings J (mayo de 2002). "Búsqueda de sinónimos entre estreptomicetos mediante electroforesis en gel de poliacrilamida con SDS de proteínas de células completas. Enmienda de las especies Streptomyces aurantiacus, Streptomyces cacaoi subsp. cacaoi, Streptomyces caeruleus y Streptomyces violaceus". Revista internacional de microbiología sistemática y evolutiva . 52 (parte 3): 823–9. doi :10.1099/00207713-52-3-823. PMID 12054245.
- ^ ab da Silva Eustáquio A (2004). Biosíntesis de antibióticos aminocumarina en Streptomyces: generación de análogos estructurales mediante ingeniería genética y conocimientos sobre la regulación de la producción de antibióticos (tesis doctoral). Universidad de Tubinga.
- ^ Hoeksema H, Johnson JL, Hinman JW (diciembre de 1955). "Estudios estructurales sobre la estreptonivicina, un nuevo antibiótico". Revista de la Sociedad Química Americana . 77 (24): 6710–6711. doi :10.1021/ja01629a129.
- ^ Smith CG, Dietz A, Sokolski WT, Savage GM (febrero de 1956). "Estreptonivicina, un nuevo antibiótico. I. Descubrimiento y estudios biológicos". Antibióticos y quimioterapia . 6 (2): 135–142. PMID 24543916.
- ^ Raad I, Darouiche R, Hachem R, Sacilowski M, Bodey GP (noviembre de 1995). "Antibióticos y prevención de la colonización microbiana de los catéteres". Agentes antimicrobianos y quimioterapia . 39 (11): 2397–400. doi :10.1128/aac.39.11.2397. PMC 162954. PMID 8585715 .
- ^ Raad II, Hachem RY, Abi-Said D, Rolston KV, Whimbey E, Buzaid AC, Legha S (enero de 1998). "Un ensayo aleatorio cruzado prospectivo de profilaxis con novobiocina y rifampicina para la prevención de infecciones por catéter intravascular en pacientes con cáncer tratados con interleucina-2". Cancer . 82 (2): 403–11. doi :10.1002/(SICI)1097-0142(19980115)82:2<412::AID-CNCR22>3.0.CO;2-0. PMID 9445199. S2CID 10940970.
- ^ "Determinación de que la cápsula de ALBAMYCIN (novobiocina sódica), 250 miligramos, fue retirada de la venta por razones de seguridad o eficacia". The Federal Register . 19 de enero de 2011.
- ^ Mintz M (agosto de 1969). "FDA y Panalba: ¿Un conflicto de objetivos comerciales y terapéuticos?". Science . 165 (3896): 875–881. Bibcode :1969Sci...165..875M. doi :10.1126/science.165.3896.875. PMID 5819616.
- ^ Mintz M. "Upjohn's Shuck and Jive Routine". Mother Jones . Mother Jones y la Fundación para el Progreso Nacional . Consultado el 16 de febrero de 2022 .
- ^ Walsh TJ, Standiford HC, Reboli AC, John JF, Mulligan ME, Ribner BS, Montgomerie JZ, Goetz MB, Mayhall CG, Rimland D (junio de 1993). "Ensayo aleatorizado doble ciego de rifampicina con novobiocina o trimetoprima-sulfametoxazol contra la colonización por Staphylococcus aureus resistente a la meticilina: prevención de la resistencia a los antimicrobianos y efecto de los factores del huésped en el resultado". Agentes antimicrobianos y quimioterapia . 37 (6): 1334–42. doi :10.1128/aac.37.6.1334. PMC 187962. PMID 8328783 .
- ^ ab Maxwell A (agosto de 1993). "La interacción entre los fármacos cumarínicos y la ADN girasa". Microbiología molecular . 9 (4): 681–6. doi :10.1111/j.1365-2958.1993.tb01728.x. PMID 8231802. S2CID 43159068.
- ^ Maxwell A (febrero de 1999). "La girasa de ADN como diana farmacológica". Biochemical Society Transactions . 27 (2): 48–53. doi :10.1042/bst0270048. PMID 10093705.
- ^ Lewis RJ, Tsai FT, Wigley DB (agosto de 1996). "Mecanismos moleculares de inhibición farmacológica de la ADN girasa". BioEssays . 18 (8): 661–71. doi :10.1002/bies.950180810. PMID 8760340. S2CID 9488669.
- ^ Maxwell A, Lawson DM (2003). "El sitio de unión de ATP de las topoisomerasas de tipo II como objetivo para fármacos antibacterianos". Temas actuales en química médica . 3 (3): 283–303. doi :10.2174/1568026033452500. PMID 12570764.
- ^ Yu XM, Shen G, Neckers L, Blake H, Holzbeierlein J, Cronk B, Blagg BS (septiembre de 2005). "Inhibidores de Hsp90 identificados a partir de una biblioteca de análogos de novobiocina". Journal of the American Chemical Society . 127 (37): 12778–9. doi :10.1021/ja0535864. PMID 16159253.
- ^ Mandler MD, Baidin V, Lee J, Pahil KS, Owens TW, Kahne D (junio de 2018). "La novobiocina mejora la actividad de la polimixina al estimular el transporte de lipopolisacáridos". Journal of the American Chemical Society . 140 (22): 6749–6753. doi :10.1021/jacs.8b02283. PMC 5990483 . PMID 29746111.
- ^ May JM, Owens TW, Mandler MD, Simpson BW, Lazarus MB, Sherman DJ, Davis RM, Okuda S, Massefski W, Ruiz N, Kahne D (diciembre de 2017). "El antibiótico novobiocina se une y activa la ATPasa que impulsa el transporte de lipopolisacáridos". Revista de la Sociedad Química Estadounidense . 139 (48): 17221–17224. doi :10.1021/jacs.7b07736. PMC 5735422 . PMID 29135241.
- ^ Zhou J, Gelot C, Pantelidou C, Li A, Yücel H, Davis RE, Färkkilä A, Kochupurakkal B, Syed A, Shapiro GI, Tainer JA, Blagg BS, Ceccaldi R, D'Andrea AD (junio de 2021). "Un inhibidor de la polimerasa theta, el primero en su clase, se dirige selectivamente a tumores con deficiencia de recombinación homóloga". Cáncer de la naturaleza . 2 (junio de 2021): 598–610. doi :10.1038/s43018-021-00203-x. PMC 8224818 . PMID 34179826. S2CID 235659640.
- ^ Tsai FT, Singh OM, Skarzynski T, Wonacott AJ, Weston S, Tucker A, Pauptit RA, Breeze AL, Poyser JP, O'Brien R, Ladbury JE, Wigley DB (mayo de 1997). "La estructura cristalina de alta resolución de un fragmento de girasa B de 24 kDa de E. coli en complejo con uno de los inhibidores de cumarina más potentes, la clorobiocina". Proteins . 28 (1): 41–52. doi :10.1002/(sici)1097-0134(199705)28:1<41::aid-prot4>3.3.co;2-b. PMID 9144789.
- ^ ab Flatman RH, Eustaquio A, Li SM, Heide L, Maxwell A (abril de 2006). "Relaciones estructura-actividad de los inhibidores de la girasa de tipo aminocumarina y la topoisomerasa IV obtenidos mediante biosíntesis combinatoria". Agentes antimicrobianos y quimioterapia . 50 (4): 1136–42. doi :10.1128/AAC.50.4.1136-1142.2006. PMC 1426943. PMID 16569821 .
- ^ Steffensky M, Mühlenweg A, Wang ZX, Li SM, Heide L (mayo de 2000). "Identificación del grupo de genes biosintéticos de novobiocina de Streptomyces spheroides NCIB 11891". Agentes antimicrobianos y quimioterapia . 44 (5): 1214–22. doi :10.1128/AAC.44.5.1214-1222.2000. PMC 89847. PMID 10770754 .
- ^ Pojer F, Wemakor E, Kammerer B, Chen H, Walsh CT, Li SM, Heide L (marzo de 2003). "CloQ, una preniltransferasa implicada en la biosíntesis de clorobiocina". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 100 (5): 2316–21. Bibcode :2003PNAS..100.2316P. doi : 10.1073/pnas.0337708100 . PMC 151338 . PMID 12618544.
- ^ Pojer F, Kahlich R, Kammerer B, Li SM, Heide L (agosto de 2003). "CloR, una oxigenasa de hierro no hemo bifuncional involucrada en la biosíntesis de clorobiocina". The Journal of Biological Chemistry . 278 (33): 30661–8. doi : 10.1074/jbc.M303190200 . PMID 12777382.
- ^ Chen H, Walsh CT (abril de 2001). "Formación de cumarina en la biosíntesis de novobiocina: beta-hidroxilación de la enzima aminoacilo tirosil-S-NovH por un citocromo P450 NovI". Química y biología . 8 (4): 301–12. doi : 10.1016/S1074-5521(01)00009-6 . PMID 11325587.
- ^ Pacholec M, Hillson NJ, Walsh CT (septiembre de 2005). "NovJ/NovK catalizan la oxidación bencílica de una enzima beta-hidroxil tirosil-S-panteteinil durante la formación del anillo de aminocumarina en la biosíntesis de novobiocina". Bioquímica . 44 (38): 12819–26. CiteSeerX 10.1.1.569.1481 . doi :10.1021/bi051297m. PMID 16171397.
- ^ Thuy TT, Lee HC, Kim CG, Heide L, Sohng JK (abril de 2005). "Caracterizaciones funcionales de novWUS implicadas en la biosíntesis de novobiocina a partir de Streptomyces spheroides". Archivos de bioquímica y biofísica . 436 (1): 161–7. doi :10.1016/j.abb.2005.01.012. PMID 15752721.
- ^ Pacholec M, Tao J, Walsh CT (noviembre de 2005). "CouO y NovO: C-metiltransferasas para adaptar el andamiaje de aminocumarina en la biosíntesis de los antibióticos cumermicina y novobiocina". Biochemistry . 44 (45): 14969–76. doi :10.1021/bi051599o. PMID 16274243.
- ^ Freel Meyers CL, Oberthür M, Xu H, Heide L, Kahne D, Walsh CT (enero de 2004). "Caracterización de NovP y NovN: finalización de la biosíntesis de novobiocina mediante la adaptación secuencial del anillo noviosilo". Angewandte Chemie . 43 (1): 67–70. doi :10.1002/anie.200352626. PMID 14694473.
Enlaces externos
- Novobiocina unida a proteínas en el PDB
