Ion

Un ion ( /ˈaɪ.ɒn , -ən / ) [ 1 ] es un átomo o molécula con una carga eléctrica neta . La carga de un electrón se considera negativa por convención y esta carga es igual y opuesta a la carga de un protón , que se considera positiva por convención. La carga neta de un ion no es cero porque su número total de electrones es desigual a su número total de protones.
Un catión es un ion cargado positivamente con menos electrones que protones [2] (por ejemplo, K + (ion potasio)) mientras que un anión es un ion cargado negativamente con más electrones que protones. [3] (por ejemplo, Cl - (ion cloruro) y OH - (ion hidróxido)). Las cargas eléctricas opuestas son atraídas entre sí por la fuerza electrostática , por lo que los cationes y los aniones se atraen entre sí y forman fácilmente compuestos iónicos .
Si solo está presente un + o un -, indica una carga +1 o -1 (2+ indica carga +2, 2- indica carga -2). [4]
Las cargas +2 y -2 se ven así: O 2 2- (carga negativa, peróxido ) He 2+ (carga positiva, partícula alfa ). [4]
Los iones que consisten en un solo átomo se denominan iones atómicos o monoatómicos , mientras que dos o más átomos forman iones moleculares o iones poliatómicos . En el caso de la ionización física en un fluido (gas o líquido), los "pares de iones" se crean por colisiones espontáneas de moléculas, donde cada par generado consiste en un electrón libre y un ion positivo. [5] Los iones también se crean por interacciones químicas, como la disolución de una sal en líquidos, o por otros medios, como pasar una corriente continua a través de una solución conductora, disolviendo un ánodo mediante ionización .
Historia del descubrimiento
La palabra ion se acuñó del participio presente neutro del griego ἰέναι ( ienai ), que significa "ir". Un catión es algo que se mueve hacia abajo ( griego : κάτω , kato , que significa "abajo") y un anión es algo que se mueve hacia arriba ( griego : ἄνω , ano , que significa "arriba"). Se llaman así porque los iones se mueven hacia el electrodo de carga opuesta. Este término fue introducido (después de una sugerencia del polímata inglés William Whewell ) [6] por el físico y químico inglés Michael Faraday en 1834 para la especie entonces desconocida que va de un electrodo al otro a través de un medio acuoso. [7] [8] Faraday no conocía la naturaleza de estas especies, pero sabía que, dado que los metales se disolvieron y entraron en una solución en un electrodo y un nuevo metal salió de una solución en el otro electrodo, algún tipo de sustancia se ha movido a través de la solución en una corriente. Esto transporta materia de un lugar a otro. En correspondencia con Faraday, Whewell también acuñó los términos ánodo y cátodo , así como anión y catión como iones que son atraídos por los respectivos electrodos. [6]
Svante Arrhenius propuso, en su tesis de 1884, la explicación del hecho de que las sales cristalinas sólidas se disocian en partículas cargadas apareadas cuando se disuelven, por lo que ganaría el Premio Nobel de Química en 1903. [9] La explicación de Arrhenius fue que al formar una solución, la sal se disocia en iones de Faraday; propuso que los iones se formaban incluso en ausencia de una corriente eléctrica. [10] [11] [12]
Características
Los iones en su estado gaseoso son altamente reactivos e interactuarán rápidamente con iones de carga opuesta para dar moléculas neutras o sales iónicas. Los iones también se producen en estado líquido o sólido cuando las sales interactúan con solventes (por ejemplo, agua) para producir iones solvatados , que son más estables, por razones que involucran una combinación de cambios de energía y entropía a medida que los iones se alejan unos de otros para interactuar con el líquido. Estas especies estabilizadas se encuentran más comúnmente en el medio ambiente a bajas temperaturas. Un ejemplo común son los iones presentes en el agua de mar, que se derivan de sales disueltas.
Los iones, como objetos cargados, se sienten atraídos por cargas eléctricas opuestas (positivas a negativas y viceversa) y repelidos por cargas iguales. Cuando se mueven, sus trayectorias pueden verse desviadas por un campo magnético .
Los electrones, debido a su menor masa y, por lo tanto, a sus mayores propiedades de llenado del espacio como ondas de materia , determinan el tamaño de los átomos y las moléculas que poseen algún electrón. Por lo tanto, los aniones (iones con carga negativa) son más grandes que la molécula o átomo original, ya que el exceso de electrones se repelen entre sí y se suman al tamaño físico del ion, porque su tamaño está determinado por su nube de electrones . Los cationes son más pequeños que el átomo o molécula original correspondiente debido al menor tamaño de la nube de electrones. Un catión en particular (el del hidrógeno) no contiene electrones y, por lo tanto, consta de un solo protón, mucho más pequeño que el átomo de hidrógeno original.
Aniones y cationes
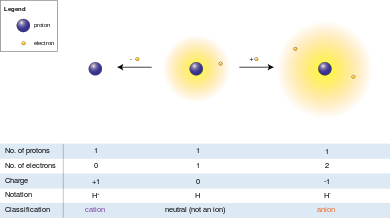
El anión (−) y el catión (+) indican la carga eléctrica neta de un ion. Un ion que tiene más electrones que protones, lo que le da una carga neta negativa, se denomina anión, y la indicación menos "Anión (−)" indica la carga negativa. Con un catión es exactamente lo contrario: tiene menos electrones que protones, lo que le da una carga neta positiva, de ahí la indicación "Catión (+)".
Como la carga eléctrica de un protón es igual en magnitud a la carga de un electrón, la carga eléctrica neta de un ion es igual al número de protones en el ion menos el número de electrones.
UnEl anión (−) ( / ˈ æ n ˌ aɪ . ən / ANN -eye-ən , de la palabra griega ἄνω ( ánō ), que significa "arriba" [13] ) es un ion con más electrones que protones, lo que le da una carga neta negativa (ya que los electrones tienen carga negativa y los protones tienen carga positiva). [14]
AEl catión (+) ( / ˈ k æ t ˌ aɪ . ən / KAT -eye-ən , de la palabra griega κάτω ( kátō ), que significa "abajo" [15] ) es un ion con menos electrones que protones, lo que le da una carga positiva. [16]
Existen otros nombres que se utilizan para los iones con cargas múltiples. Por ejemplo, un ion con una carga de -2 se conoce como dianión y un ion con una carga de +2 se conoce como dicatión . Un zwitterión es una molécula neutra con cargas positivas y negativas en diferentes lugares dentro de esa molécula. [17]
Los cationes y aniones se miden por su radio iónico y difieren en tamaño relativo: "Los cationes son pequeños, la mayoría de ellos con un radio de menos de 10 −10 m (10 −8 cm). Pero la mayoría de los aniones son grandes, como lo es el anión terrestre más común, el oxígeno . De este hecho se desprende que la mayor parte del espacio de un cristal está ocupado por el anión y que los cationes encajan en los espacios entre ellos". [18]
Los términos anión y catión (para los iones que viajan respectivamente al ánodo y al cátodo durante la electrólisis) fueron introducidos por Michael Faraday en 1834 después de su consulta con William Whewell .
Fenómenos naturales
Los iones son omnipresentes en la naturaleza y son responsables de diversos fenómenos, desde la luminiscencia del Sol hasta la existencia de la ionosfera terrestre . Los átomos en su estado iónico pueden tener un color diferente al de los átomos neutros, y por lo tanto la absorción de luz por los iones metálicos da el color de las piedras preciosas . Tanto en la química inorgánica como en la orgánica (incluida la bioquímica), la interacción del agua y los iones suele ser relevante para comprender las propiedades de los sistemas; un ejemplo de su importancia es la descomposición del trifosfato de adenosina ( ATP ), que proporciona la energía para muchas reacciones en los sistemas biológicos.
Tecnología relacionada
Los iones se pueden preparar de forma no química utilizando diversas fuentes de iones , que suelen implicar alto voltaje o temperatura. Se utilizan en una multitud de dispositivos, como espectrómetros de masas , espectrómetros de emisión óptica , aceleradores de partículas , implantadores de iones y motores de iones .
Como partículas cargadas reactivas, también se utilizan en la purificación del aire, alterando los microbios, y en artículos domésticos como detectores de humo .
Como la señalización y el metabolismo en los organismos están controlados por un gradiente iónico preciso a través de las membranas , la alteración de este gradiente contribuye a la muerte celular. Este es un mecanismo común explotado por los biocidas naturales y artificiales , incluidos los canales iónicos gramicidina y anfotericina (un fungicida ).
Los iones inorgánicos disueltos son un componente de los sólidos disueltos totales , un indicador ampliamente conocido de la calidad del agua .
Detección de radiación ionizante
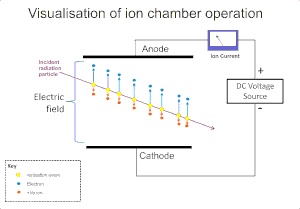
El efecto ionizante de la radiación sobre un gas se utiliza ampliamente para la detección de radiaciones como alfa , beta , gamma y rayos X. El evento de ionización original en estos instrumentos da como resultado la formación de un "par de iones"; un ion positivo y un electrón libre, por el impacto iónico de la radiación sobre las moléculas de gas. La cámara de ionización es el más simple de estos detectores y recoge todas las cargas creadas por la ionización directa dentro del gas mediante la aplicación de un campo eléctrico. [5]
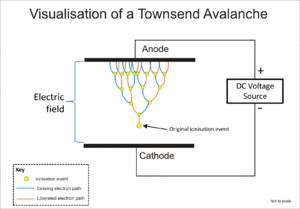
Tanto el tubo Geiger-Müller como el contador proporcional utilizan un fenómeno conocido como avalancha de Townsend para multiplicar el efecto del evento ionizante original mediante un efecto en cascada mediante el cual los electrones libres reciben suficiente energía del campo eléctrico para liberar más electrones por impacto iónico.
Química
Denotando el estado cargado
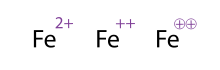
Al escribir la fórmula química de un ion, su carga neta se escribe en superíndice inmediatamente después de la estructura química de la molécula/átomo. La carga neta se escribe con la magnitud antes del signo; es decir, un catión con doble carga se indica como 2+ en lugar de +2 . Sin embargo, la magnitud de la carga se omite para moléculas/átomos con una sola carga; por ejemplo, el catión sodio se indica como Na + y no Na1 + .
Una forma alternativa (y aceptable) de mostrar una molécula/átomo con múltiples cargas es dibujando los signos varias veces, algo que se ve a menudo con los metales de transición. Los químicos a veces encierran el signo en un círculo; esto es meramente ornamental y no altera el significado químico. Las tres representaciones de Fe 2+ , Fe ++ y Fe ⊕⊕ que se muestran en la figura son, por lo tanto, equivalentes.

Los iones monoatómicos a veces también se denotan con números romanos , particularmente en espectroscopia ; por ejemplo, el ejemplo Fe 2+ (doble carga positiva) visto anteriormente se conoce como Fe(III) , Fe III o Fe III (Fe I para un átomo de Fe neutro, Fe II para un ion Fe ionizado simple). El número romano designa el estado de oxidación formal de un elemento, mientras que los números indoarábigos superíndices denotan la carga neta. Las dos notaciones son, por lo tanto, intercambiables para iones monoatómicos, pero los números romanos no se pueden aplicar a iones poliatómicos. Sin embargo, es posible mezclar las notaciones para el centro metálico individual con un complejo poliatómico, como lo muestra el ejemplo del ion uranilo.
Subclases
Si un ion contiene electrones desapareados , se denomina ion radical . Al igual que los radicales sin carga, los iones radicales son muy reactivos. Los iones poliatómicos que contienen oxígeno, como el carbonato y el sulfato, se denominan oxianiones . Los iones moleculares que contienen al menos un enlace carbono-hidrógeno se denominan iones orgánicos . Si la carga de un ion orgánico está formalmente centrada en un carbono, se denomina carbocatión (si tiene carga positiva) o carbanión (si tiene carga negativa).
Formación
Formación de iones monoatómicos
Los iones monoatómicos se forman por la ganancia o pérdida de electrones en la capa de valencia (la capa electrónica más externa) de un átomo. Las capas internas de un átomo están llenas de electrones que están fuertemente unidos al núcleo atómico con carga positiva y, por lo tanto, no participan en este tipo de interacción química. El proceso de ganar o perder electrones de un átomo o molécula neutros se llama ionización .
Los átomos pueden ionizarse mediante bombardeo con radiación , pero el proceso de ionización más habitual en química es la transferencia de electrones entre átomos o moléculas. Esta transferencia suele estar impulsada por la consecución de configuraciones electrónicas estables ("de capa cerrada") . Los átomos ganarán o perderán electrones según qué acción requiera menos energía.
Por ejemplo, un átomo de sodio , Na, tiene un solo electrón en su capa de valencia, que rodea dos capas internas estables y llenas de 2 y 8 electrones. Como estas capas llenas son muy estables, un átomo de sodio tiende a perder su electrón adicional y alcanzar esta configuración estable, convirtiéndose en un catión de sodio en el proceso.
Por otra parte, un átomo de cloro , Cl, tiene 7 electrones en su capa de valencia, que es uno menos que la capa estable y llena con 8 electrones. Por lo tanto, un átomo de cloro tiende a ganar un electrón adicional y alcanzar una configuración estable de 8 electrones , convirtiéndose en un anión cloruro en el proceso:
Esta fuerza impulsora es la que hace que el sodio y el cloro experimenten una reacción química, en la que el electrón "extra" se transfiere del sodio al cloro, formando cationes de sodio y aniones de cloruro. Al tener cargas opuestas, estos cationes y aniones forman enlaces iónicos y se combinan para formar cloruro de sodio , NaCl, más comúnmente conocido como sal de mesa.
Formación de iones poliatómicos y moleculares.

Los iones poliatómicos y moleculares se forman a menudo por la ganancia o pérdida de iones elementales como un protón, H + , en moléculas neutras. Por ejemplo, cuando el amoníaco , NH3 , acepta un protón, H + —un proceso llamado protonación— forma el ion amonio , NH+4El amoníaco y el amonio tienen la misma cantidad de electrones en esencialmente la misma configuración electrónica , pero el amonio tiene un protón adicional que le da una carga neta positiva.
El amoníaco también puede perder un electrón para ganar una carga positiva, formando el ion NH+3Sin embargo, este ion es inestable, porque tiene una capa de valencia incompleta alrededor del átomo de nitrógeno, lo que lo convierte en un ion radical muy reactivo .
Debido a la inestabilidad de los iones radicales, los iones poliatómicos y moleculares se forman generalmente ganando o perdiendo iones elementales como H + , en lugar de ganando o perdiendo electrones. Esto permite que la molécula conserve su configuración electrónica estable mientras adquiere una carga eléctrica.
Potencial de ionización
La energía necesaria para desprender un electrón en su estado de energía más bajo de un átomo o molécula de un gas con menor carga eléctrica neta se denomina potencial de ionización o energía de ionización . La n- ésima energía de ionización de un átomo es la energía necesaria para desprender su n -ésimo electrón después de que ya se hayan desprendido los primeros n − 1 electrones.
Cada energía de ionización sucesiva es notablemente mayor que la anterior. Se producen aumentos particularmente grandes después de que cualquier bloque dado de orbitales atómicos se agote de electrones. Por esta razón, los iones tienden a formarse de formas que los dejan con bloques orbitales completos. Por ejemplo, el sodio tiene un electrón de valencia en su capa más externa, por lo que en forma ionizada se encuentra comúnmente con un electrón perdido, como Na + . En el otro lado de la tabla periódica, el cloro tiene siete electrones de valencia, por lo que en forma ionizada se encuentra comúnmente con un electrón ganado, como Cl − . El cesio tiene la energía de ionización medida más baja de todos los elementos y el helio tiene la más alta. [19] En general, la energía de ionización de los metales es mucho menor que la energía de ionización de los no metales , por lo que, en general, los metales perderán electrones para formar iones con carga positiva y los no metales ganarán electrones para formar iones con carga negativa.
Enlace iónico
El enlace iónico es un tipo de enlace químico que surge de la atracción mutua de iones con cargas opuestas. Los iones de igual carga se repelen entre sí, y los iones de carga opuesta se atraen entre sí. Por lo tanto, los iones no suelen existir por sí solos, sino que se unirán a iones de carga opuesta para formar una red cristalina . El compuesto resultante se denomina compuesto iónico y se dice que se mantiene unido por enlace iónico . En los compuestos iónicos surgen distancias características entre iones vecinos de las que se puede derivar la extensión espacial y el radio iónico de iones individuales.
El tipo más común de enlace iónico se observa en compuestos de metales y no metales (excepto los gases nobles , que rara vez forman compuestos químicos). Los metales se caracterizan por tener una pequeña cantidad de electrones en exceso de una configuración electrónica estable de capa cerrada . Como tal, tienen la tendencia a perder estos electrones adicionales para lograr una configuración estable. Esta propiedad se conoce como electropositividad . Los no metales, por otro lado, se caracterizan por tener una configuración electrónica a solo unos pocos electrones de una configuración estable. Como tal, tienen la tendencia a ganar más electrones para lograr una configuración estable. Esta tendencia se conoce como electronegatividad . Cuando un metal altamente electropositivo se combina con un no metal altamente electronegativo, los electrones adicionales de los átomos del metal se transfieren a los átomos del no metal deficientes en electrones. Esta reacción produce cationes metálicos y aniones no metálicos, que se atraen entre sí para formar una sal .
Iones comunes
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Véase también
Referencias
- ^ "ión". CollinsDictionary.com . HarperCollins . "Diccionario Collins English | Siempre gratis en línea". Archivado desde el original el 2013-12-24 . Consultado el 2013-12-21 .
{{cite web}}: CS1 maint: bot: estado de URL original desconocido ( enlace ). - ^ "catión". Diccionario Merriam-Webster.com . Merriam-Webster . Consultado el 6 de octubre de 2021 . "Definición de CATION". Archivado desde el original el 2021-10-06 . Consultado el 2021-10-06 .
{{cite web}}: CS1 maint: bot: estado de URL original desconocido ( enlace ). - ^ "anión". Diccionario Merriam-Webster.com . Merriam-Webster . Consultado el 6 de octubre de 2021 . "Definición de ANION". Archivado desde el original el 2021-10-06 . Consultado el 2021-10-06 .
{{cite web}}: CS1 maint: bot: estado de URL original desconocido ( enlace ). - ^ ab "¿Qué es un ion? Definición y ejemplos". ThoughtCo . Archivado desde el original el 2024-08-26 . Consultado el 2024-08-26 .
- ^ abc Knoll, Glenn F. (1999). Detección y medición de la radiación (3.ª ed.). Nueva York: Wiley . ISBN 978-0-471-07338-3.
- ^ de Frank AJL James, ed. (1991). La correspondencia de Michael Faraday, vol. 2: 1832–1840, pág. 183. ISBN 9780863412493Archivado del original el 14 de abril de 2021. Consultado el 16 de octubre de 2020 .
- ↑ Michael Faraday (1791–1867). Reino Unido: BBC . Archivado desde el original el 25 de agosto de 2016. Consultado el 21 de diciembre de 2019 .
- ^ "Diccionario etimológico en línea". Archivado desde el original el 14 de mayo de 2011. Consultado el 7 de enero de 2011 .
- ^ "El Premio Nobel de Química 1903". nobelprize.org . Archivado desde el original el 8 de julio de 2018 . Consultado el 13 de junio de 2017 .
- ^ Harris, William; Levey, Judith, eds. (1976). The New Columbia Encyclopedia (4.ª ed.). Nueva York: Universidad de Columbia . pág. 155. ISBN 978-0-231-03572-9.
- ^ Goetz, Philip W. (1992). McHenry, Charles (ed.). The New Encyclopædia Britannica . Vol. 1 (15.ª ed.). Chicago: Encyclopædia Britannica, Inc. p. 587. Bibcode :1991neb..book.....G. ISBN 978-0-85229-553-3.
{{cite book}}:|work=ignorado ( ayuda ) - ^ Cillispie, Charles, ed. (1970). Dictionary of Scientific Biography (1.ª ed.). Nueva York: Charles Scribner's Sons . pp. 296–302. ISBN. 978-0-684-10112-5.
- ^ Oxford University Press (2013). «Oxford Reference: OVERVIEW anion». oxfordreference.com. Archivado desde el original el 18 de enero de 2017. Consultado el 15 de enero de 2017 .
- ^ University of Colorado Boulder (21 de noviembre de 2013). «Átomos y elementos, isótopos e iones». colorado.edu. Archivado desde el original el 2 de febrero de 2015. Consultado el 22 de noviembre de 2013 .
- ^ Oxford University Press (2013). «Oxford Reference: OVERVIEW cation». oxfordreference.com. Archivado desde el original el 18 de enero de 2017. Consultado el 15 de enero de 2017 .
- ^ Douglas W. Haywick, Ph.D.; Universidad del Sur de Alabama (2007-2008). "Química elemental" (PDF) . usouthal.edu. Archivado (PDF) desde el original el 2011-12-04 . Consultado el 2013-11-22 .
- ^ Purdue University (21 de noviembre de 2013). «Aminoácidos». purdue.edu. Archivado desde el original el 13 de julio de 2011. Consultado el 22 de noviembre de 2013 .
- ^ Press, Frank; Siever, Raymond (1986). Tierra (14.ª ed.). Nueva York: WH Freeman and Company . pág. 63. ISBN 0-7167-1743-3.OCLC 12556840 .
- ^ Elementos químicos ordenados por energía de ionización Archivado el 30 de marzo de 2009 en Wayback Machine . Lenntech.com
- ^ abc "Iones comunes y sus cargas" (PDF) . Science Geek . Archivado (PDF) del original el 18 de febrero de 2018 . Consultado el 11 de mayo de 2018 .


