Nicho de células madre
This article needs additional citations for verification. (October 2015) |
El nicho de células madre se refiere a un microambiente, dentro de la ubicación anatómica específica donde se encuentran las células madre , que interactúa con las células madre para regular el destino celular. [1] La palabra "nicho" puede referirse al microambiente de células madre in vivo o in vitro . Durante el desarrollo embrionario, varios factores del nicho actúan sobre las células madre embrionarias para alterar la expresión genética e inducir su proliferación o diferenciación para el desarrollo del feto. Dentro del cuerpo humano, los nichos de células madre mantienen a las células madre adultas en un estado inactivo, pero después de una lesión tisular, el microambiente circundante envía señales activas a las células madre para promover la autorrenovación o la diferenciación para formar nuevos tejidos. Varios factores son importantes para regular las características de las células madre dentro del nicho: las interacciones célula-célula entre células madre, así como las interacciones entre células madre y células diferenciadas vecinas, las interacciones entre células madre y moléculas de adhesión, los componentes de la matriz extracelular , la tensión de oxígeno, los factores de crecimiento, las citocinas y la naturaleza fisicoquímica del entorno, incluido el pH, la fuerza iónica (por ejemplo, la concentración de Ca 2+ ) y los metabolitos, como el ATP , también son importantes. [2] Las células madre y el nicho pueden inducirse mutuamente durante el desarrollo y enviarse señales recíprocamente para mantenerse mutuamente durante la edad adulta.
Los científicos están estudiando los diversos componentes del nicho y tratando de replicar las condiciones del nicho in vivo in vitro . [2] Esto se debe a que para las terapias regenerativas, la proliferación y diferenciación celular deben controlarse en matraces o placas, de modo que se produzca una cantidad suficiente del tipo de célula adecuado antes de introducirlas nuevamente en el paciente para la terapia.
Las células madre embrionarias humanas suelen cultivarse en medios suplementados con suero bovino fetal y que contienen factor de crecimiento fibrotástico 2. Se cultivan en una capa de células alimentadoras, que se cree que ayuda a mantener las características pluripotentes de las células madre embrionarias. Sin embargo, incluso estas condiciones pueden no imitar verdaderamente las condiciones del nicho in vivo .
Las células madre adultas permanecen en un estado indiferenciado durante toda la vida adulta. Sin embargo, cuando se cultivan in vitro , a menudo sufren un proceso de "envejecimiento" en el que se modifica su morfología y se reduce su capacidad proliferativa. Se cree que es necesario mejorar las condiciones de cultivo de las células madre adultas para que puedan mantener su condición de células madre adultas a lo largo del tiempo. [ cita requerida ]
Una revisión de Nature Insight define el nicho de la siguiente manera:
"Las poblaciones de células madre se establecen en 'nichos', lugares anatómicos específicos que regulan su participación en la generación, el mantenimiento y la reparación de los tejidos. El nicho salva a las células madre de la disminución de su tamaño, al tiempo que protege al huésped de una proliferación excesiva de células madre. Constituye una unidad básica de la fisiología tisular, que integra señales que median la respuesta equilibrada de las células madre a las necesidades de los organismos. Sin embargo, el nicho también puede inducir patologías al imponer una función aberrante a las células madre u otros objetivos. La interacción entre las células madre y su nicho crea el sistema dinámico necesario para el mantenimiento de los tejidos y para el diseño definitivo de terapias con células madre... La simple ubicación de las células madre no es suficiente para definir un nicho. El nicho debe tener dimensiones tanto anatómicas como funcionales". [3]
Historia
Aunque el concepto de nicho de células madre prevalecía en los vertebrados, la primera caracterización del nicho de células madre in vivo se elaboró en el desarrollo germinal de Drosophila . [ cita requerida ]
La arquitectura del nicho de células madre
Mediante la obtención de imágenes intravitales continuas en ratones, los investigadores pudieron explorar la estructura del nicho de células madre y obtener el destino de las células madre individuales (CM) y su progenie a lo largo del tiempo in vivo. En particular, en la cripta intestinal, [4] se han identificado dos grupos distintos de CM: las "células madre de borde" ubicadas en la parte superior del nicho en la interfaz con las células amplificadoras de tránsito (TA), y las "células madre centrales" ubicadas en la base de la cripta. El potencial proliferativo de los dos grupos fue desigual y se correlacionó con la ubicación de las células (central o de borde). También se demostró que los dos compartimentos de CM actuaban de acuerdo para mantener una población celular constante y una renovación celular constante. Una dependencia similar del potencial de autorrenovación en la proximidad al borde del nicho se informó en el contexto del folículo piloso, en un estudio de imágenes en vivo in vivo. [5]
Esta estructura bicompartimental del nicho de células madre se ha modelado matemáticamente para obtener la arquitectura óptima que conduce al retraso máximo en la producción de mutantes de doble impacto. [6] Encontraron que la arquitectura de SC bicompartimental minimiza la tasa de producción de mutantes de doble impacto en comparación con el modelo de compartimento de SC único. Además, la probabilidad mínima de generación de mutantes de doble impacto corresponde a una división puramente simétrica de SC con una gran tasa de proliferación de células madre limítrofes junto con una tasa de proliferación pequeña, pero no nula, de células madre centrales. [ cita requerida ]
Los nichos de células madre que albergan células en división continua, como las ubicadas en la base de la glándula intestinal , se mantienen en un tamaño poblacional pequeño. Esto presenta un desafío para el mantenimiento de tejidos multicelulares, ya que pequeñas poblaciones de individuos que se dividen asexualmente acumularán mutaciones deletéreas a través de la deriva genética y sucumbirán al colapso mutacional . [7] El modelado matemático de la glándula intestinal revela que el pequeño tamaño de la población dentro del nicho de células madre minimiza la probabilidad de que ocurra carcinogénesis en cualquier lugar, a expensas de mutaciones deletéreas acumuladas gradualmente a lo largo de la vida del organismo, un proceso que contribuye a la degradación y envejecimiento de los tejidos . [8] Por lo tanto, el tamaño de la población del nicho de células madre representa una compensación evolutiva entre la probabilidad de formación de cáncer y la tasa de envejecimiento.
Ejemplos
Línea germinal
Las células madre de la línea germinal (GSC) se encuentran en organismos que producen continuamente espermatozoides y óvulos hasta que se vuelven estériles. Estas células madre especializadas residen en el nicho de las GSC, el sitio inicial para la producción de gametos, que está compuesto por las GSC, las células madre somáticas y otras células somáticas. En particular, el nicho de las GSC está bien estudiado en el organismo modelo genético Drosophila melanogaster y ha proporcionado una comprensión extensa de la base molecular de la regulación de las células madre. [ cita requerida ]
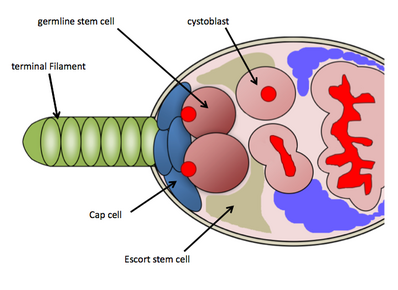
Nicho de GSC enDrosophilaovarios
En Drosophila melanogaster , el nicho de las GSC reside en la región más anterior de cada ovariola , conocida como germario. El nicho de las GSC consta de células somáticas necesarias: células filamentosas terminales, células de la tapa, células de escolta y otras células madre que funcionan para mantener las GSC. [9] El nicho de las GSC contiene en promedio de 2 a 3 GSC, que están directamente unidas a las células de la tapa somáticas y a las células madre de escolta, que envían señales de mantenimiento directamente a las GSC. [10] Las GSC se identifican fácilmente mediante tinción histológica contra la proteína vasa (para identificar células germinales) y la proteína 1B1 (para delinear las estructuras celulares y una estructura de fusoma específica de la línea germinal ). Su unión física a las células de la tapa es necesaria para su mantenimiento y actividad. [10] Una GSC se dividirá asimétricamente para producir un cistoblasto hijo, que luego experimenta 4 rondas de mitosis incompleta a medida que avanza por el ovariola (a través del proceso de ovogénesis ) y finalmente emerge como una cámara de óvulos madura; El fusoma que se encuentra en las GSC funciona en la formación de quistes y puede regular las divisiones celulares asimétricas de las GSC. [11] Debido a las abundantes herramientas genéticas disponibles para su uso en Drosophila melanogaster y la facilidad de detectar GSC a través de tinciones histológicas , los investigadores han descubierto varias vías moleculares que controlan el mantenimiento y la actividad de las GSC. [12] [13]
Mecanismos moleculares del mantenimiento y la actividad de las GSC
Señales locales
Los ligandos de la proteína morfogenética ósea (BMP), el ligando decapentapléjico (Dpp) y el de barco con fondo de cristal (Gbb), se envían señales directamente a las GSC y son esenciales para el mantenimiento y la autorrenovación de las GSC. [14] La señalización de BMP en el nicho funciona para reprimir directamente la expresión de la bolsa de canicas ( Bam ) en las GSC, que se regula positivamente en las células cistoblastas en desarrollo. [15] La pérdida de la función de dpp en el nicho da como resultado la desrepresión de Bam en las GSC, lo que resulta en una rápida diferenciación de las GSC. [10] Junto con la señalización de BMP, las células de la tapa también envían señales a otras moléculas a las GSC: Yb y Piwi . Ambas moléculas son necesarias de forma no autónoma para que las GSC proliferen; piwi también es necesario de forma autónoma en las GSC para la proliferación. [16] En el germario, la señalización de BMP tiene un efecto de corto alcance, por lo tanto, la unión física de las GSC a las células de la tapa es importante para el mantenimiento y la actividad. [ cita requerida ]
Fijación física de las GSC a las células de la cubierta
Las GSC están físicamente unidas a las células de la tapa por uniones adherentes de E-cadherina de Drosophila (DE-cadherina) y si se pierde esta unión física, las GSC se diferenciarán y perderán su identidad como célula madre. [10] El gen que codifica la DE-cadherina, shotgun ( shg ), y un gen que codifica el ortólogo de la beta-catenina, armadillo , controlan esta unión física. [17] Una molécula de GTPasa, rab11, está involucrada en el tráfico celular de DE-cadherinas. La eliminación de rab11 en las GSC da como resultado el desprendimiento de las GSC de las células de la tapa y la diferenciación prematura de las GSC. [18] Además, el crecimiento poblacional cero ( zpg ), que codifica una unión en hendidura específica de la línea germinal, es necesario para la diferenciación de las células germinales. [19]
Señales sistémicas que regulan las GSC
Tanto la dieta como la señalización similar a la insulina controlan directamente la proliferación de GSC en Drosophila melanogaster . El aumento de los niveles de péptido similar a la insulina de Drosophila (DILP) a través de la dieta da como resultado una mayor proliferación de GSC. [20] La regulación positiva de DILP en GSC envejecidas y su nicho da como resultado un mayor mantenimiento y proliferación. [21] También se ha demostrado que los DILP regulan las cantidades de células de la tapa y regulan la unión física de las GSC a las células de la tapa. [21]
Mecanismos de renovación
Existen dos mecanismos posibles para la renovación de células madre: la división simétrica de las células madre germinales o la desdiferenciación de los cistoblastos. Normalmente, las células madre germinales se dividirán asimétricamente para producir un cistoblasto hijo, pero se ha propuesto que la división simétrica podría dar como resultado que las dos células hijas sigan siendo células madre germinales. [22] [23] Si se eliminan las células madre germinales para crear un nicho vacío y las células de la tapa siguen presentes y enviando señales de mantenimiento, se pueden reclutar cistoblastos diferenciados al nicho y desdiferenciarse en células madre germinales funcionales. [24]
Envejecimiento de células madre
A medida que la hembra de Drosophila envejece, el nicho de células madre sufre una pérdida dependiente de la edad de la presencia y actividad de GSC. Se cree que estas pérdidas son causadas en parte por la degradación de los factores de señalización importantes del nicho que mantiene las GSC y su actividad. La disminución progresiva de la actividad de GSC contribuye a la reducción observada en la fecundidad de Drosophila melanogaster en la vejez; esta disminución de la actividad de GSC puede atribuirse parcialmente a una reducción de la actividad de la vía de señalización en el nicho de GSC. [25] [26] Se ha encontrado que hay una reducción en la señalización de Dpp y Gbb a través del envejecimiento. Además de una reducción en la actividad de la vía de señalización del nicho, las GSC envejecen de forma autónoma. Además de estudiar la disminución de las señales que vienen del nicho, las GSC envejecen intrínsecamente; hay una reducción dependiente de la edad de la adhesión de las GSC a las células del casquete y hay acumulación de especies reactivas de oxígeno (ROS) que resultan en daño celular que contribuye al envejecimiento de las GSC. Se observa una reducción en la cantidad de células de la tapa y en la unión física de las GSC a las células de la tapa a medida que envejecemos. La Shg se expresa en niveles significativamente más bajos en un nicho de GSC viejo en comparación con uno joven. [26]
Nicho de GSC enDrosophilatestículos
Los machos de Drosophila melanogaster tienen dos testículos (estructuras largas, tubulares y enrolladas) y en la punta más anterior de cada uno se encuentra el nicho de las células madre de los testículos. El nicho de las células madre de los testículos está construido alrededor de una población de células no mitóticas (células nicho), a las que se adhieren dos poblaciones de células madre: las células madre de los testículos y las células madre somáticas (SSC, también conocidas como células madre de los quistes somáticos o células madre de los quistes). Cada célula madre de los testículos está rodeada por un par de SSC, aunque cada tipo de célula madre sigue en contacto con las células nodrizas. De esta manera, el nicho de células madre consta de estos tres tipos de células, ya que no solo las células nodrizas regulan el comportamiento de las células madre de los testículos y las SSC, sino que las células madre también regulan la actividad de cada una de ellas. El nicho de las células madre de los testículos de Drosophila ha demostrado ser un valioso sistema modelo para examinar una amplia gama de procesos celulares y vías de señalización. [27]
Fuera del nicho GSC del testículo
El proceso de espermatogénesis comienza cuando las células madre de esperma se dividen asimétricamente, produciendo una célula madre de esperma que mantiene el contacto con el eje y un gonialblasto que sale del nicho. Las células madre de esperma se dividen con su pareja de células madre de esperma y su progenie no mitótica, las células quísticas somáticas (CCS, también conocidas como células quísticas), envolverán al gonialblasto. El gonialblasto luego experimenta cuatro rondas de divisiones sincrónicas de amplificación de tránsito con citocinesis incompleta para producir un quiste espermatogónico de dieciséis células. Este quiste espermatogónico luego se diferencia y crece hasta convertirse en un espermatocito, que eventualmente experimentará meiosis y producirá espermatozoides. [27]
Señalización molecular en el nicho de las GSC en los testículos
Las dos principales vías de señalización molecular que regulan el comportamiento de las células madre en el nicho de las GSC de los testículos son las vías de señalización Jak-STAT y BMP. La señalización Jak-STAT se origina en las células hub, donde el ligando Upd se secreta a las GSC y SSC. [28] [29] Esto conduce a la activación del STAT de Drosophila , Stat92E, un factor de transcripción que efectúa la adhesión de las GSC a las células hub, [30] y la autorrenovación de las SSC a través de Zfh-1. [31] La señalización Jak-STAT también influye en la activación de la señalización BMP, a través de los ligandos Dpp y Gbb. Estos ligandos se secretan a las GSC desde las SSC y las células hub, activan la señalización BMP y suprimen la expresión de Bam, un factor de diferenciación. [32] Fuera del nicho, los gonialblastos ya no reciben ligandos BMP y son libres de comenzar su programa de diferenciación. Otras vías de señalización importantes incluyen MAPK y Hedgehog, que regulan el encierro de la línea germinal [33] y la autorrenovación de las células somáticas [34] respectivamente.
Nicho de GSC en testículos de ratón
El nicho de las células madre espermatogoniales (GSC) en los machos murinos, también llamado nicho de células madre espermatogoniales (SSC), se encuentra en la región basal de los túbulos seminíferos de los testículos. El epitelio seminífero está compuesto por células de Sertoli que están en contacto con la membrana basal de los túbulos, que separa las células de Sertoli del tejido intersticial que se encuentra debajo. Este tejido intersticial está compuesto por células de Leydig, macrófagos, células mesenquimales, redes capilares y nervios. [35]
Durante el desarrollo, las células germinales primordiales migran a los túbulos seminíferos y hacia abajo, hacia la membrana basal, mientras permanecen unidas a las células de Sertoli, donde posteriormente se diferenciarán en SSC, también conocidas como espermatogonias A simples. [35] [36] Estas SSC pueden autorenovarse o comprometerse a diferenciarse en espermatozoides tras la proliferación de espermatogonias A simples en A apareadas. Las 2 células de las espermatogonias A apareadas permanecen unidas por puentes intercelulares y posteriormente se dividen en espermatogonias A alineadas, que se componen de 4 a 16 células conectadas. Las espermatogonias A alineadas experimentan luego la meiosis I para formar espermatocitos y la meiosis II para formar espermátidas que madurarán en espermatozoides. [37] [38] Esta diferenciación se produce a lo largo del eje longitudinal de las células de Sertoli, desde la membrana basal hasta el lumen apical de los túbulos seminíferos. Sin embargo, las células de Sertoli forman uniones estrechas que separan las células madre espermáticas y las espermatogonias en contacto con la membrana basal de los espermatocitos y las espermátidas para crear un compartimento basal y uno adluminal, por lo que los espermatocitos en diferenciación deben atravesar las uniones estrechas. [35] [39] Estas uniones estrechas forman la barrera hematotesticular (BTB) y se ha sugerido que desempeñan un papel en el aislamiento de las células diferenciadas en el compartimento adluminal de los factores secretados por el tejido intersticial y la vasculatura vecina al compartimento basal. [35]
Mecanismos moleculares del mantenimiento y la actividad de las células madre
Señales físicas
La membrana basal del túbulo seminífero es una forma modificada de matriz extracelular compuesta de fibronectina, colágenos y laminina. [35] La integrina β1 se expresa en la superficie de las SSC y está involucrada en su adhesión al componente de laminina de la membrana basal, aunque es probable que otras moléculas de adhesión también estén implicadas en la unión de las SSC a la membrana basal. [40] Se ha demostrado que la expresión de E-cadherina en las SSC en ratones, a diferencia de Drosophila , es prescindible ya que el trasplante de SSC cultivadas que carecen de E-cadherina puede colonizar los túbulos seminíferos del huésped y experimentar espermatogénesis. [41] Además, la barrera hematotesticular proporciona soporte arquitectónico y está compuesta de componentes de unión estrecha como ocludinas, claudinas y zonula occludens (ZO) que muestran una expresión dinámica durante la espermatogénesis. [42] Por ejemplo, se ha demostrado que la claudina 11 es un componente necesario de estas uniones estrechas, ya que los ratones que carecen de este gen tienen una barrera hematoencefálica defectuosa y no producen espermatozoides maduros. [40]
Señales moleculares que regulan la renovación de las células madre
Se sabe que el GDNF (factor neurotrófico derivado de células gliales) estimula la autorrenovación de las células madre epiteliales y es secretado por las células de Sertoli bajo la influencia de la gonadotropina FSH. El GDNF es un miembro relacionado de la superfamilia TGFβ de factores de crecimiento y cuando se sobreexpresa en ratones, se observó un aumento en las espermatogonias indiferenciadas que condujo a la formación de tumores germinales. [35] [40] En corroboración de su papel como factor de renovación, los ratones machos knock out heterocigotos para GDNF muestran una espermatogénesis reducida que eventualmente conduce a la infertilidad. [40] Además, se ha demostrado que la suplementación de GDNF extiende la expansión de las células madre epiteliales de ratón en cultivo. Sin embargo, el receptor de GDNF c-RET y el correceptor GFRa1 no se expresan únicamente en las células madre de la piel, sino también en las células madre apareadas y alineadas, lo que demuestra que el GDNF es un factor de renovación para las células madre de la piel de Asingle a Aaligned en general, en lugar de ser específico de la población de células madre de la piel de Asingle. También se ha demostrado que el FGF2 (factor de crecimiento de fibroblastos −2), secretado por las células de Sertoli, influye en la renovación de las células madre de la piel y de las espermatogonias indiferenciadas de manera similar al GDNF. [35]
Aunque las células de Sertoli parecen desempeñar un papel importante en la renovación, expresan receptores para la testosterona que es secretada por las células de Leydig, mientras que las células germinales no contienen este receptor, lo que alude a un papel importante de las células de Leydig en la mediación de la renovación. Las células de Leydig también producen CSF 1 (factor estimulante de colonias −1) para el cual las células madre esqueléticas expresan fuertemente el receptor CSF1R. [37] Cuando se añadió CSF 1 en cultivo con GDNF y FGF2 no se observó un mayor aumento en la proliferación, sin embargo, cuanto más tiempo permanecieron las células germinales en cultivo con CSF-1, mayor fue la densidad de células madre esqueléticas observada cuando estas células germinales se trasplantaron a los túbulos seminíferos del huésped. Esto demostró que CSF 1 es un factor de renovación específico que inclina las células madre esqueléticas hacia la renovación sobre la diferenciación, en lugar de afectar la proliferación de las células madre esqueléticas y las espermatogonias. También se ha demostrado que GDNF, FGF 2 y CSF 1 influyen en la autorrenovación de células madre en otros tejidos de mamíferos. [35]
El Plzf (dedo de zinc de la leucemia promielocítica) también se ha implicado en la regulación de la autorrenovación de las células madre y se expresa en espermatogonias A, A apareadas y A alineadas. El Plzf inhibe directamente la transcripción de un receptor, c-kit, en estas espermatogonias tempranas. Sin embargo, su ausencia en las espermatogonias tardías permite la expresión de c-kit, que posteriormente se activa por su ligando SCF (factor de células madre) secretado por las células de Sertoli, lo que da lugar a una mayor diferenciación. Además, se ha demostrado que la adición de BMP4 y Activina-A reduce la autorrenovación de las células madre en cultivo y aumenta la diferenciación de las células madre, y se ha demostrado que BMP4 aumenta la expresión de c-kit. [37]
Envejecimiento del nicho SSC
La espermatogénesis prolongada depende del mantenimiento de las células madre espermáticas, sin embargo, este mantenimiento disminuye con la edad y conduce a la infertilidad. Los ratones entre 12 y 14 meses de edad muestran una disminución del peso de los testículos, una reducción de la espermatogénesis y del contenido de células madre espermáticas. Aunque se considera que las células madre tienen el potencial de replicarse infinitamente in vitro, los factores proporcionados por el nicho son cruciales in vivo. De hecho, el trasplante en serie de células madre espermáticas de ratones machos de diferentes edades a ratones jóvenes de 3 meses de edad, cuya espermatogénesis endógena había sido ablacionada, se utilizó para estimar el contenido de células madre dado que cada célula madre generaría una colonia de espermatogénesis. [35] [43] Los resultados de este experimento mostraron que las células madre espermáticas trasplantadas podrían mantenerse mucho más tiempo que su vida útil replicativa para su edad. Además, un estudio también mostró que las células madre espermáticas de ratones fértiles jóvenes no podían mantenerse ni experimentar espermatogénesis cuando se trasplantaban a testículos de ratones viejos e infértiles. En conjunto, estos resultados apuntan a un deterioro del nicho del SSC en sí mismo con el envejecimiento, en lugar de la pérdida de factores intrínsecos en el SSC. [43]
Nichos de células madre adultas de vertebrados
Nicho de células madre hematopoyéticas
El nicho de las células madre hematopoyéticas de vertebrados en la médula ósea está formado por células osteoblastos subendostales, células endoteliales sinusoidales y células del estroma de la médula ósea (también llamadas a veces reticulares) que incluyen una mezcla de células fibroblastoides , monocíticas y adipocíticas (que comprenden el tejido adiposo de la médula ósea ). [1]
Nicho de células madre del folículo piloso
El nicho de células madre del folículo piloso es uno de los nichos más estudiados gracias a su relativa accesibilidad y papel en enfermedades importantes como el melanoma . Se ha demostrado que el área abultada en la unión del músculo erector del pelo con la vaina del folículo piloso alberga las células madre de la piel que pueden contribuir a todas las capas epiteliales de la piel. Estas células se mantienen mediante señalización en concierto con las células del nicho ; las señales incluyen señales paracrinas (p. ej. , sonic hedgehog ), autocrinas y yuxtacrinas . [44] La región abultada del folículo piloso depende de estas señales para mantener la pluripotencia de las células. El mapeo del destino o el rastreo del linaje celular ha demostrado que la progenie de las células madre positivas para queratina 15 participa en todos los linajes epiteliales. [45] El folículo experimenta una regeneración cíclica en la que estas células madre migran a varias regiones y se diferencian en el tipo de célula epitelial apropiado. Algunas señales importantes en el nicho de células madre del folículo piloso producidas por la papila dérmica mesenquimal o el bulto incluyen BMP, TGF-β y ligandos del factor de crecimiento de fibroblastos (FGF) e inhibidores de Wnt. [46] Si bien las vías de señalización de Wnt y la β-catenina son importantes para el mantenimiento de las células madre, [47] la sobreexpresión de β-catenina en los folículos pilosos induce un crecimiento inadecuado del cabello. Por lo tanto, estas señales, como los inhibidores de Wnt producidos por las células circundantes, son importantes para mantener y facilitar el nicho de células madre. [48]
Nicho de células madre intestinales
Los organoides intestinales se han utilizado para estudiar los nichos de células madre intestinales. Un cultivo de organoides intestinales se puede utilizar para evaluar indirectamente el efecto de la manipulación sobre las células madre mediante la evaluación de la supervivencia y el crecimiento del organoides. Las investigaciones realizadas con organoides intestinales han demostrado que la supervivencia de las células madre intestinales mejora con la presencia de neuronas y fibroblastos [49] y mediante la administración de IL-22 [50] .
Nicho de células madre cardiovasculares
Los nichos de células madre cardiovasculares se pueden encontrar dentro de la pared libre del ventrículo derecho, las aurículas y las vías de salida del corazón. Están compuestos de células progenitoras cardíacas (CPC) Isl1+/Flk1+ que se localizan en grupos discretos dentro de una matriz extracelular (ECM) de ColIV y laminina. ColI y fibronectina se encuentran predominantemente fuera de los grupos de CPC dentro del miocardio. La tinción inmunohistoquímica se ha utilizado para demostrar que las CPC diferenciadoras, que migran lejos de los grupos progenitores y hacia la ECM de ColI y fibronectina que rodea el nicho, regulan a la baja Isl1 mientras regulan al alza marcadores cardíacos maduros como la troponina C. [51] Existe una controversia actual sobre el papel de las células Isl1+ en el sistema cardiovascular. Aunque las publicaciones más importantes han identificado estas células como CPC y han encontrado una gran cantidad en el corazón murino y humano, publicaciones recientes han encontrado muy pocas células Isl1+ en el corazón fetal murino y atribuyen su localización al nódulo sinoatrial [52] , que se conoce como un área que contribuye a la marcapasos cardíaco. El papel de estas células y su nicho son objeto de intensa investigación y debate. [ cita requerida ]
Nicho de células madre neurales
Los nichos de células madre neurales se dividen en dos: la zona subependimaria (SEZ) y la zona subgranular (SGZ).
La SEZ es un área delgada debajo de la capa de células ependimarias que contiene tres tipos de células madre neurales: células madre neurales de división infrecuente (NSC), precursores amplificadores de tránsito de división rápida (TaP) y neuroblastos (NB). La matriz extracelular ( ECM ) de la SEZ tiene diferencias significativas en la composición en comparación con los tejidos circundantes. Recientemente, se describió que las células progenitoras, NSC, TaP y NB estaban unidas a estructuras de ECM llamadas Fractonas . [53] Estas estructuras son ricas en laminina, colágeno y proteoglicanos de heparán sulfato . [54] Otras moléculas de ECM, como tenascina-C, MMP y diferentes proteoglicanos también están implicadas en el nicho de células madre neurales. [55]
Nicho de células madre cancerosas
El tejido canceroso es morfológicamente heterogéneo, no sólo por la variedad de tipos de células presentes, endoteliales, fibroblastos y diversas células inmunes, sino que las células cancerosas en sí mismas tampoco son una población homogénea. [ cita requerida ]
De acuerdo con el modelo de jerarquía de tumores, las células madre cancerosas (CSC) se mantienen mediante señales contextuales bioquímicas y físicas que emanan del microambiente, llamado nicho de células madre cancerosas. [56] El nicho de las CSC es muy similar al nicho de células madre normales ( células madre embrionarias (ESC), células madre adultas ASC) en función (mantenimiento de la auto-renovación, estado indiferenciado y capacidad de diferenciación) y en vías de señalización (Activina/Noda, Akt/PTEN, JAK/STAT, PI3-K, TGF-β, Wnt y BMP). [57] Se plantea la hipótesis de que las CSC surgen de la señalización aberrante del microambiente y participan no solo en proporcionar señales de supervivencia a las CSC sino también en la metástasis por inducción de la transición epitelial-mesenquimal (EMT). [ cita requerida ]
Hipoxia
La condición hipóxica en los nichos de células madre (ESC, ASC o CSC) es necesaria para mantener las células madre en un estado indiferenciado y también para minimizar el daño del ADN por oxidación. El mantenimiento del estado hipóxico está bajo el control de los factores de transcripción inducibles por hipoxia (HIF). [58] Los HIF contribuyen a la progresión tumoral, la supervivencia celular y la metástasis mediante la regulación de genes diana como VEGF, GLUT-1, ADAM-1, Oct4 y Notch. [57]
Hipoxia en el nicho de las CSC
La hipoxia juega un papel importante en la regulación de los nichos de las células madre del cáncer y la EMT a través de la promoción de los HIF. [59] Estos HIF ayudan a mantener los nichos de las células madre del cáncer regulando genes importantes de la pluripotencia como Oct4 , Nanog , SOX2 , Klf4 y cMyc . [60] [61] Los HIF también regulan genes supresores de tumores importantes como p53 y genes que promueven la metástasis . [62] [63] Aunque los HIF aumentan la supervivencia de las células al disminuir los efectos del estrés oxidativo , también se ha demostrado que disminuyen factores como RAD51 y H2AX que mantienen la estabilidad genómica. [64] En la condición hipóxica hay un aumento de las especies reactivas de oxígeno (ROS) intracelulares que también promueven la supervivencia de las CSC a través de la respuesta al estrés. [65] [66] ROS estabiliza HIF-1α que promueve el protooncogén Met , que impulsa la metástasis o el escape motogénico en las células de melanoma . [67] Todos estos factores contribuyen al fenotipo de las células madre cancerosas, por lo que a menudo se las denomina nicho de células madre hipóxicas. Los entornos hipóxicos se encuentran a menudo en tumores donde las células se dividen más rápido de lo que puede ocurrir la angiogénesis . Es importante estudiar la hipoxia como un aspecto del cáncer porque se ha demostrado que los entornos hipóxicos son resistentes a la radioterapia . [68] Se ha demostrado que la radiación aumenta las cantidades de HIF-1 . [69] La inducción de EMT por hipoxia a través de interacciones entre HIF-1α y ROS es crucial para la metástasis en cánceres como el melanoma . Se ha descubierto que muchos genes asociados con el melanoma están regulados por la hipoxia, como MXI1, FN1 y NME1. [70]
Transición epitelial-mesenquimal
La transición epitelial-mesenquimal es un proceso morfogenético que ocurre normalmente en la embriogénesis y que es "secuestrado" por las células madre cancerosas al separarse de su lugar primario y migrar a otro. La diseminación es seguida por una transición inversa llamada Transición Epitelial-Mesenquimal (EMT). Este proceso está regulado por el microambiente de las CSC a través de las mismas vías de señalización que en la embriogénesis utilizando los factores de crecimiento ( TGF-β , PDGF , EGF), la citocina IL-8 y los componentes de la matriz extracelular. Se ha demostrado que las interacciones de estos factores de crecimiento a través de transductores de señales intracelulares como la β-catenina inducen potencial metastásico. [71] [72] Una característica de la EMT es la pérdida de los marcadores epiteliales (E-cadherina, citoqueratinas, claudina, oclusión, desmogleína, desmocolina) y la ganancia de marcadores mesenquimales (N-cadherina, vimentina, fibronectina). [73]
También existe cierto grado de similitud entre la movilización de células madre normales y la invasión de metástasis de células madre cancerosas. Existe un papel importante de las metaloproteinasas de matriz (MMP), las principales enzimas que degradan la matriz extracelular; por ejemplo, las metaloproteinasas de matriz-2 y -9 son inducidas a la expresión y secreción por las células del estroma durante la metástasis del cáncer de colon a través del contacto directo o la regulación paracrina. La siguiente molécula que comparte es el factor derivado de células del estroma-1 (SDF-1). [73] [74]
Inflamación
La EMT y la progresión del cáncer también pueden ser desencadenadas por la inflamación crónica . Los papeles principales los desempeñan moléculas (IL-6, IL-8, TNF-α, NFκB, TGF-β, HIF-1α) que pueden regular ambos procesos a través de la regulación de la señalización descendente que se superpone entre la EMT y la inflamación. [57] Las vías descendentes que participan en la regulación de las CSC son Wnt, SHH, Notch, TGF-β, RTKs-EGF, FGF, IGF, HGF.
El NFκB regula la EMT, la migración y la invasión de las células madre cancerosas a través de Slug, Snail y Twist. La activación del NFκB conduce no solo a un aumento en la producción de IL-6, TNF-α y SDF-1, sino también en la administración de factores de crecimiento.
La fuente de producción de citoquinas son los linfocitos (TNF-α), células madre mesenquimales (SDF-1, IL-6, IL8).
La interleucina 6 media la activación de STAT3. Se ha descrito un alto nivel de STAT3 en células madre cancerosas aisladas de cáncer de hígado, hueso, cuello uterino y cerebro. La inhibición de STAT3 produce una reducción drástica de su formación. En general, la IL-6 aporta una ventaja de supervivencia a las células madre locales y, por lo tanto, facilita la tumorogénesis. [57]
El SDF-1α secretado por las células madre mesenquimales (MSC) tiene un papel importante en el alojamiento y el mantenimiento de las células madre hematopoyéticas (HSC) en el nicho de la médula ósea, pero también en el alojamiento y la diseminación de las CSC. [74]
Angiogénesis
La hipoxia es un estimulante principal de la angiogénesis , siendo el HIF-1α el mediador primario. La angiogénesis inducida por condiciones hipóxicas se denomina "interruptor angiogénico". El HIF-1 promueve la expresión de varios factores angiogénicos: factor de crecimiento endotelial vascular (VEGF), factor de crecimiento de fibroblastos básico (bFGF), factor de crecimiento similar a la placenta (PLGF), factor de crecimiento derivado de plaquetas (PDGF) y factor de crecimiento epidérmico. Pero hay evidencia de que la expresión de agentes angiogénicos por células cancerosas también puede ser independiente del HIF-1. Parece que existe un papel importante de la proteína Ras y que los niveles intracelulares de calcio regulan la expresión de genes angiogénicos en respuesta a la hipoxia. [73]
El interruptor angiogénico regula a la baja las proteínas supresoras de la angiogénesis, como la trombospondina, la angiostatina, la endostatina y la tumstatina. La angiogénesis es necesaria para el crecimiento del tumor primario. [ cita requerida ]
Inducida por lesiones
Durante una lesión, las células de sostén pueden activar un programa de reparación, recapitulando aspectos del desarrollo en el área dañada. Estas áreas se vuelven permisivas para la renovación, migración y diferenciación de células madre. Por ejemplo, en el SNC, la lesión puede activar un programa de desarrollo en los astrocitos que les permite expresar moléculas que apoyan a las células madre, como las quimiocinas, es decir, SDF-1 [75] y morfógenos como Sonic Hedgehog [76] .
Estrategias de imitación de la matriz extracelular para el nicho de células madre
Es evidente que las características biofisicoquímicas de la matriz extracelular, como la composición, la forma, la topografía, la rigidez y la resistencia mecánica, pueden controlar el comportamiento de las células madre. Estos factores de la matriz extracelular son igualmente importantes cuando las células madre se cultivan in vitro. Si se puede elegir entre la interacción célula de nicho-célula madre y la interacción matriz extracelular-célula madre, se prefiere la imitación de la matriz extracelular, ya que se puede controlar con precisión mediante técnicas de fabricación de andamios, parámetros de procesamiento o modificaciones posteriores a la fabricación. Para poder realizar la imitación, es esencial comprender las propiedades naturales de la matriz extracelular y su papel en los procesos de destino de las células madre. Se han realizado varios estudios que involucran diferentes tipos de andamios que regulan el destino de las células madre imitando estas propiedades de la matriz extracelular. [2] )
[77]
Referencias
- ^ ab Birbrair A, Frenette PS (abril de 2016). "Heterogeneidad de nicho en la médula ósea". Anales de la Academia de Ciencias de Nueva York . 1370 (1): 82–96. Bibcode :2016NYASA1370...82B. doi :10.1111/nyas.13016. PMC 4938003 . PMID 27015419.
- ^ abc Jhala D (2015). "Una revisión sobre estrategias de imitación de la matriz extracelular para un nicho de células madre artificial". Polymer Reviews . 55 (4): 561–595. doi :10.1080/15583724.2015.1040552. S2CID 94588894.
- ^ Scadden DT (junio de 2006). "El nicho de células madre como entidad de acción". Nature . 441 (7097): 1075–1079. Bibcode :2006Natur.441.1075S. doi :10.1038/nature04957. PMID 16810242. S2CID 4418385.
- ^ Ritsma L, Ellenbroek SI, Zomer A, Snippert HJ, de Sauvage FJ, Simons BD, et al. (marzo de 2014). "Homeostasis de las criptas intestinales revelada a nivel de células madre individuales mediante imágenes en vivo in vivo". Nature . 507 (7492): 362–365. Bibcode :2014Natur.507..362R. doi :10.1038/nature12972. PMC 3964820 . PMID 24531760.
- ^ Rompolas P, Mesa KR, Greco V (octubre de 2013). "Organización espacial dentro de un nicho como determinante del destino de las células madre". Nature . 502 (7472): 513–518. Bibcode :2013Natur.502..513R. doi :10.1038/nature12602. PMC 3895444 . PMID 24097351.
- ^ Shahriyari L, Komarova NL (julio de 2015). "El papel del nicho de células madre bicompartimental en el retraso del cáncer". Physical Biology . 12 (5): 055001. Bibcode :2015PhBio..12e5001S. doi :10.1088/1478-3975/12/5/055001. PMID 26228740. S2CID 7171931.
- ^ Cannataro VL, McKinley SA, St Mary CM (abril de 2016). "Las implicaciones de los nichos de células madre de pequeño tamaño y la distribución de los efectos de adaptación de las nuevas mutaciones en el envejecimiento y la tumorogénesis". Aplicaciones evolutivas . 9 (4): 565–582. Bibcode :2016EvApp...9..565C. doi :10.1111/eva.12361. PMC 4831459 . PMID 27099622.
- ^ Cannataro VL, McKinley SA, St Mary CM (julio de 2017). "El equilibrio evolutivo entre el tamaño del nicho de las células madre, el envejecimiento y la tumorigénesis". Aplicaciones evolutivas . 10 (6): 590–602. Bibcode :2017EvApp..10..590C. doi :10.1111/eva.12476. PMC 5469181 . PMID 28616066.
- ^ Li L, Xie T (2005). "Nicho de células madre: estructura y función". Revisión anual de biología celular y del desarrollo . 21 : 605–631. doi :10.1146/annurev.cellbio.21.012704.131525. PMID 16212509.
- ^ abcd Xie T, Spradling AC (octubre de 2000). "Un nicho que mantiene las células madre de la línea germinal en el ovario de Drosophila". Science . 290 (5490): 328–330. Bibcode :2000Sci...290..328X. doi :10.1126/science.290.5490.328. PMID 11030649.
- ^ Lin H, Yue L, Spradling AC (abril de 1994). "El fusoma de Drosophila, un orgánulo específico de la línea germinal, contiene proteínas esqueléticas de membrana y funciona en la formación de quistes". Desarrollo . 120 (4): 947–956. doi :10.1242/dev.120.4.947. PMID 7600970.
- ^ Ting, X., 2013. Control de la autorrenovación y diferenciación de células madre de la línea germinal en el ovario de Drosophila: acciones concertadas de señales de nicho y factores intrínsecos. Wiley Interdisciplinary Reviews: Developmental Biology, 2(2), pp.261-273.
- ^ Zhang, H. y Cai, Y., 2020. Vías de transducción de señales que regulan las células madre de la línea germinal ovárica de Drosophila. Current opinion in insect science, 37, pp.1-7.
- ^ Song X, Wong MD, Kawase E, Xi R, Ding BC, McCarthy JJ, Xie T (marzo de 2004). "Las señales Bmp de las células de nicho reprimen directamente la transcripción de un gen promotor de la diferenciación, bag of marbles, en células madre de la línea germinal en el ovario de Drosophila". Desarrollo . 131 (6): 1353–1364. doi : 10.1242/dev.01026 . PMID 14973291.
- ^ Chen D, McKearin D (octubre de 2003). "La señalización Dpp silencia la transcripción de BAM directamente para establecer divisiones asimétricas de las células madre de la línea germinal". Current Biology . 13 (20): 1786–1791. Bibcode :2003CBio...13.1786C. doi : 10.1016/j.cub.2003.09.033 . PMID 14561403.
- ^ Cox DN, Chao A, Lin H (febrero de 2000). "piwi codifica un factor nucleoplásmico cuya actividad modula el número y la tasa de división de las células madre de la línea germinal". Desarrollo . 127 (3): 503–514. doi :10.1242/dev.127.3.503. PMID 10631171.
- ^ Song X, Zhu CH, Doan C, Xie T (junio de 2002). "Células madre de la línea germinal ancladas por uniones adherentes en los nichos ováricos de Drosophila". Science . 296 (5574): 1855–1857. Bibcode :2002Sci...296.1855S. doi :10.1126/science.1069871. PMID 12052957. S2CID 25830121.
- ^ Bogard N, Lan L, Xu J, Cohen RS (octubre de 2007). "Rab11 mantiene conexiones entre las células madre de la línea germinal y las células del nicho en el ovario de Drosophila". Desarrollo . 134 (19): 3413–3418. doi : 10.1242/dev.008466 . PMID 17715175.
- ^ Gilboa L, Forbes A, Tazuke SI, Fuller MT, Lehmann R (diciembre de 2003). "La diferenciación de células madre de la línea germinal en Drosophila requiere uniones en hendidura y se lleva a cabo a través de un estado intermedio". Desarrollo . 130 (26): 6625–6634. doi : 10.1242/dev.00853 . PMID 14660550.
- ^ Drummond-Barbosa D , Spradling AC (marzo de 2001). "Las células madre y su progenie responden a los cambios nutricionales durante la ovogénesis de Drosophila". Biología del desarrollo . 231 (1): 265–278. doi : 10.1006/dbio.2000.0135 . PMID 11180967.
- ^ ab Hsu HJ, Drummond-Barbosa D (enero de 2009). "Los niveles de insulina controlan el mantenimiento de las células madre de la línea germinal femenina a través del nicho en Drosophila". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 106 (4): 1117–1121. Bibcode :2009PNAS..106.1117H. doi : 10.1073/pnas.0809144106 . PMC 2633547 . PMID 19136634.
- ^ Margolis J, Spradling A (noviembre de 1995). "Identificación y comportamiento de células madre epiteliales en el ovario de Drosophila". Desarrollo . 121 (11): 3797–3807. doi :10.1242/dev.121.11.3797. PMID 8582289.
- ^ Xie T, Spradling AC (julio de 1998). "La decapentaplejia es esencial para el mantenimiento y la división de las células madre de la línea germinal en el ovario de Drosophila". Cell . 94 (2): 251–260. doi : 10.1016/s0092-8674(00)81424-5 . PMID 9695953.
- ^ Kai T, Spradling A (abril de 2003). "Un nicho de células madre de Drosophila vacío reactiva la proliferación de células ectópicas". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 100 (8): 4633–4638. Bibcode :2003PNAS..100.4633K. doi : 10.1073/pnas.0830856100 . PMC 153607 . PMID 12676994.
- ^ Zhao R, Xuan Y, Li X, Xi R (junio de 2008). "Cambios relacionados con la edad en la actividad de las células madre de la línea germinal, la actividad de señalización de nicho y la producción de óvulos en Drosophila". Aging Cell . 7 (3): 344–354. doi : 10.1111/j.1474-9726.2008.00379.x . PMID 18267001.
- ^ ab Pan L, Chen S, Weng C, Call G, Zhu D, Tang H, et al. (octubre de 2007). "El envejecimiento de las células madre se controla tanto intrínsecamente como extrínsecamente en el ovario de Drosophila". Cell Stem Cell . 1 (4): 458–469. doi : 10.1016/j.stem.2007.09.010 . PMID 18371381.
- ^ ab La Marca JE, Somers WG (2014). "Las gónadas de Drosophila: modelos de proliferación, autorrenovación y diferenciación de células madre". AIMS Genetics . 1 (1): 55–80. doi : 10.3934/genet.2014.1.55 .
- ^ Kiger AA, Jones DL, Schulz C, Rogers MB, Fuller MT (diciembre de 2001). "Autorenovación de células madre especificada por la activación de JAK-STAT en respuesta a una señal de célula de apoyo". Science . 294 (5551): 2542–2545. Bibcode :2001Sci...294.2542K. doi :10.1126/science.1066707. PMID 11752574. S2CID 206506814.
- ^ Tulina N, Matunis E (diciembre de 2001). "Control de la autorrenovación de células madre en la espermatogénesis de Drosophila mediante señalización JAK-STAT". Science . 294 (5551): 2546–2549. Bibcode :2001Sci...294.2546T. doi :10.1126/science.1066700. PMID 11752575. S2CID 43266825.
- ^ Leatherman JL, Dinardo S (agosto de 2010). "La autorrenovación de la línea germinal requiere células madre del quiste y regula la adhesión al nicho en los testículos de Drosophila". Nature Cell Biology . 12 (8): 806–811. doi :10.1038/ncb2086. PMC 2917891 . PMID 20622868.
- ^ Leatherman JL, Dinardo S (julio de 2008). "Zfh-1 controla la autorrenovación de las células madre somáticas en el testículo de Drosophila e influye de forma no autónoma en la autorrenovación de las células madre de la línea germinal". Cell Stem Cell . 3 (1): 44–54. doi :10.1016/j.stem.2008.05.001. PMC 2601693 . PMID 18593558.
- ^ Kawase E, Wong MD, Ding BC, Xie T (marzo de 2004). "La señalización Gbb/Bmp es esencial para mantener las células madre de la línea germinal y para reprimir la transcripción de BAM en el testículo de Drosophila". Desarrollo . 131 (6): 1365–1375. doi : 10.1242/dev.01025 . PMID 14973292.
- ^ Sarkar A, Parikh N, Hearn SA, Fuller MT, Tazuke SI, Schulz C (julio de 2007). "Funciones antagónicas de Rac y Rho en la organización del microambiente de las células germinales". Current Biology . 17 (14): 1253–1258. Bibcode :2007CBio...17.1253S. doi : 10.1016/j.cub.2007.06.048 . PMID 17629483.
- ^ Michel M, Kupinski AP, Raabe I, Bökel C (agosto de 2012). "La señalización de Hh es esencial para el mantenimiento de las células madre somáticas en el nicho testicular de Drosophila". Desarrollo . 139 (15): 2663–2669. doi : 10.1242/dev.075242 . PMID 22745310.
- ^ abcdefghi Oatley JM, Brinster RL (abril de 2012). "La unidad de nicho de células madre de la línea germinal en los testículos de los mamíferos". Physiological Reviews . 92 (2): 577–595. doi :10.1152/physrev.00025.2011. PMC 3970841 . PMID 22535892.
- ^ Griswold MD, Oatley JM (enero de 2013). "Revisión concisa: características definitorias de las células madre espermatogénicas de mamíferos". Células madre . 31 (1): 8–11. doi :10.1002/stem.1253. PMC 5312674 . PMID 23074087.
- ^ abc de Rooij DG (agosto de 2009). "El nicho de las células madre espermatogoniales". Microscopy Research and Technique . 72 (8): 580–585. doi : 10.1002/jemt.20699 . PMID 19263493.
- ^ Bowles J, Koopman P (octubre de 2007). "Ácido retinoico, meiosis y destino de las células germinales en mamíferos". Desarrollo . 134 (19): 3401–3411. doi : 10.1242/dev.001107 . PMID 17715177.
- ^ Hess RA, de Franca LR (2009). "Espermatogénesis y ciclo del epitelio seminífero". En Cheng CY (ed.). Mecanismos moleculares en la espermatogénesis . Avances en medicina experimental y biología. Vol. 636. págs. 1–15. doi :10.1007/978-0-387-09597-4_1. ISBN 978-0-387-09597-4. Número de identificación personal 19856159.
- ^ abcd Kanatsu-Shinohara M, Shinohara T (2013). "Autorenovación y desarrollo de células madre espermatogoniales". Revisión anual de biología celular y del desarrollo . 29 : 163–187. doi :10.1146/annurev-cellbio-101512-122353. PMID 24099084.
- ^ Yoshida S (2011). "Sistema de nicho de células madre en la espermatogénesis del ratón". Células madre de la línea germinal masculina: potencial de desarrollo y regeneración . Vol. 2011. págs. 159-175. doi :10.1007/978-1-61737-973-4_8. ISBN 978-1-61737-972-7.
{{cite book}}:|journal=ignorado ( ayuda ) - ^ Chihara M, Otsuka S, Ichii O, Hashimoto Y, Kon Y (julio de 2010). "Dinámica molecular de los componentes de la barrera hematotesticular durante la espermatogénesis murina". Reproducción y Desarrollo Molecular . 77 (7): 630–639. doi :10.1002/mrd.21200. PMID 20578065. S2CID 21630147.
- ^ ab Ryu BY, Orwig KE, Oatley JM, Avarbock MR, Brinster RL (junio de 2006). "Efectos del envejecimiento y del microambiente de nicho en la autorrenovación de las células madre espermatogoniales". Células madre . 24 (6): 1505–1511. doi :10.1634/stemcells.2005-0580. PMC 5501308 . PMID 16456131.
- ^ Aloni-Grinstein R, Shetzer Y, Kaufman T, Rotter V (agosto de 2014). "p53: la barrera para la formación de células madre cancerosas". FEBS Letters . 588 (16): 2580–2589. Bibcode :2014FEBSL.588.2580A. doi : 10.1016/j.febslet.2014.02.011 . PMID 24560790.
- ^ Morris RJ, Liu Y, Marles L, Yang Z, Trempus C, Li S, et al. (abril de 2004). "Captura y elaboración de perfiles de células madre de folículos pilosos adultos". Nature Biotechnology . 22 (4): 411–417. doi :10.1038/nbt950. PMID 15024388. S2CID 9257482.
- ^ Rompolas P, Greco V (2014). "Dinámica de células madre en el nicho del folículo piloso". Seminarios en biología celular y del desarrollo . 25–26: 34–42. doi :10.1016/j.semcdb.2013.12.005. PMC 3988239 . PMID 24361866.
- ^ Hosseini V, Kalantary-Charvadeh A, Hajikarami M, Fayyazpour P, Rahbarghazi R, Totonchi M, Darabi M (octubre de 2021). "Una pequeña molécula que modula los ácidos grasos monoinsaturados y la señalización de Wnt confiere mantenimiento a las células madre pluripotentes inducidas contra la diferenciación endodérmica". Investigación y terapia con células madre . 12 (1): 550. doi : 10.1186/s13287-021-02617-x . PMC 8532309 . PMID 34674740.
- ^ Deschene ER, Myung P, Rompolas P, Zito G, Sun TY, Taketo MM, et al. (marzo de 2014). "La activación de β-catenina regula el crecimiento tisular de forma no celular autónoma en el nicho de células madre del cabello". Science . 343 (6177): 1353–1356. Bibcode :2014Sci...343.1353D. doi :10.1126/science.1248373. PMC 4096864 . PMID 24653033.
- ^ Pastuła A, Middelhoff M, Brandtner A, Tobiasch M, Höhl B, Nuber AH, et al. (2016). "Cultivo tridimensional de organoides gastrointestinales en combinación con nervios o fibroblastos: un método para caracterizar el nicho de células madre gastrointestinales". Stem Cells International . 2016 : 3710836. doi : 10.1155/2016/3710836 . PMC 4677245 . PMID 26697073.
- ^ Lindemans C, Mertelsmann A, Dudakov JA, Velardi E, Hua G, O'Connor M, et al. (2014). "La administración de IL-22 protege las células madre intestinales del Gvhd". Biología del trasplante de sangre y médula . 20 (2): S53-S54. doi : 10.1016/j.bbmt.2013.12.056 .
- ^ Schenke-Layland K, Nsair A, Van Handel B, Angelis E, Gluck JM, Votteler M, et al. (abril de 2011). "Recapitulación del nicho de células progenitoras cardiovasculares embrionarias". Biomateriales . 32 (11): 2748–2756. doi :10.1016/j.biomaterials.2010.12.046. PMC 3414535 . PMID 21257198.
- ^ Weinberger F, Mehrkens D, Friedrich FW, Stubbendorff M, Hua X, Müller JC, et al. (mayo de 2012). "Localización de células positivas para Islet-1 en el corazón murino adulto sano e infartado". Circulation Research . 110 (10): 1303–1310. doi :10.1161/CIRCRESAHA.111.259630. PMC 5559221 . PMID 22427341.
- ^ Luo, Pifu; Moritani, Masayuki; Dessem, Dean (2001-07-02). "Vías aferentes del huso muscular de la mandíbula al núcleo motor del trigémino en la rata". The Journal of Comparative Neurology . 435 (3): 341–353. doi :10.1002/cne.1034. ISSN 0021-9967. PMID 11406816. S2CID 36398505.
- ^ Mercier, Frederic (2016). "Fractonas: nicho de la matriz extracelular que controla el destino de las células madre y la actividad de los factores de crecimiento en el cerebro en condiciones de salud y enfermedad". Ciencias de la vida celular y molecular . 73 (24): 4661–4674. doi :10.1007/s00018-016-2314-y. ISSN 1420-682X. PMC 11108427 . PMID 27475964. S2CID 28119663.
- ^ "El microambiente de las células madre neuronales | StemBook". www.stembook.org . Consultado el 29 de abril de 2022 .
- ^ van de Stolpe A (2013). "Sobre el origen y el destino de las células madre del cáncer: una evaluación conceptual". American Journal of Cancer Research . 3 (1): 107–116. PMC 3555199 . PMID 23359140.
- ^ abcd Cabarcas SM, Mathews LA, Farrar WL (noviembre de 2011). "El nicho de células madre del cáncer: ¿se acaba el vecindario?". Revista internacional del cáncer . 129 (10): 2315–2327. doi :10.1002/ijc.26312. PMC 6953416 . PMID 21792897.
- ^ Borovski T, De Sousa E, Melo F, Vermeulen L, Medema JP (febrero de 2011). "Nicho de células madre cancerosas: el lugar donde estar". Cancer Research . 71 (3): 634–639. doi : 10.1158/0008-5472.CAN-10-3220 . PMID 21266356.
- ^ Peitzsch C, Perrin R, Hill RP, Dubrovska A, Kurth I (agosto de 2014). "Hipoxia como biomarcador de células madre cancerosas radioresistentes". Revista internacional de biología de la radiación . 90 (8): 636–652. doi :10.3109/09553002.2014.916841. PMID 24844374. S2CID 25813277.
- ^ Covello KL, Kehler J, Yu H, Gordan JD, Arsham AM, Hu CJ, et al. (marzo de 2006). "HIF-2alpha regula Oct-4: efectos de la hipoxia en la función de las células madre, el desarrollo embrionario y el crecimiento tumoral". Genes & Development . 20 (5): 557–570. doi :10.1101/gad.1399906. PMC 1410808 . PMID 16510872.
- ^ Keith B, Simon MC (mayo de 2007). "Factores inducibles por hipoxia, células madre y cáncer". Cell . 129 (3): 465–472. doi :10.1016/j.cell.2007.04.019. PMC 3150586 . PMID 17482542.
- ^ Bertout JA, Majmundar AJ, Gordan JD, Lam JC, Ditsworth D, Keith B, et al. (agosto de 2009). "La inhibición de HIF2alpha promueve la actividad de la vía p53, la muerte de células tumorales y las respuestas a la radiación". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 106 (34): 14391–14396. Bibcode :2009PNAS..10614391B. doi : 10.1073/pnas.0907357106 . PMC 2726037 . PMID 19706526.
- ^ Liu L, Zhu XD, Wang WQ, Shen Y, Qin Y, Ren ZG, et al. (mayo de 2010). "La activación de beta-catenina por hipoxia en el carcinoma hepatocelular contribuye a un mayor potencial metastásico y un mal pronóstico". Clinical Cancer Research . 16 (10): 2740–2750. doi : 10.1158/1078-0432.CCR-09-2610 . PMID 20460486.
- ^ Bindra RS, Schaffer PJ, Meng A, Woo J, Måseide K, Roth ME, et al. (octubre de 2004). "Regulación negativa de Rad51 y disminución de la recombinación homóloga en células cancerosas hipóxicas". Biología molecular y celular . 24 (19): 8504–8518. doi :10.1128/MCB.24.19.8504-8518.2004. PMC 516750 . PMID 15367671.
- ^ Singh S, Brocker C, Koppaka V, Chen Y, Jackson BC, Matsumoto A, et al. (marzo de 2013). "Aldehído deshidrogenasas en las respuestas celulares al estrés oxidativo/electrófilo". Free Radical Biology & Medicine . 56 : 89–101. doi :10.1016/j.freeradbiomed.2012.11.010. PMC 3631350 . PMID 23195683.
- ^ Diehn M, Cho RW, Lobo NA, Kalisky T, Dorie MJ, Kulp AN, et al. (abril de 2009). "Asociación de los niveles de especies reactivas de oxígeno y la radioresistencia en células madre cancerosas". Nature . 458 (7239): 780–783. Bibcode :2009Natur.458..780D. doi :10.1038/nature07733. PMC 2778612 . PMID 19194462.
- ^ Comito G, Calvani M, Giannoni E, Bianchini F, Calorini L, Torre E, et al. (agosto de 2011). "La estabilización de HIF-1α por ROS mitocondriales promueve el crecimiento invasivo dependiente de Met y el mimetismo vasculogénico en células de melanoma". Biología y medicina de radicales libres . 51 (4): 893–904. doi :10.1016/j.freeradbiomed.2011.05.042. hdl : 2158/496457 . PMID 21703345.
- ^ Brown JM (2007). "Hipoxia tumoral en la terapia del cáncer". Biología del oxígeno e hipoxia . Métodos en enzimología. Vol. 435. págs. 297–321. doi :10.1016/S0076-6879(07)35015-5. ISBN 9780123739704. Número de identificación personal 17998060.
- ^ Moeller BJ, Cao Y, Li CY, Dewhirst MW (mayo de 2004). "La radiación activa el HIF-1 para regular la radiosensibilidad vascular en tumores: papel de la reoxigenación, los radicales libres y los gránulos de estrés". Cancer Cell . 5 (5): 429–441. doi : 10.1016/s1535-6108(04)00115-1 . PMID 15144951.
- ^ Olbryt M, Habryka A, Tyszkiewicz T, Rusin A, Cichoń T, Jarząb M, Krawczyk Z (octubre de 2011). "Los genes asociados al melanoma, MXI1, FN1 y NME1, responden a la hipoxia en células de melanoma humano y murino". Investigación del melanoma . 21 (5): 417–425. doi :10.1097/CMR.0b013e328348db2f. PMID 21912348. S2CID 33171556.
- ^ Moustakas A, Heldin CH (octubre de 2007). "Redes de señalización que guían las transiciones epitelial-mesenquimal durante la embriogénesis y la progresión del cáncer". Cancer Science . 98 (10): 1512–1520. doi : 10.1111/j.1349-7006.2007.00550.x . PMC 11158989 . PMID 17645776. S2CID 23032956.
- ^ Zhou B, Liu Y, Kahn M, Ann DK, Han A, Wang H, et al. (marzo de 2012). "Las interacciones entre la β-catenina y las vías de señalización del factor de crecimiento transformante β median la transición epitelial-mesenquimal y dependen de la proteína de unión al elemento de respuesta a AMPc (CREB), un coactivador transcripcional, la proteína de unión (CBP)". The Journal of Biological Chemistry . 287 (10): 7026–7038. doi : 10.1074/jbc.M111.276311 . PMC 3293544 . PMID 22241478.
- ^ abc Gout S, Huot J (diciembre de 2008). "El papel del microambiente del cáncer en la metástasis: enfoque en el cáncer de colon". Cancer Microenvironment . 1 (1): 69–83. doi :10.1007/s12307-008-0007-2. PMC 2654352 . PMID 19308686.
- ^ ab Li L, Neaves WB (mayo de 2006). "Células madre normales y células madre cancerosas: el nicho importa". Cancer Research . 66 (9): 4553–4557. doi : 10.1158/0008-5472.CAN-05-3986 . PMID 16651403.
- ^ Imitola J, Raddassi K, Park KI, Mueller FJ, Nieto M, Teng YD, et al. (diciembre de 2004). "Migración dirigida de células madre neurales a sitios de lesión del SNC por la vía del factor 1alfa derivado de células estromales/receptor de quimiocina CXC 4". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 101 (52): 18117–18122. Bibcode :2004PNAS..10118117I. doi : 10.1073/pnas.0408258102 . PMC 536055 . PMID 15608062.
- ^ Wang Y, Imitola J, Rasmussen S, O'Connor KC, Khoury SJ (octubre de 2008). "Desregulación paradójica de la vía de células madre neurales sonic hedgehog-Gli1 en la encefalomielitis autoinmune y la esclerosis múltiple". Anales de neurología . 64 (4): 417–427. doi :10.1002/ana.21457. PMC 2757750 . PMID 18991353.
- ^ Vishwakarma A (1 de abril de 2017). Biología e ingeniería de nichos de células madre. Academic Press, 2017. ISBN 9780128027561.
