Glicosilación
La glicosilación es la reacción en la que un carbohidrato (o " glicano "), es decir, un donante de glicosilo , se une a un hidroxilo u otro grupo funcional de otra molécula (un aceptor de glicosilo ) para formar un glicoconjugado . En biología (pero no siempre en química), la glicosilación generalmente se refiere a una reacción catalizada por enzimas, mientras que la glicación (también "glicación no enzimática" y "glicosilación no enzimática") puede referirse a una reacción no enzimática. [1]
La glicosilación es una forma de modificación co-traduccional y postraduccional . Los glicanos cumplen una variedad de funciones estructurales y funcionales en las proteínas de membrana y secretadas. [2] La mayoría de las proteínas sintetizadas en el retículo endoplasmático rugoso experimentan glicosilación. La glicosilación también está presente en el citoplasma y el núcleo como la modificación O -GlcNAc . La aglicosilación es una característica de los anticuerpos diseñados para evitar la glicosilación. [3] [4] Se producen cinco clases de glicanos:
- Glicanos unidos a N unidos a un nitrógeno de las cadenas laterales de asparagina o arginina . La glicosilación unida a N requiere la participación de un lípido especial llamado fosfato de dolicol .
- Glicanos unidos a O unidos al oxígeno hidroxilo de las cadenas laterales de serina , treonina , tirosina , hidroxilisina o hidroxiprolina , o a oxígenos en lípidos como la ceramida .
- Fosfoglicanos unidos a través del fosfato de una fosfoserina.
- Glicanos unidos a C , una forma poco común de glicosilación en la que se añade un azúcar a un carbono de la cadena lateral del triptófano . La aloína es una de las pocas sustancias que se encuentran en la naturaleza.
- Glipización , que es la adición de un ancla GPI que une las proteínas a los lípidos a través de enlaces de glicano.
Objetivo
La glicosilación es el proceso por el cual un carbohidrato se une covalentemente a una macromolécula objetivo , típicamente proteínas y lípidos . Esta modificación cumple varias funciones. [5] Por ejemplo, algunas proteínas no se pliegan correctamente a menos que estén glicosiladas. [2] En otros casos, las proteínas no son estables a menos que contengan oligosacáridos unidos en el nitrógeno amida de ciertos residuos de asparagina . La influencia de la glicosilación en el plegamiento y la estabilidad de la glicoproteína es doble. En primer lugar, los glicanos altamente solubles pueden tener un efecto de estabilización fisicoquímica directa. En segundo lugar, los glicanos N -ligados median un punto de control de calidad crítico en el plegamiento de la glicoproteína en el retículo endoplásmico. [6] La glicosilación también juega un papel en la adhesión de célula a célula (un mecanismo empleado por las células del sistema inmunológico ) a través de proteínas de unión a azúcar llamadas lectinas , que reconocen fracciones específicas de carbohidratos. [2] La glicosilación es un parámetro importante en la optimización de muchos fármacos basados en glicoproteínas, como los anticuerpos monoclonales . [6] La glicosilación también sustenta el sistema de grupos sanguíneos ABO . Es la presencia o ausencia de glicosiltransferasas la que determina qué antígenos de grupos sanguíneos se presentan y, por lo tanto, qué especificidades de anticuerpos se exhiben. Esta función inmunológica bien puede haber impulsado la diversificación de la heterogeneidad de los glicanos y crea una barrera a la transmisión zoonótica de virus. [7] Además, los virus suelen utilizar la glicosilación para proteger la proteína viral subyacente del reconocimiento inmunológico. Un ejemplo significativo es el denso escudo de glicanos de la espícula de la envoltura del virus de la inmunodeficiencia humana . [8]
En general, la glicosilación debe entenderse a partir de las probables presiones de selección evolutiva que la han moldeado. En un modelo, la diversificación puede considerarse puramente como resultado de la funcionalidad endógena (como el tráfico celular). Sin embargo, es más probable que la diversificación esté impulsada por el mecanismo de evasión de la infección por patógenos (por ejemplo, la adhesión de Helicobacter a los residuos sacáridos terminales) y que la diversidad dentro del organismo multicelular se explote de manera endógena.
La glicosilación también puede modular la estabilidad termodinámica y cinética de las proteínas. [9]
Diversidad de glicoproteínas
La glicosilación aumenta la diversidad en el proteoma , porque casi todos los aspectos de la glicosilación se pueden modificar, incluidos:
- Enlace glucosídico : el sitio de unión del glicano
- Composición de glicanos: los tipos de azúcares que están vinculados a una proteína determinada.
- Estructura del glicano: pueden ser cadenas de azúcares ramificadas o no ramificadas.
- Longitud del glicano: pueden ser oligosacáridos de cadena corta o larga.
Mecanismos
Existen varios mecanismos de glicosilación, aunque la mayoría comparte varias características comunes: [2]
- La glicosilación, a diferencia de la glicación , es un proceso enzimático. De hecho, se cree que la glicosilación es la modificación postraduccional más compleja , debido a la gran cantidad de pasos enzimáticos involucrados. [10]
- La molécula donante suele ser un azúcar nucleótido activado .
- El proceso no sigue una plantilla (a diferencia de la transcripción del ADN o la traducción de proteínas ); en cambio, la célula depende de la segregación de enzimas en diferentes compartimentos celulares (por ejemplo, retículo endoplasmático , cisternas en el aparato de Golgi ). Por lo tanto, la glicosilación es una modificación específica del sitio.
Tipos
norte-glicosilación ligada
La N -glicosilación es una forma muy frecuente de glicosilación y es importante para el plegamiento de muchas glicoproteínas eucariotas y para la unión célula-célula y célula- matriz extracelular . El proceso de N -glicosilación ocurre en eucariotas en el lumen del retículo endoplasmático y ampliamente en arqueas , pero muy raramente en bacterias . Además de su función en el plegamiento de proteínas y la unión celular, los glicanos N -ligados de una proteína pueden modular la función de una proteína, en algunos casos actuando como un interruptor de encendido/apagado.
Oh-glicosilación ligada
La glicosilación ligada a O es una forma de glicosilación que ocurre en eucariotas en el aparato de Golgi , [11] pero también ocurre en arqueas y bacterias .
Glicosilación de fosfoserina
En la literatura se han descrito los glicanos de xilosa , fucosa , manosa y fosfoserina GlcNAc . La fucosa y la GlcNAc se han encontrado solo en Dictyostelium discoideum , la manosa en Leishmania mexicana y la xilosa en Trypanosoma cruzi . Recientemente se ha descrito la manosa en un vertebrado, el ratón Mus musculus , en el receptor de laminina de la superficie celular alfa distroglicano 4. Se ha sugerido que este raro hallazgo puede estar relacionado con el hecho de que el alfa distroglicano está altamente conservado desde los vertebrados inferiores hasta los mamíferos. [12]
do-manosilación
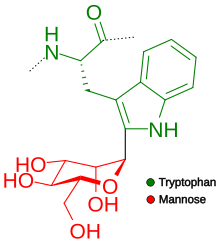
Al primer residuo de triptófano en la secuencia W–X–X–W (W indica triptófano; X es cualquier aminoácido) se le añade un azúcar manosa , formándose un enlace CC entre el primer carbono de la alfa-manosa y el segundo carbono del triptófano. [13] Sin embargo, no todas las secuencias que presentan este patrón están manosiladas. Se ha establecido que, de hecho, sólo dos tercios lo están y que existe una clara preferencia por que el segundo aminoácido sea uno de los polares (Ser, Ala , Gly y Thr) para que se produzca la manosilación. Recientemente se ha producido un gran avance en la técnica de predecir si la secuencia tendrá o no un sitio de manosilación que proporciona una precisión del 93% frente al 67% de precisión si sólo consideramos el motivo WXXW. [14]
Las trombospondinas son una de las proteínas más comúnmente modificadas de esta manera. Sin embargo, existe otro grupo de proteínas que experimentan C -manosilación, los receptores de citocinas tipo I. [ 15 ] La C -manosilación es inusual porque el azúcar está unido a un carbono en lugar de a un átomo reactivo como el nitrógeno o el oxígeno . En 2011, se determinó la primera estructura cristalina de una proteína que contiene este tipo de glicosilación: la del componente 8 del complemento humano. [16] Actualmente se establece que el 18% de las proteínas humanas , secretadas y transmembrana, experimentan el proceso de C-manosilación. [14] Numerosos estudios han demostrado que este proceso juega un papel importante en la secreción de proteínas que contienen trombospondina tipo 1 que se retienen en el retículo endoplásmico si no experimentan C-manosilación [14] Esto explica por qué un tipo de receptores de citocinas , el receptor de eritropoyetina , permaneció en el retículo endoplásmico si carecía de sitios de C-manosilación. [17]
Formación de anclajes GPI (glipiación)
La glicosilación es una forma especial de glicosilación que se caracteriza por la formación de un ancla GPI . En este tipo de glicosilación, una proteína se une a un ancla lipídica a través de una cadena de glicano. (Véase también prenilación ).
Glicosilación química
La glicosilación también se puede efectuar utilizando las herramientas de la química orgánica sintética . A diferencia de los procesos bioquímicos, la glicoquímica sintética depende en gran medida de los grupos protectores [18] (por ejemplo, el 4,6- O -bencilideno) para lograr la regioselectividad deseada. El otro desafío de la glicosilación química es la estereoselectividad, ya que cada enlace glicosídico tiene dos resultados estereoscópicos, α/β o cis / trans . En general, el α- o cis -glicósido es más difícil de sintetizar. [19] Se han desarrollado nuevos métodos basados en la participación de disolventes o la formación de iones de sulfonio bicíclicos como grupos auxiliares quirales. [20]
Glicosilación no enzimática
La glicosilación no enzimática, también conocida como glicación o glucosilación no enzimática, es una reacción espontánea y un tipo de modificación postraduccional de las proteínas, es decir, altera su estructura y actividad biológica. Es la unión covalente entre el grupo carbonilo de un azúcar reductor (principalmente glucosa y fructosa) y la cadena lateral de aminoácidos de la proteína. En este proceso no es necesaria la intervención de una enzima. Se lleva a cabo a través y cerca de los canales de agua y los túbulos protuberantes. [21]
En un primer momento, la reacción forma moléculas temporales que posteriormente sufren diferentes reacciones ( transformaciones de Amadori , reacciones de bases de Schiff , reacciones de Maillard , reticulaciones ...) y forman residuos permanentes conocidos como productos finales de glicación avanzada (AGEs).
Los AGE se acumulan en proteínas extracelulares de larga duración, como el colágeno [22] , que es la proteína más glicosilada y estructuralmente abundante, especialmente en los seres humanos. Además, algunos estudios han demostrado que la lisina puede desencadenar una glicosilación no enzimática espontánea. [23]
Papel de las AGE
Las AGE son responsables de muchas cosas. Estas moléculas juegan un papel importante especialmente en la nutrición, son responsables del color amarronado y de los aromas y sabores de algunos alimentos. Está demostrado que cocinar a altas temperaturas da como resultado varios productos alimenticios con altos niveles de AGE. [24]
Tener niveles elevados de AGEs en el organismo tiene un impacto directo en el desarrollo de muchas enfermedades. Tiene una implicación directa en la diabetes mellitus tipo 2 que puede derivar en muchas complicaciones como: cataratas , insuficiencia renal , daño cardíaco... [25] Y, si están presentes en un nivel disminuido, se reduce la elasticidad de la piel lo que es un síntoma importante del envejecimiento. [22]
También son precursores de muchas hormonas y regulan y modifican sus mecanismos receptores a nivel del ADN . [22]
Desglicosilación
Existen diferentes enzimas para eliminar los glicanos de las proteínas o eliminar alguna parte de la cadena de azúcar .
- α2-3,6,8,9-Neuraminidasa (de Arthrobacter ureafaciens ): escinde todos los ácidos siálicos ramificados y no ramificados terminales no reductores .
- β1,4-Galactosidasa (de Streptococcus pneumoniae ): libera únicamente galactosa terminal no reductora ligada a β1,4 de carbohidratos complejos y glicoproteínas .
- β-N-acetilglucosaminidasa (de Streptococcus pneumoniae): escinde todos los residuos de N-acetilglucosamina con enlaces β terminales no reductores de carbohidratos complejos y glicoproteínas.
- Endo-α-N-acetilgalactosaminidasa ( O -glicosidasa de Streptococcus pneumoniae ): elimina la O -glicosilación. Esta enzima escinde la Galβ1,3GalNAc no sustituida unida a serina o treonina .
- PNGasa F : escinde oligosacáridos unidos a asparagina a menos que estén fucosilados en el núcleo α1,3.
Regulación de la señalización Notch
La señalización Notch es una vía de señalización celular cuya función es, entre muchas otras, controlar el proceso de diferenciación celular en células precursoras equivalentes . [26] Esto significa que es crucial en el desarrollo embrionario, hasta el punto de que se ha probado en ratones que la eliminación de glicanos en las proteínas Notch puede resultar en muerte embrionaria o malformaciones de órganos vitales como el corazón. [27]
Algunos de los moduladores específicos que controlan este proceso son las glicosiltransferasas localizadas en el retículo endoplasmático y el aparato de Golgi . [28] Las proteínas Notch pasan por estos orgánulos en su proceso de maduración y pueden ser objeto de diferentes tipos de glicosilación: glicosilación ligada a N y glicosilación ligada a O (más específicamente: glucosa ligada a O y fucosa ligada a O). [26]
Todas las proteínas Notch son modificadas por una O-fucosa, porque comparten un rasgo común: las secuencias consenso de O-fucosilación . [26] Uno de los moduladores que intervienen en este proceso es Fringe, una glicosiltransferasa que modifica la O-fucosa para activar o desactivar partes de la señalización, actuando como regulador positivo o negativo, respectivamente. [28]
Clínico
Existen tres tipos de trastornos de la glicosilación clasificados según el tipo de alteraciones que se realizan en el proceso de glicosilación: alteraciones congénitas, alteraciones adquiridas y alteraciones adquiridas no enzimáticas.
- Alteraciones congénitas: Se han descrito más de 40 trastornos congénitos de la glicosilación (CGD) en humanos. [29] Estos pueden dividirse en cuatro grupos: trastornos de la N -glicosilación de proteínas , trastornos de la O -glicosilación de proteínas, trastornos de la glicosilación de lípidos y trastornos de otras vías de glicosilación y de múltiples vías de glicosilación. No se conoce ningún tratamiento eficaz para ninguno de estos trastornos. El 80% de ellos afectan al sistema nervioso. [ cita requerida ]
- Alteraciones adquiridas: En este segundo grupo las principales enfermedades son las infecciosas, las enfermedades autoinmunes o el cáncer . En estos casos, las alteraciones en la glicosilación son la causa de determinados eventos biológicos. Por ejemplo, en la Artritis Reumatoide (AR) , el organismo del paciente produce anticuerpos contra la enzima galactosiltransferasa de los linfocitos que inhibe la glicosilación de las IgG. Por tanto, las alteraciones en la N-glicosilación producen la inmunodeficiencia propia de esta enfermedad. En este segundo grupo también podemos encontrar trastornos causados por mutaciones en las enzimas que controlan la glicosilación de las proteínas Notch, como el síndrome de Alagille . [28]
- Alteraciones no enzimáticas adquiridas: Las alteraciones no enzimáticas, también son adquiridas, pero se deben a la falta de enzimas que fijan los oligosacáridos a la proteína. En este grupo destacan la enfermedad de Alzheimer y la diabetes . [30]
Todas estas enfermedades son difíciles de diagnosticar porque no afectan sólo a un órgano, sino a muchos de ellos y de diferentes maneras. Como consecuencia, también son difíciles de tratar. Sin embargo, gracias a los muchos avances que se han hecho en la secuenciación de nueva generación , los científicos ahora pueden comprender mejor estos trastornos y han descubierto nuevos CDG. [31]
Efectos sobre la eficacia terapéutica
Se ha informado que la glicosilación de mamíferos puede mejorar la eficacia terapéutica de los bioterapéuticos . Por ejemplo, la eficacia terapéutica del interferón gamma humano recombinante , expresado en la plataforma HEK 293 , mejoró contra líneas celulares de cáncer de ovario resistentes a fármacos. [32]
Véase también
- Producto final de glicación avanzada : proteínas o lípidos que se vuelven glicosilados como resultado de la exposición a azúcares.Páginas que muestran descripciones breves de los objetivos de redireccionamiento
- Glicosilación química : reacción de un donador y un aceptor de glicosilo
- Fucosilación : La unión covalente de un grupo fucosilo a una molécula aceptora.
- Glicación : unión de un azúcar a una proteína o lípido.
- Glicorandomización : tecnología que permite una rápida diversificación de moléculas
Referencias
- ^ Lima, M.; Baynes, JW (2013). "Glicación". En Lennarz, William J.; Lane, M. Daniel (eds.). Enciclopedia de química biológica (segunda edición). Academic Press. págs. 405–411. doi :10.1016/B978-0-12-378630-2.00120-1. ISBN 9780123786319.
- ^ abcd Varki A, Cummings RD, Esko JD, Freeze HH, Stanley P, Bertozzi CR, Hart GW, Etzler ME (2009). Varki A (ed.). Fundamentos de glicobiología (2ª ed.). Prensa de Cold Spring Harbor Laboratories. ISBN 978-0-87969-770-9. Número de identificación personal 20301239.
- ^ Jung ST, Kang TH, Kelton W, Georgiou G (diciembre de 2011). "Evitar la glicosilación: diseñar anticuerpos IgG de longitud completa aglicosilados para terapia humana". Current Opinion in Biotechnology . 22 (6): 858–67. doi :10.1016/j.copbio.2011.03.002. PMID 21420850.
- ^ "Plantas transgénicas de Nicotiana tabacum L. expresan anticuerpo monoclonal aglicosilado con actividad antitumoral". Biotecnologia Aplicada . 2013.
- ^ Drickamer K, Taylor ME (2006). Introducción a la glicobiología (2.ª ed.). Oxford University Press, EE. UU. ISBN 978-0-19-928278-4.
- ^ ab Dalziel M, Crispin M, Scanlan CN, Zitzmann N, Dwek RA (enero de 2014). "Principios emergentes para la explotación terapéutica de la glicosilación". Science . 343 (6166): 1235681. doi :10.1126/science.1235681. PMID 24385630. S2CID 206548002.
- ^ Crispin M, Harvey DJ, Bitto D, Bonomelli C, Edgeworth M, Scrivens JH, Huiskonen JT, Bowden TA (marzo de 2014). "Plasticidad estructural del glicoma del virus del bosque Semliki tras la transmisión entre especies". Journal of Proteome Research . 13 (3): 1702–12. doi :10.1021/pr401162k. PMC 4428802 . PMID 24467287.
- ^ Crispin M, Doores KJ (abril de 2015). "Dirigir los glicanos derivados del huésped a los virus con envoltura para el diseño de vacunas basadas en anticuerpos". Current Opinion in Virology . Patogénesis viral • Vacunas preventivas y terapéuticas. 11 : 63–9. doi :10.1016/j.coviro.2015.02.002. PMC 4827424 . PMID 25747313.
- ^ Ardejani, Maziar S.; Noodleman, Louis; Powers, Evan T.; Kelly, Jeffery W. (15 de marzo de 2021). "Efectos estereoelectrónicos en la estabilización de las interacciones proteína-N-glicano revelados por experimentos y aprendizaje automático". Nature Chemistry . 13 (5): 480–487. Bibcode :2021NatCh..13..480A. doi :10.1038/s41557-021-00646-w. ISSN 1755-4349. PMC 8102341 . PMID 33723379.
- ^ Walsh C (2006). Modificación postraduccional de proteínas: expansión del inventario de la naturaleza . Roberts and Co. Publishers, Englewood, CO. ISBN 978-0974707730.
- ^ Flynne WG (2008). Biotecnología y bioingeniería. Nova Publishers. pp. 45ff. ISBN 978-1-60456-067-1.
- ^ Yoshida-Moriguchi T, Yu L, Stalnaker SH, Davis S, Kunz S, Madson M, Oldstone MB, Schachter H, Wells L, Campbell KP (enero de 2010). "La fosforilación de O-manosilo de alfa-distroglicano es necesaria para la unión de la laminina". Science . 327 (5961): 88–92. Bibcode :2010Sci...327...88Y. doi :10.1126/science.1180512. PMC 2978000 . PMID 20044576.
- ^ Ihara, Yoshito. "C-Mannosilación: una modificación del triptófano en las proteínas celulares". Glicociencia: Biología y Medicina .
- ^ abc Julenius, Karin (mayo de 2007). "NetCGlyc 1.0: predicción de sitios de C-manosilación en mamíferos, K Julenius (2007)". Glicobiología . 17 (8): 868–876. doi : 10.1093/glycob/cwm050 . PMID 17494086.
- ^ Aleksandra, Shcherbakova (2019). "La C-manosilación favorece el plegamiento y mejora la estabilidad de las repeticiones de trombospondina". eLife . 8 . doi : 10.7554/eLife.52978 . PMC 6954052 . PMID 31868591.
- ^ Lovelace LL, Cooper CL, Sodetz JM, Lebioda L (2011). "La estructura de la proteína C8 humana proporciona información mecanicista sobre la formación de poros de membrana por complemento". J Biol Chem . 286 (20): 17585–17592. doi : 10.1074/jbc.M111.219766 . PMC 3093833 . PMID 21454577.
- ^ Yoshimura (junio de 1992). "Las mutaciones en el motivo Trp-Ser-X-Trp-Ser del receptor de eritropoyetina anulan el procesamiento, la unión del ligando y la activación del receptor". The Journal of Biological Chemistry . 267 (16): 11619–25. doi : 10.1016/S0021-9258(19)49956-0 . PMID 1317872.
- ^ Crich D (agosto de 2010). "Mecanismo de una reacción de glicosilación química". Accounts of Chemical Research . 43 (8): 1144–53. doi :10.1021/ar100035r. PMID 20496888.
- ^ Nigudkar SS, Demchenko AV (mayo de 2015). "La cis-glicosilación como fuerza impulsora del progreso en la química de carbohidratos sintéticos". Chemical Science . 6 (5): 2687–2704. doi :10.1039/c5sc00280j. PMC 4465199 . PMID 26078847.
- ^ Fang T, Gu Y, Huang W, Boons GJ (marzo de 2016). "Mecanismo de glicosilación de iones sulfonio anoméricos". Revista de la Sociedad Química Estadounidense . 138 (9): 3002–11. doi :10.1021/jacs.5b08436. PMC 5078750. PMID 26878147 .
- ^ Henle, Thomas; Duerasch, Anja; Weiz, Alexander; Ruck, Michael; Moeckel, Ulrike (1 de noviembre de 2020). "Reacciones de glicación de micelas de caseína". Revista de química agrícola y alimentaria . 64 (14): 2953–2961. doi :10.1021/acs.jafc.6b00472. PMID 27018258.
- ^ abc Baynes, JW; Lima, M. (2013). Enciclopedia de química biológica . págs. 405–411. ISBN 978-0-12-378631-9.
- ^ Świa̧tecka, D.; Kostyra, H.; Świa̧tecki, A. (2010). "Impacto de las proteínas de guisante glicosiladas en la actividad de bacterias inmovilizadas y de nado libre". J. Sci. Food Agric . 90 (11): 1837–1845. doi :10.1002/jsfa.4022. PMID 20549652.
- ^ Gill, Vidhu; Kumar, Vijay; Singh, Kritanjali; Kumar, Ashok; Kim, Jong-Joo (17 de diciembre de 2019). "Los productos finales de glicación avanzada (AGE) pueden ser un vínculo sorprendente entre la dieta moderna y la salud". Biomolecules . 9 (12): 888. doi : 10.3390/biom9120888 . PMC 6995512 . PMID 31861217.
- ^ Ansari, NA; Rasheed, Z. (marzo de 2010). "НЕФЕРМЕНТАТИВНОЕ ГЛИКИРОВАНИЕ БЕЛКОВ: ОТ ДИАБЕТА ДО РАКА" [Glicación no enzimática de proteínas: de la diabetes a cáncer]. Biomeditsinskaya Khimiya (en ruso). 56 (2): 168-178. doi : 10.18097/pbmc20105602168 . ISSN 2310-6905. PMID 21341505.
- ^ abc Haines, Nicole (octubre de 2003). "La glicosilación regula la señalización de Notch". Nature Reviews. Molecular Cell Biology . 4 (10): 786–797. doi :10.1038/nrm1228. PMID 14570055. S2CID 22917106 . Consultado el 1 de noviembre de 2020 .
- ^ Stanley, Pamela; Okajima, Tetsuya (2010). "Funciones de la glicosilación en la señalización Notch". Temas actuales en biología del desarrollo . 92 : 131–164. doi :10.1016/S0070-2153(10)92004-8. ISBN . 9780123809148. PMID 20816394 . Consultado el 2 de noviembre de 2020 .
- ^ abc Hideyuki, Takeuchi (17 de octubre de 2014). "Importancia de la glicosilación en la señalización Notch". Comunicaciones de investigación bioquímica y biofísica . 453 (2): 235–42. doi :10.1016/j.bbrc.2014.05.115. PMC 4254162. PMID 24909690 .
- ^ Jaeken J (2013). "Trastornos congénitos de la glicosilación". Neurología pediátrica, parte III . Manual de neurología clínica. Vol. 113. págs. 1737–43. doi :10.1016/B978-0-444-59565-2.00044-7. ISBN 9780444595652. Número de identificación personal 23622397.
- ^ Jiménez Martínez, María del Carmen (enero-marzo de 2002). "Alteraciones de la glicosilación en enfermedades humanas". Rev Inst Nal Enf Resp Mex . 15 : 39–47 . Consultado el 2 de noviembre de 2020 .
- ^ S. Kane, Megan (4 de febrero de 2016). "Recombinación intragénica mitótica: un mecanismo de supervivencia para varios trastornos congénitos de la glicosilación". The American Journal of Human Genetics . 98 (2): 339–46. doi :10.1016/j.ajhg.2015.12.007. PMC 4746335 . PMID 26805780.
- ^ Razaghi A, Villacrés C, Jung V, Mashkour N, Butler M, Owens L, Heimann K (octubre de 2017). "Mejora de la eficacia terapéutica del interferón gamma recombinante expresado en mamíferos contra células de cáncer de ovario". Experimental Cell Research . 359 (1): 20–29. doi :10.1016/j.yexcr.2017.08.014. PMID 28803068. S2CID 12800448.
Enlaces externos
- GlycoEP Chauhan JS, Rao A, Raghava GP (2013). "Plataforma in silico para la predicción de N-, O- y C-glicositios en secuencias de proteínas eucariotas". PLOS ONE . 8 (6): e67008. Bibcode :2013PLoSO...867008C. doi : 10.1371/journal.pone.0067008 . PMC 3695939 . PMID 23840574.
- Varki A, Cummings R, Esko J, Freeze H, Hart G, Marth J, eds. (1999). Fundamentos de glicobiología. Cold Spring Harbor Laboratory Press. ISBN 0-87969-559-5.NBK20709.
- GlyProt: N-glicosilación in silico de proteínas en la web [ enlace muerto permanente ]
- NetNGlyc: El servidor NetNglyc predice sitios de N-glicosilación en proteínas humanas utilizando redes neuronales artificiales que examinan el contexto de secuencia de los sequones Asn-Xaa-Ser/Thr.
- Material complementario del libro “El Código del Azúcar”
- Información adicional sobre glicosilación y figuras
- Emanual Maverakis; et al. (2015). "Glicanos en el sistema inmunológico y la teoría de los glicanos alterados de la autoinmunidad". Journal of Autoimmunity . 57 : 1–13. doi :10.1016/j.jaut.2014.12.002. PMC 4340844 . PMID 25578468.