Modulador selectivo del receptor de progesterona
| Modulador selectivo del receptor de progesterona | |
|---|---|
| Clase de droga | |
 Acetato de ulipristal , un SPRM que se utiliza como anticonceptivo de emergencia y en el tratamiento de los fibromas uterinos . | |
| Identificadores de clase | |
| Sinónimos | SPRMR-ES |
| Usar | Anticoncepción de emergencia , fibromas uterinos |
| Código ATC | G03XB |
| Objetivo biológico | Receptor de progesterona |
| Clase química | Esteroides |
| Estatus legal | |
| En Wikidata | |
Un modulador selectivo del receptor de progesterona ( SPRM ) es un agente que actúa sobre el receptor de progesterona (PR), el objetivo biológico de los progestágenos como la progesterona . Una característica que distingue a estas sustancias de los agonistas completos del receptor (p. ej., progesterona, progestinas ) y antagonistas completos (p. ej., aglepristona ) es que su acción difiere en diferentes tejidos , es decir, agonista en algunos tejidos mientras que antagonista en otros. Este perfil mixto de acción conduce a la estimulación o inhibición de manera específica del tejido, lo que aumenta aún más la posibilidad de disociar los efectos adversos indeseables del desarrollo de candidatos a fármacos moduladores sintéticos del PR . [1]
Historia
Desde el descubrimiento de la hormona progesterona a mediados de la década de 1930. [2] [3] y especialmente después del descubrimiento de su receptor en 1970 [4] [5] ha habido un interés significativo en el desarrollo de un agente antagonista para uso terapéutico. Se sintetizaron varios análogos de progesterona , conocidos como progestinas , y en 1981 se introdujo el primer antagonista del receptor de progesterona con el nombre de RU 38486 (RU 486, mifepristona ). [6] [7] Sin embargo, la limitación clínica de la mifepristona debido a su afinidad de unión relativamente alta para el receptor de glucocorticoides en comparación con el receptor de progesterona ha provocado la demanda de antagonistas de progesterona más selectivos para minimizar el riesgo de efectos adversos. [7] [8] [9] Como contribución, se han desarrollado los llamados moduladores selectivos del receptor de progesterona (SPRM). Se han descrito como agentes con efectos antagonistas y agonistas mixtos sobre los receptores de progesterona de una manera específica de tejido, mientras que minimizan las interacciones con otros receptores esteroides . [10] [11] A diferencia de los antagonistas de la progesterona, los SPRM agonistas-antagonistas mixtos, debido a su actividad agonista intrínseca de la progesterona, tienen un efecto nulo o mínimo sobre la interrupción del embarazo y, por lo tanto, son ideales para tratar afecciones ginecológicas sin eliminar el potencial de embarazo. [12] Se han descrito SPRM esteroides [13] y no esteroides [14] y los ejemplos más notables son el asoprisnil [15] , que fracasó en el ensayo clínico de fase 3 en 2008, [16] y el acetato de ulipristal [17] , el primer SPRM en el mercado (2009 en Europa [18] ).
Receptor de progesterona
Receptor
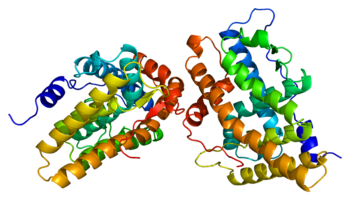
Como proteína , el receptor de progesterona (Fig. 1) es un miembro de la familia de receptores hormonales nucleares dependientes de ligando . [19] Se han identificado dos isoformas principales del receptor de progesterona , A y B, así como algunas otras variantes de empalme menos comunes y todas están codificadas por el mismo gen de 8 exones . [20] [21] [22] [23] Al igual que otros receptores nucleares de esteroides , la proteína de longitud completa, isoforma B, se puede dividir en 4 regiones funcionales, a saber, una región N-terminal variable seguida de un dominio de unión al ADN altamente conservado , una región bisagra variable y un dominio de unión al ligando moderadamente conservado. [20] [21] El sitio de unión del ligando, conocido como dominio AF2 , se expresa por los exones 4-8, correspondientes a 253 aminoácidos , y su estructura es de gran interés para el desarrollo de SPRM. [24] Consiste en 10 hélices α (H1, H3-H12) que forman un haz de 3 capas entrelazadas con 4 láminas β . H12 es una unidad contigua condensada compuesta por las hélices 10 y 11, que se ha sugerido que participa en el proceso de unión del coactivador . [25] El dominio de unión del ligando del receptor está en equilibrio entre dos conformaciones diferentes. La primera es una conformación agonista que favorece la unión de proteínas coactivadoras que a su vez favorece la regulación positiva de la transcripción genética. [25] La segunda es una conformación antagonista que, en contraste, favorece la unión de correpresores y, como consecuencia, la regulación negativa de la expresión genética. Los agonistas completos como la progesterona, que muestran propiedades agonistas en todos los tejidos, cambian fuertemente el equilibrio conformacional en la dirección del agonista. [25] Por el contrario, los antagonistas completos como la aglepristona cambian fuertemente el equilibrio en la dirección del antagonista. Por último, la relación global de concentraciones de coactivador y correpresor puede diferir en diferentes tipos de células. [25]
Receptor acoplado a proteína G
A principios del milenio se hizo evidente que la actividad de la progesterona no estaba mediada únicamente por un factor de transcripción, sino también por un receptor acoplado a la proteína G unido a la membrana, denominado 7TMPR . Cuando el receptor se activa, bloquea la adenilato ciclasa , lo que conduce a una disminución de la biosíntesis del segundo mensajero intracelular cAMP . [24]
Mecanismos posteriores
Desde la década de 1990 ha sido evidente que los dos principales isómeros del receptor, A y B, son funcionalmente distintos dentro del sistema reproductor femenino . Las investigaciones dirigidas al perfil de expresión de los isómeros sugieren que los isómeros se expresan en diferentes tejidos en diferentes momentos a lo largo del ciclo menstrual . [12] Se ha descubierto que el PR-B se regula positivamente en el estroma y el epitelio glandular durante la fase folicular , pero se regula negativamente en ambos tejidos durante la fase lútea . Por el contrario, el PR-A se regula positivamente en ambos tipos de tejido en la fase folicular y persiste en el tejido del estroma durante la fase lútea tardía. [12] Los estudios han demostrado que la activación del PR-B es importante para el crecimiento y desarrollo de la glándula mamaria , mientras que el PR-A tiene un papel significativo en la función reproductiva normal y la ovulación . Además, las investigaciones in vitro han demostrado que, en condiciones idénticas, el PR-B funciona como un transactivador más fuerte de los genes reporteros , mientras que el PR-A es capaz de transreprimir el PR-B y otros receptores de esteroides. [24] Se han encontrado varias razones para esta variedad de funciones entre las isoformas. [26] En primer lugar, hay que mencionar que la isoforma A del receptor de progesterona carece de 164 aminoácidos N-terminales en comparación con el isómero B, lo que lo priva de la función de activación de AF-3 debido a la pérdida del segmento B-upstream, lo que lo deja con solo 2 funciones de activación. [27] Además, los estudios del mecanismo han demostrado una diferencia en el reclutamiento de cofactores entre las isoformas. Debido a estas diferencias funcionales, se puede ver por qué existe un interés en desarrollar un fármaco que pueda dirigirse selectivamente a las isoformas del receptor. El desarrollo de SPRM, en algunos casos, se ha centrado en dirigirse a estas dos isoformas diferentes. [24] [26] [27]
Interacción de SPRM con los bolsillos de unión del receptor
Se ha descrito que ciertas interacciones entre el ligando y el receptor de progesterona son importantes para la unión del ligando (Fig. 2). Los estudios de cristalografía de la progesterona unida a su receptor han revelado una importante interacción de enlace de hidrógeno entre el grupo 3- ceto aceptor de electrones de la progesterona y los residuos Gln 725 de la hélice-3 y Arg 766 de la hélice-5, que se mantienen en posición mediante una molécula de agua estructural. [26] Se ha demostrado que esta interacción está presente en la interacción con varios otros ligandos, por ejemplo, mifepristona, tanaproget y asoprisnil y, por lo tanto, puede considerarse una interacción vital para la función de los agonistas y antagonistas. [28] Además, se ha descubierto que la progesterona y el tanaproget forman un enlace de hidrógeno con Asn 719 en la hélice-3, lo que da la oportunidad de una mayor selectividad y afinidad; sin embargo, se ha descubierto que el SPRM asoprisnil no interactúa con este residuo. [26] Aunque el residuo polar Thr 894 está muy próximo al grupo carbonilo C 20 de la progesterona, no se forma ningún enlace de hidrógeno entre estos grupos químicos. Es importante señalar que se ha descubierto que Thr 894 interactúa con otros ligandos. [26] [28]
Varios estudios han descrito la presencia de un bolsillo hidrofóbico , denominado bolsillo 17α, que consta de Leu 715 , Leu 718 , Phe 794 , Leu 797 , Met 801 y Tyr 890 y parece proporcionar espacio adicional para la expansión del ligando independientemente del agonismo o antagonismo. El bolsillo 17α, junto con Met 756 y Met 759 dentro de la hélice-5, así como Met 909 , muestran una sorprendente flexibilidad en la acomodación de varios ligandos, lo que hace que el receptor de progesterona sea muy adaptable cuando se trata de unión. [26] Los estudios que comparan los cambios conformacionales en la hélice-12 que contribuyen a los efectos agonistas y antagonistas han demostrado una importante interacción de hidrógeno con el residuo Glu 723 de la hélice-3. En estado inactivo , el Glu 723 estabiliza la conformación de la hélice-12 formando un enlace de hidrógeno con las aminas de la cadena principal en Met 908 y Met 909. [26] [28] Cuando un ligando lleva a cabo un efecto agonista, como el grupo oxima de asoprisnil que interactúa con el bolsillo de unión del agonista, entonces la interacción del enlace de hidrógeno entre los residuos mencionados anteriormente en la hélice-12 y la hélice-3 se fortalece, lo que lleva al acoplamiento y reclutamiento de coactivadores. Sin embargo, cuando un antagonista, por ejemplo, mifepristona, interactúa con este sistema de enlace de hidrógeno, entonces su grupo dimetilamina choca con Met 909 y desestabiliza la hélice-12, causando un cambio conformacional, que promueve el reclutamiento de correpresores. [26] [28]

Mecanismo de acción
Cuando los SPRM se unen al receptor de progesterona, el equilibrio entre los dos estados conformacionales está más equilibrado y, por lo tanto, se altera más fácilmente por las diferencias en el entorno celular. En los tejidos donde la concentración de coactivadores es mayor que la de correpresores, el exceso de coactivadores impulsa el equilibrio en la dirección agonista. Por el contrario, en los tejidos donde la concentración de correpresores es mayor, el equilibrio se impulsa en la dirección antagonista. [29] [30] Por lo tanto, los SPRM muestran actividad agonista en los tejidos donde predominan los coactivadores y actividad antagonista donde los correpresores están en exceso.
Cuando está inactivo, el receptor de progesterona, como otros receptores de esteroides, forma un complejo que consiste en sí mismo, proteínas de choque térmico (hsp70, hsp90) e inmunofilinas . [31] [32] Tras la activación, debido a la unión de la hormona al bolsillo de unión del ligando, se ha demostrado que el complejo del receptor se disocia, desencadenando la importación nuclear y dando al receptor la propiedad de dimerización (Fig. 3). En el núcleo, el dímero interactúa con el elemento de respuesta a la hormona progesterona en el ADN causando la regulación positiva o negativa del gen. [33] [34] [35] [36] Varios estudios han demostrado que afecta la expresión de hasta 100 genes diferentes, dependiendo del isómero del receptor. [26] En la acción del agonismo ocurren cambios conformacionales, donde las hélices alfa 3, 4 y 12 crean una superficie de acoplamiento para las proteínas coactivadoras, que actúan como factores de puente entre el receptor y la maquinaria de transcripción general. [37] [38] Sin embargo, el antagonista impide el empaquetamiento adecuado de la hélice alfa 12 contra las hélices 3 y 4, lo que perjudica la capacidad del receptor para interactuar con coactivadores, lo que permite el reclutamiento de correpresores , como SMRT y NCoR . [39] Debido al reclutamiento mínimo de correpresores durante la unión del agonista, Liu et al. (2002) postularon que la relación entre el reclutamiento de coactivadores y correpresores podría ser el determinante de si el compuesto se considera un agonista, antagonista o una combinación de agonista y antagonista. [40] Los moduladores selectivos del receptor de progesterona se han descrito como agentes con actividad agonista y antagonista mixta y, por lo tanto, el mecanismo de acción debe deberse a un equilibrio de estas funciones.
Relaciones estructura-actividad
SPRM esteroides
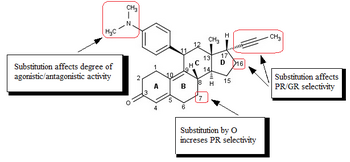
La investigación sobre análogos de mifepristona , principalmente enfocada en la mejora de la relación de actividad antiprogestacional/antiglucocorticoide, [1] [41] condujo al descubrimiento de los SPRM. [42] Las modificaciones de o cerca del grupo propinilo 17-alfa (Fig. 4) en el anillo D juegan un papel clave en la unión al receptor de progesterona y/o receptor de glucocorticoides. [41] [42] [43] Cambios menores en la región 17-alfa generan antiprogestinas con actividad antiglucocorticoide reducida, donde alfa se refiere a un estereodescriptor esteroide absoluto. [41] [42] [43] [44] [45] [46] Parece que los sustituyentes hidrofóbicos 17-alfa como 17-alfa etilo y 17-alfa (1'-pentinilo) dan lugar a una actividad antiprogestacional superior a la de la mifepristona. [43] También se descubrió que la sustitución en la posición 17-alfa que involucra al grupo fenilo con sustituyentes pequeños que atraen electrones, como F y CF 3 , en la posición para , aumentaba en gran medida la selectividad sobre el receptor de glucocorticoides, así como la potencia de los compuestos resultantes. La misma sustitución en la posición orto o meta condujo a una disminución de la selectividad. Los sustituyentes voluminosos, como el terc -butilo, en esta región disminuyen la potencia de la progesterona. [45]
Los datos biológicos y de rayos X disponibles sugieren que la sustitución del grupo 4-(dimetilamino) fenilo en la posición C11 (Fig. 4) determina el grado de actividad agonista y antagonista. [41] [42] Pequeños sustituyentes como metilo o vinilo dan lugar a potentes propiedades agonistas del receptor de progesterona [42] mientras que los derivados de fenilo sustituidos muestran diferentes grados de actividad antagonista. [42] [43] [44] Hay una indicación, cuando se sustituye por varios heterociclos de nitrógeno , de que los más agonistas son compuestos con un máximo claro en el potencial eléctrico negativo en la región de los átomos meta y para del anillo arilo [47] mientras que los compuestos que carecen de un centro de electronegatividad en esta región tienen la actividad antagonista más alta. [26] [47]
La modificación de la estructura esteroidea central afecta el modo de unión al receptor de progesterona. [45] [48] Se ha investigado la sustitución de C7 (Fig. 4) por un átomo de oxígeno y estos oxasteroides similares a la mifepristona mostraron una mayor selectividad sobre el receptor de glucocorticoides, pero fueron menos potentes que la mifepristona. [45] [49]
SPRM no esteroides
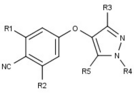
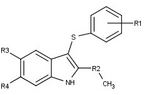
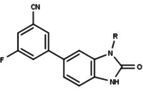
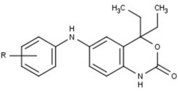
Los moduladores del receptor de progesterona con estructuras no esteroideas únicas se encuentran actualmente en las primeras etapas de desarrollo (Fig. 5-12). Se ha informado de una variedad de nuevos tipos de antagonistas del receptor de progesterona con diferentes grados de potencia y muestran una notable diversidad estructural que se puede ver en la tabla siguiente. También se han identificado varios compuestos líderes como nuevos agonistas del receptor de progesterona. También se pueden ver en la tabla. [26]
Drogas
Los miembros incluyen:
- Acetato de ulipristal ("Ella")
- Asoprisnil (J867; estado incierto)
- Telapristona (CDB-4124; Proellex, Progenta; en desarrollo)
Se han sugerido múltiples aplicaciones ginecológicas de los SPRM, como la anticoncepción y la anticoncepción de emergencia, el tratamiento de la endometriosis , el leiomioma uterino y como terapia de reemplazo hormonal en mujeres posmenopáusicas. [50] La actividad de los SPRM está mediada principalmente por el receptor de progesterona, donde el endometrio es el principal tejido diana. A diferencia de los antagonistas de la progesterona convencionales, los SPRM eliminan la capacidad de interrumpir el embarazo debido a su perfil mixto antagonista/agonista. Dado que los SPRM tienen una baja afinidad por el receptor de estrógeno, no se cree que induzcan pérdida ósea asociada a la posmenopausia. [12] El uso de SPRM se ha asociado con metaplasia endometrial , lo que exige la necesidad de una evaluación de seguridad a largo plazo. [12]
| Compuesto | Estructura química |
|---|---|
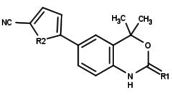
| Acetato de ulipristal |  |
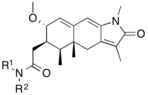
| Asoprisnil | 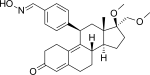 |
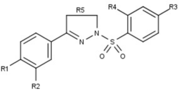
| Telapristona |  |
Acetato de ulipristal
El acetato de ulipristal (también conocido como CDB-2914) [51] (Fig. 13) es un SPRM sustituido con 11-β arilo que ha estado disponible como anticonceptivo de emergencia en Europa desde 2009 y fue aprobado por la FDA en 2010. [52] También se comercializa como tratamiento para el leiomioma uterino en América del Norte y Europa. Como anticonceptivo de emergencia, el acetato de ulipristal ha demostrado ser potente hasta 120 horas después de una relación sexual sin protección, en comparación con la potencia de 72 horas de los anticonceptivos de emergencia actuales. [50] En el endometrio posmenopáusico, el compuesto parece tener un efecto antagónico sobre el receptor de progesterona, lo que indica un uso potencial en el tratamiento de la menopausia, pero esto aún debe confirmarse. [12]
Asoprisnil
El asoprisnil (J867) es un SPRM esteroide sustituido con 11β-benzaldoxima (Fig. 14). [15] Se sugiere que la geometría de su grupo oxima desempeña un papel importante en la potencia in vitro . [26] Se ha sugerido como tratamiento para el leiomioma y la endometriosis [53] y es el primer SPRM en el desarrollo clínico del tratamiento de la endometriosis que alcanza una fase avanzada. [54]
Telapristona
La telapristona (CDB-4124), también conocida como Proellex (Fig. 15), entró en un ensayo clínico de fase II para el tratamiento de los fibromas uterinos en 2014 [55] y tiene un ensayo clínico de fase II planificado para el alivio de los síntomas de la endometriosis a principios de 2016. [56] [57] También se ha sugerido que tiene efectos quimiopreventivos. [58]
Usos
Se están desarrollando SPRM para los siguientes usos:
- Tanto el asoprisnil como la telapristona están bajo investigación (2005) para el tratamiento médico del leiomioma uterino . [59] [60]
- Proellex ha completado una serie de ensayos clínicos para tratar la endometriosis y los fibromas uterinos. [61]
Si bien estos SPRM han sido eficaces para el tratamiento de los fibromas uterinos, el desarrollo de efectos secundarios como el engrosamiento del endometrio ha limitado su administración a no más de tres a cuatro meses. [60]
Futuro
Debido a su actividad antiglucocorticoide, la mifepristona se investiga por su potencial terapéutico en indicaciones como el síndrome de Cushing , la enfermedad de Alzheimer o la psicosis . Además, se están desarrollando SPRM para diversas aplicaciones ginecológicas, incluida la anticoncepción sin estrógenos, el leiomioma uterino y la endometriosis. [62]
Véase también
- Fitoprogestágeno
- Modulador selectivo del receptor de andrógenos
- Modulador selectivo del receptor de estrógeno
- Agonista selectivo del receptor de glucocorticoides
- Modulador selectivo del receptor
Referencias
- ^ ab Chwalisz K, Perez MC, Demanno D, Winkel C, Schubert G, Elger W (mayo de 2005). "Desarrollo y uso de moduladores selectivos del receptor de progesterona en el tratamiento de leiomiomas y endometriosis". Endocrine Reviews . 26 (3): 423–38. doi : 10.1210/er.2005-0001 . PMID 15857972.
- ^ Misrahi M, Loosfelt H, Atger M, Mériel C, Zerah V, Dessen P, Milgrom E (junio de 1988). "Organización de todo el ARNm del receptor de progesterona de conejo y del promotor y la región flanqueante 5' del gen". Nucleic Acids Research . 16 (12): 5459–72. doi :10.1093/nar/16.12.5459. PMC 336778 . PMID 3387238.
- ^ Allen WM (agosto de 1935). "El aislamiento de la progestina cristalina". Science . 82 (2118): 89–93. Bibcode :1935Sci....82...89A. doi :10.1126/science.82.2118.89. PMID 17747122.
- ^ Karrer P, Schwarzenbach G (enero de 1934). "Nachtrag betreffend Acidität und Reduktions-Vermögen der Ascorbinsäure". Helvetica Chimica Acta . 17 (1): 58–59. doi :10.1002/hlca.19340170111. ISSN 1522-2675.
- ^ Sherman MR, Corvol PL, O'Malley BW (noviembre de 1970). "Componentes de unión a progesterona del oviducto del pollo. I. Caracterización preliminar de los componentes citoplasmáticos". The Journal of Biological Chemistry . 245 (22): 6085–96. doi : 10.1016/S0021-9258(18)62667-5 . PMID 5484467.
- ^ Philibert D, Deraedt R, Deutsch G (1981). RU 38486: un potente antiglucocorticoide in vivo . VII Congreso Internacional de Farmacología. Japón: Tokio.
- ^ ab Groyer A, Le Bouc Y, Joab I, Radanyi C, Renoir JM, Robel P, Baulieu EE (junio de 1985). "Receptor de glucocorticosteroides del oviducto de pollo. Unión específica del esteroide sintético RU 486 y estudios inmunológicos con anticuerpos contra el receptor de progesterona del oviducto de pollo". Revista Europea de Bioquímica . 149 (2): 445–51. doi : 10.1111/j.1432-1033.1985.tb08945.x . PMID 3996417.
- ^ Gass EK, Leonhardt SA, Nordeen SK, Edwards DP (abril de 1998). "Los antagonistas RU486 y ZK98299 estimulan la unión del receptor de progesterona al ácido desoxirribonucleico in vitro e in vivo, pero tienen efectos distintos en la conformación del receptor". Endocrinología . 139 (4): 1905–19. doi : 10.1210/endo.139.4.5944 . PMID 9528977.
- ^ Lázár G, Lázár G, Husztik E, Duda E, Agarwal MK (junio de 1995). "La influencia de los antiglucocorticoides sobre el estrés y el shock". Anales de la Academia de Ciencias de Nueva York . 761 (1): 276–95. Código bibliográfico : 1995NYASA.761..276L. doi :10.1111/j.1749-6632.1995.tb31384.x. PMID 7625726. S2CID 40422188.
- ^ Spitz IM, Chwalisz K (agosto de 2010). "Moduladores del receptor de progesterona y antagonistas de la progesterona en la salud de la mujer". Esteroides . 65 (10–11): 807–15. doi :10.1016/S0039-128X(00)00194-X. PMID 11108892. S2CID 27699000.
- ^ Chen W, Ohara N, Wang J, Xu Q, Liu J, Morikawa A, Sasaki H, Yoshida S, Demanno DA, Chwalisz K, Maruo T (abril de 2006). "Un nuevo modulador selectivo del receptor de progesterona, asoprisnil (J867), inhibe la proliferación e induce la apoptosis en células de leiomioma uterino humano cultivadas en ausencia de efectos comparables en las células del miometrio". The Journal of Clinical Endocrinology and Metabolism . 91 (4): 1296–304. doi : 10.1210/jc.2005-2379 . PMID 16464945.
- ^ abcdef Chabbert-Buffet N, Meduri G, Bouchard P, Spitz IM (2005). "Moduladores selectivos del receptor de progesterona y antagonistas de la progesterona: mecanismos de acción y aplicaciones clínicas". Human Reproduction Update . 11 (3): 293–307. doi :10.1093/humupd/dmi002. PMID 15790602.
- ^ Elger W, Bartley J, Schneider B, Kaufmann G, Schubert G, Chwalisz K (1 de octubre de 2000). "Caracterización farmacológica endocrina de antagonistas de progesterona y moduladores del receptor de progesterona con respecto a la actividad agonista y antagonista de PR". Esteroides . 65 (10–11): 713–23. doi :10.1016/S0039-128X(00)00178-1. PMID 11108882. S2CID 46138800.
- ^ Palmer S, Campen CA, Allan GF, Rybczynski P, Haynes-Johnson D, Hutchins A, Kraft P, Kiddoe M, Lai M, Lombardi E, Pedersen P, Hodgen G, Combs DW (diciembre de 2000). "Ligandos del receptor de progesterona no esteroide con selectividad de receptor sin precedentes". Revista de bioquímica y biología molecular de esteroides . 75 (1): 33–42. doi :10.1016/S0960-0760(00)00134-5. PMID 11179906. S2CID 19167595.
- ^ ab DeManno D, Elger W, Garg R, Lee R, Schneider B, Hess-Stumpp H, Schubert G, Chwalisz K (noviembre de 2003). "Asoprisnil (J867): un modulador selectivo del receptor de progesterona para la terapia ginecológica". Esteroides . 68 (10–13): 1019–32. doi :10.1016/j.steroids.2003.09.008. PMID 14667995. S2CID 23074350.
- ^ "Seguridad del tratamiento de los fibromas uterinos con asoprisnil - Ver texto completo - ClinicalTrials.gov". clinicaltrials.gov . Consultado el 11 de enero de 2016 .
- ^ Donnez J, Vázquez F, Tomaszewski J, Nouri K, Bouchard P, Fauser BC, Barlow DH, Palacios S, Donnez O, Bestel E, Osterloh I, Loumaye E (junio de 2014). "Tratamiento a largo plazo de los miomas uterinos con acetato de ulipristal". Fertilidad y esterilidad . 101 (6): 1565–73.e1–18. doi : 10.1016/j.fertnstert.2014.02.008 . PMID 24630081.
- ^ "Informe de evaluación de Ellaone" (PDF) . Agencia Europea de Medicamentos. 2009. Consultado el 4 de abril de 2022 .
- ^ Mangelsdorf DJ, Thummel C, Beato M, Herrlich P, Schütz G, Umesono K, Blumberg B, Kastner P, Mark M, Chambon P, Evans RM (diciembre de 1995). "La superfamilia de receptores nucleares: la segunda década". Cell . 83 (6): 835–9. doi :10.1016/0092-8674(95)90199-X. PMC 6159888 . PMID 8521507.
- ^ ab Conneely OM, Maxwell BL, Toft DO, Schrader WT, O'Malley BW (diciembre de 1987). "Las formas A y B del receptor de progesterona de pollo surgen por iniciación alternada de la traducción de un ARNm único". Comunicaciones de investigación bioquímica y biofísica . 149 (2): 493–501. doi :10.1016/0006-291X(87)90395-0. PMID 3426587.
- ^ ab Kastner P, Krust A, Turcotte B, Stropp U, Tora L, Gronemeyer H, Chambon P (mayo de 1990). "Dos promotores distintos regulados por estrógeno generan transcripciones que codifican las dos formas A y B del receptor de progesterona humano funcionalmente diferentes". The EMBO Journal . 9 (5): 1603–14. doi :10.1002/j.1460-2075.1990.tb08280.x. PMC 551856 . PMID 2328727.
- ^ Hirata S, Shoda T, Kato J, Hoshi K (diciembre de 2002). "Nuevas isoformas del ARNm de los receptores de hormonas sexuales esteroides femeninas humanas". The Journal of Steroid Biochemistry and Molecular Biology . 83 (1–5): 25–30. doi :10.1016/S0960-0760(02)00255-8. PMID 12650698. S2CID 23588169.
- ^ Hirata S, Shoda T, Kato J, Hoshi K (abril de 2003). "Isoformas/variantes de ARNm para receptores de hormonas sexuales esteroides en humanos". Tendencias en endocrinología y metabolismo . 14 (3): 124–9. doi :10.1016/S1043-2760(03)00028-6. PMID 12670738. S2CID 46220794.
- ^ abcd Brinton RD, Thompson RF, Foy MR, Baudry M, Wang J, Finch CE, Morgan TE, Pike CJ, Mack WJ, Stanczyk FZ, Nilsen J (mayo de 2008). "Receptores de progesterona: forma y función en el cerebro". Frontiers in Neuroendocrinology . 29 (2): 313–39. doi :10.1016/j.yfrne.2008.02.001. PMC 2398769 . PMID 18374402.
- ^ abcd Ellmann S, Sticht H, Thiel F, Beckmann MW, Strick R, Strissel PL (agosto de 2009). "Receptores de estrógeno y progesterona: de estructuras moleculares a objetivos clínicos". Ciencias de la vida celular y molecular . 66 (15): 2405–26. doi :10.1007/s00018-009-0017-3. PMC 11115849 . PMID 19333551. S2CID 19975774.
- ^ abcdefghijkl Winneker RC, Fensome A, Zhang P, Yudt MR, McComas CC, Unwalla RJ (agosto de 2008). "Una nueva generación de moduladores del receptor de progesterona". Esteroides . 73 (7): 689–701. doi :10.1016/j.steroids.2008.03.005. PMID 18472121. S2CID 25094160.
- ^ ab Edwards DP, Altmann M, DeMarzo A, Zhang Y, Weigel NL, Beck CA (junio de 1995). "Receptor de progesterona y mecanismo de acción de los antagonistas de la progesterona". Revista de bioquímica de esteroides y biología molecular . 53 (1–6): 449–58. doi :10.1016/0960-0760(95)00091-d. PMID 7626494. S2CID 41957428.
- ^ abcd Lusher SJ, Raaijmakers HC, Vu-Pham D, Kazemier B, Bosch R, McGuire R, Azevedo R, Hamersma H, Dechering K, Oubrie A, van Duin M, de Vlieg J (junio de 2012). "Las estructuras de rayos X del dominio de unión del ligando del receptor de progesterona en su estado agonista revelan diferentes mecanismos para perfiles mixtos de esteroides 11β-sustituidos". The Journal of Biological Chemistry . 287 (24): 20333–43. doi : 10.1074/jbc.M111.308403 . PMC 3370215 . PMID 22535964.
- ^ Jackson TA, Richer JK, Bain DL, Takimoto GS, Tung L, Horwitz KB (junio de 1997). "La actividad agonista parcial de los receptores de esteroides ocupados por antagonistas está controlada por un nuevo coactivador de unión al dominio bisagra L7/SPA y los correpresores N-CoR o SMRT". Endocrinología molecular . 11 (6): 693–705. doi :10.1210/mend.11.6.0004. PMID 9171233. S2CID 21356045.
- ^ Smith CL, O'Malley BW (febrero de 2004). "Función correguladora: una clave para comprender la especificidad tisular de los moduladores selectivos de receptores". Endocrine Reviews . 25 (1): 45–71. doi : 10.1210/er.2003-0023 . PMID 14769827.
- ^ Oñate SA, Estes PA, Welch WJ, Nordeen SK, Edwards DP (diciembre de 1991). "Evidencia de que la proteína de choque térmico-70 asociada con los receptores de progesterona no está involucrada en la unión del receptor al ADN". Endocrinología molecular . 5 (12): 1993–2004. doi : 10.1210/mend-5-12-1993 . PMID 1791844.
- ^ Smith DF, Stensgard BA, Welch WJ, Toft DO (enero de 1992). "El ensamblaje del receptor de progesterona con proteínas de choque térmico y la activación del receptor son eventos mediados por ATP". The Journal of Biological Chemistry . 267 (2): 1350–6. doi : 10.1016/S0021-9258(18)48438-4 . PMID 1730655.
- ^ DeMarzo AM, Beck CA, Onate SA, Edwards DP (enero de 1991). "La dimerización de los receptores de progesterona en mamíferos ocurre en ausencia de ADN y está relacionada con la liberación de la proteína de choque térmico de 90 kDa". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 88 (1): 72–6. Bibcode :1991PNAS...88...72D. doi : 10.1073/pnas.88.1.72 . PMC 50750 . PMID 1986383.
- ^ Guiochon-Mantel A, Loosfelt H, Lescop P, Sar S, Atger M, Perrot-Applanat M, Milgrom E (junio de 1989). "Mecanismos de localización nuclear del receptor de progesterona: evidencia de interacción entre monómeros". Cell . 57 (7): 1147–54. doi : 10.1016/0092-8674(89)90052-4 . PMID 2736623.
- ^ O'Malley BW, Tsai MJ (febrero de 1992). "Vías moleculares de la acción del receptor de esteroides". Biología de la reproducción . 46 (2): 163–7. doi : 10.1095/biolreprod46.2.163 . PMID 1536890.
- ^ Bagchi MK, Tsai MJ, O'Malley BW, Tsai SY (agosto de 1992). "Análisis del mecanismo de activación génica dependiente del receptor de hormonas esteroides en sistemas libres de células". Endocrine Reviews . 13 (3): 525–35. doi :10.1210/edrv-13-3-525. PMID 1425487.
- ^ McKenna NJ, O'Malley BW (febrero de 2002). "Control combinatorio de la expresión génica por receptores nucleares y correguladores". Cell . 108 (4): 465–74. doi : 10.1016/S0092-8674(02)00641-4 . PMID 11909518.
- ^ Oñate SA, Tsai SY, Tsai MJ, O'Malley BW (noviembre de 1995). "Secuencia y caracterización de un coactivador para la superfamilia de receptores de hormonas esteroides". Science . 270 (5240): 1354–7. Bibcode :1995Sci...270.1354O. doi :10.1126/science.270.5240.1354. PMID 7481822. S2CID 28749162.
- ^ Wagner BL, Norris JD, Knotts TA, Weigel NL, McDonnell DP (marzo de 1998). "Los correpresores nucleares NCoR y SMRT son reguladores clave de la actividad transcripcional dependiente del ligando y del AMP 8-bromocíclico del receptor de progesterona humano". Biología molecular y celular . 18 (3): 1369–78. doi :10.1128/mcb.18.3.1369. PMC 108850 . PMID 9488452.
- ^ Liu Z, Auboeuf D, Wong J, Chen JD, Tsai SY, Tsai MJ, O'Malley BW (junio de 2002). "Las proporciones de coactivador/correpresor modulan la transcripción mediada por PR mediante el modulador selectivo del receptor RU486". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 99 (12): 7940–4. Bibcode :2002PNAS...99.7940L. doi : 10.1073/pnas.122225699 . PMC 122999 . PMID 12048256.
- ^ abcd Nickisch K, Elger W, Cessac J, Kesavaram N, Das B, Garfield R, Shi SQ, Amelkina O, Meister R (febrero de 2013). "Síntesis y evaluación biológica de antiprogestinas y mesoprogestinas parcialmente fluoradas". Esteroides . 78 (2): 255–67. doi :10.1016/j.steroids.2012.09.010. PMID 23178161. S2CID 17158416.
- ^ abcdef Nickisch K, Elger W, Santhamma B, Garfield R, Killeen Z, Amelkina O, Schneider B, Meister R (diciembre de 2014). "Síntesis y evaluación biológica de antiprogestinas y mesoprogestinas 11' imidazolilo". Esteroides . 92 : 45–55. doi :10.1016/j.steroids.2014.08.017. PMID 25174783. S2CID 6311225.
- ^ abcd Rao PN, Wang Z, Cessac JW, Rosenberg RS, Jenkins DJ, Diamandis EP (octubre de 1998). "Los nuevos esteroides sustituidos con 11 beta-arilo exhiben actividad progestacional y antiprogestacional". Esteroides . 63 (10): 523–30. doi :10.1016/S0039-128X(98)00060-9. PMID 9800283. S2CID 42703467.
- ^ ab Wagner BL, Pollio G, Leonhardt S, Wani MC, Lee DY, Imhof MO, Edwards DP, Cook CE, McDonnell DP (agosto de 1996). "Los análogos alfa-sustituidos 16 de la antiprogestina RU486 inducen una conformación única en el receptor de progesterona humano, lo que resulta en una actividad agonista mixta". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 93 (16): 8739–44. Bibcode :1996PNAS...93.8739W. doi : 10.1073/pnas.93.16.8739 . PMC 38743 . PMID 8710941.
- ^ abcd Kang FA, Guan J, Jain N, Allan G, Linton O, Tannenbaum P, Chen X, Xu J, Zhu P, Gunnet J, Demarest K, Lundeen S, Sui Z (mayo de 2007). "Síntesis paralela y estudio SAR de nuevos oxaesteroides como antagonistas potentes y selectivos del receptor de progesterona". Bioorganic & Medicinal Chemistry Letters . 17 (9): 2531–4. doi :10.1016/j.bmcl.2007.02.013. PMID 17317167.
- ^ Kang FA, Allan G, Guan J, Jain N, Linton O, Tannenbaum P, Xu J, Zhu P, Gunnet J, Chen X, Demarest K, Lundeen S, Sui Z (febrero de 2007). "Síntesis e identificación de nuevos oxaesteroides como antagonistas del receptor de progesterona". Bioorganic & Medicinal Chemistry Letters . 17 (4): 907–10. doi :10.1016/j.bmcl.2006.11.062. PMID 17169557.
- ^ ab Rewinkel J, Enthoven M, Golstein I, van der Rijst M, Scholten A, van Tilborg M, de Weys D, Wisse J, Hamersma H (marzo de 2008). "Esteroides 11-(piridinilfenilo): una nueva clase de agonistas/antagonistas de progesterona de perfil mixto". Química bioorgánica y medicinal . 16 (6): 2753–63. doi :10.1016/j.bmc.2008.01.010. PMID 18243712.
- ^ Jain N, Allan G, Linton O, Tannenbaum P, Chen X, Xu J, Zhu P, Gunnet J, Demarest K, Lundeen S, Murray W, Sui Z (julio de 2009). "Síntesis y estudio SAR de nuevos pseudoesteroides como antagonistas potentes y selectivos del receptor de progesterona". Bioorganic & Medicinal Chemistry Letters . 19 (14): 3977–80. doi :10.1016/j.bmcl.2009.01.095. PMID 19217285.
- ^ Kang FA, Chen X, Jain N, Allan G, Tannenbaum P, Lundeen S, Sui Z (julio de 2008). "Información a partir del modelado molecular sobre la diferente conformación y SAR de esteroides naturales y 7-oxa-esteroides no naturales". Bioorganic & Medicinal Chemistry Letters . 18 (13): 3687–90. doi :10.1016/j.bmcl.2008.05.070. PMID 18539027.
- ^ ab Benagiano G, Bastianelli C, Farris M, Brosens I (julio de 2014). "Moduladores selectivos del receptor de progesterona: una actualización". Opinión de expertos sobre farmacoterapia . 15 (10): 1403–15. doi :10.1517/14656566.2014.914494. PMID 24787486. S2CID 31746942.
- ^ Brache V, Cochon L, Jesam C, Maldonado R, Salvatierra AM, Levy DP, Gainer E, Croxatto HB (septiembre de 2010). "La administración preovulatoria inmediata de 30 mg de acetato de ulipristal retrasa significativamente la ruptura folicular". Human Reproduction . 25 (9): 2256–63. doi :10.1093/humrep/deq157. PMID 20634186.
- ^ Aiken AR, Trussell J (2014). "Avances recientes en anticoncepción". F1000Prime Reports . 6 : 113. doi : 10.12703/p6-113 . PMC 4251416 . PMID 25580267.
- ^ Spitz IM (noviembre de 2003). "Antagonistas de la progesterona y moduladores del receptor de progesterona: una descripción general". Esteroides . 68 (10–13): 981–93. doi :10.1016/j.steroids.2003.08.007. PMID 14667991. S2CID 23054270.
- ^ Lindsay SF, Luciano DE, Luciano AA (septiembre de 2015). "Terapia emergente para la endometriosis". Opinión de expertos sobre fármacos emergentes . 20 (3): 449–61. doi :10.1517/14728214.2015.1051966. PMID 26050551. S2CID 19276904.
- ^ "Estudio de fase 2 para evaluar la seguridad y eficacia de Proellex® (acetato de telapristona) administrado por vía vaginal en el tratamiento de los fibromas uterinos - Ver texto completo - ClinicalTrials.gov". clinicaltrials.gov . Consultado el 11 de enero de 2016 .
- ^ Eckstein N, Haas B, Hass MD, Pfeifer V (agosto de 2014). "Terapia sistémica del síndrome de Cushing". Orphanet Journal of Rare Diseases . 9 (1): 122. doi : 10.1186/s13023-014-0122-8 . PMC 4237936 . PMID 25091295.
- ^ Taylor DK, Holthouser K, Segars JH, Leppert PC (2015). "Los recientes avances científicos en la investigación de los leiomiomas (fibromas uterinos) facilitan una mejor comprensión y tratamiento". F1000Research . 4 (F1000 Faculty Rev): 183. doi : 10.12688/f1000research.6189.1 . PMC 4513689 . PMID 26236472.
- ^ Pabla B, Bissonnette M, Konda VJ (octubre de 2015). "Cáncer de colon y receptor del factor de crecimiento epidérmico: paradigmas de tratamiento actuales, la importancia de la dieta y el papel de la quimioprevención". Revista mundial de oncología clínica . 6 (5): 133–41. doi : 10.5306/wjco.v6.i5.133 . PMC 4600187 . PMID 26468449.
- ^ Ohara N (2008). "Acción de los moduladores del receptor de progesterona en los leiomiomas uterinos". Obstetricia y ginecología clínica y experimental . 35 (3): 165–6. PMID 18754282.
- ^ ab Spitz IM (agosto de 2009). "Utilidad clínica de los moduladores del receptor de progesterona y su efecto sobre el endometrio". Current Opinion in Obstetrics and Gynecology . 21 (4): 318–24. doi :10.1097/GCO.0b013e32832e07e8. PMID 19602929. S2CID 2121292.
- ^ "Proellex". ClinicalTrials.gov . Institutos Nacionales de Salud de EE. UU . . Consultado el 1 de abril de 2021 .
- ^ Bouchard P, Chabbert-Buffet N, Fauser BC (noviembre de 2011). "Moduladores selectivos del receptor de progesterona en medicina reproductiva: farmacología, eficacia clínica y seguridad". Fertilidad y esterilidad . 96 (5): 1175–89. doi : 10.1016/j.fertnstert.2011.08.021 . PMID 21944187.