Microbiota
La introducción de este artículo puede ser demasiado breve para resumir adecuadamente los puntos clave . ( Octubre de 2018 ) |
La microbiota es el conjunto de microorganismos que pueden ser comensales , mutualistas o patógenos y que se encuentran en todos los organismos multicelulares , incluidas las plantas . La microbiota incluye bacterias , arqueas , protistas , hongos y virus , [2] [3] y se ha descubierto que es crucial para la homeostasis inmunológica, hormonal y metabólica de su huésped.
El término microbioma describe los genomas colectivos de los microbios que residen en un nicho ecológico o bien los microbios mismos. [4] [5] [6]
El microbioma y el huésped surgieron durante la evolución como una unidad sinérgica de la epigenética y las características genéticas, a veces denominada colectivamente como holobionte . [7] [8] La presencia de microbiota en los intestinos humanos y de otros metazoos ha sido fundamental para comprender la coevolución entre metazoos y bacterias. [9] [10] La microbiota juega un papel clave en las respuestas inmunes y metabólicas intestinales a través de su producto de fermentación ( ácido graso de cadena corta ), el acetato . [11]
Introducción
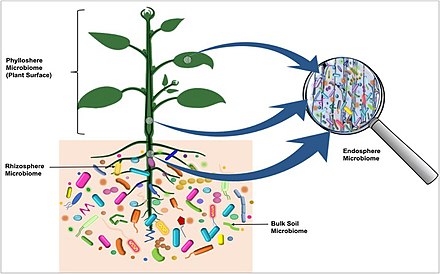
Todas las plantas y los animales, desde las formas de vida más simples hasta los humanos, viven en estrecha asociación con organismos microbianos. [12] Varios avances han impulsado la percepción de los microbiomas, entre ellos:
- la capacidad de realizar análisis genómicos y de expresión genética de células individuales y de comunidades microbianas enteras en las disciplinas de metagenómica y metatranscriptómica [13]
- bases de datos accesibles para investigadores de múltiples disciplinas [13]
- métodos de análisis matemático adecuados para conjuntos de datos complejos [13]
Los biólogos han llegado a apreciar que los microbios constituyen una parte importante del fenotipo de un organismo , mucho más allá del estudio de caso simbiótico ocasional. [13]
Tipos de relaciones entre microbios y huéspedes
El comensalismo , un concepto desarrollado por Pierre-Joseph van Beneden (1809-1894), profesor belga de la Universidad de Lovaina durante el siglo XIX [14], es fundamental para el microbioma, donde la microbiota coloniza un huésped en una coexistencia no dañina. La relación con su huésped se denomina mutualista cuando los organismos realizan tareas que se sabe que son útiles para el huésped, [15] : 700 [16] parasitaria , cuando es desventajosa para el huésped. Otros autores definen una situación como mutualista donde ambos se benefician, y comensal, donde el huésped no afectado beneficia al simbionte. [17] Un intercambio de nutrientes puede ser bidireccional o unidireccional, puede depender del contexto y puede ocurrir de diversas formas. [17] La microbiota que se espera que esté presente y que en circunstancias normales no causa enfermedades se considera flora normal o microbiota normal ; [15] la flora normal no solo puede ser inofensiva, sino que puede proteger al huésped. [18]
Adquisición y cambio
La adquisición inicial de la microbiota en animales, desde mamíferos hasta esponjas marinas , se produce al nacer, e incluso puede ocurrir a través de la línea de células germinales. En las plantas, el proceso de colonización puede iniciarse bajo tierra en la zona de la raíz , alrededor de la semilla en germinación, la espermosfera , u originarse en las partes aéreas, la filosfera y la zona floral o antósfera. [19] La estabilidad de la microbiota de la rizosfera a lo largo de las generaciones depende del tipo de planta, pero aún más de la composición del suelo, es decir, del entorno vivo y no vivo. [20] Clínicamente, se puede adquirir nueva microbiota a través del trasplante de microbiota fecal para tratar infecciones como la infección crónica por C. difficile . [21]
Microbiota por huésped

Humanos
La microbiota humana incluye bacterias , hongos , arqueas y virus. Se excluyen los microanimales que viven en el cuerpo humano. El microbioma humano se refiere a sus genomas colectivos . [15]
Los seres humanos están colonizados por muchos microorganismos; la estimación tradicional era que los humanos viven con diez veces más células no humanas que células humanas; estimaciones más recientes han reducido esta relación a 3:1 e incluso a aproximadamente 1:1 en número (1:350 en masa). [22] [23] [24] [25] [26]
De hecho, son tan pequeños que hay alrededor de 100 billones de microbiota en el cuerpo humano, [27] alrededor de 39 billones según estimaciones revisadas, con solo 0,2 kg de masa total en un cuerpo humano de "referencia" de 70 kg. [26]
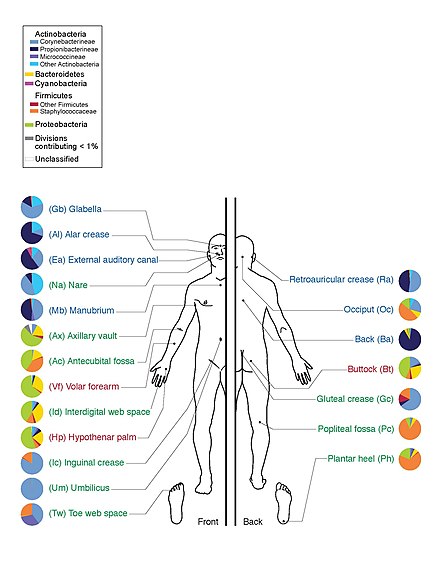
El Proyecto del Microbioma Humano secuenció el genoma de la microbiota humana, centrándose particularmente en la microbiota que normalmente habita en la piel, la boca, la nariz, el tracto digestivo y la vagina. [15] Alcanzó un hito en 2012 cuando publicó los resultados iniciales. [28]
Animales no humanos
- Los anfibios tienen microbiota en su piel. [29] Algunas especies son capaces de portar un hongo llamado Batrachochytrium dendrobatidis , que en otras puede causar una infección mortal quitridiomicosis dependiendo de su microbioma, resistiendo la colonización de patógenos o inhibiendo su crecimiento con péptidos cutáneos antimicrobianos. [30]
- Los marsupiales recién nacidos nacen con tejidos inmunes histológicamente inmaduros y no pueden desarrollar su propia defensa inmunológica específica. Por lo tanto, dependen en gran medida del sistema inmunológico de su madre [31] y de la leche [32] para su protección. La mayoría de los marsupiales tienen bolsas y su propia microbiota cambia a lo largo de las etapas reproductivas: estro, parto/estro y postestro [33] . Se han identificado péptidos antimicrobianos en algunas secreciones de la piel y de las bolsas, que presumiblemente ayudan a las crías en este momento vulnerable.
- En los mamíferos, los herbívoros como el ganado dependen de su microbioma ruminal para convertir la celulosa en proteínas, ácidos grasos de cadena corta y gases. Los métodos de cultivo no pueden proporcionar información sobre todos los microorganismos presentes. Los estudios metagenómicos comparativos arrojaron el sorprendente resultado de que los bovinos individuales poseen estructuras comunitarias, fenotipos previstos y potenciales metabólicos marcadamente diferentes, [34] a pesar de que se les alimentó con dietas idénticas, estuvieron alojados juntos y fueron aparentemente funcionalmente idénticos en su utilización de los recursos de la pared celular vegetal.
- Los ratones se han convertido en los mamíferos más estudiados en lo que respecta a sus microbiomas. La microbiota intestinal se ha estudiado en relación con la enfermedad alérgica de las vías respiratorias, la obesidad, las enfermedades gastrointestinales y la diabetes. El cambio perinatal de la microbiota a través de antibióticos de dosis bajas puede tener efectos duraderos en la susceptibilidad futura a la enfermedad alérgica de las vías respiratorias. La frecuencia de ciertos subconjuntos de microbios se ha relacionado con la gravedad de la enfermedad. La presencia de microbios específicos en las primeras etapas de la vida posnatal instruye futuras respuestas inmunitarias. [35] [36] En ratones gnotobióticos se encontró que ciertas bacterias intestinales transmitían un fenotipo particular a los ratones receptores libres de gérmenes, que promovía la acumulación de células T reguladoras colónicas y cepas que modulaban la adiposidad del ratón y las concentraciones de metabolitos cecales. [37] Este enfoque combinatorio permite una comprensión a nivel de sistemas de las contribuciones microbianas a la biología humana. [38] Pero también se han estudiado otros tejidos mucoides como el pulmón y la vagina en relación con enfermedades como el asma, la alergia y la vaginosis. [39]
- Los insectos tienen sus propios microbiomas. Por ejemplo, las hormigas cortadoras de hojas forman enormes colonias subterráneas que cosechan cientos de kilogramos de hojas cada año y no pueden digerir la celulosa de las hojas directamente. Mantienen jardines de hongos como fuente principal de alimento de la colonia. Si bien el hongo en sí no digiere la celulosa, una comunidad microbiana que contiene una diversidad de bacterias sí lo hace. El análisis del genoma de la población microbiana reveló muchos genes con un papel en la digestión de la celulosa. El perfil de enzimas degradadoras de carbohidratos previsto de este microbioma es similar al del rumen bovino, pero la composición de especies es casi completamente diferente. [40] La microbiota intestinal de la mosca de la fruta puede afectar la apariencia de su intestino, al impactar la tasa de renovación epitelial, el espaciamiento celular y la composición de diferentes tipos de células en el epitelio. [41] Cuando la polilla Spodoptera exigua se infecta con baculovirus, los genes relacionados con el sistema inmunitario se regulan a la baja y la cantidad de su microbiota intestinal aumenta. [42] En el intestino de los dípteros, las células enteroendocrinas detectan los metabolitos derivados de la microbiota intestinal y coordinan las ramas antibacterianas, mecánicas y metabólicas de la respuesta inmune innata intestinal del huésped a la microbiota comensal. [43]
- Los peces tienen su propio microbioma, incluida la especie de corta vida Nothobranchius furzeri (pez killi turquesa). La transferencia de la microbiota intestinal de los peces killi jóvenes a los peces killi de mediana edad extiende significativamente la esperanza de vida de estos últimos. [44]
Plantas

Recientemente se descubrió que el microbioma de las plantas se origina en la semilla. [46] Los microorganismos que se transmiten a través de la semilla migran a la plántula en desarrollo en una ruta específica en la que cierta comunidad se mueve a las hojas y otras a las raíces. [46] En el diagrama de la derecha, la microbiota que coloniza la rizosfera , ingresa a las raíces y coloniza la siguiente generación de tubérculos a través de los estolones , se visualiza con un color rojo. Las bacterias presentes en el tubérculo madre , que pasan a través de los estolones y migran a la planta, así como a la siguiente generación de tubérculos, se muestran en azul. [45]
- El suelo es el principal reservorio de bacterias que colonizan los tubérculos de papa.
- Las bacterias se reclutan del suelo más o menos independientemente de la variedad de papa.
- Las bacterias pueden colonizar los tubérculos predominantemente desde el interior de las plantas a través del estolón.
- La microbiota bacteriana de los tubérculos de papa está formada por bacterias transmitidas de una generación de tubérculos a la siguiente y bacterias reclutadas del suelo que colonizan las plantas de papa a través de la raíz. [45]

Las plantas son huéspedes atractivos para los microorganismos, ya que proporcionan una variedad de nutrientes. Los microorganismos en las plantas pueden ser epífitas (que se encuentran en las plantas) o endófitas (que se encuentran dentro del tejido vegetal). [47] [48] Los oomicetos y los hongos han desarrollado, a través de la evolución convergente, una morfología similar y ocupan nichos ecológicos similares. Desarrollan hifas , estructuras filiformes que penetran en la célula huésped. En situaciones mutualistas, la planta a menudo intercambia azúcares hexosas por fosfato inorgánico del simbionte fúngico. Se especula que estas asociaciones muy antiguas han ayudado a las plantas cuando colonizaron la tierra por primera vez. [17] [49] Las bacterias promotoras del crecimiento de las plantas (PGPB) proporcionan a la planta servicios esenciales como la fijación de nitrógeno , la solubilización de minerales como el fósforo, la síntesis de hormonas vegetales , la mejora directa de la absorción de minerales y la protección contra patógenos. [50] [51] Los PGPB pueden proteger a las plantas de los patógenos al competir con el patógeno por un nicho ecológico o un sustrato, produciendo aleloquímicos inhibidores o induciendo resistencia sistémica en las plantas hospedantes al patógeno [19]
Investigación
La relación simbiótica entre un huésped y su microbiota está siendo investigada en el laboratorio para determinar cómo puede moldear el sistema inmunológico de los mamíferos. [52] [53] En muchos animales, el sistema inmunológico y la microbiota pueden participar en una "intercomunicación" intercambiando señales químicas, lo que puede permitir que la microbiota influya en la reactividad y la focalización inmunológicas. [54] Las bacterias pueden transferirse de madre a hijo a través del contacto directo y después del nacimiento . [55] A medida que se establece el microbioma infantil, las bacterias comensales pueblan rápidamente el intestino, lo que provoca una variedad de respuestas inmunes y "programa" el sistema inmunológico con efectos duraderos. [54] Las bacterias pueden estimular el tejido linfoide asociado con la mucosa intestinal, lo que permite que el tejido produzca anticuerpos para patógenos que pueden ingresar al intestino. [54]
El microbioma humano puede desempeñar un papel en la activación de los receptores tipo Toll en los intestinos, un tipo de receptor de reconocimiento de patrones que las células huésped utilizan para reconocer peligros y reparar daños. Los patógenos pueden influir en esta coexistencia, lo que conduce a una desregulación inmunológica que incluye la susceptibilidad a enfermedades, mecanismos de inflamación , tolerancia inmunológica y enfermedades autoinmunes . [56] [57]
Coevolución de la microbiota

Los organismos evolucionan dentro de los ecosistemas de modo que el cambio de un organismo afecta el cambio de los demás. La teoría hologenómica de la evolución propone que un objeto de la selección natural no es el organismo individual, sino el organismo junto con sus organismos asociados, incluidas sus comunidades microbianas.
Arrecifes de coral . La teoría del hologenoma se originó en estudios sobre arrecifes de coral. [58] Los arrecifes de coral son las estructuras más grandes creadas por organismos vivos y contienen comunidades microbianas abundantes y altamente complejas. Durante las últimas décadas, se han producido importantes disminuciones en las poblaciones de coral. El cambio climático , la contaminación del agua y la sobrepesca son tres factores de estrés que se han descrito como causantes de la susceptibilidad a las enfermedades. Se han descrito más de veinte enfermedades de coral diferentes, pero de estas, solo un puñado han tenido sus agentes causales aislados y caracterizados. El blanqueamiento de los corales es la más grave de estas enfermedades. En el mar Mediterráneo, el blanqueamiento de Oculina patagonica se describió por primera vez en 1994 y poco después se determinó que se debía a una infección por Vibrio shiloi. De 1994 a 2002, el blanqueamiento bacteriano de O. patagonica ocurrió cada verano en el Mediterráneo oriental. Sin embargo, sorprendentemente, después de 2003, O. patagonica en el Mediterráneo oriental ha sido resistente a la infección por V. shiloi , aunque otras enfermedades aún causan blanqueamiento. La sorpresa surge del conocimiento de que los corales son seres vivos de larga duración, con una vida útil del orden de décadas, [59] y no tienen sistemas inmunológicos adaptativos . [ cita requerida ] Sus sistemas inmunológicos innatos no producen anticuerpos, y aparentemente no deberían ser capaces de responder a nuevos desafíos excepto en escalas de tiempo evolutivas. [ cita requerida ]
El misterio de cómo los corales lograron adquirir resistencia a un patógeno específico condujo a una propuesta en 2007 de que existe una relación dinámica entre los corales y sus comunidades microbianas simbióticas. Se cree que al alterar su composición, el holobionte puede adaptarse a condiciones ambientales cambiantes mucho más rápidamente que mediante mutación y selección genética únicamente. La extrapolación de esta hipótesis a otros organismos, incluidas las plantas y los animales superiores, condujo a la propuesta de la teoría hologenómica de la evolución. [58]
En 2007, [actualizar]la teoría del hologenoma todavía se encontraba en debate. [60] Una crítica importante ha sido la afirmación de que V. shiloi fue identificado erróneamente como el agente causante del blanqueamiento de los corales, y que su presencia en O. patagonica blanqueada era simplemente la de una colonización oportunista. [61] Si esto es cierto, la observación básica que conduce a la teoría sería inválida. La teoría ha ganado una popularidad significativa como una forma de explicar los cambios rápidos en la adaptación que de otra manera no se pueden explicar por los mecanismos tradicionales de selección natural. Dentro de la teoría del hologenoma, el holobionte no solo se ha convertido en la unidad principal de la selección natural, sino también en el resultado de otro paso de integración que también se observa a nivel celular ( simbiogénesis , endosimbiosis ) y genómico. [7]
Métodos de investigación
Secuenciación de amplicones dirigida
| Parte de una serie sobre |
| Microbiomas |
|---|
 |
La secuenciación de amplicones dirigida se basa en tener algunas expectativas sobre la composición de la comunidad que se está estudiando. En la secuenciación de amplicones diana, se selecciona un marcador filogenéticamente informativo para la secuenciación. Tal marcador debería estar presente idealmente en todos los organismos esperados. También debería evolucionar de tal manera que se conserve lo suficiente como para que los cebadores puedan dirigirse a genes de una amplia gama de organismos mientras evolucionan lo suficientemente rápido como para permitir una resolución más fina a nivel taxonómico. Un marcador común para los estudios del microbioma humano es el gen del ARNr 16S bacteriano ( es decir , "ADNr 16S", la secuencia de ADN que codifica la molécula de ARN ribosómico). [62] Dado que los ribosomas están presentes en todos los organismos vivos, el uso de ADNr 16S permite amplificar el ADN de muchos más organismos que si se usara otro marcador. El gen del ARNr 16S contiene regiones de evolución lenta y 9 regiones de evolución rápida, también conocidas como regiones hipervariables (HVR); [63] El primero se puede utilizar para diseñar iniciadores amplios, mientras que el segundo permite una distinción taxonómica más fina. Sin embargo, la resolución a nivel de especie no suele ser posible utilizando el ADNr 16S. La selección de iniciadores es un paso importante, ya que todo lo que no pueda ser seleccionado por el iniciador no se amplificará y, por lo tanto, no se detectará; además, se pueden seleccionar diferentes conjuntos de iniciadores para amplificar diferentes HVR en el gen, o pares de ellos. La elección apropiada de qué HVR amplificar debe realizarse de acuerdo con los grupos taxonómicos de interés, ya que se ha demostrado que diferentes regiones objetivo influyen en la clasificación taxonómica. [64]
Los estudios específicos de las comunidades eucariotas y virales son limitados [65] y están sujetos al desafío de excluir el ADN del huésped de la amplificación y la biomasa eucariota y viral reducida en el microbioma humano. [66]
Una vez secuenciados los amplicones, se utilizan métodos filogenéticos moleculares para inferir la composición de la comunidad microbiana. Esto se puede hacer mediante metodologías de agrupamiento , agrupando los amplicones en unidades taxonómicas operativas (OTU); o alternativamente, con metodologías de eliminación de ruido, identificando variantes de secuencia de amplicones (ASV).
Luego se infieren las relaciones filogenéticas entre las secuencias. Debido a la complejidad de los datos, las medidas de distancia como las distancias UniFrac se definen generalmente entre muestras de microbioma, y se llevan a cabo métodos multivariados posteriores en las matrices de distancia. Un punto importante es que la escala de datos es extensa y se deben adoptar enfoques adicionales para identificar patrones a partir de la información disponible. Las herramientas utilizadas para analizar los datos incluyen VAMPS, [67] QIIME , [68] mothur [69] y DADA2 [70] o UNOISE3 [71] para la eliminación de ruido.
Secuenciación metagenómica
La metagenómica también se utiliza ampliamente para estudiar las comunidades microbianas. [72] [73] [74] En la secuenciación metagenómica, el ADN se recupera directamente de muestras ambientales de manera no dirigida con el objetivo de obtener una muestra imparcial de todos los genes de todos los miembros de la comunidad. Estudios recientes utilizan la secuenciación shotgun Sanger o la pirosecuenciación para recuperar las secuencias de las lecturas. [75] Las lecturas luego se pueden ensamblar en contigs . Para determinar la identidad filogenética de una secuencia, se compara con secuencias de genoma completo disponibles utilizando métodos como BLAST . Una desventaja de este enfoque es que muchos miembros de las comunidades microbianas no tienen un genoma secuenciado representativo, pero esto también se aplica a la secuenciación de amplicones de ARNr 16S y es un problema fundamental. [62] Con la secuenciación shotgun, se puede resolver al tener una alta cobertura (50-100x) del genoma desconocido, haciendo efectivamente un ensamblaje de genoma de novo . Tan pronto como se dispone de un genoma completo de un organismo desconocido, se puede comparar filogenéticamente y colocar al organismo en su lugar en el árbol de la vida , mediante la creación de nuevos taxones . Un enfoque emergente es combinar la secuenciación shotgun con datos de ligación por proximidad ( Hi-C ) para ensamblar genomas microbianos completos sin cultivo. [76]
A pesar de que la metagenómica está limitada por la disponibilidad de secuencias de referencia, una ventaja significativa de la metagenómica sobre la secuenciación dirigida de amplicones es que los datos metagenómicos pueden dilucidar el potencial funcional del ADN de la comunidad. [77] [78] Los estudios de genes dirigidos no pueden hacer esto, ya que solo revelan la relación filogenética entre el mismo gen de diferentes organismos. El análisis funcional se realiza comparando las secuencias recuperadas con bases de datos de anotaciones metagenómicas como KEGG . Las vías metabólicas en las que participan estos genes se pueden predecir con herramientas como MG-RAST, [79] CAMERA [80] e IMG/M . [81]
Enfoques basados en ARN y proteínas
Se han realizado estudios de metatranscriptómica para estudiar la expresión génica de las comunidades microbianas a través de métodos como la pirosecuenciación del ARN extraído. [82] Los estudios basados en la estructura también han identificado ARN no codificantes (ARNnc) como las ribozimas de la microbiota. [83] La metaproteómica es un enfoque que estudia las proteínas expresadas por la microbiota, lo que brinda información sobre su potencial funcional. [84]
Proyectos
El Proyecto del Microbioma Humano, lanzado en 2008, fue una iniciativa de los Institutos Nacionales de Salud de los Estados Unidos para identificar y caracterizar los microorganismos que se encuentran tanto en humanos sanos como enfermos. [85] El proyecto de cinco años, mejor caracterizado como un estudio de viabilidad con un presupuesto de 115 millones de dólares, probó cómo los cambios en el microbioma humano están asociados con la salud o la enfermedad humana. [85]
El Proyecto del Microbioma de la Tierra (EMP, por sus siglas en inglés) es una iniciativa para recolectar muestras naturales y analizar la comunidad microbiana en todo el mundo. Los microbios son muy abundantes, diversos y tienen un papel importante en el sistema ecológico. Sin embargo, en 2010 [update], se estimó que el esfuerzo total de secuenciación de ADN ambiental global había producido menos del 1 por ciento del ADN total encontrado en un litro de agua de mar o un gramo de suelo, [86] y las interacciones específicas entre microbios son en gran parte desconocidas. El EMP tiene como objetivo procesar hasta 200.000 muestras en diferentes biomas, generando una base de datos completa de microbios en la Tierra para caracterizar entornos y ecosistemas por composición e interacción microbiana. Usando estos datos, se pueden proponer y probar nuevas teorías ecológicas y evolutivas. [87]
Microbiota intestinal y diabetes tipo 2
La microbiota intestinal es muy importante para la salud del huésped porque desempeña un papel en la degradación de polisacáridos no digestibles (fermentación de almidón resistente, oligosacáridos, inulina), fortaleciendo la integridad intestinal o dando forma al epitelio intestinal, recolectando energía, protegiendo contra patógenos y regulando la inmunidad del huésped. [88] [89]
Varios estudios demostraron que la composición bacteriana intestinal en pacientes diabéticos se alteró con el aumento de los niveles de Lactobacillus gasseri , Streptococcus mutans y miembros de Clostridiales, con una disminución de las bacterias productoras de butirato como Roseburia intestinalis y Faecalibacterium prausnitzii. [90] [91] Esta alteración se debe a muchos factores como el abuso de antibióticos, la dieta y la edad .
La disminución de la producción de butirato se asocia con defectos en la permeabilidad intestinal, lo que podría conducir a la endotoxemia , que es el aumento del nivel de lipopolisacáridos circulantes de la pared celular de las bacterias gramnegativas. Se ha descubierto que la endotoxemia tiene asociación con el desarrollo de resistencia a la insulina. [90]
Además, la producción de butirato afecta el nivel de serotonina. [90] Un nivel elevado de serotonina contribuye a la obesidad, que se sabe que es un factor de riesgo para el desarrollo de diabetes.
Desarrollo de la microbiota intestinal y antibióticos
La colonización de la microbiota intestinal humana puede comenzar incluso antes del nacimiento. [92] Existen múltiples factores ambientales que afectan el desarrollo de la microbiota, siendo el modo de nacimiento uno de los más impactantes. [93]
Otro factor que se ha observado que causa grandes cambios en la microbiota intestinal, particularmente en niños, es el uso de antibióticos, asociándose con problemas de salud como un IMC más alto, [94] [95] y además un mayor riesgo de enfermedades metabólicas como la obesidad. [96] En bebés se observó que la amoxicilina y los macrólidos causan cambios significativos en la microbiota intestinal caracterizada por un cambio en las clases bacterianas Bifidobacteria, Enterobacteria y Clostridia. [97] Un solo ciclo de antibióticos en adultos causa cambios tanto en la microbiota bacteriana como fúngica, con cambios aún más persistentes en las comunidades fúngicas. [98] Las bacterias y los hongos viven juntos en el intestino y lo más probable es que haya una competencia por las fuentes de nutrientes presentes. [99] [100] Seelbinder et al . encontraron que las bacterias comensales en el intestino regulan el crecimiento y la patogenicidad de Candida albicans por sus metabolitos, particularmente por propionato, ácido acético y 5-dodecenoato. [98] Candida se ha asociado previamente con EII [101] y además se ha observado que aumenta en pacientes que no responden a un fármaco biológico, infliximab, administrado a pacientes con EII grave. [102] El propionato y el ácido acético son ácidos grasos de cadena corta (AGCC) que se ha observado que son beneficiosos para la salud de la microbiota intestinal. [103] [104] [105] Cuando los antibióticos afectan el crecimiento de bacterias en el intestino, puede haber un crecimiento excesivo de ciertos hongos, que pueden ser patógenos cuando no se regulan. [98]
Cuestiones de privacidad
El ADN microbiano que habita en el cuerpo humano de una persona puede identificarla de forma única. La privacidad de una persona puede verse comprometida si dona anónimamente datos de ADN microbiano. Su condición médica y su identidad podrían ser reveladas. [106] [107] [108]
Véase también
Referencias
- ^ Dastogeer, KM, Tumpa, FH, Sultana, A., Akter, MA y Chakraborty, A. (2020) "Microbioma vegetal: una descripción de los factores que dan forma a la composición y diversidad de la comunidad". Current Plant Biology , 23 : 100161. doi :10.1016/j.cpb.2020.100161.
 El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional.
El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional. - ^ De Sordi, Luisa; Lourenço, Marta; Debarbieux, Laurent (2019). "La batalla interna: interacciones de bacteriófagos y bacterias en el tracto gastrointestinal". Cell Host & Microbe . 25 (2): 210–218. doi : 10.1016/j.chom.2019.01.018 . PMID 30763535. S2CID 73455329.
- ^ Peterson, J; Garges, S; et al. (2009). "El proyecto del microbioma humano del NIH". Genome Research . 19 (12). Grupo de trabajo del NIH HMP: 2317–2323. doi :10.1101/gr.096651.109. PMC 2792171 . PMID 19819907.
- ^ Backhed, F.; Ley, RE; Sonnenburg, JL; Peterson, DA; Gordon, JI (2005). "Mutualismo huésped-bacteria en el intestino humano". Science . 307 (5717): 1915–1920. Bibcode :2005Sci...307.1915B. doi :10.1126/science.1104816. PMID 15790844. S2CID 6332272.
- ^ Turnbaugh, PJ; Ley, RE; Hamady, M.; Fraser-Liggett, CM; Knight, R.; Gordon, JI (2007). "El proyecto del microbioma humano". Nature . 449 (7164): 804–810. Bibcode :2007Natur.449..804T. doi :10.1038/nature06244. PMC 3709439 . PMID 17943116.
- ^ Ley, RE; Peterson, DA; Gordon, JI (2006). "Fuerzas ecológicas y evolutivas que configuran la diversidad microbiana en el intestino humano". Cell . 124 (4): 837–848. doi : 10.1016/j.cell.2006.02.017 . PMID 16497592. S2CID 17203181.
- ^ ab Salvucci, E. (2016). "Microbioma, holobionte y la red de la vida". Critical Reviews in Microbiology . 42 (3): 485–494. doi :10.3109/1040841X.2014.962478. hdl : 11336/33456 . PMID 25430522. S2CID 30677140.
- ^ Guerrero, R.; Margulis, Lynn ; Berlanga, M. (2013). "Simbiogénesis: El holobionte como unidad de evolución". Microbiología Internacional . 16 (3): 133–143. doi :10.2436/20.1501.01.188. PMID 24568029.
- ^ Davenport, Emily R et al. "El microbioma humano en la evolución". BMC Biology . vol. 15,1 127. 27 de diciembre de 2017, doi :10.1186/s12915-017-0454-7
- ^ "Evolución de la flora intestinal humana". Andrew H. Moeller, Yingying Li, Eitel Mpoudi Ngole, Steve Ahuka-Mundeke, Elizabeth V. Lonsdorf, Anne E. Pusey, Martine Peeters, Beatrice H. Hahn, Howard Ochman. Actas de la Academia Nacional de Ciencias . Noviembre de 2014, 111 (46) 16431–16435; doi :10.1073/pnas.1419136111
- ^ Jugder, Bat-Erdene; Kamareddine, Layla; Watnick, Paula I. (2021). "El acetato derivado de la microbiota activa la inmunidad innata intestinal a través del complejo de histona acetiltransferasa Tip60". Inmunidad . 54 (8): 1683–1697.e3. doi :10.1016/j.immuni.2021.05.017. ISSN 1074-7613. PMC 8363570 . PMID 34107298.
- ^ Mendes, R.; Raaijmakers, JM (2015). "Similitudes entre reinos en las funciones del microbioma". La Revista ISME . 9 (9): 1905-1907. Código Bib : 2015ISMEJ...9.1905M. doi :10.1038/ismej.2015.7. PMC 4542044 . PMID 25647346.
- ^ abcd Bosch, TCG; McFall-Ngai, MJ (2011). "Los metaorganismos como la nueva frontera". Zoología . 114 (4): 185–190. Bibcode :2011Zool..114..185B. doi :10.1016/j.zool.2011.04.001. PMC 3992624 . PMID 21737250.
- ^ Poreau B., Biología y complejidad: historia y modelos del comensalismo . Tesis Doctoral, Universidad de Lyon, Francia, 2014.
- ^ abcd Sherwood, Linda; Willey, Joanne; Woolverton, Christopher (2013). Microbiología de Prescott (novena edición). Nueva York: McGraw Hill. págs. 713–721. ISBN 9780073402406.OCLC 886600661 .
- ^ Quigley, EM (septiembre de 2013). "Bacterias intestinales en la salud y la enfermedad". Gastroenterol Hepatol (NY) . 9 (9): 560–569. PMC 3983973. PMID 24729765 .
- ^ abc Remy W, Taylor TN, Hass H, Kerp H (1994). "Micorrizas arbusculares vesiculares de cuatrocientos millones de años". Proc. Natl. Sci. USA . 91 (25): 11841–11843. Bibcode :1994PNAS...9111841R. doi : 10.1073/pnas.91.25.11841 . PMC 45331 . PMID 11607500.
- ^ Copeland, CS (septiembre-octubre de 2017). "El mundo dentro de nosotros". Healthcare Journal of New Orleans . Archivado desde el original el 7 de diciembre de 2019. Consultado el 7 de diciembre de 2019 .
- ^ ab Compant S, Duffy B, Nowak J, Clément C, Barka EA (2005). "Uso de bacterias promotoras del crecimiento de las plantas para el biocontrol de enfermedades de las plantas: principios, mecanismos de acción y perspectivas futuras". Appl Environ Microbiol . 71 (9): 4951–4959. Bibcode :2005ApEnM..71.4951C. doi :10.1128/AEM.71.9.4951-4959.2005. PMC 1214602 . PMID 16151072.
- ^ Tkacz, Andrzej; Cheema, Jitender; Chandra, Govind; Grant, Alastair; Poole, Philip S. (noviembre de 2015). "La estabilidad y la sucesión de la microbiota de la rizosfera dependen del tipo de planta y la composición del suelo". ISME J . 9 (11): 2349–2359. Bibcode :2015ISMEJ...9.2349T. doi :10.1038/ismej.2015.41. PMC 4611498 . PMID 25909975.
- ^ Copeland, CS (19 de abril de 2019). "¿Qué es Clostridium difficile?". Vitalacy .
- ^ Preguntas frecuentes de la Academia Estadounidense de Microbiología: microbioma humano Archivado el 31 de diciembre de 2016 en Wayback Machine . Enero de 2014
- ^ Judah L. Rosner para Microbe Magazine, febrero de 2014. ¿Diez veces más células microbianas que células corporales en los humanos?
- ^ Alison Abbott para Nature News. 8 de enero de 2016 Los científicos desmienten el mito de que nuestros cuerpos tienen más bacterias que células humanas
- ^ Sender, R; Fuchs, S; Milo, R (enero de 2016). "¿Realmente nos superan en número? Revisando la proporción de células bacterianas y células huésped en humanos". Cell . 164 (3): 337–340. doi : 10.1016/j.cell.2016.01.013 . PMID 26824647. S2CID 1790146.
- ^ ab Sender, Ron; Fuchs, Shai; Milo, Ron (19 de agosto de 2016). "Estimaciones revisadas del número de células humanas y bacterianas en el cuerpo". PLOS Biology . 14 (8): e1002533. doi : 10.1371/journal.pbio.1002533 . PMC 4991899 . PMID 27541692.
- ^ "Sobre y en ti". Micropia, www.micropia.nl/en/discover/stories/on-and-in-you/#:~:text=Están%20sobre%20ti%2C%20en,re%20conocidos%20como%20microbiota%20humana.
- ^ "El proyecto del microbioma humano del NIH define la composición bacteriana normal del cuerpo". Noticias del NIH. 13 de junio de 2012.
- ^ Bataille, A; Lee-Cruz, L; Tripathi, B; Kim, H; Waldman, B (enero de 2016). "Variación del microbioma en las regiones cutáneas de los anfibios: implicaciones para los esfuerzos de mitigación de la quitridiomicosis". Microb. Ecol . 71 (1): 221–232. Bibcode :2016MicEc..71..221B. doi :10.1007/s00248-015-0653-0. PMID 26271741. S2CID 12951957.
- ^ Woodhams DC, Rollins-Smith LA, Alford RA, Simon MA, Harris RN (2007). "Defensas inmunitarias innatas de la piel de los anfibios: péptidos antimicrobianos y más". Conservación Animal . 10 (4): 425–428. Código Bibliográfico :2007AnCon..10..425W. doi : 10.1111/j.1469-1795.2007.00150.x . S2CID 84293044.
- ^ Old JM, Deane EM (2000). "Desarrollo del sistema inmunológico y protección inmunológica en crías de marsupiales". Inmunología comparada y del desarrollo . 24 (5): 445–454. doi :10.1016/S0145-305X(00)00008-2. PMID 10785270.
- ^ Stannard HJ, Miller RD, Old JM (2020). "Leche de marsupiales y monotremas: una revisión de sus nutrientes y propiedades inmunitarias". PeerJ . 8 : e9335. doi : 10.7717/peerj.9335 . PMC 7319036 . PMID 32612884.
- ^ Old JM, Deane EM (1998). "El efecto del estro y la presencia de crías en la bolsa sobre las bacterias aeróbicas aisladas de la bolsa del ualabí tammar, Macropus eugenii ". Inmunología comparada, microbiología y enfermedades infecciosas . 21 (4): 237–245. doi :10.1016/s0147-9571(98)00022-8. PMID 9775355.
- ^ Brulc JM; Antonopoulos DA; Miller MEB; et al. (2009). "La metagenómica centrada en los genes del microbioma del rumen bovino adherente a la fibra revela hidrolasas de glicósidos específicas del forraje". Proc. Natl. Sci. USA . 106 (6): 1948–1953. Bibcode :2009PNAS..106.1948B. doi : 10.1073/pnas.0806191105 . PMC 2633212 . PMID 19181843.
- ^ Russell SL, Gold MJ; et al. (mayo de 2012). "Los cambios en la microbiota provocados por los antibióticos en las primeras etapas de la vida aumentan la susceptibilidad al asma alérgico". EMBO Rep . 13 (5): 440–447. doi :10.1038/embor.2012.32. PMC 3343350 . PMID 22422004.
- ^ Russell SL, Gold MJ, et al. (agosto de 2014). "Los cambios inducidos por antibióticos perinatales en la microbiota intestinal tienen efectos diferenciales en las enfermedades pulmonares inflamatorias". J Allergy Clin Immunol . 135 (1): 100–109. doi :10.1016/j.jaci.2014.06.027. PMID 25145536.
- ^ Turnbaugh PJ, et al. (diciembre de 2006). "Un microbioma intestinal asociado a la obesidad con mayor capacidad para la recolección de energía". Nature . 444 (7122): 1027–1031. Bibcode :2006Natur.444.1027T. doi :10.1038/nature05414. PMID 17183312. S2CID 4400297.
- ^ Faith JJ, Ahern PP, Ridaura VK, et al. (enero de 2014). "Identificación de relaciones entre el fenotipo del huésped y el microbio intestinal mediante comunidades combinatorias en ratones gnotobióticos". Sci. Transl. Med . 6 (220): 220. doi :10.1126/scitranslmed.3008051. PMC 3973144. PMID 24452263 .
- ^ Barfod, KK; Roggenbuck, M; Hansen, LH; Schjørring, S; Larsen, ST; Sorensen, SJ; Krogfelt, KA (2013). "El microbioma pulmonar murino en relación con las comunidades bacterianas intestinales y vaginales". BMC Microbiol . 13 : 303. doi : 10.1186/1471-2180-13-303 . PMC 3878784 . PMID 24373613.
- ^ Suen; Scott JJ; Aylward FO; et al. (2010). Sonnenburg, Justin (ed.). "Un microbioma de insectos herbívoros con alta capacidad de degradación de biomasa vegetal". PLOS Genet . 6 (9): e1001129. doi : 10.1371/journal.pgen.1001129 . PMC 2944797 . PMID 20885794.
- ^ Broderick, Nichole A.; Buchon, Nicolas; Lemaitre, Bruno (2014). "Cambios inducidos por la microbiota en la expresión génica del huésped y la morfología intestinal de Drosophila melanogaster". mBio . 5 (3): e01117–14. doi :10.1128/mBio.01117-14. PMC 4045073 . PMID 24865556.
- ^ Jakubowska, Agata K.; Vogel, Heiko; Herrero, Salvador (mayo de 2013). "Aumento de la microbiota intestinal tras la supresión inmunitaria en larvas infectadas por baculovirus". PLOS Pathog . 9 (5): e1003379. doi : 10.1371/journal.ppat.1003379 . PMC 3662647 . PMID 23717206.
- ^ Watnick, Paula I.; Jugder, Bat-Erdene (1 de febrero de 2020). "Control microbiano de la homeostasis intestinal a través de la señalización inmunitaria innata de las células enteroendocrinas". Tendencias en microbiología . 28 (2): 141–149. doi :10.1016/j.tim.2019.09.005. ISSN 0966-842X. PMC 6980660 . PMID 31699645.
- ^ Tibbs TN, Lopez LR, Arthur JC (2019). "La influencia de la microbiota en el desarrollo inmunológico, la inflamación crónica y el cáncer en el contexto del envejecimiento". Microbial Cell . 6 (8): 324–334. doi :10.15698/mic2019.08.685 (inactivo 2024-04-15). PMC 6685047 . PMID 31403049.
{{cite journal}}: CS1 maint: DOI inactive as of April 2024 (link) - ^ abc Buchholz, F., Antonielli, L., Kostić, T., Sessitsch, A. y Mitter, B. (2019) "La comunidad bacteriana en la papa se recluta del suelo y se hereda parcialmente a través de generaciones". PLOS One , 14 (11): e0223691. doi :10.1371/journal.pone.0223691.
 El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional.
El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional. - ^ ab Abdelfattah, Ahmed; Wisniewski, Michael; Schena, Leonardo; Tack, Ayco JM (2021). "Evidencia experimental de herencia microbiana en plantas y rutas de transmisión desde la semilla hasta la filosfera y la raíz". Microbiología ambiental . 23 (4): 2199–2214. Bibcode :2021EnvMi..23.2199A. doi : 10.1111/1462-2920.15392 . ISSN 1462-2920. PMID 33427409. S2CID 231576517.
- ^ Berlec, Aleš (1 de septiembre de 2012). "Nuevas técnicas y hallazgos en el estudio de la microbiota vegetal: búsqueda de probióticos vegetales". Plant Science . 193–194: 96–102. Bibcode :2012PlnSc.193...96B. doi :10.1016/j.plantsci.2012.05.010. PMID 22794922.
- ^ Whipps, Jm; Hand, P.; Pink, D.; Bending, Gd (1 de diciembre de 2008). "Microbiología de la filosfera con especial referencia a la diversidad y el genotipo de las plantas" (PDF) . Journal of Applied Microbiology . 105 (6): 1744–1755. doi :10.1111/j.1365-2672.2008.03906.x. ISSN 1365-2672. PMID 19120625. S2CID 35055151.
- ^ Chibucos MC, Tyler BM (2009). "Temas comunes en la adquisición de nutrientes por microbios simbióticos de plantas, descritos por la ontología genética". BMC Microbiology . 9(Suppl 1) (Suppl 1): S6. doi : 10.1186/1471-2180-9-S1-S6 . PMC 2654666 . PMID 19278554.
- ^ Kloepper, J. W (1993). "Rizobacterias promotoras del crecimiento de las plantas como agentes de control biológico". En Metting, FB Jr (ed.). Ecología microbiana del suelo: aplicaciones en la gestión agrícola y medioambiental . Nueva York: Marcel Dekker Inc., págs. 255–274. ISBN 978-0-8247-8737-0.
- ^ Bloemberg, GV; Lugtenberg, BJJ (2001). "Base molecular de la promoción del crecimiento de las plantas y el biocontrol por rizobacterias". Current Opinion in Plant Biology . 4 (4): 343–350. Bibcode :2001COPB....4..343B. doi :10.1016/S1369-5266(00)00183-7. PMID 11418345.
- ^ Palm, Noah W.; de Zoete, Marcel R.; Flavell, Richard A. (30 de junio de 2015). "Interacciones entre el sistema inmunitario y la microbiota en la salud y la enfermedad". Inmunología clínica . 159 (2): 122–127. doi :10.1016/j.clim.2015.05.014. ISSN 1521-6616. PMC 4943041 . PMID 26141651.
- ^ Round, June L.; O'Connell, Ryan M.; Mazmanian, Sarkis K. (2010). "Coordinación de las respuestas inmunitarias tolerogénicas por la microbiota comensal". Journal of Autoimmunity . 34 (3): J220–J225. doi :10.1016/j.jaut.2009.11.007. PMC 3155383 . PMID 19963349.
- ^ abc Cahenzli, Julia; Balmer, Maria L.; McCoy, Kathy D. (2012). "Interacción entre microorganismos e inmunidad y regulación del sistema inmunitario". Inmunología . 138 (1): 12–22. doi :10.1111/j.1365-2567.2012.03624.x. PMC 3533697 . PMID 22804726.
- ^ Rosenberg, Eugene; Zilber-Rosenberg, Ilana (2016). "Los microbios impulsan la evolución de animales y plantas: el concepto de hologenoma". mBio . 7 (2): e01395–15. doi :10.1128/mbio.01395-15. PMC 4817260 . PMID 27034283.
- ^ Blander, J Magarian; Longman, Randy S; Iliev, Iliyan D; Sonnenberg, Gregory F; Artis, David (19 de julio de 2017). "Regulación de la inflamación mediante interacciones de la microbiota con el huésped". Nature Immunology . 18 (8): 851–860. doi :10.1038/ni.3780. ISSN 1529-2908. PMC 5800875 . PMID 28722709.
- ^ Nikoopour, E; Singh, B (2014). "Reciprocidad en las interacciones entre el microbioma y el sistema inmunológico y sus implicaciones en la enfermedad y la salud". Inflamm Allergy Drug Targets . 13 (2): 94–104. doi :10.2174/1871528113666140330201056. PMID 24678760.
- ^ ab Rosenberg E, Koren O, Reshef L, Efrony R, Zilber-Rosenberg I (2007). "El papel de los microorganismos en la salud, la enfermedad y la evolución de los corales". Nature Reviews Microbiology . 5 (5): 355–362. doi :10.1038/nrmicro1635. PMID 17384666. S2CID 2967190.
- ^ Baird AH, Bhagooli R, Ralph PJ, Takahashi S (2009). "Blanqueamiento de corales: el papel del huésped" (PDF) . Tendencias en ecología y evolución . 24 (1): 16–20. Bibcode :2009TEcoE..24...16B. doi :10.1016/j.tree.2008.09.005. PMID 19022522.
- ^ Leggat W, Ainsworth T, Bythell J, Dove S, Gates R, Hoegh-Guldberg O, Iglesias-Prieto R, Yellowlees D (2007). "La teoría del hologenoma no tiene en cuenta el holobionte coralino". Nature Reviews Microbiology . 5 (10): Correspondencia en línea. doi : 10.1038/nrmicro1635-c1 . S2CID 9031305.
- ^ Ainsworth TD, Fine M, Roff G, Hoegh-Guldberg O (2008). "Las bacterias no son la causa principal del blanqueamiento en el coral mediterráneo Oculina patagonica". The ISME Journal . 2 (1): 67–73. Bibcode :2008ISMEJ...2...67A. doi : 10.1038/ismej.2007.88 . PMID 18059488. S2CID 1032896.
- ^ ab Kuczynski, J.; Lauber, CL; Walters, WA; Parfrey, LW; Clemente, JC; Gevers, D.; Knight, R. (2011). "Herramientas experimentales y analíticas para estudiar el microbioma humano". Nature Reviews Genetics . 13 (1): 47–58. doi :10.1038/nrg3129. PMC 5119550 . PMID 22179717.
- ^ Chakravorty, Soumitesh; Helb, Danica; Burday, Michele; Connell, Nancy; Alland, David (mayo de 2007). "Un análisis detallado de los segmentos del gen ARN ribosómico 16S para el diagnóstico de bacterias patógenas". Journal of Microbiological Methods . 69 (2): 330–339. doi :10.1016/j.mimet.2007.02.005. PMC 2562909 . PMID 17391789.
- ^ Soriano-Lerma, Ana; Pérez-Carrasco, Virginia; Sánchez-Marañón, Manuel; Ortiz-González, Matilde; Sánchez-Martín, Victoria; Gijón, Juan; Navarro-Mari, José María; García-Salcedo, José Antonio; Soriano, Miguel (diciembre 2020). "Influencia de la región objetivo del ARNr 16S en el resultado de estudios de microbioma en muestras de suelo y saliva". Informes científicos . 10 (1): 13637. Código bibliográfico : 2020NatSR..1013637S. doi :10.1038/s41598-020-70141-8. ISSN 2045-2322. PMC 7423937 . PMID 32788589.
- ^ Marchesi, JR (2010). "Diversidad procariota y eucariota del intestino humano". Advances in Applied Microbiology Volumen 72. Vol. 72. págs. 43–62. doi :10.1016/S0065-2164(10)72002-5. ISBN 9780123809896. Número de identificación personal 20602987.
- ^ Vestheim, H.; Jarman, SN (2008). "Primers bloqueadores para mejorar la amplificación por PCR de secuencias raras en muestras mixtas: un estudio de caso sobre el ADN de presas en estómagos de krill antártico". Frontiers in Zoology . 5 : 12. doi : 10.1186/1742-9994-5-12 . PMC 2517594 . PMID 18638418.
- ^ "VAMPS: Visualización y análisis de estructuras de poblaciones microbianas". Bay Paul Center, MBL, Woods Hole . Consultado el 11 de marzo de 2012 .
- ^ Caporaso, JG; Kuczynski, J.; Stombaugh, J.; Bittinger, K.; bosquimano, FD; Costello, EK; Fierer, N.; Peña, AG; Goodrich, JK; Gordon, JI; Huttley, Georgia; Kelley, ST; Caballeros, D.; Koenig, JE; Ley, RE; Lozupone, California; McDonald, D.; Muegge, BD; Pirrung, M.; Reeder, J.; Sevinsky, JR; Turnbaugh, PJ; Walters, Washington; Widmann, J.; Yatsunenko, T.; Zaneveld, J.; Caballero, R. (2010). "QIIME permite el análisis de datos de secuenciación comunitaria de alto rendimiento". Métodos de la naturaleza . 7 (5): 335–336. doi :10.1038/nmeth.f.303. Número de modelo : PMID 20383131 .
- ^ Schloss, PD; Westcott, SL; Ryabin, T.; Hall, JR; Hartmann, M.; Hollister, EB; Lesniewski, RA; Oakley, BB; Parks, DH; Robinson, CJ; Sahl, JW; Stres, B.; Thallinger, GG; Van Horn, DJ; Weber, CF (2009). "Introducción de mothur: software de código abierto, independiente de la plataforma y con soporte comunitario para describir y comparar comunidades microbianas". Microbiología aplicada y ambiental . 75 (23): 7537–7541. Bibcode :2009ApEnM..75.7537S. doi :10.1128/AEM.01541-09. PMC 2786419 . PMID 19801464.
- ^ Callahan, Benjamin J.; McMurdie, Paul J.; Rosen, Michael J.; Han, Andrew W.; Johnson, Amy Jo A.; Holmes, Susan P. (julio de 2016). "DADA2: Inferencia de muestras de alta resolución a partir de datos de amplicones de Illumina". Nature Methods . 13 (7): 581–583. doi :10.1038/nmeth.3869. ISSN 1548-7105. PMC 4927377 . PMID 27214047.
- ^ Edgar, Robert C. (15 de octubre de 2016). "UNOISE2: corrección de errores mejorada para la secuenciación de amplicones Illumina 16S e ITS": 081257. doi :10.1101/081257. S2CID 784388.
{{cite journal}}: Requiere citar revista|journal=( ayuda ) - ^ Turnbaugh, PJ; Hamady, M.; Yatsunenko, T.; Cantarel, BL; Duncan, A.; Ley, RE; Sogin, ML; Jones, WJ; Roe, BA; Affourtit, JP; Egholm, M.; Henrissat, B.; Heath, AC; Knight, R.; Gordon, JI (2008). "Un microbioma intestinal central en gemelos obesos y delgados". Nature . 457 (7228): 480–484. Bibcode :2009Natur.457..480T. doi :10.1038/nature07540. PMC 2677729 . PMID 19043404.
- ^ Qin, J.; Li, R.; Raes, J.; Arumugam, M.; Burgdorf, KS; Manichanh, C.; Nielsen, T.; Pons, N.; Levénez, F.; Yamada, T.; Mendé, DR; Li, J.; Xu, J.; Li, S.; Li, D.; Cao, J.; Wang, B.; Liang, H.; Zheng, H.; Xie, Y.; Toque, J.; Lepage, P.; Bertalán, M.; Batto, JM; Hansen, T.; Le Paslier, D.; Linneberg, A.; Nielsen, HBR; Pelletier, E.; Renault, P. (2010). "Un catálogo de genes microbianos del intestino humano establecido mediante secuenciación metagenómica". Naturaleza . 464 (7285): 59–65. Código Bibliográfico :2010Natur.464...59.. doi :10.1038/nature08821. PMC 3779803. PMID 20203603 .
- ^ Tringe, SG; Von Mering, C.; Kobayashi, A.; Salamov, AA; Chen, K.; Chang, HW; Podar, M.; Short, JM; Mathur, EJ; Detter, JC; Bork, P.; Hugenholtz, P.; Rubin, EM (2005). "Metagenómica comparativa de comunidades microbianas". Science . 308 (5721): 554–557. Bibcode :2005Sci...308..554T. CiteSeerX 10.1.1.377.2288 . doi :10.1126/science.1107851. PMID 15845853. S2CID 161283.
- ^ Wooley, JC; Godzik, A.; Friedberg, I. (2010). Bourne, Philip E. (ed.). "Una introducción a la metagenómica". PLOS Computational Biology . 6 (2): e1000667. Bibcode :2010PLSCB...6E0667W. doi : 10.1371/journal.pcbi.1000667 . PMC 2829047 . PMID 20195499.
- ^ Watson, Mick; Roehe, Rainer; Walker, Alan W.; Dewhurst, Richard J.; Snelling, Timothy J.; Ivan Liachko; Langford, Kyle W.; Press, Maximilian O.; Wiser, Andrew H. (28 de febrero de 2018). "Ensamblaje de 913 genomas microbianos a partir de la secuenciación metagenómica del rumen de la vaca". Nature Communications . 9 (1): 870. Bibcode :2018NatCo...9..870S. doi :10.1038/s41467-018-03317-6. ISSN 2041-1723. PMC 5830445 . PMID 29491419.
- ^ Muller, J.; Szklarczyk, D.; Julien, P.; Letunic, I.; Roth, A.; Kuhn, M.; Powell, S.; Von Mering, C.; Doerks, T.; Jensen, LJ; Bork, P. (2009). "EggNOG v2.0: Extendiendo la genealogía evolutiva de genes con grupos ortólogos no supervisados mejorados, especies y anotaciones funcionales". Nucleic Acids Research . 38 (número de base de datos): D190–D195. doi :10.1093/nar/gkp951. PMC 2808932 . PMID 19900971.
- ^ Kanehisa, M.; Goto, S.; Furumichi, M.; Tanabe, M.; Hirakawa, M. (2009). "KEGG para la representación y análisis de redes moleculares que involucran enfermedades y fármacos". Nucleic Acids Research . 38 (número de base de datos): D355–D360. doi :10.1093/nar/gkp896. PMC 2808910 . PMID 19880382.
- ^ Meyer, F.; Paarmann, D.; d'Souza, M.; Olson, R.; Glass, EM; Kubal, M.; Paczian, T.; Rodriguez, A.; Stevens, R.; Wilke, A.; Wilkening, J.; Edwards, RA (2008). "El servidor metagenómico RAST: un recurso público para el análisis filogenético y funcional automático de metagenomas". BMC Bioinformatics . 9 : 386. doi : 10.1186/1471-2105-9-386 . PMC 2563014 . PMID 18803844.
- ^ Sun, S.; Chen, J.; Li, W.; Altintas, I.; Lin, A.; Peltier, S.; Stocks, K.; Allen, EE; Ellisman, M.; Grethe, J.; Wooley, J. (2010). "Ciberinfraestructura comunitaria para la investigación y el análisis avanzados de la ecología microbiana: el recurso CAMERA". Nucleic Acids Research . 39 (número de la base de datos): D546–D551. doi :10.1093/nar/gkq1102. PMC 3013694 . PMID 21045053.
- ^ Markowitz, VM; Ivanova, NN; Szeto, E.; Palaniappan, K.; Chu, K.; Dalevi, D.; Chen, IMA; Grechkin, Y.; Dubchak, I.; Anderson, I.; Lykidis, A.; Mavromatis, K.; Hugenholtz, P.; Kyrpides, Carolina del Norte (2007). "IMG/M: un sistema de análisis y gestión de datos para metagenomas". Investigación de ácidos nucleicos . 36 (Problema de la base de datos): D534 – D538. doi : 10.1093/nar/gkm869. PMC 2238950 . PMID 17932063.
- ^ Shi, Y.; Tyson, GW; Delong, EF (2009). "La metatranscriptómica revela ARN pequeños microbianos únicos en la columna de agua del océano". Nature . 459 (7244): 266–269. Bibcode :2009Natur.459..266S. doi :10.1038/nature08055. PMID 19444216. S2CID 4340144.
- ^ Jiménez, RM; Delwart, E.; Luptak, A (2011). "La búsqueda basada en la estructura revela ribozimas Hammerhead en el microbioma humano". Journal of Biological Chemistry . 286 (10): 7737–7743. doi : 10.1074/jbc.C110.209288 . PMC 3048661 . PMID 21257745.
- ^ Maron, PA; Ranjard, L.; Mougel, C.; Lemanceau, P. (2007). "Metaproteómica: un nuevo enfoque para estudiar la ecología microbiana funcional". Ecología microbiana . 53 (3): 486–493. Bibcode :2007MicEc..53..486M. doi :10.1007/s00248-006-9196-8. PMID 17431707. S2CID 26953155.
- ^ ab "NIH Human Microbiome Project". Institutos Nacionales de Salud de EE. UU., Departamento de Salud y Servicios Humanos, Gobierno de EE. UU. 2016. Archivado desde el original el 11 de junio de 2016 . Consultado el 14 de junio de 2016 .
- ^ Gilbert, JA; Meyer, F.; Antonopoulos, D.; et al. (2010). "Informe de la reunión: Taller sobre metagenómica de terabase y la visión de un proyecto de microbioma terrestre". Estándares en ciencias genómicas . 3 (3): 243–248. doi :10.4056/sigs.1433550. PMC 3035311 . PMID 21304727.
- ^ Gilbert, JA; O'Dor, R.; King, N.; Vogel, TM (2011). "La importancia de los estudios metagenómicos para la ecología microbiana: o por qué Darwin habría sido un científico metagenómico". Microbial Informatics and Experimentation . 1 (1): 5. doi : 10.1186/2042-5783-1-5 . PMC 3348666 . PMID 22587826.
- ^ Ibrahim, Nesma (1 de julio de 2018). "Microbiota intestinal y diabetes mellitus tipo 2: ¿cuál es el vínculo?". Revista afroegipcia de enfermedades infecciosas y endémicas . 6 (2): 112–119. doi : 10.21608/aeji.2018.9950 . ISSN 2090-7184. S2CID 3900880.
- ^ Thursby, Elizabeth; Juge, Nathalie (1 de junio de 2017). "Introducción a la microbiota intestinal humana". Revista bioquímica . 474 (11): 1823–1836. doi :10.1042/BCJ20160510. ISSN 0264-6021. PMC 5433529 . PMID 28512250.
- ^ abc Muñoz-Garach, Araceli; Díaz-Perdigones, Cristina; Tinahones, Francisco J. (diciembre 2016). "Microbiota y diabetes mellitus tipo 2". Endocrinología y Nutrición (en español). 63 (10): 560–568. doi :10.1016/j.endonu.2016.07.008. PMID 27633134.
- ^ Blandino, G.; Inturri, R.; Lazzara, F.; Di Rosa, M.; Malaguarnera, L. (1 de noviembre de 2016). "Impacto de la microbiota intestinal en la diabetes mellitus". Diabetes y metabolismo . 42 (5): 303–315. doi :10.1016/j.diabet.2016.04.004. ISSN 1262-3636. PMID 27179626.
- ^ Vandenplas, Y., Carnielli, VP, Ksiazyk, J., Luna, MS, Migacheva, N., Mosselmans, JM, ... y Wabitsch, M. (2020), Factores que afectan el desarrollo de la microbiota intestinal en las primeras etapas de la vida. Nutrición, 78, 110812.
- ^ Korpela K, Helve O, Kolho KL, Saisto T, Skogberg K, Dikareva E, Stefanovic V, Salonen A, Andersson S, de Vos WM. El trasplante de microbiota fecal materna en bebés nacidos por cesárea restaura rápidamente el desarrollo microbiano intestinal normal: un estudio de prueba de concepto. Cell. 15 de octubre de 2020;183(2):324-334.e5. doi: 10.1016/j.cell.2020.08.047. Publicación electrónica 1 de octubre de 2020. PMID 33007265.
- ^ Korpela, K., Salonen, A., Saxen, H., Nikkonen, A., Peltola, V., Jaakkola, T., ... y Kolho, KL (2020). Los antibióticos en las primeras etapas de la vida se asocian con firmas específicas de la microbiota intestinal en una cohorte infantil longitudinal prospectiva. Investigación pediátrica, 1-6
- ^ Schei, K., Simpson, MR, Avershina, E., Rudi, K., Øien, T., Júlíusson, PB, ... y Ødegård, RA (2020). Microbiota fúngica y bacteriana intestinal temprana y crecimiento infantil. Frontiers in pediatrics, 8, 658
- ^ Korpela, K., Salonen, A., Virta, LJ, Kekkonen, RA, Forslund, K., Bork, P. y De Vos, WM (2016). El microbioma intestinal está relacionado con el uso de antibióticos a lo largo de la vida en niños finlandeses en edad preescolar. Nature communications, 7, 10410
- ^ Korpela, K., Salonen, A., Saxen, H., Nikkonen, A., Peltola, V., Jaakkola, T., ... y Kolho, KL (2020). Los antibióticos en las primeras etapas de la vida se asocian con firmas específicas de la microbiota intestinal en una cohorte infantil longitudinal prospectiva. Investigación pediátrica, 1-6.
- ^ abc Seelbinder, B., Chen, J., Brunke, S., Vazquez-Uribe, R., Santhaman, R., Meyer, AC, ... y Panagiotou, G. (2020). Los antibióticos crean un cambio del mutualismo a la competencia en las comunidades intestinales humanas con un impacto más duradero en los hongos que en las bacterias. Microbiome, 8(1), 1-20
- ^ Cabral, DJ, Penumutchu, S., Norris, C., Morones-Ramirez, JR, & Belenky, P. (2018). La competencia microbiana entre Escherichia coli y Candida albicans revela un factor fungicida soluble. Microbial cell, 5(5), 249
- ^ Peleg, AY, Hogan, DA y Mylonakis, E. (2010). Interacciones entre bacterias y hongos de importancia médica. Nature Reviews Microbiology, 8(5), 340-349
- ^ Sokol H, Leducq V, Aschard H, Pham HP, Jegou S, Landman C, Cohen D, Liguori G, Bourrier A, Nion-Larmurier I, Cosnes J, Seksik P, Langella P, Skurnik D, Richard ML, Beaugerie L Disbiosis de la microbiota fúngica en la EII. Gut 2017;66:1039–1048. doi: 10.1136/gutjnl-2015-310746
- ^ Rebecka Ventin-Holmberg, Anja Eberl, Schahzad Saqib, Katri Korpela, Seppo Virtanen, Taina Sipponen, Anne Salonen, Päivi Saavalainen, Eija Nissilä, perfiles bacterianos y fúngicos como marcadores de la respuesta al fármaco infliximab en la enfermedad inflamatoria intestinal, Journal of Crohn's and Colitis , 2020;, jjaa252, https://doi.org/10.1093/ecco-jcc/jjaa252
- ^ El Hage, R., Hernandez-Sanabria, E., Calatayud Arroyo, M., Props, R., & Van de Wiele, T. (2019). El consorcio productor de propionato restaura la disbiosis inducida por antibióticos en un modelo dinámico in vitro del ecosistema microbiano intestinal humano. Frontiers in microbiology, 10, 1206.
- ^ Tian, X., Hellman, J., Horswill, AR, Crosby, HA, Francis, KP y Prakash, A. (2019). Los niveles elevados de propionato derivado del microbioma intestinal se asocian con una menor inflamación pulmonar estéril y una menor inmunidad bacteriana en ratones. Frontiers in microbiology, 10, 159.
- ^ Li, Y., Faden, HS y Zhu, L. (2020). La respuesta de la microbiota intestinal a los cambios en la dieta durante los dos primeros años de vida. Frontiers in Pharmacology, 11, 334.
- ^ Revista, Ewen. "El ADN microbiano en el cuerpo humano puede utilizarse para identificar individuos". Scientific American . Consultado el 17 de mayo de 2015 .
- ^ Callaway, Ewen (2015). "Los microbiomas plantean problemas de privacidad". Nature . 521 (7551): 136. Bibcode :2015Natur.521..136C. doi : 10.1038/521136a . PMID 25971486. S2CID 4393347.
- ^ Yong, Ed (11 de mayo de 2015). "¿Pueden los microbios que dejas atrás usarse para identificarte?". National Geographic . Archivado desde el original el 30 de mayo de 2015. Consultado el 17 de mayo de 2015 .





