Pirosecuenciación
La pirosecuenciación es un método de secuenciación de ADN (determinación del orden de los nucleótidos en el ADN) basado en el principio de "secuenciación por síntesis", en el que la secuenciación se realiza detectando el nucleótido incorporado por una ADN polimerasa . La pirosecuenciación se basa en la detección de luz basada en una reacción en cadena cuando se libera pirofosfato . De ahí el nombre de pirosecuenciación.
El principio de pirosecuenciación fue descrito por primera vez en 1993 [1] por Bertil Pettersson, Mathias Uhlen y Pål Nyren combinando el método de secuenciación en fase sólida [2] usando perlas magnéticas recubiertas de estreptavidina con ADN polimerasa recombinante carente de actividad 3' a 5' exonucleasa (corrección de pruebas) y detección de luminiscencia usando la enzima luciferasa de luciérnaga . [3] Una mezcla de tres enzimas ( ADN polimerasa , ATP sulfurilasa y luciferasa de luciérnaga ) y un nucleótido ( dNTP ) se agregan al ADN monocatenario que se va a secuenciar y la incorporación del nucleótido se sigue midiendo la luz emitida. La intensidad de la luz determina si se han incorporado 0, 1 o más nucleótidos, mostrando así cuántos nucleótidos complementarios están presentes en la cadena molde. La mezcla de nucleótidos se elimina antes de agregar la siguiente mezcla de nucleótidos. Este proceso se repite con cada uno de los cuatro nucleótidos hasta que se determina la secuencia de ADN de la plantilla monocatenaria.
En 1998 [4] , Mostafa Ronaghi , Mathias Uhlen y Pål Nyren describieron un segundo método basado en soluciones para la pirosecuenciación . En este método alternativo, se introduce una enzima adicional, la apirasa, para eliminar los nucleótidos que no son incorporados por la ADN polimerasa. Esto permitió que la mezcla de enzimas que incluye la ADN polimerasa , la luciferasa y la apirasa se añadiera al principio y se mantuviera durante todo el procedimiento, proporcionando así una configuración sencilla adecuada para la automatización. Al año siguiente, la empresa Pyrosequencing introdujo en el mercado un instrumento automatizado basado en este principio.
En 2005 [5] Jonathan Rothberg y sus colaboradores de la empresa 454 Life Sciences describieron una tercera variante microfluídica del método de pirosecuenciación . Este enfoque alternativo para la pirosecuenciación se basaba en el principio original de unir el ADN que se iba a secuenciar a un soporte sólido y demostraron que la secuenciación se podía realizar de una manera altamente paralela utilizando una micromatriz microfabricada . Esto permitió una secuenciación de ADN de alto rendimiento y se introdujo en el mercado un instrumento automatizado. Este se convirtió en el primer instrumento de secuenciación de próxima generación que inició una nueva era en la investigación genómica , con precios en rápida caída para la secuenciación de ADN que permitieron la secuenciación del genoma completo a precios asequibles.
Procedimiento
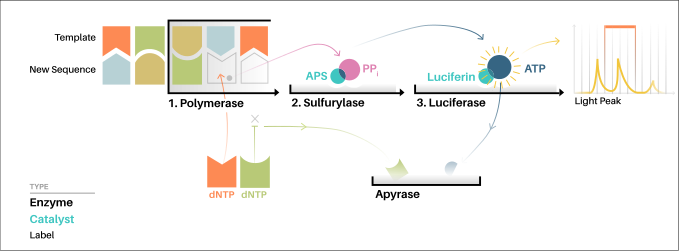
La "secuenciación por síntesis" implica tomar una sola hebra del ADN que se va a secuenciar y luego sintetizar enzimáticamente su hebra complementaria. El método de pirosecuenciación se basa en detectar la actividad de la ADN polimerasa (una enzima que sintetiza ADN) con otra enzima quimioluminiscente . Básicamente, el método permite secuenciar una sola hebra de ADN sintetizando la hebra complementaria a lo largo de ella, un par de bases a la vez, y detectando qué base se agregó realmente en cada paso. El ADN molde es inmóvil y las soluciones de nucleótidos A, C, G y T se agregan y eliminan secuencialmente de la reacción. La luz se produce solo cuando la solución de nucleótidos complementa la primera base no apareada del molde. La secuencia de soluciones que producen señales quimioluminiscentes permite la determinación de la secuencia del molde. [6]
Para la versión basada en solución de la pirosecuenciación, la plantilla de ADN monocatenario ( ssDNA ) se hibrida con un cebador de secuenciación y se incuba con las enzimas ADN polimerasa , ATP sulfurilasa , luciferasa y apirasa , y con los sustratos adenosina 5' fosfosulfato (APS) y luciferina .
- La adición de uno de los cuatro desoxinucleótidos trifosfato ( dNTP ) (dATPαS, que no es un sustrato para una luciferasa, se añade en lugar de dATP para evitar el ruido) inicia el segundo paso. La ADN polimerasa incorpora los dNTP complementarios correctos a la plantilla. Esta incorporación libera pirofosfato (PPi).
- La ATP sulfurilasa convierte el PPi en ATP en presencia de adenosina 5' fosfosulfato. Este ATP actúa como sustrato para la conversión mediada por la luciferasa de luciferina a oxiluciferina que genera luz visible en cantidades proporcionales a la cantidad de luz. La luz producida en la reacción catalizada por la luciferasa es detectada por una cámara y analizada en un programa.
- Los nucleótidos no incorporados y el ATP son degradados por la apirasa y la reacción puede reiniciarse con otro nucleótido.
El proceso se puede representar mediante las siguientes ecuaciones:
- PPi + APS → ATP + Sulfato (catalizado por ATP-sulfurilasa);
- ATP + luciferina + O2 → AMP + PPi + oxiluciferina + CO 2 + hv (catalizado por luciferasa);
dónde:
- PPi es pirofosfato
- APS es adenosina 5-fosfosulfato;
- ATP es trifosfato de adenosina;
- O2 es una molécula de oxígeno;
- AMP es monofosfato de adenosina;
- CO 2 es dióxido de carbono;
- hv es luz.
Limitaciones
Actualmente, una limitación del método es que las longitudes de las lecturas individuales de la secuencia de ADN están en el orden de los 300-500 nucleótidos, más cortas que los 800-1000 que se pueden obtener con los métodos de terminación de cadena (por ejemplo, la secuenciación de Sanger). Esto puede dificultar el proceso de ensamblaje del genoma , en particular para secuencias que contienen una gran cantidad de ADN repetitivo . La falta de actividad de corrección de pruebas limita la precisión de este método.
Comercialización
La empresa Pyrosequencing AB en Uppsala, Suecia, fue fundada con capital de riesgo proporcionado por HealthCap con el fin de comercializar maquinaria y reactivos para secuenciar tramos cortos de ADN utilizando la técnica de pirosecuenciación. Pyrosequencing AB cotizó en la Bolsa de Valores de Estocolmo en 1999. Pasó a llamarse Biotage en 2003. [7] La línea de negocio de pirosecuenciación fue adquirida por Qiagen en 2008. La tecnología de pirosecuenciación fue licenciada a 454 Life Sciences . 454 desarrolló una tecnología de pirosecuenciación basada en matrices que surgió como una plataforma para la secuenciación de ADN a gran escala , incluida la secuenciación del genoma y la metagenómica .
Roche anunció la discontinuación de la plataforma de secuenciación 454 en 2013. [8]
Referencias
- ^ Nyren, Pettersson y Uhlen (1993) “Minisecuenciación de ADN en fase sólida mediante un ensayo enzimático luminométrico de detección de pirofosfato inorgánico” Analytical Biochemistry 208 (1), 171-175, https://doi.org/10.1006/abio.1993.1024
- ^ Uhlen (1989) ”Separación magnética del ADN” Nature 340: 733-4, https://doi.org/10.1038/340733a0
- ^ Nyren y Lundin (1985) “Método enzimático para el monitoreo continuo de la síntesis de pirofosfato inorgánico” Analytiocal Biochemistry 151 (2): 504-509. https://doi.org/10.1016/0003-2697(85)90211-8
- ^ Ronaghi, Mostafa; Uhlén, Mathías; Nyrén, Pål (17 de julio de 1998). "Un método de secuenciación basado en pirofosfato en tiempo real". Ciencia . 281 (5375): 363–365. doi : 10.1126/ciencia.281.5375.363. PMID 9705713. S2CID 26331871.
- ^ Marguiles et al (2005) “Secuenciación del genoma en reactores de picolitros de alta densidad microfabricados” Nature 437, 376-380. https://doi.org/doi:10.1038/nature03959;
- ^ QIAGEN. «Descripción general de la tecnología y plataforma de pirosecuenciación» . Consultado el 4 de agosto de 2017 .
- ^ Biotage. "Historia de Biotage". www.biotage.com . Consultado el 19 de septiembre de 2022 .
- ^ Hollmer, Mark (17 de octubre de 2013). "Roche cerrará 454 Life Sciences porque reducirá su enfoque en la secuenciación genética". Fierce Biotech .