Metabolismo de las purinas
This article includes a list of general references, but it lacks sufficient corresponding inline citations. (July 2014) |
El metabolismo de las purinas se refiere a las vías metabólicas para sintetizar y descomponer las purinas que están presentes en muchos organismos.
Biosíntesis
Las purinas se sintetizan biológicamente como nucleótidos y, en particular, como ribótidos, es decir, bases unidas a la ribosa 5-fosfato . Tanto la adenina como la guanina derivan del nucleótido inosina monofosfato (IMP), que es el primer compuesto de la vía en tener un sistema de anillo de purina completamente formado.
DIABLILLO
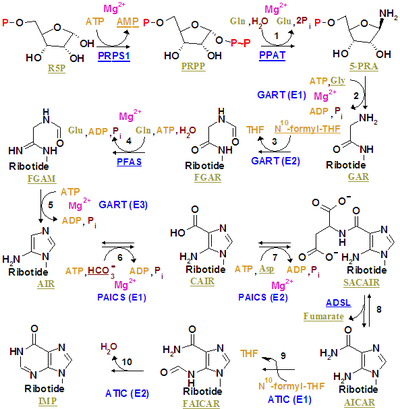
El monofosfato de inosina se sintetiza en una ribosa-fosfato preexistente a través de una vía compleja (como se muestra en la figura de la derecha). La fuente de los átomos de carbono y nitrógeno del anillo de purina, 5 y 4 respectivamente, proviene de múltiples fuentes. El aminoácido glicina contribuye con todos sus átomos de carbono (2) y nitrógeno (1), con átomos de nitrógeno adicionales de glutamina (2) y ácido aspártico (1), y átomos de carbono adicionales de grupos formilo (2), que se transfieren desde la coenzima tetrahidrofolato como 10-formiltetrahidrofolato , y un átomo de carbono del bicarbonato (1). Los grupos formilo construyen carbono-2 y carbono-8 en el sistema del anillo de purina, que son los que actúan como puentes entre dos átomos de nitrógeno.
Un paso regulador clave es la producción de 5-fosfo-α- D -ribosil 1-pirofosfato ( PRPP ) por la ribosa fosfato pirofosfoquinasa, que se activa con fosfato inorgánico e inactiva con ribonucleótidos de purina. No es el paso comprometido para la síntesis de purina porque el PRPP también se utiliza en la síntesis de pirimidina y en las vías de recuperación.
El primer paso comprometido es la reacción de PRPP, glutamina y agua a 5'-fosforribosilamina (PRA), glutamato y pirofosfato , catalizada por la amidofosforribosiltransferasa , que es activada por PRPP e inhibida por AMP , GMP e IMP .
- PRPP + L-Glutamina + H 2 O → PRA + L-Glutamato + PPi
En el segundo paso, la PRA , la glicina y el ATP reaccionan para crear GAR , ADP y pirofosfato, catalizado por la fosforribosilamina-glicina ligasa (GAR sintetasa). Debido a la labilidad química de la PRA, que tiene una vida media de 38 segundos a pH 7,5 y 37 °C, los investigadores han sugerido que el compuesto se canaliza desde la amidofosforibosiltransferasa a la GAR sintetasa in vivo. [1]
- PRA + Glicina + ATP → GAR + ADP + Pi
La tercera es catalizada por la fosforribosilglicinamida formiltransferasa .
La cuarta es catalizada por la fosforribosilformilglicinamidina sintasa .
- fGAR + L-Glutamina + ATP → fGAM + L-Glutamato + ADP + Pi
La quinta es catalizada por la AIR sintetasa (FGAM ciclasa) .
- fGAM + ATP → AIRE + ADP + Pi + H2O
La sexta es catalizada por la fosforribosilaminoimidazol carboxilasa .
La séptima es catalizada por la fosforribosilaminoimidazolesuccinocarboxamida sintasa .
- CAIR + L-Aspartato + ATP → SAICAR + ADP + Pi
El ocho es catalizado por la adenilosuccinato liasa .
Los productos AICAR y fumarato pasan a dos vías diferentes. AICAR sirve como reactivo para el noveno paso, mientras que fumarato es transportado al ciclo del ácido cítrico, que luego puede omitir los pasos de evolución del dióxido de carbono para producir malato. La conversión de fumarato en malato es catalizada por la fumarasa. De esta manera, el fumarato conecta la síntesis de purinas con el ciclo del ácido cítrico. [2]
La novena es catalizada por la fosforribosilaminoimidazolcarboxamida formiltransferasa .
- AICAR + fTHF → FAICAR + THF
El último paso es catalizado por la inosina monofosfato sintasa .
- FAICAR → IMP + H2O
En los eucariotas, el segundo, tercer y quinto paso son catalizados por la proteína biosintética de purina trifuncional adenosina-3 , que está codificada por el gen GART.
Tanto el noveno como el décimo paso se llevan a cabo mediante una única proteína denominada proteína de biosíntesis de purina bifuncional PURH, codificada por el gen ATIC.
BPF
- La IMP deshidrogenasa (IMPDH) convierte IMP en XMP
- La GMP sintasa convierte XMP en GMP
- La GMP reductasa convierte GMP nuevamente en IMP
AMPERIO
- La adenilosuccinato sintasa convierte el IMP en adenilosuccinato
- La adenilosuccinato liasa convierte el adenilosuccinato en AMP
- La AMP desaminasa convierte el AMP nuevamente en IMP
Degradación
Las purinas son metabolizadas por varias enzimas :
Guanina
- Una nucleasa libera el nucleótido
- Una nucleotidasa crea guanosina.
- La purina nucleósido fosforilasa convierte la guanosina en guanina
- La guanasa convierte la guanina en xantina
- La xantina oxidasa (una forma de xantina oxidorreductasa) cataliza la oxidación de la xantina a ácido úrico .
Adenina
- Una nucleasa libera el nucleótido
- Una nucleotidasa crea adenosina , luego la adenosina desaminasa crea inosina.
- Alternativamente, la AMP desaminasa crea ácido inosínico , luego una nucleotidasa crea inosina.
- La purina nucleósido fosforilasa actúa sobre la inosina para crear hipoxantina.
- La xantina oxidasa cataliza la biotransformación de hipoxantina en xantina.
- La xantina oxidasa actúa sobre la xantina para crear ácido úrico.
Regulaciones de la biosíntesis de nucleótidos de purina
La formación de 5'-fosforribosilamina a partir de glutamina y PRPP catalizada por la PRPP aminotransferasa es el punto de regulación para la síntesis de purina. La enzima es una enzima alostérica, por lo que puede convertirse de IMP, GMP y AMP en alta concentración se une a la enzima para ejercer inhibición mientras que el PRPP en gran cantidad se une a la enzima que causa la activación. Por lo tanto, IMP, GMP y AMP son inhibidores mientras que el PRPP es un activador. Entre la formación de 5'-fosforribosil, aminoimidazol e IMP, no hay ningún paso de regulación conocido.
Salvar
Las purinas provenientes del recambio de ácidos nucleicos celulares (o de los alimentos) también pueden recuperarse y reutilizarse en nuevos nucleótidos.
- La enzima adenina fosforribosiltransferasa (APRT) recupera la adenina .
- La enzima hipoxantina-guanina fosforribosiltransferasa (HGPRT) recupera guanina e hipoxantina . [3] (La deficiencia genética de HGPRT causa el síndrome de Lesch-Nyhan ).
Trastornos
Cuando un gen defectuoso provoca la aparición de lagunas en el proceso de reciclaje metabólico de las purinas y las pirimidinas, estas sustancias químicas no se metabolizan adecuadamente y los adultos o los niños pueden sufrir cualquiera de los veintiocho trastornos hereditarios, posiblemente algunos más aún desconocidos. Los síntomas pueden incluir gota , anemia, epilepsia, retraso en el desarrollo, sordera, morderse compulsivamente, insuficiencia renal o cálculos renales o pérdida de inmunidad.
El metabolismo de las purinas puede presentar desequilibrios que pueden surgir de la incorporación de trifosfatos de nucleótidos nocivos al ADN y al ARN, lo que a su vez conduce a alteraciones genéticas y mutaciones y, como resultado, da lugar a varios tipos de enfermedades. Algunas de las enfermedades son:
- Inmunodeficiencia grave por pérdida de adenosina desaminasa.
- Hiperuricemia y síndrome de Lesch-Nyhan por pérdida de hipoxantina-guanina fosforribosiltransferasa.
- Diferentes tipos de cáncer se pueden producir por un aumento en la actividad de enzimas como la IMP deshidrogenasa. [4]
Farmacoterapia
La modulación del metabolismo de las purinas tiene valor farmacoterapéutico.
Los inhibidores de la síntesis de purinas inhiben la proliferación de células, especialmente de leucocitos . Entre estos inhibidores se encuentra la azatioprina , un inmunosupresor utilizado en el trasplante de órganos , enfermedades autoinmunes como la artritis reumatoide o enfermedades inflamatorias del intestino como la enfermedad de Crohn y la colitis ulcerosa .
El micofenolato de mofetilo es un fármaco inmunosupresor utilizado para prevenir el rechazo en el trasplante de órganos; inhibe la síntesis de purinas al bloquear la inosina monofosfato deshidrogenasa (IMPDH). [5] El metotrexato también inhibe indirectamente la síntesis de purinas al bloquear el metabolismo del ácido fólico (es un inhibidor de la dihidrofolato reductasa ).
El alopurinol es un fármaco que inhibe la enzima xantina oxidorreductasa y, por tanto, reduce el nivel de ácido úrico en el organismo. Esto puede ser útil en el tratamiento de la gota, que es una enfermedad causada por el exceso de ácido úrico, que forma cristales en las articulaciones.
Síntesis prebiótica de ribonucleósidos de purina
Para entender cómo surgió la vida , es necesario conocer las vías químicas que permiten la formación de los componentes básicos de la vida en condiciones prebióticas plausibles . Nam et al. [6] demostraron la condensación directa de nucleobases de purina y pirimidina con ribosa para dar ribonucleósidos en microgotas acuosas, un paso clave que conduce a la formación de ARN. Además, Becker et al. [7] presentaron un proceso prebiótico plausible para sintetizar ribonucleósidos de purina.
Biosíntesis de purinas en los tres dominios de la vida
Los organismos en los tres dominios de la vida, eucariotas , bacterias y arqueas , son capaces de llevar a cabo la biosíntesis de novo de purinas. Esta capacidad refleja la esencialidad de las purinas para la vida. La vía bioquímica de síntesis es muy similar en eucariotas y especies bacterianas, pero es más variable entre especies arqueales. [8] Se determinó que un conjunto casi completo, o completo, de genes requeridos para la biosíntesis de purinas estaba presente en 58 de las 65 especies arqueales estudiadas. [8] Sin embargo, también se identificaron siete especies arqueales con genes codificadores de purinas totalmente, o casi totalmente, ausentes. Aparentemente, las especies arqueales incapaces de sintetizar purinas son capaces de adquirir purinas exógenas para el crecimiento., [8] y por lo tanto son similares a los mutantes de purinas de eucariotas, por ejemplo, mutantes de purinas del hongo Ascomycete Neurospora crassa , [9] que también requieren purinas exógenas para el crecimiento.
Véase también
Referencias
- ^ Antle VD, Liu D, McKellar BR, Caperelli CA, Hua M, Vince R (abril de 1996). "Especificidad de sustrato de la glicinamida ribonucleótido sintetasa de hígado de pollo". The Journal of Biological Chemistry . 271 (14): 8192–5. doi : 10.1074/jbc.271.14.8192 . PMID 8626510.
- ^ Garrett RH, Grisham CM (2016). Bioquímica (6.ª ed.). Cengage Learning. pp. 666, 934. ISBN 9781305577206.OCLC 914290655 .
- ^ Ansari MY, Equbal A, Dikhit MR, Mansuri R, Rana S, Ali V, et al. (febrero de 2016). "Establecimiento de correlación entre el análisis de pruebas in silico e in vitro contra inhibidores de HGPRT de Leishmania". Revista internacional de macromoléculas biológicas . 83 : 78–96. doi :10.1016/j.ijbiomac.2015.11.051. PMID 26616453.
- ^ Pang B, McFaline JL, Burgis NE, Dong M, Taghizadeh K, Sullivan MR, et al. (febrero de 2012). "Los defectos en el metabolismo de los nucleótidos de purina conducen a una incorporación sustancial de xantina e hipoxantina en el ADN y el ARN". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 109 (7): 2319–24. Bibcode :2012PNAS..109.2319P. doi : 10.1073/pnas.1118455109 . JSTOR 41477470. PMC 3289290 . PMID 22308425.
- ^ "Monografía sobre micofenolato para profesionales". Drugs.com . Archivado desde el original el 21 de abril de 2020. Consultado el 28 de octubre de 2019 .
- ^ Nam I, Nam HG, Zare RN (enero de 2018). "Síntesis abiótica de ribonucleósidos de purina y pirimidina en microgotas acuosas". Proc Natl Acad Sci USA . 115 (1): 36–40. Bibcode :2018PNAS..115...36N. doi : 10.1073/pnas.1718559115 . PMC 5776833 . PMID 29255025.
- ^ Becker S, Thoma I, Deutsch A, Gehrke T, Mayer P, Zipse H, Carell T (mayo de 2016). "Una vía de formación de nucleósidos de purina prebióticos estrictamente regioselectiva y de alto rendimiento". Science . 352 (6287): 833–6. Bibcode :2016Sci...352..833B. doi :10.1126/science.aad2808. PMID 27174989.
- ^ abc Brown AM, Hoopes SL, White RH, Sarisky CA (diciembre de 2011). "Biosíntesis de purina en arqueas: variaciones sobre un tema". Biol Direct . 6 : 63. doi : 10.1186/1745-6150-6-63 . PMC 3261824 . PMID 22168471.
- ^ Bernstein H (1961). "Compuestos de imidazol acumulados por mutantes de purina de Neurospora crassa". J. Gen. Microbiol . 25 (1): 41–46. doi : 10.1099/00221287-25-1-41 .
Enlaces externos
- La página de bioquímica médica
- Metabolismo de las purinas: vía de referencia
- PUMPA: Asociación de Pacientes Metabólicos con Purinas
