Mecanismo de reacción
En química , un mecanismo de reacción es la secuencia paso a paso de reacciones elementales mediante las cuales se produce la reacción química general . [1]
Un mecanismo químico es una conjetura teórica que intenta describir en detalle lo que ocurre en cada etapa de una reacción química general. Los pasos detallados de una reacción no son observables en la mayoría de los casos. El mecanismo conjeturado se elige porque es termodinámicamente factible y tiene respaldo experimental en intermediarios aislados (ver la siguiente sección) u otras características cuantitativas y cualitativas de la reacción. También describe cada intermediario reactivo , complejo activado y estado de transición , qué enlaces se rompen (y en qué orden) y qué enlaces se forman (y en qué orden). Un mecanismo completo también debe explicar la razón de los reactivos y el catalizador utilizados, la estereoquímica observada en reactivos y productos, todos los productos formados y la cantidad de cada uno.

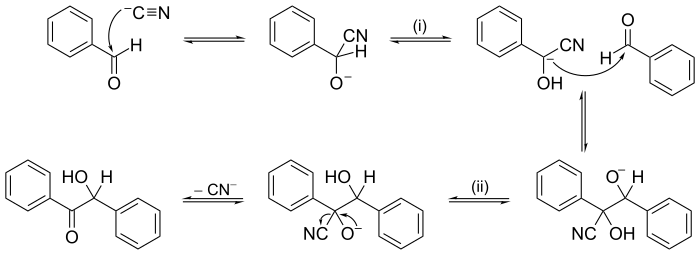
El método del empuje del electrón o de la flecha se utiliza a menudo para ilustrar un mecanismo de reacción; por ejemplo, consulte la ilustración del mecanismo de condensación de benzoína en la siguiente sección de ejemplos.
Un mecanismo de reacción también debe tener en cuenta el orden en el que reaccionan las moléculas. A menudo, lo que parece una conversión de un solo paso es, de hecho, una reacción de varios pasos.
Intermedios de reacción
Los intermediarios de reacción son especies químicas, a menudo inestables y de vida corta (sin embargo, a veces se pueden aislar), que no son reactivos o productos de la reacción química general, sino productos y/o reactivos temporales en los pasos de reacción del mecanismo. Los intermediarios de reacción suelen ser radicales libres o iones . Los intermediarios de reacción a menudo se confunden con el estado de transición. El estado de transición es una configuración fugaz de alta energía que existe solo en el pico de la barrera de energía durante una reacción, mientras que un intermediario de reacción es una especie relativamente estable que existe durante un tiempo medible entre los pasos de una reacción. A diferencia del estado de transición, los intermediarios a veces se pueden aislar u observar directamente.
La cinética (velocidades relativas de los pasos de reacción y la ecuación de velocidad para la reacción general) se explica en términos de la energía necesaria para la conversión de los reactivos a los estados de transición propuestos (estados moleculares que corresponden a los máximos en las coordenadas de reacción y a los puntos de silla en la superficie de energía potencial para la reacción).
Cinética química
La información sobre el mecanismo de una reacción a menudo se proporciona mediante el uso de la cinética química para determinar la ecuación de velocidad y el orden de reacción en cada reactivo. [2]
Consideremos como ejemplo la siguiente reacción:
- CO2 + NO2 → CO2 + NO
En este caso, los experimentos han determinado que esta reacción se lleva a cabo según la ley de velocidad . Esta forma sugiere que el paso que determina la velocidad es una reacción entre dos moléculas de NO 2 . Un posible mecanismo para la reacción general que explica la ley de velocidad es:
- 2 NO 2 → NO 3 + NO (lento)
- NO 3 + CO → NO 2 + CO 2 (rápido)
Cada paso se denomina paso elemental y cada uno tiene su propia ley de velocidad y molecularidad . Los pasos elementales deberían sumarse para dar la reacción original. (Es decir, si canceláramos todas las moléculas que aparecen en ambos lados de la reacción, nos quedaría la reacción original).
Al determinar la ley de velocidad general de una reacción, el paso más lento es el que determina la velocidad de reacción. Debido a que el primer paso (en la reacción anterior) es el más lento, es el paso que determina la velocidad . Debido a que implica la colisión de dos moléculas de NO 2 , es una reacción bimolecular con una velocidad que obedece a la ley de velocidad .
Otras reacciones pueden tener mecanismos de varios pasos consecutivos. En química orgánica , el mecanismo de reacción de condensación de benzoína , propuesto en 1903 por A. J. Lapworth , fue uno de los primeros mecanismos de reacción propuestos.
Una reacción en cadena es un ejemplo de un mecanismo complejo, en el que los pasos de propagación forman un ciclo cerrado. En una reacción en cadena, el intermediario producido en un paso genera un intermediario en otro paso. Los intermediarios se denominan portadores de cadena. A veces, los portadores de cadena son radicales, pero también pueden ser iones. En la fisión nuclear, son neutrones.
Las reacciones en cadena tienen varios pasos, que pueden incluir: [3]
- Iniciación de la cadena: puede ser por termólisis (calentamiento de las moléculas) o fotólisis (absorción de luz) dando lugar a la ruptura de un enlace.
- Propagación: un portador en cadena crea otro portador.
- Ramificación: un portador genera más de un portador.
- Retardo: un portador de cadena puede reaccionar con un producto reduciendo la velocidad de formación del producto. Se forma otro portador de cadena, pero se reduce la concentración del producto.
- Terminación de la cadena: los radicales se combinan y los portadores de la cadena se pierden.
- Inhibición: los portadores de cadena se eliminan mediante procesos distintos a la terminación, como por ejemplo mediante la formación de radicales.
Aunque todos estos pasos pueden aparecer en una reacción en cadena, los mínimos necesarios son Iniciación, propagación y terminación.
Un ejemplo de una reacción en cadena simple es la descomposición térmica del acetaldehído (CH 3 CHO) en metano (CH 4 ) y monóxido de carbono (CO). El orden de reacción experimental es 3/2, [4] lo que se puede explicar mediante un mecanismo de Rice-Herzfeld . [5]
Este mecanismo de reacción para el acetaldehído tiene 4 pasos con ecuaciones de velocidad para cada paso:
- Iniciación: CH 3 CHO → •CH 3 + •CHO (Velocidad = k 1 [CH 3 CHO])
- Propagación: CH 3 CHO + •CH 3 → CH 4 + CH 3 CO• (Velocidad=k 2 [CH 3 CHO][•CH 3 ])
- Propagación: CH 3 CO• → •CH 3 + CO (Velocidad=k 3 [CH 3 CO•])
- Terminación: •CH 3 + •CH 3 → CH 3 CH 3 (Velocidad=k 4 [•CH 3 ] 2 )
Para la reacción global, las tasas de cambio de la concentración de los intermediarios •CH 3 y CH 3 CO• son cero, según la aproximación de estado estacionario , que se utiliza para explicar las leyes de velocidad de las reacciones en cadena. [6]
d[•CH 3 ]/dt = k 1 [CH 3 CHO] – k 2 [•CH 3 ][CH 3 CHO] + k 3 [CH 3 CO•] - 2k 4 [•CH 3 ] 2 = 0
y d[CH3CO • ]/dt = k2 [ •CH3 ] [CH3CHO ] – k3 [ CH3CO • ] = 0
La suma de estas dos ecuaciones es k 1 [CH 3 CHO] – 2 k 4 [•CH 3 ] 2 = 0. Esto se puede resolver para encontrar la concentración en estado estacionario de radicales •CH 3 como [•CH 3 ] = (k 1 / 2k 4 ) 1/2 [CH 3 CHO] 1/2 .
De ello se deduce que la velocidad de formación de CH 4 es d[CH 4 ]/dt = k 2 [•CH 3 ][CH 3 CHO] = k 2 (k 1 / 2k 4 ) 1/2 [CH 3 CHO] 3/2
De esta forma, el mecanismo explica la expresión de la velocidad observada para los productos principales CH 4 y CO. La ley de velocidad exacta puede ser incluso más complicada, ya que también hay productos menores como la acetona (CH 3 COCH 3 ) y el propanal (CH 3 CH 2 CHO).
Otros métodos experimentales para determinar el mecanismo
Se han diseñado muchos experimentos que sugieren la posible secuencia de pasos en un mecanismo de reacción, entre ellos:
- Medición del efecto de la temperatura ( ecuación de Arrhenius ) para determinar la energía de activación [7]
- Observación espectroscópica de intermediarios de reacción.
- determinación de la estereoquímica de productos, por ejemplo en reacciones de sustitución nucleofílica [8]
- Medición del efecto de la sustitución isotópica en la velocidad de reacción [9]
- Para reacciones en solución, medición del efecto de la presión sobre la velocidad de reacción para determinar el cambio de volumen en la formación del complejo activado [10] [11]
- Para reacciones de iones en solución, medición del efecto de la fuerza iónica en la velocidad de reacción [12] [13]
- Observación directa del complejo activado mediante espectroscopia de bombeo-sonda [14]
- Quimioluminiscencia infrarroja para detectar excitación vibracional en los productos [15] [16]
- espectrometría de masas por ionización por electrospray . [17]
- experimentos cruzados . [18]
Modelado teórico
Un mecanismo de reacción correcto es una parte importante de un modelo predictivo preciso . En el caso de muchos sistemas de combustión y plasma, no se dispone de mecanismos detallados o es necesario desarrollarlos.
Incluso cuando se dispone de información, identificar y reunir los datos pertinentes de diversas fuentes, conciliar los valores discrepantes y extrapolarlos a diferentes condiciones puede ser un proceso difícil sin la ayuda de un experto. Las constantes de velocidad o los datos termoquímicos a menudo no están disponibles en la literatura, por lo que se deben utilizar técnicas de química computacional o métodos de aditividad de grupos para obtener los parámetros necesarios.
Los métodos de química computacional también se pueden utilizar para calcular superficies de energía potencial para reacciones y determinar mecanismos probables. [19]
Molecularidad
La molecularidad en química es el número de entidades moleculares en colisión que participan en un solo paso de reacción .
- Un paso de reacción que involucra una entidad molecular se llama unimolecular.
- Un paso de reacción que involucra dos entidades moleculares se llama bimolecular.
- Un paso de reacción que involucra tres entidades moleculares se llama trimolecular o termolecular.
En general, no ocurren pasos de reacción que involucran más de tres entidades moleculares, porque es estadísticamente improbable en términos de la distribución de Maxwell encontrar tal estado de transición.
Véase también
- Reacciones orgánicas por mecanismo
- Sustitución nucleofílica de acilo
- Participación de grupos vecinos
- Reacción de Finkelstein
- Mecanismo de Lindemann
- Mecanismo de reacción electroquímica
- Abstracción nucleófila
Referencias
- ^ March, Jerry (1985), Química orgánica avanzada: reacciones, mecanismos y estructura, 3.ª edición, Nueva York: Wiley, ISBN 9780471854722, OCLC 642506595
- ^ Espenson, James H. Cinética química y mecanismos de reacción (2.ª ed., McGraw-Hill, 2002) cap. 6, Deducción de los mecanismos de reacción ISBN 0-07-288362-6
- ^ Bäckström, Hans LJ (1 de junio de 1927). «La teoría de la reacción en cadena de la catálisis negativa». Journal of the American Chemical Society . 49 (6): 1460–1472. doi :10.1021/ja01405a011 . Consultado el 20 de enero de 2021 .
- ^ Laidler KJ y Meiser JH, Química física (Benjamin/Cummings 1982) p.416-417 ISBN 0-8053-5682-7
- ^ Atkins y de Paula pág. 830-1
- ^ Atkins P y de Paula J, Química física (8.ª ed., WH Freeman 2006) pág. 812 ISBN 0-7167-8759-8
- ^ Espenson pág. 156-160
- ^ Morrison RT y Boyd RN Química orgánica (4.ª ed., Allyn y Bacon 1983) págs. 216-9 y págs. 228-231, ISBN 0-205-05838-8
- ^ Atkins P y de Paula J, Química física (8.ª ed., WH Freeman 2006) pág. 816-8 ISBN 0-7167-8759-8
- ^ Moore JW y Pearson RG Cinética y mecanismo (3.ª ed., John Wiley 1981) pág. 276-8 ISBN 0-471-03558-0
- ^ Laidler KJ y Meiser JH, Química física (Benjamin/Cummings 1982) p.389-392 ISBN 0-8053-5682-7
- ^ Atkins y de Paula pág. 884-5
- ^ Laidler y Meiser pág. 388-9
- ^ Atkins y de Paula pág. 892-3
- ^ Atkins y de Paula pág. 886
- ^ Laidler y Meiser pág. 396-7
- ^ Investigación de reacciones químicas en solución utilizando API-MSLeonardo Silva Santos, Larissa Knaack, Jurgen O. Metzger Int. J. Espectro de masas. ; 2005 ; 246 págs. 84 - 104; (Revisión) doi :10.1016/j.ijms.2005.08.016
- ^ Espenson pág. 112
- ^ Atkins y de Paula pág. 887-891
LGWADE, QUÍMICA ORGÁNICA, 7.ª EDICIÓN, 2010
Enlaces externos
- Mecanismos de reacción para la combustión de hidrocarburos.
![{\displaystyle r=k[NO_{2}]^{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7c34576960b3342cceed6c0b51b1764beb2dfcf4)

![{\displaystyle r=k[NO_{2}(t)]^{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/581dd3ba310fe8d53ab10b6a2ed319f4d67ed40a)