Colágeno

El colágeno ( / ˈkɒlədʒən / ) es la principal proteína estructural en la matriz extracelular de los diversos tejidos conectivos de un cuerpo . Como componente principal del tejido conectivo, es la proteína más abundante en los mamíferos. [1] Entre el 25% y el 35% del contenido proteico del cuerpo de un mamífero es colágeno. Los aminoácidos se unen para formar una triple hélice de fibrillas alargadas [2] conocida como hélice de colágeno . La hélice de colágeno se encuentra principalmente en el tejido conectivo, como el cartílago , los huesos , los tendones , los ligamentos y la piel . La vitamina C es vital para la síntesis de colágeno, mientras que la vitamina E mejora su producción.

Dependiendo del grado de mineralización , los tejidos de colágeno pueden ser rígidos (hueso) o flexibles (tendón) o tener un gradiente de rígido a flexible (cartílago). El colágeno también es abundante en las córneas , los vasos sanguíneos , el intestino , los discos intervertebrales y la dentina de los dientes. [3] En el tejido muscular , sirve como un componente principal del endomisio . El colágeno constituye del 1% al 2% del tejido muscular y representa el 6% del peso del músculo esquelético . [4] El fibroblasto es la célula más común que crea colágeno en un cuerpo. La gelatina , que se utiliza en alimentos e industria, es colágeno que se hidrolizó irreversiblemente usando calor, soluciones básicas o ácidos débiles. [5]
Etimología
.jpg/440px-Collagen_--_Smart-Servier_(cropped).jpg)
El nombre colágeno proviene del griego κόλλα ( kólla ), que significa " pegamento ", y del sufijo -γέν, -gen , que denota "producir". [6] [7]
Tipos humanos
Más del 90% del colágeno del cuerpo humano es colágeno tipo I. [8] Sin embargo, a partir de 2011, se han identificado, descrito y dividido en varios grupos según la estructura que forman 28 tipos de colágeno humano. [9] Todos los tipos contienen al menos una triple hélice . [9] La cantidad de tipos muestra la diversa funcionalidad del colágeno. [10]
- Fibrilar (Tipo I, II, III, V, XI)
- No fibrilar
- FACIT (Colágenos asociados a fibrillas con triples hélices interrumpidas) (Tipo IX, XII, XIV, XIX, XXI)
- Cadena corta (Tipo VIII, X)
- Membrana basal (Tipo IV)
- Multiplexina (múltiples dominios de triple hélice con interrupciones) (tipo XV, XVIII)
- MACIT (Colágenos asociados a membrana con triple hélice interrumpida) (Tipo XIII, XVII)
- Formación de microfibrillas (Tipo VI)
- Fibrillas de anclaje (Tipo VII)
Los cinco tipos más comunes son: [11]
- Tipo I : piel, tendones , vasculatura, órganos, hueso (componente principal de la parte orgánica del hueso)
- Tipo II : cartílago (principal componente colágeno del cartílago)
- Tipo III : reticulado (componente principal de las fibras reticulares ), que se encuentra comúnmente junto con el tipo I
- Tipo IV : forma la lámina basal, la capa secretada por el epitelio de la membrana basal.
- Tipo V : superficies celulares, cabello y placenta.
En biología humana
Cardíaco
El esqueleto cardíaco colágeno , que incluye los cuatro anillos de las válvulas cardíacas , está unido histológicamente, elásticamente y de forma única al músculo cardíaco. El esqueleto cardíaco también incluye los tabiques que separan las cámaras cardíacas : el tabique interventricular y el tabique auriculoventricular . La contribución del colágeno a la medida del rendimiento cardíaco representa sumariamente una fuerza de torsión continua opuesta a la mecánica de fluidos de la presión sanguínea emitida desde el corazón. La estructura de colágeno que divide las cámaras superiores del corazón de las cámaras inferiores es una membrana impermeable que excluye tanto la sangre como los impulsos eléctricos a través de medios fisiológicos típicos. Con el apoyo del colágeno, la fibrilación auricular nunca se deteriora a fibrilación ventricular . El colágeno está dispuesto en capas en densidades variables con masa de músculo liso. La masa, la distribución, la edad y la densidad del colágeno contribuyen a la elasticidad necesaria para mover la sangre de un lado a otro. Las valvas cardíacas individuales se pliegan en forma por colágeno especializado bajo presión variable . La deposición gradual de calcio dentro del colágeno ocurre como una función natural del envejecimiento. Los puntos calcificados dentro de las matrices de colágeno muestran contraste en una representación en movimiento de sangre y músculo, lo que permite que los métodos de tecnología de imágenes cardíacas lleguen a proporciones que básicamente indican la sangre que entra ( entrada cardíaca ) y la sangre que sale ( gasto cardíaco ). La patología del colágeno que sustenta el corazón se entiende dentro de la categoría de enfermedad del tejido conectivo . [ cita requerida ]
Injertos óseos
Como el esqueleto forma la estructura del cuerpo, es vital que mantenga su fuerza, incluso después de fracturas y lesiones. El colágeno se utiliza en injertos óseos, ya que tiene una estructura de triple hélice, lo que lo convierte en una molécula muy fuerte. Es ideal para su uso en huesos, ya que no compromete la integridad estructural del esqueleto. La estructura de triple hélice del colágeno evita que se descomponga por enzimas, permite la adhesividad de las células y es importante para el ensamblaje adecuado de la matriz extracelular. [12]
Regeneración tisular
Los andamios de colágeno se utilizan en la regeneración de tejidos, ya sea en esponjas, [13] láminas delgadas, [14] geles, [15] o fibras. [16] El colágeno tiene propiedades favorables para la regeneración de tejidos, como la estructura de poros, la permeabilidad, la hidrofilicidad y la estabilidad in vivo. Los andamios de colágeno también favorecen la deposición de células, como osteoblastos y fibroblastos , y una vez insertados, facilitan el crecimiento para que se lleve a cabo con normalidad. [17]
Usos quirúrgicos reconstructivos
Los colágenos se emplean ampliamente en la construcción de sustitutos de piel artificiales utilizados en el tratamiento de quemaduras y heridas graves. [18] [19] Estos colágenos pueden derivar de fuentes bovinas, equinas, porcinas o incluso humanas; y a veces se utilizan en combinación con siliconas , glicosaminoglicanos , fibroblastos, factores de crecimiento y otras sustancias. [20]
Cicatrización de heridas
This section needs additional citations for verification. (April 2021) |
El colágeno es uno de los recursos naturales clave del cuerpo y un componente del tejido cutáneo que puede beneficiar todas las etapas de la cicatrización de heridas . [21] Cuando el colágeno se pone a disposición del lecho de la herida, se puede producir el cierre de la misma. De este modo, se puede evitar el deterioro de la herida, seguido a veces de procedimientos como la amputación.
El colágeno es un producto natural y, por lo tanto, se utiliza como apósito natural para heridas y tiene propiedades que los apósitos artificiales no tienen. Es resistente a las bacterias, lo que es de vital importancia en un apósito para heridas. Ayuda a mantener la herida estéril, debido a su capacidad natural para combatir las infecciones. Cuando se utiliza colágeno como apósito para quemaduras, se puede formar tejido de granulación sano muy rápidamente sobre la quemadura, lo que ayuda a que se cure rápidamente. [18]
A lo largo de las cuatro fases de cicatrización de heridas, el colágeno realiza las siguientes funciones:
- Función de guía: las fibras de colágeno sirven para guiar a los fibroblastos, que migran a lo largo de una matriz de tejido conectivo.
- Propiedades quimiotácticas : La gran superficie disponible en las fibras de colágeno puede atraer células fibrogénicas que ayudan en la curación.
- Nucleación : El colágeno, en presencia de ciertas moléculas de sal neutra, puede actuar como agente nucleante provocando la formación de estructuras fibrilares.
- Propiedades hemostáticas : Las plaquetas sanguíneas interactúan con el colágeno para formar un tapón hemostático.
Investigación básica
El colágeno se utiliza en estudios de laboratorio para el cultivo de células , estudiando el comportamiento celular y las interacciones celulares con el entorno extracelular . [22] El colágeno también se utiliza ampliamente como biotinta para la bioimpresión 3D y la biofabricación de modelos de tejido 3D.
Biología
La proteína de colágeno está compuesta por una triple hélice, que generalmente consta de dos cadenas idénticas (α1) y una cadena adicional que difiere ligeramente en su composición química (α2). [23] La composición de aminoácidos del colágeno es atípica para las proteínas, particularmente con respecto a su alto contenido de hidroxiprolina . Los motivos más comunes en la secuencia de aminoácidos del colágeno son glicina - prolina -X y glicina-X-hidroxiprolina, donde X es cualquier aminoácido distinto de glicina, prolina o hidroxiprolina. Se proporciona la composición promedio de aminoácidos para la piel de peces y mamíferos. [24]
| Aminoácido | Abundancia en piel de mamíferos ( residuos /1000) | Abundancia en piel de pescado (residuos/1000) |
|---|---|---|
| Glicina | 329 | 339 |
| Prolina | 126 | 108 |
| Alanina | 109 | 114 |
| Hidroxiprolina | 95 | 67 |
| Ácido glutámico | 74 | 76 |
| Arginina | 49 | 52 |
| Ácido aspártico | 47 | 47 |
| Serina | 36 | 46 |
| Lisina | 29 | 26 |
| Leucina | 24 | 23 |
| Valina | 22 | 21 |
| Treonina | 19 | 26 |
| Fenilalanina | 13 | 14 |
| Isoleucina | 11 | 11 |
| Hidroxilisina | 6 | 8 |
| Metionina | 6 | 13 |
| Histidina | 5 | 7 |
| Tirosina | 3 | 3 |
| Cisteína | 1 | 1 |
| Triptófano | 0 | 0 |
Síntesis
This section needs additional citations for verification. (April 2021) |
En primer lugar, se ensambla una estructura tridimensional hebra con los aminoácidos glicina y prolina como sus componentes principales. Esto todavía no es colágeno pero es su precursor: procolágeno. Luego, el procolágeno se modifica mediante la adición de grupos hidroxilo a los aminoácidos prolina y lisina . Este paso es importante para la glicosilación posterior y la formación de una estructura de triple hélice para el colágeno. Debido a que las enzimas hidroxilasas que realizan estas reacciones requieren vitamina C como cofactor , una deficiencia a largo plazo de esta vitamina da como resultado una síntesis de colágeno deteriorada y escorbuto . [25] Estas reacciones de hidroxilación son catalizadas por dos enzimas diferentes: prolil 4-hidroxilasa [26] y lisil hidroxilasa . La reacción consume una molécula de ascorbato por hidroxilación. [27] La síntesis de colágeno ocurre dentro y fuera de una célula. Aquí se analiza la formación de colágeno que da como resultado colágeno fibrilar (la forma más común). El colágeno reticulado, que suele participar en la formación de sistemas de filtración, es otra forma común de colágeno. Todos los tipos de colágeno son triples hélices y las diferencias radican en la composición de sus péptidos alfa creados en el paso 2.
- Transcripción del ARNm : unos 44 genes están asociados con la formación de colágeno, cada uno de los cuales codifica una secuencia específica de ARNm y, por lo general, tienen el prefijo " COL ". El inicio de la síntesis de colágeno comienza con la activación de genes asociados con la formación de un péptido alfa particular (normalmente alfa 1, 2 o 3).
- Formación del pre-pro-péptido : Una vez que el ARNm final sale del núcleo celular y entra en el citoplasma, se une a las subunidades ribosómicas y se produce el proceso de traducción. La parte inicial/primera del nuevo péptido se conoce como secuencia señal. La secuencia señal en el extremo N-terminal del péptido es reconocida por una partícula de reconocimiento de señales en el retículo endoplasmático , que será responsable de dirigir el pre-pro-péptido hacia el retículo endoplasmático. Por lo tanto, una vez finalizada la síntesis del nuevo péptido, este va directamente al retículo endoplasmático para su procesamiento postraduccional. En la actualidad se lo conoce como preprocolágeno.
- Pre-pro-péptido a pro-colágeno : Se producen tres modificaciones del pre-pro-péptido que conducen a la formación del péptido alfa:
- Se elimina el péptido señal en el extremo N y la molécula ahora se conoce como propéptido (no procolágeno).
- La hidroxilación de las lisinas y prolinas en el propéptido por las enzimas "prolil hidroxilasa" y "lisil hidroxilasa" (para producir hidroxiprolina e hidroxilisina) se produce para facilitar la reticulación de los péptidos alfa. Este paso enzimático requiere vitamina C como cofactor. En el escorbuto, la falta de hidroxilación de las prolinas y las lisinas provoca una triple hélice más laxa (que está formada por tres péptidos alfa).
- La glicosilación se produce añadiendo monómeros de glucosa o galactosa a los grupos hidroxilo que se colocaron en las lisinas, pero no en las prolinas.
- Una vez que se han producido estas modificaciones, tres de los propéptidos hidroxilados y glicosilados se retuercen formando una triple hélice formando procolágeno. El procolágeno aún tiene extremos desenrollados, que serán recortados posteriormente. En este punto, el procolágeno se empaqueta en una vesícula de transferencia destinada al aparato de Golgi.
- Modificación del aparato de Golgi : En el aparato de Golgi, el procolágeno sufre una última modificación postraduccional antes de ser secretado fuera de la célula. En este paso, se añaden oligosacáridos (no monosacáridos como en el paso 3) y, a continuación, el procolágeno se empaqueta en una vesícula secretora destinada al espacio extracelular.
- Formación del tropocolágeno : Una vez fuera de la célula, las enzimas unidas a la membrana, conocidas como peptidasas de colágeno, eliminan los "cabos sueltos" de la molécula de procolágeno. Lo que queda se conoce como tropocolágeno. Los defectos en este paso producen una de las muchas colagenopatías conocidas como síndrome de Ehlers-Danlos . Este paso está ausente cuando se sintetiza el tipo III, un tipo de colágeno fibrilar.
- Formación de la fibrilla de colágeno : la lisil oxidasa , una enzima extracelular dependiente del cobre , produce el paso final en la vía de síntesis del colágeno. Esta enzima actúa sobre las lisinas e hidroxilisinas produciendo grupos aldehído, que finalmente sufrirán enlaces covalentes entre las moléculas de tropocolágeno. Este polímero de tropocolágeno se conoce como fibrilla de colágeno.

Aminoácidos
El colágeno tiene una composición y secuencia de aminoácidos inusuales:
- La glicina se encuentra en casi cada tercer residuo .
- La prolina constituye aproximadamente el 17% del colágeno.
- El colágeno contiene dos aminoácidos derivados inusuales que no se insertan directamente durante la traducción . Estos aminoácidos se encuentran en lugares específicos en relación con la glicina y se modifican postraduccionalmente por diferentes enzimas, las cuales requieren vitamina C como cofactor.
- Hidroxiprolina derivada de la prolina
- Hidroxilisina derivada de la lisina: dependiendo del tipo de colágeno, se glicosilan cantidades variables de hidroxilisinas (en su mayoría tienen disacáridos unidos).
El cortisol estimula la degradación del colágeno (de la piel) en aminoácidos. [28]
Formación de colágeno I
La mayoría de las formas de colágeno se forman de manera similar, pero el siguiente proceso es típico para el tipo I:
- Dentro de la célula
- Durante la traducción en los ribosomas a lo largo del retículo endoplasmático rugoso (RER) se forman dos tipos de cadenas alfa: alfa-1 y alfa-2. Estas cadenas peptídicas, conocidas como preprocolágeno, tienen péptidos de registro en cada extremo y un péptido señal . [29]
- Las cadenas polipeptídicas se liberan en el lumen del RER.
- Los péptidos señal se escinden dentro del RER y las cadenas ahora se conocen como cadenas pro-alfa.
- La hidroxilación de los aminoácidos lisina y prolina ocurre dentro del lumen. Este proceso depende del ácido ascórbico (vitamina C) y lo consume como cofactor .
- Se produce la glicosilación de residuos específicos de hidroxilisina.
- La estructura helicoidal triple alfa se forma dentro del retículo endoplásmico a partir de dos cadenas alfa-1 y una cadena alfa-2.
- El procolágeno se envía al aparato de Golgi , donde se empaqueta y se secreta al espacio extracelular por exocitosis .
- Fuera de la celda
- Los péptidos de registro se escinden y el tropocolágeno se forma por acción de la procolágeno peptidasa .
- Las múltiples moléculas de tropocolágeno forman fibrillas de colágeno, mediante la reticulación covalente ( reacción aldólica ) por la lisiloxidasa , que une los residuos de hidroxilisina y lisina. Las múltiples fibrillas de colágeno se convierten en fibras de colágeno.
- El colágeno puede unirse a las membranas celulares a través de varios tipos de proteínas, incluidas la fibronectina , la laminina , la fibulina y la integrina .
Estructura molecular
This section needs additional citations for verification. (April 2021) |
Una sola molécula de colágeno, el tropocolágeno, se utiliza para formar agregados de colágeno más grandes, como las fibrillas. Tiene aproximadamente 300 nm de largo y 1,5 nm de diámetro, y está formada por tres cadenas polipeptídicas (llamadas péptidos alfa, véase el paso 2), cada una de las cuales tiene la conformación de una hélice levógira ; esto no debe confundirse con la hélice alfa dextrógira . Estas tres hélices levógiras están retorcidas entre sí en una triple hélice dextrógira o "superhélice", una estructura cuaternaria cooperativa estabilizada por muchos enlaces de hidrógeno . Con el colágeno tipo I y posiblemente con todos los colágenos fibrilares, si no con todos los colágenos, cada triple hélice se asocia en una super-super-espira dextrógira denominada microfibrilla de colágeno. Cada microfibrilla está entrelazada con sus microfibrillas vecinas hasta un grado que podría sugerir que son individualmente inestables, aunque dentro de las fibrillas de colágeno están tan bien ordenadas que son cristalinas.
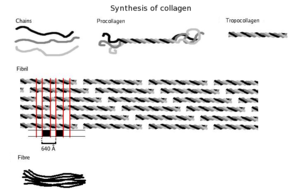
Una característica distintiva del colágeno es la disposición regular de los aminoácidos en cada una de las tres cadenas de estas subunidades de colágeno. La secuencia a menudo sigue el patrón Gly - Pro -X o Gly-X- Hyp , donde X puede ser cualquiera de varios otros residuos de aminoácidos. [24] La prolina o la hidroxiprolina constituyen aproximadamente 1/6 de la secuencia total. Con la glicina representando el 1/3 de la secuencia, esto significa que aproximadamente la mitad de la secuencia de colágeno no es glicina, prolina o hidroxiprolina, un hecho que a menudo se pasa por alto debido a la distracción del carácter inusual GX 1 X 2 de los alfa-péptidos de colágeno. El alto contenido de glicina del colágeno es importante con respecto a la estabilización de la hélice de colágeno, ya que esto permite la asociación muy cercana de las fibras de colágeno dentro de la molécula, facilitando la unión de hidrógeno y la formación de enlaces cruzados intermoleculares. [24] Este tipo de repetición regular y alto contenido de glicina se encuentra sólo en algunas otras proteínas fibrosas, como la fibroína de seda .
El colágeno no es sólo una proteína estructural. Debido a su papel clave en la determinación del fenotipo celular, la adhesión celular, la regulación tisular y la infraestructura, muchas secciones de sus regiones no ricas en prolina tienen funciones de asociación/regulación celular o de la matriz. El contenido relativamente alto de anillos de prolina e hidroxiprolina, con sus grupos carboxilo y amino (secundario) geométricamente restringidos , junto con la gran abundancia de glicina, explica la tendencia de las hebras individuales de polipéptidos a formar hélices levógiras de manera espontánea, sin ningún enlace de hidrógeno intracadena.
Debido a que la glicina es el aminoácido más pequeño sin cadena lateral, desempeña un papel único en las proteínas estructurales fibrosas. En el colágeno, se requiere Gly en cada tercera posición porque el ensamblaje de la triple hélice coloca este residuo en el interior (eje) de la hélice, donde no hay espacio para un grupo lateral más grande que el átomo de hidrógeno único de la glicina . Por la misma razón, los anillos de Pro e Hyp deben apuntar hacia afuera. Estos dos aminoácidos ayudan a estabilizar la triple hélice, Hyp incluso más que Pro; se requiere una concentración menor de ellos en animales como los peces, cuyas temperaturas corporales son más bajas que la mayoría de los animales de sangre caliente. Los contenidos más bajos de prolina e hidroxiprolina son característicos de los peces de agua fría, pero no de los de agua caliente; estos últimos tienden a tener contenidos de prolina e hidroxiprolina similares a los de los mamíferos. [24] Los contenidos más bajos de prolina e hidroxiprolina de los peces de agua fría y otros animales poiquilotermos hacen que su colágeno tenga una estabilidad térmica menor que el colágeno de los mamíferos. [24] Esta menor estabilidad térmica significa que la gelatina derivada del colágeno de pescado no es adecuada para muchas aplicaciones alimentarias e industriales.
Las subunidades del tropocolágeno se autoensamblan espontáneamente , con extremos escalonados regularmente, en conjuntos aún más grandes en los espacios extracelulares de los tejidos. [30] [31] El ensamblaje adicional de fibrillas es guiado por fibroblastos, que depositan fibrillas completamente formadas a partir de fibripositores. En los colágenos fibrilares, las moléculas están escalonadas con respecto a las moléculas adyacentes por aproximadamente 67 nm (una unidad que se conoce como "D" y cambia dependiendo del estado de hidratación del agregado). En cada repetición del período D de la microfibrilla, hay una parte que contiene cinco moléculas en sección transversal, llamada "superposición", y una parte que contiene solo cuatro moléculas, llamada "espacio". [32] Estas regiones de superposición y espacio se conservan a medida que las microfibrillas se ensamblan en fibrillas y, por lo tanto, se pueden ver mediante microscopía electrónica. Los tropocolágenos de triple hélice en las microfibrillas están dispuestos en un patrón de empaquetamiento cuasihexagonal. [32] [33]

Hay cierta reticulación covalente dentro de las triples hélices y una cantidad variable de reticulación covalente entre las hélices de tropocolágeno que forman agregados bien organizados (como fibrillas). [34] Los haces fibrilares más grandes se forman con la ayuda de varias clases diferentes de proteínas (incluidos diferentes tipos de colágeno), glicoproteínas y proteoglicanos para formar los diferentes tipos de tejidos maduros a partir de combinaciones alternativas de los mismos actores clave. [31] La insolubilidad del colágeno fue una barrera para el estudio del colágeno monomérico hasta que se descubrió que el tropocolágeno de animales jóvenes se puede extraer porque aún no está completamente reticulado . Sin embargo, los avances en las técnicas de microscopía (es decir, microscopía electrónica (EM) y microscopía de fuerza atómica (AFM)) y la difracción de rayos X han permitido a los investigadores obtener imágenes cada vez más detalladas de la estructura del colágeno in situ . [35] Estos últimos avances son particularmente importantes para entender mejor la forma en que la estructura del colágeno afecta la comunicación célula-célula y célula-matriz y cómo los tejidos se construyen en el crecimiento y la reparación y se modifican en el desarrollo y la enfermedad. [36] [37] Por ejemplo, utilizando nanoindentación basada en AFM se ha demostrado que una sola fibrilla de colágeno es un material heterogéneo a lo largo de su dirección axial con propiedades mecánicas significativamente diferentes en sus regiones de espacio y superposición, lo que se correlaciona con sus diferentes organizaciones moleculares en estas dos regiones. [38]
Las fibrillas/agregados de colágeno se organizan en diferentes combinaciones y concentraciones en varios tejidos para proporcionar diversas propiedades tisulares. En el hueso, las triples hélices de colágeno completas se encuentran en una disposición paralela y escalonada. Los espacios de 40 nm entre los extremos de las subunidades de tropocolágeno (aproximadamente iguales a la región del espacio) probablemente sirven como sitios de nucleación para la deposición de cristales largos, duros y finos del componente mineral, que es hidroxiapatita (aproximadamente) Ca 10 (OH) 2 (PO 4 ) 6 . [39] El colágeno tipo I le da al hueso su resistencia a la tracción .
Trastornos asociados
Las enfermedades relacionadas con el colágeno surgen con mayor frecuencia de defectos genéticos o deficiencias nutricionales que afectan la biosíntesis, el ensamblaje, la modificación postraduccional, la secreción u otros procesos involucrados en la producción normal de colágeno.
| Tipo | Notas | Gen(es) | Trastornos |
| I | Es el colágeno más abundante del cuerpo humano. Está presente en el tejido cicatricial , el producto final de la curación del tejido mediante la reparación. Se encuentra en los tendones , la piel, las paredes arteriales, la córnea, el endomisio que rodea las fibras musculares, el fibrocartílago y la parte orgánica de los huesos y los dientes. | COL1A1 , COL1A2 | Osteogénesis imperfecta , síndrome de Ehlers-Danlos , hiperostosis cortical infantil , también conocida como enfermedad de Caffey |
| II | El cartílago hialino constituye el 50% de toda la proteína del cartílago. Humor vítreo del ojo. | COL2A1 | Colagenopatía, tipos II y XI |
| III | Se trata del colágeno del tejido de granulación y lo producen rápidamente los fibroblastos jóvenes antes de que se sintetice el colágeno tipo I, más resistente. Fibra reticular . También se encuentra en las paredes arteriales, la piel, los intestinos y el útero. | COL3A1 | Síndrome de Ehlers-Danlos , contractura de Dupuytren |
| IV | Lámina basal ; cristalino del ojo . También forma parte del sistema de filtración en los capilares y los glomérulos de la nefrona en el riñón . | COL4A1 , COL4A2 , COL4A3 , COL4A4 , COL4A5 , COL4A6 | Síndrome de Alport , síndrome de Goodpasture |
| V | La mayor parte del tejido intersticial, asociado con el tipo I, se asocia con la placenta. | COL5A1 , COL5A2 , COL5A3 | Síndrome de Ehlers-Danlos (clásico) |
| VI | La mayor parte del tejido intersticial, asociado con el tipo I | COL6A1 , COL6A2 , COL6A3 , COL6A5 | Miopatía de Ulrich , miopatía de Bethlem , dermatitis atópica [40] |
| VII | Forma fibrillas de anclaje en las uniones dermoepidérmicas. | COL7A1 | Epidermólisis ampollosa distrófica |
| VIII | Algunas células endoteliales | COL8A1 , COL8A2 | Distrofia corneal polimorfa posterior tipo 2 |
| IX | Colágeno FACIT , cartílago, asociado con fibrillas tipo II y XI | COL9A1 , COL9A2 , COL9A3 | EDM2 y EDM3 |
| incógnita | Cartílago hipertrófico y mineralizante | COL10A1 | Displasia metafisaria de Schmidt |
| XI | Cartílago | COL11A1 , COL11A2 | Colagenopatía, tipos II y XI |
| XII | El colágeno FACIT interactúa con fibrillas de tipo I que contienen decorina y glicosaminoglicanos. | COL12A1 | – |
| XIII | El colágeno transmembrana interactúa con la integrina a1b1, fibronectina y componentes de las membranas basales como nidogen y perlecan . | COL13A1 | – |
| XIV | Colágeno FACIT , también conocido como undulina | COL14A1 | – |
| XV | – | COL15A1 | – |
| XVI | Colágeno FACIT | COL16A1 | – |
| XVII | Colágeno transmembrana, también conocido como BP180, una proteína de 180 kDa | COL17A1 | Penfigoide ampolloso y ciertas formas de epidermólisis ampollosa de la unión |
| XVIII | Fuente de endostatina | COL18A1 | – |
| XIX | Colágeno FACIT | COL19A1 | – |
| XX | – | COL20A1 | – |
| XXI | Colágeno FACIT | COL21A1 | – |
| XXII | Colágeno FACIT | COL22A1 | – |
| XXIII | Colágeno MACIT | COL23A1 | – |
| XXIV | – | COL24A1 | – |
| XXV | – | COL25A1 | – |
| XXVI | – | EMID2 | – |
| XXVII | – | COL27A1 | – |
| XXVIII | – | COL28A1 | – |
Además de los trastornos mencionados anteriormente, en la esclerodermia se produce un depósito excesivo de colágeno .
Enfermedades
Se han identificado mil mutaciones en 12 de más de 20 tipos de colágeno. Estas mutaciones pueden provocar diversas enfermedades a nivel tisular. [41]
Osteogénesis imperfecta : causada por una mutación en el colágeno tipo 1 , trastorno autosómico dominante, que provoca huesos débiles y tejido conectivo irregular; algunos casos pueden ser leves, mientras que otros pueden ser letales. Los casos leves tienen niveles reducidos de colágeno tipo 1, mientras que los casos graves tienen defectos estructurales en el colágeno. [42]
Condrodisplasias : trastorno esquelético que se cree que es causado por una mutación en el colágeno tipo 2 ; se están realizando más investigaciones para confirmarlo. [43]
Síndrome de Ehlers-Danlos : se conocen trece tipos diferentes de este trastorno, que provocan deformidades en el tejido conectivo. [44] Algunos de los tipos más raros pueden ser letales y provocar la ruptura de las arterias. Cada síndrome es causado por una mutación diferente. Por ejemplo, el tipo vascular (vEDS) de este trastorno es causado por una mutación en el colágeno tipo 3. [ 45]
Síndrome de Alport : puede transmitirse genéticamente, generalmente como dominante ligado al cromosoma X, pero también como un trastorno autosómico dominante y autosómico recesivo; quienes padecen esta afección tienen problemas con los riñones y los ojos; la pérdida de audición también puede desarrollarse durante la infancia o la adolescencia. [46]
Síndrome de Knobloch : causado por una mutación en el gen COL18A1 que codifica la producción de colágeno XVIII. Los pacientes presentan protrusión del tejido cerebral y degeneración de la retina; una persona que tiene familiares con el trastorno tiene un mayor riesgo de desarrollarlo, ya que existe un vínculo hereditario. [41]
Recolección de animales
Cuando no se sintetiza, el colágeno se puede extraer de la piel de los animales, lo que ha provocado deforestación, como ocurrió en Paraguay, donde los grandes productores de colágeno compran grandes cantidades de pieles de ganado de regiones que han sido taladas para el pastoreo de ganado. [47]
Características
El colágeno es una de las proteínas estructurales largas y fibrosas cuyas funciones son bastante diferentes a las de las proteínas globulares , como las enzimas . Los haces resistentes de colágeno llamados fibras de colágeno son un componente principal de la matriz extracelular que sostiene la mayoría de los tejidos y da estructura a las células desde el exterior, pero el colágeno también se encuentra en el interior de ciertas células. El colágeno tiene una gran resistencia a la tracción , y es el componente principal de la fascia , el cartílago , los ligamentos , los tendones , el hueso y la piel. [48] [49] Junto con la elastina y la queratina blanda , es responsable de la fuerza y elasticidad de la piel, y su degradación conduce a las arrugas que acompañan al envejecimiento . [50] Fortalece los vasos sanguíneos y desempeña un papel en el desarrollo de los tejidos . Está presente en la córnea y el cristalino del ojo en forma cristalina . Puede ser una de las proteínas más abundantes en el registro fósil, dado que parece fosilizarse con frecuencia, incluso en huesos del Mesozoico y Paleozoico . [51]
Propiedades mecánicas
El colágeno es un material jerárquico complejo con propiedades mecánicas que varían significativamente en diferentes escalas.
A escala molecular, las simulaciones de modelado atomístico y de grano grueso , así como numerosos métodos experimentales, han llevado a varias estimaciones del módulo de Young del colágeno a nivel molecular. Solo por encima de una cierta tasa de deformación existe una fuerte relación entre el módulo elástico y la tasa de deformación, posiblemente debido a la gran cantidad de átomos en una molécula de colágeno. [52] La longitud de la molécula también es importante, ya que las moléculas más largas tienen resistencias a la tracción menores que las más cortas debido a que las moléculas cortas tienen una gran proporción de enlaces de hidrógeno que se rompen y se reforman. [53]
En la escala fibrilar , el colágeno tiene un módulo más bajo en comparación con la escala molecular y varía según la geometría, la escala de observación, el estado de deformación y el nivel de hidratación. [52] Al aumentar la densidad de reticulación de cero a 3 por molécula, la tensión máxima que la fibrilla puede soportar aumenta de 0,5 GPa a 6 GPa. [54]
Se han realizado pruebas limitadas sobre la resistencia a la tracción de la fibra de colágeno, pero en general se ha demostrado que tiene un módulo de Young más bajo en comparación con las fibrillas. [55]
Al estudiar las propiedades mecánicas del colágeno, el tendón se suele elegir como el material ideal porque se acerca a una estructura de colágeno puro y alineado. Sin embargo, a escala macro, tisular, la gran cantidad de estructuras en las que se pueden organizar las fibras y fibrillas de colágeno da como resultado propiedades muy variables. Por ejemplo, el tendón tiene fibras principalmente paralelas, mientras que la piel consta de una red de fibras onduladas, lo que da como resultado una resistencia mucho mayor y una ductilidad menor en el tendón en comparación con la piel. Se dan las propiedades mecánicas del colágeno en múltiples niveles jerárquicos.
| Nivel jerárquico | Módulo de Young |
|---|---|
| Molecular (a través de modelado atomístico) | 2,4-7 GPa [56] [57] |
| Fibrilla | 0,2-0,8 GPa [58] |
| Fibra (medida a partir del tendón de cola de rata reticulado) | 1,10 GPa [59] |
| Fibra (medida a partir del tendón de cola de rata no reticulado) | 50-250 MPa [59] |
Se sabe que el colágeno es un sólido viscoelástico. Cuando la fibra de colágeno se modela como dos modelos Kelvin-Voigt en serie, cada uno de ellos compuesto por un resorte y un amortiguador en paralelo, la tensión en la fibra se puede modelar de acuerdo con la siguiente ecuación:
donde α, β y γ son propiedades de los materiales definidos, ε D es la deformación fibrilar y ε T es la deformación total. [60]
Usos

El colágeno tiene una amplia variedad de aplicaciones, desde la alimentación hasta la medicina. [61] En la industria médica, se utiliza en cirugía estética y cirugía de quemaduras . En el sector alimentario, un ejemplo de uso es en tripas para embutidos .
Si el colágeno se somete a una desnaturalización suficiente , como por ejemplo mediante calentamiento, las tres hebras de tropocolágeno se separan parcial o completamente en dominios globulares, que contienen una estructura secundaria diferente a la del colágeno normal, la poliprolina II (PPII) de espirales aleatorias . Este proceso describe la formación de gelatina , que se utiliza en muchos alimentos, incluidos los postres de gelatina saborizados . Además de en los alimentos, la gelatina se ha utilizado en las industrias farmacéutica, cosmética y fotográfica. También se utiliza como suplemento dietético y se ha publicitado como un posible remedio contra el proceso de envejecimiento. [62] [63] [64]
Del griego para pegamento, kolla , la palabra colágeno significa " productor de pegamento " y se refiere al proceso temprano de hervir la piel y los tendones de caballos y otros animales para obtener pegamento. El adhesivo de colágeno fue utilizado por los egipcios hace unos 4.000 años, y los nativos americanos lo usaron en arcos hace unos 1.500 años. Se descubrió que el pegamento más antiguo del mundo, datado por carbono con más de 8.000 años, era colágeno, utilizado como revestimiento protector en cestas de cuerda y telas bordadas , para mantener juntos los utensilios y en decoraciones entrecruzadas en cráneos humanos . [65] El colágeno normalmente se convierte en gelatina, pero sobrevivió debido a las condiciones secas. Los pegamentos animales son termoplásticos y se ablandan nuevamente al recalentarse, por lo que todavía se utilizan para fabricar instrumentos musicales como violines y guitarras finos, que pueden tener que volver a abrirse para reparaciones, una aplicación incompatible con los adhesivos plásticos sintéticos resistentes , que son permanentes. Los tendones y las pieles de animales, incluido el cuero, se han utilizado para fabricar artículos útiles durante milenios.
Se ha utilizado pegamento de gelatina - resorcinol - formaldehído (y con formaldehído reemplazado por pentanodial y etanodial menos tóxicos ) para reparar incisiones experimentales en pulmones de conejos . [66]
Productos cosméticos
This section needs more reliable medical references for verification or relies too heavily on primary sources. (March 2023) |
El colágeno bovino se utiliza ampliamente en rellenos dérmicos para la corrección estética de arrugas y el envejecimiento de la piel. [67] Las cremas de colágeno también se venden ampliamente a pesar de que el colágeno no puede penetrar la piel porque sus fibras son demasiado grandes. [68] El colágeno es una proteína vital en la piel , el cabello , las uñas y otros tejidos. Su producción disminuye con la edad y factores como el daño solar y el tabaquismo . Los suplementos de colágeno, derivados de fuentes como el pescado y el ganado , se comercializan para mejorar la piel, el cabello y las uñas. Los estudios muestran algunos beneficios para la piel, pero estos suplementos a menudo contienen otros ingredientes beneficiosos, lo que no está claro si el colágeno solo es efectivo. Hay evidencia mínima que respalde los beneficios del colágeno para el cabello y las uñas. En general, la efectividad de los suplementos de colágeno orales no está bien probada, y se recomienda centrarse en un estilo de vida saludable y métodos de cuidado de la piel probados como la protección solar . [69]
Historia
Las estructuras moleculares y de empaquetamiento del colágeno eludieron a los científicos durante décadas de investigación. La primera evidencia de que posee una estructura regular a nivel molecular se presentó a mediados de la década de 1930. [70] [71] La investigación se concentró entonces en la conformación del monómero de colágeno , produciendo varios modelos en competencia, aunque abordando correctamente la conformación de cada cadena peptídica individual. El modelo de triple hélice "Madras", propuesto por GN Ramachandran en 1955, proporcionó un modelo preciso de la estructura cuaternaria del colágeno. [72] [73] [74] [75] [76] Este modelo fue respaldado por estudios posteriores de mayor resolución a fines del siglo XX. [77] [78] [79] [80]
La estructura de empaquetamiento del colágeno no ha sido definida en el mismo grado fuera de los tipos de colágeno fibrilar, aunque se sabe desde hace mucho tiempo que es hexagonal. [33] [81] [82] Al igual que con su estructura monomérica, varios modelos conflictivos proponen que la disposición de empaquetamiento de las moléculas de colágeno es "similar a una lámina" o es microfibrilar . [83] [84] La estructura microfibrilar de las fibrillas de colágeno en tendones, córneas y cartílagos fue fotografiada directamente por microscopía electrónica a fines del siglo XX y principios del siglo XXI. [85] [86] [87] La estructura microfibrilar del tendón de la cola de rata se modeló como la más cercana a la estructura observada, aunque simplificó demasiado la progresión topológica de las moléculas de colágeno vecinas y, por lo tanto, no predijo la conformación correcta de la disposición pentamérica D-periódica discontinua denominada microfibrilla . [32] [88] [89]
Véase también
- Péptido hibridizante de colágeno , un péptido que puede unirse al colágeno desnaturalizado.
- Trastorno del espectro de hipermovilidad
- Inhibidor de metaloproteasa
- Osteoide , un componente del hueso que contiene colágeno.
- Pérdida de colágeno
Referencias
- ^ Di Lullo GA, Sweeney SM, Korkko J, Ala-Kokko L, San Antonio JD (febrero de 2002). "Mapeo de los sitios de unión de ligandos y mutaciones asociadas a enfermedades en la proteína más abundante en el colágeno humano tipo I". The Journal of Biological Chemistry . 277 (6): 4223–4231. doi : 10.1074/jbc.M110709200 . PMID 11704682.
- ^ "El cuero producido mediante biotecnología está a punto de llegar a las pasarelas". The Economist . 26 de agosto de 2017. Archivado desde el original el 1 de septiembre de 2017 . Consultado el 2 de septiembre de 2017 .
- ^ Enciclopedia Británica Concisa 2007
- ^ Sikorski ZE (2001). Propiedades químicas y funcionales de las proteínas de los alimentos . Boca Raton, Florida: CRC Press. p. 242. ISBN 978-1-56676-960-0.
- ^ Bogue RH (1923). "Condiciones que afectan la hidrólisis del colágeno a gelatina". Química industrial y de ingeniería . 15 (11): 1154–59. doi :10.1021/ie50167a018.
- ^ OED 2da Edición 2005
- ^ Müller WE (febrero de 2003). "El origen de la complejidad de los metazoos: los poríferos como animales integrados". Biología Integrativa y Comparativa . 43 (1): 3–10. CiteSeerX 10.1.1.333.3174 . doi :10.1093/icb/43.1.3. PMID 21680404. S2CID 17232196.
- ^ Revisión del libro de texto de cirugía de Sabiston, 7.ª edición. Capítulo 5 Cicatrización de heridas, pregunta 14
- ^ ab Ricard-Blum S (enero de 2011). "La familia del colágeno". Cold Spring Harbor Perspectives in Biology . 3 (1): a004978. doi :10.1101/cshperspect.a004978. PMC 3003457 . PMID 21421911.
- ^ Franzke CW, Bruckner P, Bruckner-Tuderman L (febrero de 2005). "Proteínas transmembrana colágenas: conocimientos recientes sobre biología y patología". The Journal of Biological Chemistry . 280 (6): 4005–4008. doi : 10.1074/jbc.R400034200 . PMID 15561712.
- ^ Ashokkumar M, Ajayan PM (3 de abril de 2021). "Perspectiva de la ciencia de los materiales de los materiales multifuncionales derivados del colágeno". International Materials Reviews . 66 (3): 160–87. Bibcode :2021IMRv...66..160A. doi :10.1080/09506608.2020.1750807. ISSN 0950-6608. S2CID 216270520.
- ^ Cunniffe G, O'Brien F (2011). "Andamiajes de colágeno para la medicina regenerativa ortopédica". Revista de la Sociedad de Minerales, Metales y Materiales . 63 (4): 66–73. Bibcode :2011JOM....63d..66C. doi :10.1007/s11837-011-0061-y. S2CID 136755815.
- ^ Geiger M, Li RH, Friess W (noviembre de 2003). "Esponjas de colágeno para la regeneración ósea con rhBMP-2". Advanced Drug Delivery Reviews . 55 (12): 1613–1629. doi :10.1016/j.addr.2003.08.010. PMID 14623404.
- ^ Bunyaratavej P, Wang HL (febrero de 2001). "Membranas de colágeno: una revisión". Revista de Periodontología . 72 (2): 215–229. doi :10.1902/jop.2001.72.2.215. hdl : 2027.42/141506 . PMID 11288796.
- ^ Drury JL, Mooney DJ (noviembre de 2003). "Hidrogeles para ingeniería de tejidos: variables de diseño de andamios y aplicaciones". Biomateriales . 24 (24): 4337–4351. doi :10.1016/S0142-9612(03)00340-5. PMID 12922147.
- ^ Tonndorf R, Aibibu D, Cherif C (enero de 2020). "Hilado de multifilamentos de colágeno". Ciencia e ingeniería de materiales. C, Materiales para aplicaciones biológicas . 106 : 110105. doi :10.1016/j.msec.2019.110105. PMID 31753356. S2CID 202227968.
- ^ Oliveira SM, Ringshia RA, Legeros RZ, Clark E, Yost MJ, Terracio L, et al. (agosto de 2010). "Un andamiaje de colágeno mejorado para la regeneración esquelética". Revista de investigación de materiales biomédicos. Parte A. 94 ( 2): 371–379. doi :10.1002/jbm.a.32694. PMC 2891373. PMID 20186736 .
- ^ ab Singh O, Gupta SS, Soni M, Moses S, Shukla S, Mathur RK (enero de 2011). "Apósitos de colágeno frente a apósitos convencionales en quemaduras y heridas crónicas: un estudio retrospectivo". Revista de cirugía cutánea y estética . 4 (1): 12–16. doi : 10.4103/0974-2077.79180 . PMC 3081477 . PMID 21572675.
- ^ Gould LJ (enero de 2016). "Biomateriales tópicos basados en colágeno para heridas crónicas: fundamento y aplicación clínica". Avances en el cuidado de heridas . 5 (1): 19–31. doi :10.1089/wound.2014.0595. PMC 4717516 . PMID 26858912.
- ^ "Sobre de colágeno y extracto de rosa mosqueta". Alaina Pharma . Archivado desde el original el 4 de julio de 2016 . Consultado el 31 de mayo de 2021 .
- ^ Birbrair A, Zhang T, Files DC, Mannava S, Smith T, Wang ZM, et al. (noviembre de 2014). "Los pericitos de tipo 1 se acumulan después de una lesión tisular y producen colágeno de una manera dependiente del órgano". Investigación y terapia con células madre . 5 (6): 122. doi : 10.1186/scrt512 . PMC 4445991 . PMID 25376879.
- ^ Blow N (2009). "Cultivo celular: construcción de una mejor matriz". Nature Methods . 6 (8): 619–22. doi : 10.1038/nmeth0809-619 . S2CID 33438539.
- ^ Brodsky B, Persikov AV (1 de enero de 2005). "Estructura molecular de la triple hélice del colágeno". Advances in Protein Chemistry . 70 : 301–339. doi :10.1016/S0065-3233(05)70009-7. ISBN 978-0120342709. Número de identificación personal 15837519. Número de identificación personal 20879450.
- ^ abcde Szpak P (2011). "Química y ultraestructura de los huesos de pescado: implicaciones para la tafonomía y el análisis de isótopos estables". Revista de ciencia arqueológica . 38 (12): 3358–72. Código Bibliográfico :2011JArSc..38.3358S. doi :10.1016/j.jas.2011.07.022.
- ^ Peterkofsky B (diciembre de 1991). "Requerimiento de ascorbato para la hidroxilación y secreción de procolágeno: relación con la inhibición de la síntesis de colágeno en el escorbuto". The American Journal of Clinical Nutrition . 54 (6 Suppl): 1135S–1140S. doi : 10.1093/ajcn/54.6.1135s . PMID 1720597.
- ^ Gorres KL, Raines RT (abril de 2010). "Prolil 4-hidroxilasa". Critical Reviews in Biochemistry and Molecular Biology . 45 (2): 106–124. doi :10.3109/10409231003627991. PMC 2841224 . PMID 20199358.
- ^ Myllylä R, Majamaa K, Günzler V, Hanauske-Abel HM, Kivirikko KI (mayo de 1984). "El ascorbato se consume estequiométricamente en las reacciones no acopladas catalizadas por la prolil 4-hidroxilasa y la lisil hidroxilasa". The Journal of Biological Chemistry . 259 (9): 5403–5405. doi : 10.1016/S0021-9258(18)91023-9 . PMID 6325436.
- ^ Houck JC, Sharma VK, Patel YM, Gladner JA (octubre de 1968). "Inducción de actividades colagenolíticas y proteolíticas por fármacos antiinflamatorios en la piel y fibroblastos". Farmacología bioquímica . 17 (10): 2081–2090. doi :10.1016/0006-2952(68)90182-2. PMID 4301453.
- ^ "preprocolágeno". El Diccionario Libre .
- ^ Hulmes DJ (2002). "Construcción de moléculas de colágeno, fibrillas y estructuras suprafibrilares". Revista de biología estructural . 137 (1–2): 2–10. doi :10.1006/jsbi.2002.4450. PMID 12064927.
- ^ ab Hulmes DJ (1992). "La superfamilia del colágeno: estructuras y ensamblajes diversos". Ensayos en bioquímica . 27 : 49–67. PMID 1425603.
- ^ abc Orgel JP, Irving TC, Miller A, Wess TJ (junio de 2006). "Estructura microfibrilar del colágeno tipo I in situ". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 103 (24): 9001–9005. Bibcode :2006PNAS..103.9001O. doi : 10.1073/pnas.0502718103 . PMC 1473175 . PMID 16751282.
- ^ ab Hulmes DJ, Miller A (1979). "Empaquetamiento molecular cuasi-hexagonal en fibrillas de colágeno". Nature . 282 (5741): 878–880. Bibcode :1979Natur.282..878H. doi :10.1038/282878a0. PMID 514368. S2CID 4332269.
- ^ Perumal S, Antipova O, Orgel JP (febrero de 2008). "La arquitectura de las fibrillas de colágeno, la organización de los dominios y la conformación de triple hélice gobiernan su proteólisis". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 105 (8): 2824–2829. Bibcode :2008PNAS..105.2824P. doi : 10.1073/pnas.0710588105 . PMC 2268544 . PMID 18287018.
- ^ Buchanan JK, Zhang Y, Holmes G, Covington AD, Prabakar S (2019). "El papel de las técnicas de dispersión de rayos X en la comprensión de la estructura del colágeno del cuero" (PDF) . ChemistrySelect . 4 (48): 14091–102. doi :10.1002/slct.201902908. ISSN 2365-6549. S2CID 212830367. Archivado (PDF) desde el original el 27 de enero de 2022.
- ^ Sweeney SM, Orgel JP, Fertala A, McAuliffe JD, Turner KR, Di Lullo GA, et al. (julio de 2008). "Dominios candidatos de interacción entre células y matrices en la fibrilla de colágeno, la proteína predominante en vertebrados". The Journal of Biological Chemistry . 283 (30): 21187–21197. doi : 10.1074/jbc.M709319200 . PMC 2475701 . PMID 18487200.
- ^ Twardowski T, Fertala A, Orgel JP, San Antonio JD (2007). "Colágeno tipo I y miméticos de colágeno como superpolímeros promotores de la angiogénesis". Current Pharmaceutical Design . 13 (35): 3608–3621. doi :10.2174/138161207782794176. PMID 18220798.
- ^ Minary-Jolandan M, Yu MF (septiembre de 2009). "Heterogeneidad nanomecánica en las regiones de superposición y brecha de las fibrillas de colágeno tipo I con implicaciones para la heterogeneidad ósea". Biomacromolecules . 10 (9): 2565–2570. doi :10.1021/bm900519v. PMID 19694448.
- ^ Ross, MH y Pawlina, W. (2011) Histología , 6.ª ed., Lippincott Williams & Wilkins, pág. 218.
- ^ Söderhäll C, Marenholz I, Kerscher T, Rüschendorf F, Esparza-Gordillo J, Worm M, et al. (septiembre de 2007). "Variantes en un nuevo gen de colágeno epidérmico (COL29A1) están asociadas con dermatitis atópica". PLOS Biology . 5 (9): e242. doi : 10.1371/journal.pbio.0050242 . PMC 1971127 . PMID 17850181.
- ^ ab Mahajan VB, Olney AH, Garrett P, Chary A, Dragan E, Lerner G, et al. (noviembre de 2010). "Mutación del colágeno XVIII en el síndrome de Knobloch con leucemia linfoblástica aguda". American Journal of Medical Genetics. Parte A. 152A ( 11): 2875–2879. doi :10.1002/ajmg.a.33621. PMC 2965270. PMID 20799329 .
- ^ Gajko-Galicka A (2002). "Mutaciones en genes de colágeno tipo I que resultan en osteogénesis imperfecta en humanos" (PDF) . Acta Biochimica Polonica . 49 (2): 433–441. doi : 10.18388/abp.2002_3802 . PMID 12362985. Archivado (PDF) desde el original el 7 de junio de 2013.
- ^ Horton WA, Campbell D, Machado MA, Chou J (diciembre de 1989). "Cribado de colágeno tipo II en condrodisplasias humanas". American Journal of Medical Genetics . 34 (4): 579–583. doi :10.1002/ajmg.1320340425. PMID 2624272.
- ^ Malfait F, Francomano C, Byers P, Belmont J, Berglund B, Black J, et al. (marzo de 2017). "La clasificación internacional de 2017 de los síndromes de Ehlers-Danlos". American Journal of Medical Genetics. Parte C, Seminarios en genética médica . 175 (1): 8–26. doi : 10.1002/ajmg.c.31552 . PMID: 28306229. S2CID : 4440499.
- ^ Hamel BC, Pals G, Engels CH, van den Akker E, Boers GH, van Dongen PW y otros. (junio de 1998). "Síndrome de Ehlers-Danlos y anomalías del colágeno tipo III: un espectro clínico variable". Genética Clínica . 53 (6): 440–446. doi :10.1111/j.1399-0004.1998.tb02592.x. PMID 9712532. S2CID 39089732.
- ^ Kashtan CE (1993). "Síndrome de Alport y nefropatía por membrana basal delgada". En Pagon RA, Bird TD, Dolan CR, Stephens K, Adam MP (eds.). GeneReviews . Vol. Nefropatías relacionadas con el colágeno IV. Seattle WA: Universidad de Washington, Seattle. PMID 20301386.
- ↑ Alexander I (9 de octubre de 2024). «Los gigantes del colágeno y la carne alimentan la deforestación y las violaciones de derechos en Paraguay: Informe». Mongabay Environmental News . Consultado el 9 de octubre de 2024 .
- ^ Fratzl P (2008). Colágeno: estructura y mecánica . Nueva York: Springer. ISBN 978-0-387-73905-2.
- ^ Buehler MJ (agosto de 2006). "La naturaleza diseña colágeno resistente: explicación de la nanoestructura de las fibrillas de colágeno". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 103 (33): 12285–12290. Bibcode :2006PNAS..10312285B. doi : 10.1073/pnas.0603216103 . PMC 1567872 . PMID 16895989.
- ^ Rellenos dérmicos | La piel envejecida Archivado el 13 de mayo de 2011 en Wayback Machine . Pharmaxchange.info. Consultado el 21 de abril de 2013.
- ^ Zylberberg L, Laurin M (2011). "Análisis de la matriz orgánica de huesos fósiles mediante microscopía electrónica de transmisión". Comptes Rendus Palevol . 11 (5–6): 357–66. doi :10.1016/j.crpv.2011.04.004.
- ^ ab Gautieri A, Vesentini S, Redaelli A, Buehler MJ (febrero de 2011). "Estructura jerárquica y nanomecánica de las microfibrillas de colágeno desde la escala atómica hacia arriba". Nano Letters . 11 (2): 757–766. Bibcode :2011NanoL..11..757G. doi :10.1021/nl103943u. hdl :1721.1/77587. PMID 21207932.
- ^ Pradhan SM, Katti DR, Katti KS (2011). "Estudio de dinámica molecular dirigida de la respuesta mecánica de moléculas de colágeno cortas y de longitud completa". Revista de nanomecánica y micromecánica . 1 (3): 104–110. doi :10.1061/(ASCE)NM.2153-5477.0000035. ISSN 2153-5434.
- ^ Buehler MJ (enero de 2008). "Nanomecánica de las fibrillas de colágeno bajo densidades de enlaces cruzados variables: estudios atomísticos y continuos". Revista del comportamiento mecánico de materiales biomédicos . 1 (1): 59–67. doi :10.1016/j.jmbbm.2007.04.001. PMID 19627772.
- ^ Gentleman E, Lay AN, Dickerson DA, Nauman EA, Livesay GA, Dee KC (septiembre de 2003). "Caracterización mecánica de fibras de colágeno y estructuras para ingeniería de tejidos". Biomateriales . 24 (21): 3805–3813. doi :10.1016/s0142-9612(03)00206-0. PMID 12818553.
- ^ Vesentini S, Fitié CF, Montevecchi FM, Redaelli A (junio de 2005). "Evaluación molecular de las propiedades elásticas de secuencias de homotrímeros similares al colágeno". Biomecánica y modelado en mecanobiología . 3 (4): 224–234. doi :10.1007/s10237-004-0064-5. PMID 15824897.
- ^ Buehler MJ (agosto de 2006). "Modelado atomístico y continuo de las propiedades mecánicas del colágeno: elasticidad, fractura y autoensamblaje". Revista de investigación de materiales . 21 (8): 1947–1961. Código Bibliográfico :2006JMatR..21.1947B. doi :10.1557/jmr.2006.0236. ISSN 2044-5326.
- ^ van der Rijt JA, van der Werf KO, Bennink ML, Dijkstra PJ, Feijen J (septiembre de 2006). "Pruebas micromecánicas de fibrillas de colágeno individuales". Biociencia Macromolecular . 6 (9): 697–702. doi :10.1002/mabi.200600063. PMID 16967482.
- ^ ab Gentleman E, Lay AN, Dickerson DA, Nauman EA, Livesay GA, Dee KC (septiembre de 2003). "Caracterización mecánica de fibras de colágeno y estructuras para ingeniería de tejidos". Biomateriales . 24 (21): 3805–3813. doi :10.1016/S0142-9612(03)00206-0. PMID 12818553.
- ^ Puxkandl R, Zizak I, Paris O, Keckes J, Tesch W, Bernstorff S, et al. (febrero de 2002). Bailey AJ, Macmillan J, Shrewry PR, Tatham AS (eds.). "Propiedades viscoelásticas del colágeno: investigaciones de radiación de sincrotrón y modelo estructural". Philosophical Transactions of the Royal Society of London. Serie B, Ciencias Biológicas . 357 (1418): 191–197. doi :10.1098/rstb.2001.1033. PMC 1692933 . PMID 11911776.
- ^ "4 formas de mejorar la salud con el colágeno". Penn Medicine . Filadelfia, PA: University of Pennsylvania Health System . 4 de noviembre de 2018. Archivado desde el original el 19 de septiembre de 2020 . Consultado el 3 de abril de 2023 .
{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ^ Al-Atif H (febrero de 2022). "Suplementos de colágeno para el envejecimiento y las arrugas: un cambio de paradigma en los campos de la dermatología y la cosmética". Dermatología práctica y conceptual . 12 (1): e2022018. doi :10.5826/dpc.1201a18. PMC 8824545 . PMID 35223163.
- ^ Lawton G (1 de abril de 2023). "La nueva teoría radical de que las arrugas en realidad causan el envejecimiento". New Scientist .
- ^ Campos LD, Santos Junior Vd, Pimentel JD, Carregã GL, Cazarin CB (2023). "Suplementación de colágeno en enfermedades de la piel y ortopédicas: una revisión de la literatura". Heliyon . 9 (4): e14961. Bibcode :2023Heliy...914961C. doi : 10.1016/j.heliyon.2023.e14961 . ISSN 2405-8440. PMC 10102402 . PMID 37064452.
- ^ Walker AA (21 de mayo de 1998). «Descubierto el pegamento más antiguo». Arqueología . Archivado desde el original el 17 de diciembre de 2005.
- ^ Ennker IC, Ennker J, Schoon D, Schoon HA, Rimpler M, Hetzer R (junio de 1994). "Pegamento de colágeno sin formaldehído en el pegado experimental de pulmones". Anales de cirugía torácica . 57 (6): 1622–1627. doi : 10.1016/0003-4975(94)90136-8 . PMID: 8010812.
- ^ Wasley A, Mendonça E, Zuker F (6 de marzo de 2023). «La moda mundial del colágeno vinculada a la deforestación brasileña». The Guardian . ISSN 0261-3077 . Consultado el 6 de marzo de 2023 .
- ^ "Colágeno". Escuela de Salud Pública TH Chan de Harvard: The Nutrition Source . 26 de mayo de 2021. Consultado el 6 de marzo de 2023 .
- ^ "¿Está considerando tomar bebidas y suplementos de colágeno?". Blog de salud de Harvard . Harvard Health Publishing. 12 de abril de 2023. Consultado el 19 de julio de 2024 .
- ^ Wyckoff RW, Corey RB, Biscoe J (agosto de 1935). "Reflexiones de rayos X de espaciado largo desde el tendón". Science . 82 (2121): 175–176. Bibcode :1935Sci....82..175W. doi :10.1126/science.82.2121.175. PMID 17810172.
- ^ Clark G, Parker E, Schaad J, Warren WJ (1935). "Nuevas mediciones de grandes espaciamientos interplanares previamente desconocidos en materiales naturales". J. Am. Chem. Soc. 57 (8): 1509. doi :10.1021/ja01311a504.
- ^ Ramachandran GN, Kartha G (septiembre de 1955). "Estructura del colágeno". Nature . 176 (4482): 593–595. Bibcode :1955Natur.176..593R. doi :10.1038/176593a0. PMID 13265783. S2CID 33745131.
- ^ Ramachandran GN, Kartha G (agosto de 1954). "Estructura del colágeno". Nature . 174 (4423): 269–270. Bibcode :1954Natur.174..269R. doi :10.1038/174269c0. PMID 13185286. S2CID 4284147.
- ^ Balasubramanian, D. (octubre de 2001). «GNR – A Tribute». Resonance . 6 (10): 2–4. doi :10.1007/BF02836961. S2CID 122261106. Archivado desde el original el 10 de enero de 2014.
- ^ Leonidas DD, Chavali GB, Jardine AM, Li S, Shapiro R, Acharya KR (agosto de 2001). "Unión de iones de fosfato y pirofosfato en el sitio activo de la angiogenina humana según lo revelado por cristalografía de rayos X". Protein Science . 10 (8): 1669–1676. doi :10.1110/ps.13601. PMC 2374093 . PMID 11468363.
- ^ Subramanian E (junio de 2001). "GN Ramachandran". Nature Structural Biology . 8 (6): 489–491. doi : 10.1038/88544 . PMID 11373614. S2CID 7231304.
- ^ Fraser RD, MacRae TP, Suzuki E (abril de 1979). "Conformación de la cadena en la molécula de colágeno". Journal of Molecular Biology . 129 (3): 463–481. doi :10.1016/0022-2836(79)90507-2. PMID 458854.
- ^ Okuyama K, Okuyama K, Arnott S, Takayanagi M, Kakudo M (octubre de 1981). "Estructura cristalina y molecular de un polipéptido similar al colágeno (Pro-Pro-Gly)10". Revista de biología molecular . 152 (2): 427–443. doi :10.1016/0022-2836(81)90252-7. PMID 7328660.
- ^ Traub W, Yonath A, Segal DM (marzo de 1969). "Sobre la estructura molecular del colágeno". Nature . 221 (5184): 914–917. Bibcode :1969Natur.221..914T. doi :10.1038/221914a0. PMID 5765503. S2CID 4145093.
- ^ Bella J, Eaton M, Brodsky B, Berman HM (octubre de 1994). "Estructura cristalina y molecular de un péptido similar al colágeno con una resolución de 1,9 A". Science . 266 (5182): 75–81. Bibcode :1994Sci...266...75B. doi :10.1126/science.7695699. PMID 7695699.
- ^ Jésior JC, Miller A, Berthet-Colominas C (mayo de 1980). "El empaquetamiento tridimensional cristalino es una característica general de las fibrillas de colágeno tipo I". FEBS Letters . 113 (2): 238–240. Bibcode :1980FEBSL.113..238J. doi : 10.1016/0014-5793(80)80600-4 . PMID 7389896. S2CID 40958154.
- ^ Fraser RD, MacRae TP (1981). "Célula unitaria y conectividad molecular en el colágeno del tendón". Revista internacional de macromoléculas biológicas . 3 (3): 193–200. doi :10.1016/0141-8130(81)90063-5.
- ^ Fraser RD, MacRae TP, Miller A (enero de 1987). "Empaquetamiento molecular en fibrillas de colágeno tipo I". Journal of Molecular Biology . 193 (1): 115–125. doi :10.1016/0022-2836(87)90631-0. PMID 3586015.
- ^ Wess TJ, Hammersley AP, Wess L, Miller A (enero de 1998). "Empaquetamiento molecular del colágeno tipo I en el tendón". Journal of Molecular Biology . 275 (2): 255–267. doi :10.1006/jmbi.1997.1449. PMID 9466908.
- ^ Raspanti M, Ottani V, Ruggeri A (octubre de 1990). "Arquitectura subfibrilar y propiedades funcionales del colágeno: un estudio comparativo en tendones de rata". Journal of Anatomy . 172 : 157–164. PMC 1257211 . PMID 2272900.
- ^ Holmes DF, Gilpin CJ, Baldock C, Ziese U, Koster AJ, Kadler KE (junio de 2001). "Estructura de las fibrillas de colágeno corneal en tres dimensiones: perspectivas estructurales sobre el ensamblaje de las fibrillas, las propiedades mecánicas y la organización tisular". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 98 (13): 7307–7312. Bibcode :2001PNAS...98.7307H. doi : 10.1073/pnas.111150598 . PMC 34664 . PMID 11390960.
- ^ Holmes DF, Kadler KE (noviembre de 2006). "La estructura de microfibrillas 10+4 de fibrillas finas de cartílago". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 103 (46): 17249–17254. Bibcode :2006PNAS..10317249H. doi : 10.1073/pnas.0608417103 . PMC 1859918 . PMID 17088555.
- ^ Okuyama K, Bächinger HP, Mizuno K, Boudko S, Engel J, Berisio R, et al. (septiembre de 2009). "Re: Estructura microfibrilar del colágeno tipo I in situ". Acta Crystallographica. Sección D, Cristalografía biológica . 65 (Pt 9): 1009–10. Bibcode :2009AcCrD..65.1007O. doi : 10.1107/S0907444909023051 . PMID 19690380.
- ^ Orgel J (2009). "Sobre la estructura de empaquetamiento del colágeno: respuesta al comentario de Okuyama et al. sobre la estructura microfibrilar del colágeno tipo I in situ". Acta Crystallographica Sección D . D65 (9): 1009. Bibcode :2009AcCrD..65.1009O. doi : 10.1107/S0907444909028741 .

![{\displaystyle {\frac {d\epsilon_{D}}{d\epsilon_{T}}}=\alpha +(\beta -\alpha )exp[-\gamma {\frac {\epsilon_{T}}{\dot {\epsilon_{T}}}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3c23190ca6a48c29f2721dae7cce85cfc696adaa)


