Radical (química)


En química , un radical , también conocido como radical libre , es un átomo , molécula o ion que tiene al menos un electrón de valencia desapareado . [1] [2] Con algunas excepciones, estos electrones desapareados hacen que los radicales sean altamente reactivos químicamente . Muchos radicales se dimerizan espontáneamente . La mayoría de los radicales orgánicos tienen vidas medias cortas.
Un ejemplo notable de radical es el radical hidroxilo (HO · ), una molécula que tiene un electrón desapareado en el átomo de oxígeno. Otros dos ejemplos son el oxígeno triplete y el carbeno triplete ( ꞉ CH
2) que tienen dos electrones desapareados.
Los radicales se pueden generar de varias maneras, pero los métodos típicos incluyen reacciones redox , radiación ionizante , calor, descargas eléctricas y electrólisis , que se sabe que producen radicales. Los radicales son intermediarios en muchas reacciones químicas, más de lo que se desprende de las ecuaciones balanceadas.
Los radicales son importantes en la combustión , la química atmosférica , la polimerización , la química del plasma , la bioquímica y muchos otros procesos químicos. La mayoría de los productos naturales son generados por enzimas generadoras de radicales. En los organismos vivos, los radicales superóxido y óxido nítrico y sus productos de reacción regulan muchos procesos, como el control del tono vascular y, por lo tanto, la presión arterial. También desempeñan un papel clave en el metabolismo intermediario de varios compuestos biológicos. Dichos radicales pueden incluso ser mensajeros en un proceso denominado señalización redox . Un radical puede quedar atrapado dentro de una jaula de disolvente o estar unido de otra manera.
Formación
Los radicales se forman (1) a partir de moléculas con pares de espín o (2) a partir de otros radicales. Los radicales se forman a partir de moléculas con pares de espín mediante homólisis de enlaces débiles o transferencia de electrones, también conocida como reducción. Los radicales se forman a partir de otros radicales mediante reacciones de sustitución, adición y eliminación.
Formación de radicales a partir de moléculas con pares de espines
Homólisis
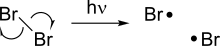
La homólisis produce dos radicales nuevos a partir de una molécula con pares de espines rompiendo un enlace covalente, lo que deja cada uno de los fragmentos con uno de los electrones en el enlace. [3] Debido a que romper un enlace químico requiere energía, la homólisis ocurre bajo la adición de calor o luz. La energía de disociación de enlaces asociada con la homólisis depende de la estabilidad de un compuesto dado, y algunos enlaces débiles pueden homolizarse a temperaturas relativamente más bajas.
Algunas reacciones de homólisis son particularmente importantes porque sirven como iniciadores de otras reacciones radicalarias. Un ejemplo de ello es la homólisis de halógenos, que se produce bajo la luz y sirve como fuerza impulsora de las reacciones de halogenación radicalaria.
Otra reacción notable es la homólisis del peróxido de dibenzoilo, que da como resultado la formación de dos radicales benzoiloxi y actúa como iniciador de muchas reacciones radicalarias. [4]
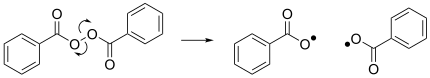
Reducción

Clásicamente, los radicales se forman por reducciones de un electrón . Normalmente, los compuestos orgánicos reducidos por un electrón son inestables. La estabilidad se confiere al anión radical cuando la carga se puede deslocalizar . Algunos ejemplos son los naftenuros de metales alcalinos , los antracenuros y los cetilos .
Formación de radicales a partir de otros radicales.
Abstracción

La abstracción de hidrógeno genera radicales. Para lograr esta reacción, el enlace CH del átomo de H donante debe ser débil, lo que rara vez ocurre en los compuestos orgánicos. Los enlaces CH alílicos y especialmente los doblemente alílicos son propensos a la abstracción por el O2 . Esta reacción es la base de los aceites secantes , como los derivados del ácido linoleico .
Suma
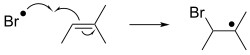
En las adiciones por radicales libres , un radical se añade a un sustrato con espín emparejado. Cuando se aplica a compuestos orgánicos, la reacción suele implicar la adición a un alqueno. Esta adición genera un nuevo radical, que puede añadirse a otro alqueno, etc. Este comportamiento sustenta la polimerización radical , tecnología que produce muchos plásticos . [5] [6]
Eliminación
La eliminación de radicales puede considerarse como el proceso inverso de la adición de radicales. En la eliminación de radicales, un compuesto radical inestable se descompone en una molécula con pares de espín y un nuevo compuesto radical. A continuación se muestra un ejemplo de una reacción de eliminación de radicales, en la que un radical benzoiloxi se descompone en un radical fenilo y una molécula de dióxido de carbono. [7]
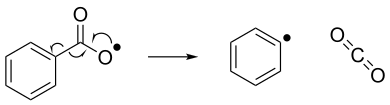
Estabilidad
Estabilidad de los radicales orgánicos
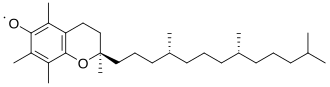
La generación y reactividad de los radicales orgánicos dependen tanto de su estabilidad termodinámica como de su estabilidad cinética, también conocida como persistencia. Esta distinción es necesaria porque estos dos tipos de estabilidad no siempre se correlacionan entre sí. Por ejemplo, los radicales bencílicos, que son conocidos por su débil fuerza de enlace C−H bencílico, están estabilizados termodinámicamente debido a la deslocalización por resonancia. Sin embargo, estos radicales son cinéticamente transitorios porque pueden experimentar una dimerización rápida, limitada por difusión, lo que resulta en una vida útil que es menor a unos pocos nanosegundos. Para evitar confusiones, particularmente para los radicales centrados en el carbono, Griller e Ingold introdujeron las siguientes definiciones: [8] "Estabilizado debe usarse para describir un radical centrado en el carbono, R · , cuando la fuerza del enlace R−H es más débil que el enlace C−H apropiado del alcano". "Persistente debe usarse para describir un radical que tiene una vida útil que es significativamente mayor que el metilo [radical] bajo la misma condición". Si bien las relaciones entre la estabilidad termodinámica y la persistencia cinética dependen en gran medida de cada caso, los radicales orgánicos pueden estabilizarse en general mediante alguno o todos estos factores: la presencia de electronegatividad, deslocalización e impedimento estérico. [8] El compuesto 2,2,6,6-tetrametilpiperidiniloxilo ilustra la combinación de los tres factores. Es un sólido disponible comercialmente que, además de ser magnético, se comporta como un compuesto orgánico normal.
Electronegatividad
Los radicales orgánicos son inherentemente deficientes en electrones, por lo que cuanto mayor sea la electronegatividad del átomo en el que reside el electrón desapareado, menos estable será el radical. [9] Entre el carbono, el nitrógeno y el oxígeno, por ejemplo, el carbono es el más estable y el oxígeno el menos estable.
La electronegatividad también influye en la estabilidad de los átomos de carbono de diferentes hibridaciones. Un mayor carácter s se correlaciona con una mayor electronegatividad del átomo de carbono (debido a la proximidad de los orbitales s al núcleo), y cuanto mayor es la electronegatividad, menos estable es el radical. [9] Los carbonos con hibridación sp (50 % de carácter s) forman los radicales menos estables en comparación con los carbonos con hibridación sp 3 (25 % de carácter s), que forman los radicales más estables.
Deslocalización
La deslocalización de electrones a lo largo de la estructura de un radical, también conocida como su capacidad para formar una o más estructuras de resonancia, permite que la deficiencia de electrones se distribuya entre varios átomos, minimizando la inestabilidad. La deslocalización suele ocurrir en presencia de grupos donadores de electrones, como grupos hidroxilo (−OH), éteres (−OR), alquenos adyacentes y aminas (−NH 2 o −NR), o grupos atractores de electrones, como C=O o C≡N. [3]

Los efectos de deslocalización también pueden entenderse utilizando la teoría de orbitales moleculares como lente, más específicamente, examinando la interacción intramolecular del electrón desapareado con el par de electrones de un grupo donante o el orbital π* vacío de un grupo atractor de electrones en forma de un diagrama de orbitales moleculares. El HOMO de un radical está ocupado individualmente, por lo que el orbital se denomina acertadamente SOMO, u orbital molecular ocupado individualmente. Para un grupo donante de electrones, el SOMO interactúa con el par solitario de menor energía para formar un nuevo orbital de enlace lleno de menor energía y un nuevo SOMO lleno individualmente, de mayor energía que el original. Si bien la energía del electrón desapareado ha aumentado, la disminución de la energía del par solitario que forma el nuevo orbital de enlace supera el aumento de la energía del nuevo SOMO, lo que resulta en una disminución neta de la energía de la molécula. Por lo tanto, los grupos donadores de electrones ayudan a estabilizar los radicales.

Con un grupo que, en cambio, atrae electrones, el SOMO interactúa con el orbital π* vacío. No hay electrones que ocupen el orbital de mayor energía formado, mientras que se forma un nuevo SOMO que tiene menor energía. Esto da como resultado una energía menor y una mayor estabilidad de las especies radicales. Tanto los grupos donantes como los grupos retractores estabilizan los radicales.
Otra forma de deslocalización conocida, aunque más débil, es la hiperconjugación . En la química de radicales, los radicales se estabilizan mediante hiperconjugación con grupos alquilo adyacentes. La donación de enlaces sigma (σ) C−H en los orbitales radicales parcialmente vacíos ayuda a diferenciar las estabilidades de los radicales en carbonos terciarios, secundarios y primarios. Los radicales de carbono terciario tienen tres enlaces σ CH que donan, los radicales secundarios solo dos y los radicales primarios solo uno. Por lo tanto, los radicales terciarios son los más estables y los radicales primarios los menos estables.
Impedimento estérico

En términos más simples, cuanto mayor sea el impedimento estérico, más difícil será que se produzcan reacciones, y la forma radical se favorece por defecto. Por ejemplo, compare la forma abstraída de hidrógeno de la N -hidroxipiperidina con la molécula TEMPO . [3] TEMPO, o (2,2,6,6-Tetrametilpiperidin-1-il)oxilo, está demasiado impedido estéricamente por los grupos metilo adicionales para reaccionar, lo que lo hace lo suficientemente estable como para ser vendido comercialmente en su forma radical. Sin embargo, la N -hidroxipiperidina no tiene los cuatro grupos metilo para impedir el paso de una molécula que reacciona, por lo que la estructura es inestable. [3]
Donantes de átomos de hidrógeno fáciles
La estabilidad de muchos (o la mayoría) de los radicales orgánicos no se indica por su aislabilidad, sino que se manifiesta en su capacidad de funcionar como donantes de H • . Esta propiedad refleja un enlace debilitado con el hidrógeno, generalmente O−H pero a veces N−H o C−H. Este comportamiento es importante porque estos donantes de H • sirven como antioxidantes en biología y en el comercio. Un ejemplo ilustrativo es el α-tocoferol ( vitamina E ). El radical de tocoferol en sí mismo no es suficientemente estable para el aislamiento, pero la molécula original es un donante de átomos de hidrógeno altamente eficaz. El enlace C−H está debilitado en los derivados de trifenilmetilo (tritilo).

Radicales inorgánicos
Existe una gran variedad de radicales inorgánicos que son estables y, de hecho, aislables. Entre los ejemplos se incluyen la mayoría de los complejos de metales de transición de primera fila.
En cuanto a los radicales del grupo principal, el radical más abundante en el universo es también el químico más abundante en el universo, H • . Sin embargo, la mayoría de los radicales del grupo principal no son aislables , a pesar de su estabilidad intrínseca. Los radicales de hidrógeno, por ejemplo, se combinan con entusiasmo para formar H 2 . El óxido nítrico (NO) es un ejemplo bien conocido de un radical inorgánico aislable. La sal de Fremy (nitrosodisulfonato de potasio, (KSO 3 ) 2 NO) es un ejemplo relacionado. Se conocen muchos radicales tiazilo , a pesar del grado limitado de estabilización por resonancia π . [10] [11]
Muchos radicales pueden considerarse productos de la ruptura de enlaces covalentes por homólisis . Las energías de disociación de enlaces homolíticos , normalmente abreviadas como "Δ H °", son una medida de la fuerza del enlace. Dividir H 2 en 2 H • , por ejemplo, requiere un Δ H ° de +435 kJ/mol , mientras que dividir Cl 2 en dos Cl • requiere un Δ H ° de +243 kJ/mol. Para enlaces débiles, la homólisis puede inducirse térmicamente. Los enlaces fuertes requieren fotones de alta energía o incluso llamas para inducir la homólisis.
Dirradicales
Los dirradicales son moléculas que contienen dos centros radicales. El dioxígeno (O 2 ) es un ejemplo importante de un dirradical estable. El oxígeno singlete , el estado no radical de dioxígeno de menor energía, es menos estable que el dirradical debido a la regla de Hund de máxima multiplicidad . La relativa estabilidad del dirradical de oxígeno se debe principalmente a la naturaleza de espín prohibido de la transición triplete-singlete necesaria para que agarre electrones, es decir, se " oxide ". El estado dirradical del oxígeno también da como resultado su carácter paramagnético, que se demuestra por su atracción a un imán externo. [12] Los dirradicales también pueden ocurrir en complejos metal-oxo , prestándose para estudios de reacciones de espín prohibido en la química de los metales de transición . [13] Los carbenos en su estado triplete pueden verse como dirradicales centrados en el mismo átomo, mientras que estos son generalmente carbenos persistentes altamente reactivos , siendo los carbenos N-heterocíclicos el ejemplo más común.
Los carbenos y nitrenos tripletes son dirradicales. Sus propiedades químicas son distintas de las de sus análogos singletes.
Aparición de radicales
Combustión

Una reacción radical conocida es la combustión . La molécula de oxígeno es un dirradical estable , mejor representado por • O–O • . Debido a que los espines de los electrones son paralelos, esta molécula es estable. Si bien el estado fundamental del oxígeno es este dirradical no reactivo de espín desapareado ( triplete ), está disponible un estado de espín apareado ( singlete ) extremadamente reactivo. Para que se produzca la combustión, se debe superar la barrera energética entre estos. Esta barrera se puede superar con calor, lo que requiere altas temperaturas. La transición triplete-singlete también está " prohibida ". Esto presenta una barrera adicional para la reacción. También significa que el oxígeno molecular es relativamente poco reactivo a temperatura ambiente, excepto en presencia de un átomo pesado catalítico como el hierro o el cobre.
La combustión consiste en varias reacciones en cadena de radicales que el radical singlete puede iniciar. La inflamabilidad de un material determinado depende en gran medida de la concentración de radicales que se debe obtener antes de que predominen las reacciones de iniciación y propagación que conducen a la combustión del material. Una vez que se ha consumido el material combustible, las reacciones de terminación dominan de nuevo y la llama se extingue. Como se ha indicado, la promoción de las reacciones de propagación o terminación altera la inflamabilidad. Por ejemplo, debido a que el plomo en sí mismo desactiva los radicales en la mezcla de gasolina y aire, antiguamente se añadía tetraetilo de plomo a la gasolina. Esto evita que la combustión se inicie de forma descontrolada o en residuos no quemados ( detonación del motor ) o ignición prematura ( preignición ).
Cuando se quema un hidrocarburo, intervienen una gran cantidad de radicales de oxígeno diferentes. Inicialmente, se forman radicales hidroperoxilo (HOO • ). Estos luego reaccionan para dar hidroperóxidos orgánicos que se descomponen en radicales hidroxilo (HO • ).
Polimerización
Muchas reacciones de polimerización se inician por radicales. La polimerización implica la adición inicial de un radical a un no radical (normalmente un alqueno) para dar lugar a nuevos radicales. Este proceso es la base de la reacción en cadena de radicales. El arte de la polimerización implica el método mediante el cual se introduce el radical iniciador. Por ejemplo, el metacrilato de metilo (MMA) se puede polimerizar para producir poli(metacrilato de metilo) (PMMA, plexiglás o perspex) mediante una serie repetida de pasos de adición de radicales :
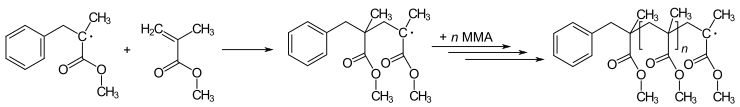
Los métodos de polimerización radical más nuevos se conocen como polimerización radical viva . Las variantes incluyen la transferencia de cadena por adición-fragmentación reversible ( RAFT ) y la polimerización radical por transferencia de átomos ( ATRP ).
Al ser un radical predominante, el O2 reacciona con muchos compuestos orgánicos para generar radicales junto con el radical hidroperóxido . Los aceites secantes y las pinturas alquídicas se endurecen debido a la reticulación radical iniciada por el oxígeno de la atmósfera.
Radicales atmosféricos
El radical más común en la atmósfera inferior es el dioxígeno molecular. La fotodisociación de las moléculas fuente produce otros radicales. En la atmósfera inferior, se producen radicales importantes por la fotodisociación del dióxido de nitrógeno en un átomo de oxígeno y óxido nítrico (véase la ecuación 1.1 a continuación), que desempeña un papel clave en la formación de smog , y la fotodisociación del ozono para dar el átomo de oxígeno excitado O(1D) (véase la ecuación 1.2 a continuación). También se muestran las reacciones neta y de retorno ( ecuación 1.3 y ecuación 1.4 , respectivamente).
| ( ecuación 1.1 ) |
| ( ecuación 1.2 ) |
| ( ecuación 1.3 ) |
| ( ecuación 1.4 ) |
En la atmósfera superior, la fotodisociación de clorofluorocarbonos (CFC) normalmente no reactivos por la radiación ultravioleta solar es una fuente importante de radicales (véase la ecuación 1 a continuación). Estas reacciones dan lugar al radical cloro , Cl • , que cataliza la conversión de ozono en O 2 , facilitando así el agotamiento del ozono ( ecuaciones 2.2 – 2.4 a continuación).
| ( ecuación 2.1 ) |
| ( ecuación 2.2 ) |
| ( ecuación 2.3 ) |
| ( ecuación 2.4 ) |
| ( ecuación 2.5 ) |
Estas reacciones provocan el agotamiento de la capa de ozono , especialmente porque el radical cloro queda libre para participar en otra cadena de reacción; en consecuencia, se ha restringido el uso de clorofluorocarbonos como refrigerantes .
En biología

Los radicales desempeñan papeles importantes en la biología. Muchos de ellos son necesarios para la vida, como la muerte intracelular de bacterias por parte de células fagocíticas como los granulocitos y los macrófagos . Los radicales están involucrados en procesos de señalización celular , [15] conocidos como señalización redox . Por ejemplo, el ataque radical del ácido linoleico produce una serie de ácidos 13-hidroxioctadecadienoicos y 9-hidroxioctadecadienoicos , que pueden actuar para regular las respuestas inflamatorias y/o curativas de los tejidos localizados, la percepción del dolor y la proliferación de células malignas. Los ataques radicales al ácido araquidónico y al ácido docosahexaenoico producen una gama similar pero más amplia de productos de señalización. [16]
Los radicales también pueden estar involucrados en la enfermedad de Parkinson , la sordera senil e inducida por fármacos , la esquizofrenia y el Alzheimer . [17] El síndrome clásico de radicales libres, la hemocromatosis , enfermedad por almacenamiento de hierro , se asocia típicamente con una constelación de síntomas relacionados con los radicales libres, incluyendo trastorno del movimiento, psicosis, anomalías de la melanina pigmentaria de la piel , sordera, artritis y diabetes mellitus. La teoría de los radicales libres del envejecimiento propone que los radicales subyacen al proceso de envejecimiento en sí. De manera similar, el proceso de mitohormesis sugiere que la exposición repetida a los radicales puede extender la esperanza de vida.
Debido a que los radicales son necesarios para la vida, el cuerpo tiene una serie de mecanismos para minimizar el daño inducido por radicales y reparar el daño que se produce, como las enzimas superóxido dismutasa , catalasa , glutatión peroxidasa y glutatión reductasa . Además, los antioxidantes juegan un papel clave en estos mecanismos de defensa. Estos suelen ser las tres vitaminas, vitamina A , vitamina C y vitamina E y los antioxidantes polifenólicos . Además, hay buena evidencia que indica que la bilirrubina y el ácido úrico pueden actuar como antioxidantes para ayudar a neutralizar ciertos radicales. La bilirrubina proviene de la descomposición del contenido de los glóbulos rojos , mientras que el ácido úrico es un producto de degradación de las purinas . Sin embargo, demasiada bilirrubina puede provocar ictericia , que eventualmente podría dañar el sistema nervioso central, mientras que demasiado ácido úrico causa gota . [18]
Especies reactivas de oxígeno
Las especies reactivas de oxígeno o ROS son especies como el superóxido , el peróxido de hidrógeno y el radical hidroxilo , comúnmente asociadas con el daño celular. Las ROS se forman como un subproducto natural del metabolismo normal del oxígeno y tienen papeles importantes en la señalización celular. Dos radicales importantes centrados en el oxígeno son el superóxido y el radical hidroxilo . Derivan del oxígeno molecular en condiciones reductoras. Sin embargo, debido a su reactividad, estos mismos radicales pueden participar en reacciones secundarias no deseadas que resultan en daño celular. Cantidades excesivas de estos radicales pueden provocar daño y muerte celular , lo que puede contribuir a muchas enfermedades como cáncer , accidente cerebrovascular , infarto de miocardio , diabetes y trastornos importantes. [19] Se cree que muchas formas de cáncer son el resultado de reacciones entre radicales y ADN , lo que potencialmente resulta en mutaciones que pueden afectar negativamente el ciclo celular y potencialmente conducir a malignidad. [20] Algunos de los síntomas del envejecimiento, como la aterosclerosis, también se atribuyen a la oxidación inducida por radicales del colesterol a 7-cetocolesterol. [21] Además, los radicales contribuyen al daño hepático inducido por el alcohol , quizás más que el propio alcohol. Los radicales producidos por el humo del cigarrillo están implicados en la inactivación de la alfa 1-antitripsina en el pulmón . Este proceso promueve el desarrollo del enfisema .
Se ha descubierto que la oxibenzona forma radicales en contacto con la luz solar y, por lo tanto, también puede estar asociada con daños celulares. Esto solo ocurrió cuando se combinó con otros ingredientes que se encuentran comúnmente en los protectores solares, como el óxido de titanio y el metoxicinamato de octilo . [22]
Las ROS atacan al ácido graso poliinsaturado , ácido linoleico , para formar una serie de productos de ácido 13-hidroxioctadecadienoico y ácido 9-hidroxioctadecadienoico que sirven como moléculas de señalización que pueden desencadenar respuestas que contrarresten la lesión tisular que causó su formación. Las ROS atacan a otros ácidos grasos poliinsaturados, por ejemplo, el ácido araquidónico y el ácido docosahexaenoico , para producir una serie similar de productos de señalización. [23]
Las especies reactivas de oxígeno también se utilizan en reacciones controladas que involucran dioxígeno singlete conocidas como reacciones de fotooxigenación de tipo II después de la transferencia de energía de Dexter ( aniquilación triplete-triplete ) del dioxígeno triplete natural y el estado triplete excitado de un fotosensibilizador. Las transformaciones químicas típicas con esta especie de dioxígeno singlete involucran, entre otras, la conversión de biorresiduos celulósicos en nuevos tintes de polimetina . [24]
Representación en reacciones químicas
En las ecuaciones químicas, los radicales se indican frecuentemente mediante un punto colocado inmediatamente a la derecha del símbolo atómico o la fórmula molecular, de la siguiente manera:
Los mecanismos de reacción radical utilizan flechas de una sola punta para representar el movimiento de electrones individuales:

La división homolítica del enlace que se rompe se dibuja con una flecha en forma de "anzuelo" para distinguirla del movimiento habitual de dos electrones representado por una flecha curva estándar. El segundo electrón del enlace que se rompe también se mueve para emparejarse con el electrón radical atacante.
Los radicales también participan en la adición y sustitución de radicales como intermediarios reactivos . Las reacciones en cadena que involucran radicales generalmente se pueden dividir en tres procesos distintos: iniciación , propagación y terminación .
- Las reacciones de iniciación son aquellas que dan como resultado un aumento neto en el número de radicales. Pueden implicar la formación de radicales a partir de especies estables, como en la Reacción 1 anterior, o pueden implicar reacciones de radicales con especies estables para formar más radicales.
- Las reacciones de propagación son aquellas reacciones que involucran radicales en las que el número total de radicales permanece igual.
- Las reacciones de terminación son aquellas que dan como resultado una disminución neta del número de radicales. Normalmente, dos radicales se combinan para formar una especie más estable, por ejemplo:
- 2Cl • → Cl2
Historia y nomenclatura

Hasta finales del siglo XX, la palabra "radical" se utilizaba en química para indicar cualquier grupo conectado de átomos, como un grupo metilo o un carboxilo , ya fuera parte de una molécula más grande o una molécula por sí sola. Un radical se conoce a menudo como un grupo R. El calificador "libre" era necesario entonces para especificar el caso no unido. Tras las recientes revisiones de la nomenclatura, una parte de una molécula más grande ahora se llama grupo funcional o sustituyente , y "radical" ahora implica "libre". Sin embargo, la antigua nomenclatura puede seguir apareciendo en algunos libros.
El término radical ya se utilizaba cuando se desarrolló la teoría de los radicales, que ahora está obsoleta. Louis-Bernard Guyton de Morveau introdujo la frase "radical" en 1785 y Antoine Lavoisier la empleó en 1789 en su Traité Élémentaire de Chimie . Entonces, un radical se identificó como la base de la raíz de ciertos ácidos (la palabra latina "radix" significa "raíz"). Históricamente, el término radical en la teoría de los radicales también se utilizó para las partes unidas de la molécula, especialmente cuando permanecen inalteradas en las reacciones. Estas ahora se denominan grupos funcionales . Por ejemplo, se describió que el alcohol metílico constaba de un "radical" metilo y un "radical" hidroxilo. Ninguno de los dos son radicales en el sentido químico moderno, ya que están permanentemente unidos entre sí y no tienen electrones reactivos desapareados; sin embargo, se pueden observar como radicales en la espectrometría de masas cuando se separan mediante la irradiación con electrones energéticos.
En un contexto moderno, el primer radical orgánico (que contiene carbono) identificado fue el radical trifenilmetilo , (C 6 H 5 ) 3 C • . Esta especie fue descubierta por Moses Gomberg en 1900. En 1933, Morris S. Kharasch y Frank Mayo propusieron que los radicales libres eran responsables de la adición anti-Markovnikov de bromuro de hidrógeno al bromuro de alilo . [25] [26]
En la mayoría de los campos de la química, la definición histórica de radicales sostiene que las moléculas tienen un espín electrónico distinto de cero. Sin embargo, en campos como la espectroscopia y la astroquímica , la definición es ligeramente diferente. Gerhard Herzberg , que ganó el premio Nobel por su investigación sobre la estructura electrónica y la geometría de los radicales, sugirió una definición más flexible de radicales libres: "cualquier especie transitoria (químicamente inestable) (átomo, molécula o ion)". [27] El punto principal de su sugerencia es que hay muchas moléculas químicamente inestables que tienen espín cero, como C 2 , C 3 , CH 2 , etc. Esta definición es más conveniente para las discusiones sobre procesos químicos transitorios y astroquímica; por lo tanto, los investigadores en estos campos prefieren utilizar esta definición flexible. [28]
Véase también
- Par de electrones
- Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos
- Reacción de Hofmann-Löffler
- Investigación sobre radicales libres
Referencias
- ^ Libro de Oro de la IUPAC sobre radicales libres (PDF) Archivado el 2 de marzo de 2017 en Wayback Machine.
- ^ Hayyan, M.; Hashim, MA; Anjkut, IM (2016). "Ión superóxido: generación e implicaciones químicas". Chem. Rev. 116 ( 5): 3029–85. doi : 10.1021/acs.chemrev.5b00407 . PMID 26875845.
- ^ abcd Clayden, Jonathan; Greeves, Nick; Warren, Stuart G. (2012). Química orgánica (2.ª ed.). Oxford: Oxford University Press. ISBN 978-0-19-927029-3.OCLC 761379371 .
- ^ "Peróxidos de diacilo". polymerdatabase.com . Consultado el 8 de diciembre de 2020 .
- ^ Gridnev, Alexei A.; Ittel, Steven D. (2001). "Transferencia de cadena catalítica en polimerizaciones por radicales libres". Chemical Reviews . 101 (12): 3611–3660. doi :10.1021/cr9901236. PMID 11740917.
- ^ Monroe, Bruce M.; Weed, Gregory C. (1993). "Fotoiniciadores para sistemas de fotoimagen iniciados por radicales libres". Chemical Reviews . 93 : 435–448. doi :10.1021/cr00017a019.
- ^ Su, Wei-Fang (2013), Su, Wei-Fang (ed.), "Polimerización en cadena radical", Principles of Polymer Design and Synthesis , Lecture Notes in Chemistry, vol. 82, Berlín, Heidelberg: Springer, págs. 137–183, doi : 10.1007/978-3-642-38730-2_7 , ISBN 978-3-642-38730-2
- ^ ab Griller, David; Ingold, Keith U. (1976). "Radicales persistentes centrados en el carbono". Accounts of Chemical Research . 9 : 13–19. doi :10.1021/ar50097a003.
- ^ ab Forrester, AR (1968). Química orgánica de radicales libres estables . Londres: Academic Press. págs. 1–6.
- ^ Oakley, Richard T. (1988). "Tiazenos cíclicos y heterocíclicos" (PDF) . Progreso en química inorgánica . Tiazenos cíclicos y heterocíclicos (sección). Vol. 36. págs. 299–391. doi :10.1002/9780470166376.ch4. ISBN 978-0-470-16637-6Archivado desde el original (PDF) el 23 de septiembre de 2015. Consultado el 31 de marzo de 2011 .
- ^ Rawson, J; Banister, A; Lavender, I (1995). La química del ditiadiazolilio y los anillos de ditiadiazolilo**Dedicado al Dr. ZV Hauptman, en reconocimiento a su importante contribución a la química del azufre-nitrógeno y del carbono-azufre-nitrógeno . Avances en química heterocíclica. Vol. 62. págs. 137–247. doi :10.1016/S0065-2725(08)60422-5. ISBN 978-0-12-020762-6.
- ^ Sin embargo, el paramagnetismo no implica necesariamente un carácter radical.
- ^ Linde, C.; Åkermark, B.; Norrby, P.-O.; Svensson, M. (1999). "El momento es crítico: efecto de los cambios de espín en la diastereoselectividad en la epoxidación catalizada por Mn(Salen)". Journal of the American Chemical Society . 121 (21): 5083–84. doi :10.1021/ja9809915.
- ^ Broderick, JB; Duffus, BR; Duschene, KS; Shepard, EM (2014). "Enzimas de S-adenosilmetionina radicales". Chemical Reviews . 114 (8): 4229–317. doi :10.1021/cr4004709. PMC 4002137 . PMID 24476342.
- ^ Pacher P, Beckman JS, Liaudet L (2007). "Óxido nítrico y peroxinitrito en la salud y la enfermedad". Physiol. Rev. 87 ( 1): 315–424. doi :10.1152/physrev.00029.2006. PMC 2248324. PMID 17237348 .
- ^ Njie-Mbye, Ya Fatou; Kulkarni-Chitnis, Madhura; Opere, Catherine A.; Barrett, Aaron; Ohia, Sunny E. (2013). "Peroxidación lipídica: implicaciones fisiopatológicas y farmacológicas en el ojo". Frontiers in Physiology . 4 : 366. doi : 10.3389/fphys.2013.00366 . PMC 3863722 . PMID 24379787.
- ^ Floyd, RA (1999). "Los procesos neuroinflamatorios son importantes en las enfermedades neurodegenerativas: una hipótesis para explicar la mayor formación de especies reactivas de oxígeno y nitrógeno como factores principales implicados en el desarrollo de enfermedades neurodegenerativas". Biología y medicina de radicales libres . 26 (9–10): 1346–55. doi :10.1016/s0891-5849(98)00293-7. PMID 10381209.
- ^ Se puede encontrar una descripción general del papel de los radicales en biología y del uso de la resonancia de espín electrónico para su detección en Rhodes CJ (2000). Toxicología del entorno humano: el papel crítico de los radicales libres . Londres: Taylor and Francis. ISBN 978-0-7484-0916-7.
- ^ Rajamani Karthikeyan; Manivasagam T; Anantharaman P; Balasubramaniano T; Somasundaram ST (2011). "Efecto quimiopreventivo de los extractos de Padina boergesenii sobre el daño oxidativo inducido por nitrilotriacetato férrico (Fe-NTA) en ratas Wistar". J. Aplica. Ficol . 23 (2): 257–63. doi :10.1007/s10811-010-9564-0. S2CID 27537163.
- ^ Mukherjee, PK; Marcheselli, VL; Serhan, CN; Bazan, NG (2004). "Neuroprotecina D1: un docosatrieno derivado del ácido docosahexanoico protege las células epiteliales pigmentarias de la retina humana del estrés oxidativo". Actas de la Academia Nacional de Ciencias de los Estados Unidos . 101 (22): 8491–96. Bibcode :2004PNAS..101.8491M. doi : 10.1073/pnas.0402531101 . PMC 420421 . PMID 15152078.
- ^ Lyons, MA; Brown, AJ (1999). "7-Ketocholesterol". Int. J. Biochem. Cell Biol . 31 (3–4): 369–75. doi :10.1016/s1357-2725(98)00123-x. PMID 10224662.
- ^ Serpone, N; Salinaro, A; Emeline, AV; Horikoshi, S; Hidaka, H; Zhao, JC (2002). "Un examen espectroscópico sistemático in vitro de las fotoestabilidades de un conjunto aleatorio de lociones de protección solar comerciales y sus agentes químicos activos UVB/UVA". Ciencias fotoquímicas y fotobiológicas . 1 (12): 970–81. doi :10.1039/b206338g. PMID 12661594. S2CID 27248506.
- ^ Njie-Mbye, Ya Fatou; Kulkarni-Chitnis, Madhura; Opere, Catherine A.; Barrett, Aaron; Ohia, Sunny E. (2013). "Peroxidación lipídica: implicaciones fisiopatológicas y farmacológicas en el ojo". Frontiers in Physiology . 4 : 366. doi : 10.3389/fphys.2013.00366 . PMC 3863722 . PMID 24379787.
- ^ Desvals, Arthur; Fortino, Mariagrazia; Lefebvre, Corentin; Rogier, Johann; Michelin, Clément; Alioui, Samy; Rousset, Elodie; Pedone, Alfonso; Lemercier, Gilles; Hoffmann, Norbert (16 de mayo de 2022). "Síntesis y caracterización de colorantes de polimetina que llevan fracciones de ácido tiobarbitúrico y carboxílico" (PDF) . New Journal of Chemistry . 46 (19): 8971–8980. doi :10.1039/D2NJ00684G. ISSN 1369-9261. S2CID 248165785.
- ^ Kharasch, MS (1933). "El efecto peróxido en la adición de reactivos a compuestos insaturados. I. La adición de bromuro de hidrógeno a bromuro de alilo". Journal of the American Chemical Society . 55 (6): 2468–2496. doi :10.1021/ja01333a041.
- ^ Yan, M; Lo, JC; Edwards, JT; Baran, PS (2016). "Radicales: intermediarios reactivos con potencial traslacional". J Am Chem Soc . 138 (39): 12692–12714. doi :10.1021/jacs.6b08856. PMC 5054485 . PMID 27631602.
- ^ G. Herzberg (1971), "Los espectros y estructuras de radicales libres simples", ISBN 0-486-65821-X .
- ^ 28º Simposio Internacional sobre Radicales Libres Archivado el 16 de julio de 2007 en Wayback Machine .
![{\displaystyle {\ce {NO2 ->[h \nu] NO + O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5da627b27ee3e5b4dc45b156c54a91e1d79ffbd1)

![{\displaystyle {\ce {NO2 + O2 ->[h \nu] NO + O3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eae7fc4c91c01822b8db1423a88911a1eb56a171)

![{\displaystyle {\ce {CFCS->[h\nu ]Cl^{\bullet }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8bdfdc999e29261e922e3863cdfa3b4bf84fb5a2)

![{\displaystyle {\ce {O3 ->[h \nu] O + O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3acd85b4a5f671e0a421576bf91c3352bec070c1)

![{\displaystyle {\ce {2O3 ->[h \nu] 3O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/afc621f0abb1c9cfc08b3cf82f43d9fc60a29c40)


