Topoisomerasa tipo II
| Topoisomerasa II del ADN (hidrolizante de ATP) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Estructura del fragmento de 42 KDa de la ATPasa N-terminal y de los dominios transductores de la ADN girasa homóloga a todas las demás topoisomerasas de tipo IIA. | |||||||||
| Identificadores | |||||||||
| N.º CE | 5.6.2.2 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista de IntEnz | ||||||||
| BRENDA | Entrada de BRENDA | ||||||||
| Expasí | Vista de NiceZyme | ||||||||
| BARRIL | Entrada de KEGG | ||||||||
| MetaCiclo | vía metabólica | ||||||||
| PRIAMO | perfil | ||||||||
| Estructuras del PDB | RCSB AP APBE APSUMA | ||||||||
| |||||||||
Las topoisomerasas de tipo II son topoisomerasas que cortan ambas hebras de la hélice de ADN simultáneamente para gestionar los ovillos y superenrollamientos de ADN . Utilizan la hidrólisis de ATP , a diferencia de la topoisomerasa de tipo I. En este proceso, estas enzimas cambian el número de enlace del ADN circular en ±2. Las topoisomerasas son enzimas ubicuas, que se encuentran en todos los organismos vivos. [1]
En los animales, la topoisomerasa II es un objetivo de la quimioterapia. En los procariotas, la girasa es un objetivo antibacteriano. [2] De hecho, estas enzimas son de interés por una amplia gama de efectos.
Función
Las topoisomerasas de tipo II aumentan o disminuyen el número de enlace de un bucle de ADN en 2 unidades y promueven el desenredo de los cromosomas. Por ejemplo, la ADN girasa , una topoisomerasa de tipo II observada en E. coli y la mayoría de los demás procariotas , introduce superenrollamientos negativos y disminuye el número de enlace en 2. La girasa también puede eliminar nudos del cromosoma bacteriano . Junto con la girasa, la mayoría de los procariotas también contienen una segunda topoisomerasa de tipo IIA, denominada topoisomerasa IV. La girasa y la topoisomerasa IV se diferencian por sus dominios C-terminales, que se cree que dictan la especificidad del sustrato y la funcionalidad de estas dos enzimas. La huella indica que la girasa, que forma una huella de 140 pares de bases y envuelve el ADN, introduce superenrollamientos negativos , mientras que la topoisomerasa IV, que forma una huella de 28 pares de bases, no envuelve el ADN.
La topoisomerasa eucariota tipo II no puede introducir superenrollamientos; sólo puede relajarlos.
Las funciones de las topoisomerasas de tipo IIB son menos conocidas. A diferencia de las topoisomerasas de tipo IIA, las topoisomerasas de tipo IIB no pueden simplificar la topología del ADN (ver a continuación), pero comparten varias características estructurales con las topoisomerasas de tipo IIA.
Simplificación de topología
Las topoisomerasas de tipo IIA son esenciales en la separación de las hebras hijas enredadas durante la replicación. Se cree que esta función la realiza la topoisomerasa II en eucariotas y la topoisomerasa IV en procariotas. Si no se separan estas hebras, se produce la muerte celular. Las topoisomerasas de tipo IIA tienen la capacidad especial de relajar el ADN a un estado por debajo del equilibrio termodinámico, una característica que no tienen las topoisomerasas de tipo IA, IB y IIB. Esta capacidad, conocida como simplificación topológica, fue identificada por primera vez por Rybenkov et al. [3] La hidrólisis del ATP impulsa esta simplificación, pero aún falta un mecanismo molecular claro para esta simplificación. Se han propuesto varios modelos para explicar este fenómeno, incluidos dos modelos que se basan en la capacidad de las topoisomerasas de tipo IIA para reconocer dúplex de ADN doblados. [4] La bioquímica, la microscopía electrónica y las estructuras recientes de la topoisomerasa II unida al ADN revelan que las topoisomerasas de tipo IIA se unen a los vértices del ADN, lo que respalda este modelo.
Clasificación
En esta sección falta información sobre los nuevos miembros del IIB [doi:10.1093/nargab/lqz021]. ( Octubre de 2021 ) |
Hay dos subclases de topoisomerasas tipo II, tipo IIA y IIB.
- Las topoisomerasas de tipo IIA incluyen las enzimas ADN girasa , topoisomerasa II eucariota (topo II) y topoisomerasa IV bacteriana (topo IV). Estas enzimas abarcan todos los dominios de la vida y son esenciales para el funcionamiento. [5]
- Las topoisomerasas de tipo IIB son estructural y bioquímicamente distintas y comprenden un solo miembro de la familia, la topoisomerasa VI (topo VI). Las topoisomerasas de tipo IIB se encuentran en arqueas y algunas plantas superiores.
Algunos organismos, incluidos los humanos, tienen dos isoformas de la topoisomerasa II: alfa y beta . En los cánceres , la topoisomerasa IIα se expresa en gran medida en las células en proliferación. En ciertos cánceres, como los tumores de la vaina de los nervios periféricos, la alta expresión de su proteína codificada también se asocia a una baja supervivencia del paciente.
Las dos clases de topoisomerasas poseen un mecanismo de paso de cadena y una estructura de dominio similares (ver más abajo), sin embargo también tienen varias diferencias importantes. Las topoisomerasas de tipo IIA forman roturas de doble cadena con salientes de cuatro pares de bases, mientras que las topoisomerasas de tipo IIB forman roturas de doble cadena con salientes de dos bases. [6] Además, las topoisomerasas de tipo IIA pueden simplificar la topología del ADN, [3] mientras que las topoisomerasas de tipo IIB no lo hacen. [7]
Estructura
Tipo IIA


Las topoisomerasas de tipo IIA constan de varios motivos clave:
- un dominio ATPasa GHKL N-terminal (para girasa, Hsp, quinasa y MutL),
- un dominio Toprim (una subclase de pliegue de Rossmann ), que existe tanto en las topoisomerasas de tipo II, como en las topoisomerasas de tipo IA y en la primasa bacteriana ( DnaG ),
- un núcleo central de unión al ADN (que estructuralmente forma una estructura en forma de corazón), y
- un dominio C-terminal variable.
Las topoisomerasas eucariotas de tipo II son homodímeras (A 2 ), mientras que las topoisomerasas procariotas de tipo II son heterotetrámeras (A 2 B 2 ). Los procariotas tienen el dominio ATPasa y el pliegue Toprim en un polipéptido ( Pfam PF00204), mientras que el núcleo de escisión del ADN y el CTD se encuentran en un segundo polipéptido ( Pfam PF00521). Para la girasa, el primer polipéptido se llama GyrB y el segundo polipéptido se llama GyrA. Para la topo IV, el primer polipéptido se llama ParE y el segundo polipéptido se llama ParC. Ambas firmas Pfam se encuentran en la topoisomerasa eucariota de cadena sencilla.
Las estructuras del dominio ATPasa N-terminal de la girasa [8] y la topoisomerasa II de la levadura [9] se han resuelto en complejo con AMPPNP (un análogo de ATP), lo que demuestra que dos dominios ATPasa se dimerizan para formar una conformación cerrada. En el caso de la girasa, la estructura tiene un agujero sustancial en el medio, que se supone que aloja el segmento T.
El dominio ATPasa se conecta al pliegue Toprim mediante un elemento helicoidal conocido como dominio transductor. Se cree que este dominio comunica el estado del nucleótido del dominio ATPasa al resto de la proteína. Las modificaciones de este dominio afectan la actividad de la topoisomerasa, y el trabajo estructural realizado por el grupo Verdine muestra que el estado de ATP afecta la orientación del dominio transductor. [10]
El núcleo central de la proteína contiene un pliegue Toprim y un núcleo de unión al ADN que contiene un dominio de hélice alada (WHD), a menudo denominado dominio CAP, ya que se identificó por primera vez que se parecía al WHD de la proteína activadora de catabolito. La tirosina catalítica se encuentra en este WHD. El pliegue Toprim es un pliegue de Rossmann que contiene tres residuos ácidos invariantes que coordinan los iones de magnesio involucrados en la escisión del ADN y la religación del ADN. [11] La estructura del pliegue Toprim y el núcleo de unión al ADN de la topoisomerasa II de levadura fue resuelta por primera vez por Berger y Wang, [12] y el primer núcleo de unión al ADN de la girasa fue resuelto por Morais Cabral et al. [13] La estructura resuelta por Berger reveló importantes conocimientos sobre la función de la enzima. El núcleo de unión al ADN consta del WHD, que conduce a un dominio de torre. Una región de hélice superenrollada conduce a un dominio C-terminal que forma la interfaz principal del dímero para este estado cristalino (a menudo denominado C-gate). Mientras que la estructura original de la topoisomerasa II muestra una situación en la que los WHD están separados por una gran distancia, la estructura de la girasa muestra una conformación cerrada, en la que los WHD se cierran.
El núcleo de la topoisomerasa II se resolvió posteriormente en nuevas conformaciones, incluida una de Fass et al. [14] y otra de Dong et al. [15] . La estructura de Fass muestra que el dominio Toprim es flexible y que esta flexibilidad puede permitir que el dominio Toprim se coordine con el WHD para formar un complejo de escisión competente. Esto fue finalmente corroborado por la estructura de Dong et al. que se resolvió en presencia de ADN. Esta última estructura mostró que el dominio Toprim y el WHD formaban un complejo de escisión muy similar al de las topoisomerasas de tipo IA e indicó cómo se podía desacoplar la unión y la escisión del ADN, y la estructura mostró que el ADN se doblaba ~150 grados a través de una isoleucina invariante (en la topoisomerasa II es I833 y en la girasa es I172). Este mecanismo de doblado se parece mucho al del factor de integración del huésped (IHF) y HU, dos proteínas arquitecturales en bacterias. Además, mientras que las estructuras anteriores del núcleo de unión del ADN tenían la puerta C cerrada, esta estructura capturó la puerta abierta, un paso clave en el mecanismo de dos puertas (ver a continuación).
Más recientemente, se han resuelto varias estructuras de la estructura unida al ADN en un intento de comprender tanto el mecanismo químico de la escisión del ADN como la base estructural de la inhibición de la topoisomerasa por venenos antibacterianos. La primera arquitectura completa de la ADN girasa de E. coli se ha resuelto mediante criomicroscopía electrónica con una resolución cercana a la atómica. [16] El complejo de nucleoproteína se capturó con un dúplex largo de ADN y gepotidacina , un nuevo inhibidor de la topoisomerasa bacteriana.
La región C-terminal de las topoisomerasas procariotas ha sido resuelta para múltiples especies. La primera estructura de un dominio C-terminal de girasa fue resuelta por Corbett et al. [17] y el dominio C-terminal de la topoisomerasa IV fue resuelto por Corbett et al. [7] Las estructuras formaron un nuevo barril beta, que dobla el ADN envolviendo el ácido nucleico alrededor de sí mismo. La curvatura del ADN por girasa ha sido propuesta como un mecanismo clave en la capacidad de la girasa para introducir superenrollamientos negativos en el ADN. Esto es consistente con los datos de huellas que muestran que la girasa tiene una huella de 140 pares de bases. Tanto los CTD de girasa como de topoisomerasa IV doblan el ADN, pero solo la girasa introduce superenrollamientos negativos.
A diferencia de la función del dominio C-terminal de las topoisomerasas procariotas, la función de la región C-terminal de la topoisomerasa II eucariota aún no está clara. Los estudios han sugerido que esta región está regulada por la fosforilación y que esto modula la actividad de la topoisomerasa, sin embargo, es necesario realizar más investigaciones para investigar esto.
Tipo IIB
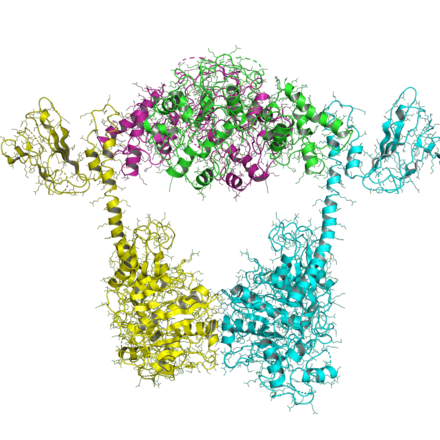
La organización de las topoisomerasas de tipo IIB es similar a la de las de tipo IIA, excepto que todas las de tipo IIB tienen dos genes y forman heterotetrámeros. Un gen, denominado topo VI-B (ya que se parece a gyrB), contiene el dominio ATPasa, un dominio transductor ( Pfam PF09239) y un dominio H2TH similar al pliegue de Ig C-terminal ( Pfam PF18000). El segundo gen, denominado topo VI-A ( Pfam PF04406), contiene el WHD y el dominio Toprim.
El dominio ATPasa de topo VI B se resolvió en múltiples estados de nucleótidos. [18] Se parece mucho al del dominio GHKL de topo II y MutL y muestra que el estado del nucleótido (ADP versus ATP) afecta la orientación del dominio transductor (y 1MX0).
La estructura del topo VI-A fue resuelta por Bergerat et al. [19] mostrando que el pliegue HTH y Toprim tenía una conformación novedosa en comparación con la del topo IIA.
Recientemente se ha resuelto una estructura del complejo topo VI A/B, que muestra una conformación abierta y cerrada, dos estados que se predicen en el mecanismo de dos compuertas (véase más abajo). Estas estructuras, de las cuales una es una estructura cristalina de rayos X y la otra es una reconstrucción de dispersión de rayos X de ángulo pequeño (SAXS), muestran que el dominio de la ATPasa puede ser abierto o cerrado. [20]
Mecanismo de acción
Pasaje de la hebra
La topoisomerasa tipo IIA opera a través de un mecanismo de "dos puertas" (aunque esta es una notación histórica), un mecanismo respaldado por la bioquímica [21] así como por el trabajo estructural. [22]
Una hebra de ADN, llamada puerta o segmento G, está unida por una puerta central de unión al ADN (puerta ADN). Una segunda hebra de ADN, llamada transporte o segmento T, es capturada por la dimerización del dominio ATPasa N-terminal (la puerta ATPasa) cuando se unen dos moléculas de ATP. La hidrólisis del ATP y la liberación de un fosfato inorgánico conducen a la escisión del segmento G, ya que las tirosinas catalíticas forman un enlace covalente de fosfotirosina con el extremo 5' del ADN. Esto crea un saliente de cuatro bases y una rotura de doble cadena en el segmento G. A medida que la puerta de unión al ADN se separa, el segmento T se transfiere a través del segmento G. El segmento G se sella, lo que lleva a que la puerta C-terminal (o puerta C) se abra, lo que permite la liberación del segmento T. La liberación del producto ADP provoca un reinicio del sistema y permite capturar un segundo segmento T.
Las topoisomerasas de tipo IIB funcionan de manera similar, excepto que la proteína forma un saliente de dos bases en el segmento G y la puerta C-terminal falta por completo.
Escisión del ADN
En el mecanismo de paso de cadena, la escisión del ADN es clave para permitir que el segmento T pase a través del segmento G. El mecanismo de escisión del ADN por las topoisomerasas de tipo IIA ha sido recientemente el foco de muchos estudios de biología estructural y bioquímica.
Cadena
La concatenación es el proceso por el cual dos cadenas circulares de ADN se unen entre sí como eslabones de una cadena. Esto ocurre después de la replicación del ADN, donde dos cadenas simples se concatenan y aún pueden replicarse pero no pueden separarse en las dos células hijas. Como las topoisomerasas de tipo II rompen una doble cadena, pueden fijar este estado (las topoisomerasas de tipo I podrían hacer esto solo si ya hubiera una muesca en la cadena simple), y el número correcto de cromosomas puede permanecer en las células hijas. El ADN lineal en eucariotas es tan largo que puede considerarse sin extremos; las topoisomerasas de tipo II son necesarias por la misma razón.
Inhibición
Las moléculas pequeñas que atacan a la topoisomerasa tipo II se dividen en dos clases: inhibidores y venenos. Debido a su frecuente presencia en células eucariotas en proliferación, los inhibidores de la topoisomerasa tipo II han sido ampliamente estudiados y utilizados como medicamentos contra el cáncer. [23]
- Los inhibidores de la topoisomerasa tipo II incluyen HU-331 , ICRF-187, ICRF-193 y mitindomida. Estas moléculas actúan inhibiendo la actividad de la ATPasa al actuar como inhibidores no competitivos del ATP. Esto se ha demostrado mediante estudios estructurales [9] y estudios bioquímicos realizados por el grupo de Lindsley.
- Los venenos de las topoisomerasas de tipo II incluyen doxorrubicina , etopósido , novobiocina , quinolonas (incluida la ciprofloxacina ) y tenipósido . Estas pequeñas moléculas actúan sobre el complejo ADN-proteína. Algunas de estas moléculas aumentan la escisión, mientras que otras, como el etopósido, inhiben la religación.
El fármaco antitumoral experimental m-AMSA (4'-(9'-acridinilamino)metanosulfon-m-anisidide) también inhibe la topoisomerasa tipo 2. [24]
Los venenos de topoisomerasa se han utilizado ampliamente como terapias anticáncer y antibacterianas. Si bien los compuestos antibacterianos como la ciprofloxacina actúan sobre la girasa bacteriana, no inhiben las topoisomerasas eucariotas de tipo IIA. Además, las bacterias resistentes a los fármacos suelen tener una mutación puntual en la girasa (Serine79Alanine en E. coli ) que hace que las quinolonas sean ineficaces. [ cita requerida ] Estudios estructurales recientes han llevado al descubrimiento de un compuesto que ya no depende de este residuo y, por lo tanto, tiene eficacia contra las bacterias resistentes a los fármacos. [ cita requerida ]
Girasa del bacteriófago T4
La girasa T4 del bacteriófago (fago) (topoismerasa tipo II) es una proteína multisubunidad que consiste en los productos de los genes 39, 52 y probablemente 60. [25] [26] Cataliza la relajación del ADN superhelicoidal negativo o positivo y se emplea en la replicación del ADN del fago durante la infección del huésped bacteriano E. coli . [27] La proteína del gen 52 del fago comparte homología con la subunidad gyrA de la girasa de E. coli [28] y la proteína del gen 39 del fago comparte homología con la subunidad gyr B. [29] Dado que la girasa del ADN del huésped E. coli puede compensar parcialmente la pérdida de los productos del gen T4 del fago, los mutantes defectuosos en los genes 39, 52 o 60 no eliminan por completo la replicación del ADN del fago, sino que retrasan su inicio. [27] La tasa de elongación del ADN no es más lenta que la del tipo salvaje en tales infecciones mutantes. [30] Los mutantes defectuosos en los genes 39, 52 o 60 muestran una recombinación genética aumentada , así como una mutación por sustitución de bases y deleción aumentada , lo que sugiere que la síntesis de ADN compensada por el huésped es menos precisa que la dirigida por el fago de tipo salvaje. [31] Un mutante defectuoso en el gen 39 muestra una mayor sensibilidad a la inactivación por irradiación ultravioleta durante la etapa de infección del fago después del inicio de la replicación del ADN cuando están presentes múltiples copias del cromosoma del fago . [32] Los mutantes defectuosos en los genes 39, 52 y 60 tienen una capacidad reducida para llevar a cabo la reactivación por multiplicidad, una forma de reparación recombinatoria que puede tratar diferentes tipos de daño del ADN. [33] La girasa especificada por el genoma de E. coli no infectada también parece participar en la reparación recombinatoria al proporcionar un punto de inicio para el intercambio de cadena recíproca impulsado por la proteína RecA. [34]
Referencias
- ^ Deweese JE, Osheroff N (febrero de 2009). "La reacción de escisión del ADN de la topoisomerasa II: un lobo con piel de oveja". Nucleic Acids Research . 37 (3): 738–748. doi :10.1093/nar/gkn937. PMC 2647315 . PMID 19042970.
- ^ Reece RJ, Maxwell A (1991). "ADN girasa: estructura y función". Critical Reviews in Biochemistry and Molecular Biology . 26 (3–4): 335–375. doi :10.3109/10409239109114072. PMID 1657531.
- ^ ab Rybenkov VV, Ullsperger C, Vologodskii AV, Cozzarelli NR (agosto de 1997). "Simplificación de la topología del ADN por debajo de los valores de equilibrio mediante topoisomerasas de tipo II". Science . 277 (5326). Nueva York, NY: 690–3. doi :10.1126/science.277.5326.690. PMID 9235892.
- ^ Vologodskii AV, Zhang W, Rybenkov VV, Podtelezhnikov AA, Subramanian D, Griffith JD, Cozzarelli NR (marzo de 2001). "Mecanismo de simplificación topológica por topoisomerasas de ADN de tipo II". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 98 (6): 3045–9. Bibcode :2001PNAS...98.3045V. doi : 10.1073/pnas.061029098 . PMC 30604 . PMID 11248029.
- ^ Reece RJ, Maxwell A (enero de 1991). "ADN girasa: estructura y función". Critical Reviews in Biochemistry and Molecular Biology . 26 (3–4): 335–75. doi :10.3109/10409239109114072. PMID 1657531.
- ^ Buhler C, Lebbink JH, Bocs C, Ladenstein R, Forterre P (octubre de 2001). "La topoisomerasa VI del ADN genera roturas de doble cadena dependientes de ATP con salientes de dos nucleótidos". The Journal of Biological Chemistry . 276 (40): 37215–22. doi : 10.1074/jbc.M101823200 . PMID 11485995. S2CID 24354635.
- ^ ab PDB : 1zvt ; Corbett KD, Schoeffler AJ, Thomsen ND, Berger JM (agosto de 2005). "La base estructural de la especificidad del sustrato en la ADN topoisomerasa IV". Journal of Molecular Biology . 351 (3): 545–61. doi :10.1016/j.jmb.2005.06.029. PMID 16023670.
- ^ Wigley DB, Davies GJ, Dodson EJ, Maxwell A, Dodson G (junio de 1991). "Estructura cristalina de un fragmento N-terminal de la proteína ADN girasa B". Nature . 351 (6328): 624–9. Bibcode :1991Natur.351..624W. doi :10.1038/351624a0. PMID 1646964. S2CID 4373125.
- ^ ab PDB : 1PVG ; Classen S, Olland S, Berger JM (septiembre de 2003). "Estructura de la región ATPasa de la topoisomerasa II y su mecanismo de inhibición por el agente quimioterapéutico ICRF-187". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 100 (19): 10629–34. Bibcode :2003PNAS..10010629C. doi : 10.1073/pnas.1832879100 . PMC 196855 . PMID 12963818.
- ^ Wei H, Ruthenburg AJ, Bechis SK, Verdine GL (noviembre de 2005). "Movimiento del dominio dependiente de nucleótidos en el dominio ATPasa de una topoisomerasa de ADN tipo IIA humana" (PDF) . The Journal of Biological Chemistry . 280 (44): 37041–7. doi : 10.1074/jbc.M506520200 . PMID 16100112. S2CID 35186716.
- ^ Aravind L, Leipe DD, Koonin EV (septiembre de 1998). "Toprim: un dominio catalítico conservado en topoisomerasas de tipo IA y II, primasas de tipo DnaG, nucleasas de la familia OLD y proteínas RecR". Nucleic Acids Research . 26 (18): 4205–13. doi :10.1093/nar/26.18.4205. PMC 147817 . PMID 9722641.
- ^ PDB : 1BGW ; Berger JM, Gamblin SJ, Harrison SC, Wang JC (enero de 1996). "Estructura y mecanismo de la ADN topoisomerasa II". Nature . 379 (6562): 225–32. Bibcode :1996Natur.379..225B. doi :10.1038/379225a0. PMID 8538787. S2CID 4360011.
- ^ PDB : 1AB4 ; Morais Cabral JH, Jackson AP, Smith CV, Shikotra N, Maxwell A, Liddington RC (agosto de 1997). "Estructura cristalina del dominio de ruptura-reunión de la ADN girasa". Nature . 388 (6645): 903–6. Bibcode :1997Natur.388..903M. doi : 10.1038/42294 . PMID 9278055. S2CID 4320715.
- ^ PDB : 1BJT ; Fass D, Bogden CE, Berger JM (abril de 1999). "Los cambios cuaternarios en la topoisomerasa II pueden dirigir el movimiento ortogonal de dos cadenas de ADN". Nature Structural Biology . 6 (4): 322–6. doi :10.1038/7556. PMID 10201398. S2CID 947461.
- ^ PDB : 2RGR ; Dong KC, Berger JM (diciembre de 2007). "Base estructural para el reconocimiento y la flexión del ADN de puerta por las topoisomerasas de tipo IIA". Nature . 450 (7173): 1201–5. Bibcode :2007Natur.450.1201D. doi :10.1038/nature06396. PMID 18097402. S2CID 1756317.
- ^ Vanden Broeck A, Lotz C, Ortiz J, Lamour V (octubre de 2019). "Estructura crio-EM del complejo nucleoproteico completo de la ADN girasa de E. coli". Nature Communications . 10 (1): 4935. Bibcode :2019NatCo..10.4935V. doi :10.1038/s41467-019-12914-y. PMC 6821735 . PMID 31666516.
- ^ PDB : 1SUU ; Corbett KD, Shultzaberger RK, Berger JM (mayo de 2004). "El dominio C-terminal de la ADN girasa A adopta un pliegue en rueda dentada beta que dobla el ADN". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 101 (19): 7293–8. Bibcode :2004PNAS..101.7293C. doi : 10.1073/pnas.0401595101 . PMC 409912 . PMID 15123801.
- ^ PDB : 1MU5 ; Corbett KD, Berger JM (enero de 2003). "Estructura de la subunidad VI-B de la topoisomerasa: implicaciones para el mecanismo y la evolución de la topoisomerasa tipo II". The EMBO Journal . 22 (1): 151–63. doi :10.1093/emboj/cdg008. PMC 140052 . PMID 12505993.
- ^ Bergerat A, de Massy B, Gadelle D, Varoutas PC, Nicolas A, Forterre P (marzo de 1997). "Una topoisomerasa II atípica de Archaea con implicaciones para la recombinación meiótica". Nature . 386 (6623): 414–7. Bibcode :1997Natur.386..414B. doi :10.1038/386414a0. PMID 9121560. S2CID 4327493.
- ^ PDB : 2Q2E ; Corbett KD, Benedetti P, Berger JM (julio de 2007). "Ensamblaje de holoenzimas y dinámica conformacional mediada por ATP de la topoisomerasa VI". Nature Structural & Molecular Biology . 14 (7): 611–9. doi :10.1038/nsmb1264. PMID 17603498. S2CID 2159631.
- ^ Roca J, Wang JC (mayo de 1994). "Transporte de ADN por una topoisomerasa de ADN tipo II: evidencia a favor de un mecanismo de dos puertas". Cell . 77 (4): 609–16. doi :10.1016/0092-8674(94)90222-4. PMID 8187179. S2CID 19776252.
- ^ Berger JM, Wang JC (febrero de 1996). "Desarrollos recientes en la estructura y el mecanismo de la ADN topoisomerasa II". Current Opinion in Structural Biology . 6 (1): 84–90. doi :10.1016/s0959-440x(96)80099-6. PMID 8696977.
- ^ Alberts B (18 de noviembre de 2014). Biología molecular de la célula (sexta edición). Nueva York, NY. ISBN 978-0-8153-4432-2.OCLC 887605755 .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ Willmore E, de Caux S, Sunter NJ, Tilby MJ, Jackson GH, Austin CA, Durkacz BW (junio de 2004). "Un nuevo inhibidor de la proteína quinasa dependiente del ADN, NU7026, potencia la citotoxicidad de los venenos de la topoisomerasa II utilizados en el tratamiento de la leucemia". Blood . 103 (12): 4659–65. doi : 10.1182/blood-2003-07-2527 . PMID 15010369.
- ^ Liu LF , Liu CC, Alberts BM (octubre de 1979). "Topoisomerasa de ADN T4: una nueva enzima dependiente de ATP esencial para la iniciación de la replicación del ADN del bacteriófago T4". Nature . 281 (5731): 456–61. Bibcode :1979Natur.281..456L. doi :10.1038/281456a0. PMID 226889. S2CID 4343962.
- ^ Stetler GL, King GJ, Huang WM (agosto de 1979). "Las proteínas de retardo del ADN T4, necesarias para la replicación específica del ADN, forman un complejo que tiene actividad de topoisomerasa del ADN dependiente de ATP". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 76 (8): 3737–41. Bibcode :1979PNAS...76.3737S. doi : 10.1073/pnas.76.8.3737 . PMC 383908 . PMID 226976.
- ^ ab McCarthy D (enero de 1979). "Iniciación de la replicación del ADN del bacteriófago T4 dependiente de la girasa: interacciones de la girasa de Escherichia coli con novobiocina, cumermicina y productos génicos de retardo del ADN del fago". Journal of Molecular Biology . 127 (3): 265–83. doi :10.1016/0022-2836(79)90329-2. PMID 372540.
- ^ Huang WM (septiembre de 1986). "La subunidad de 52 proteínas de la ADN topoisomerasa T4 es homóloga a la proteína gyrA de la girasa". Nucleic Acids Research . 14 (18): 7379–90. PMC 311757 . PMID 3020513.
- ^ Huang WM (octubre de 1986). "Secuencia de nucleótidos de un gen de topoisomerasa de ADN tipo II. Gen 39 del bacteriófago T4". Nucleic Acids Research . 14 (19): 7751–65. doi :10.1093/nar/14.19.7751. PMC 311794 . PMID 3022233.
- ^ McCarthy D, Minner C, Bernstein H, Bernstein C (octubre de 1976). "Tasas de elongación del ADN y distribuciones de puntos de crecimiento del fago T4 de tipo salvaje y un mutante ámbar con retraso del ADN". Journal of Molecular Biology . 106 (4): 963–81. doi :10.1016/0022-2836(76)90346-6. PMID 789903.
- ^ Mufti S, Bernstein H (octubre de 1974). "Los mutantes retardadores del ADN del bacteriófago T4". Revista de Virología . 14 (4): 860–71. doi :10.1128/JVI.14.4.860-871.1974. PMC 355592 . PMID 4609406.
- ^ Hyman P (agosto de 1993). "La genética del efecto Luria-Latarjet en el bacteriófago T4: evidencia de la participación de múltiples vías de reparación del ADN". Investigación genética . 62 (1): 1–9. doi : 10.1017/s0016672300031499 . PMID 8405988.
- ^ Miskimins R, Schneider S, Johns V, Bernstein H (junio de 1982). "Participación de la topoisomerasa en la reactivación de la multiplicidad del fago T4". Genética . 101 (2): 157–77. doi :10.1093/genetics/101.2.157. PMC 1201854 . PMID 6293912.
- ^ Cassuto E (septiembre de 1984). "Formación de ADN heterodúplex cerrado covalentemente mediante la acción combinada de la girasa y la proteína RecA". The EMBO Journal . 3 (9): 2159–64. doi :10.1002/j.1460-2075.1984.tb02106.x. PMC 557658 . PMID 6092061.
Lectura adicional
Enlaces externos
- Topoisomerasas de ADN+,+Tipo+II en los Encabezamientos de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.


