Serpiente
| Serpina (inhibidor de la serina proteasa) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 Una serpina (blanca) con su 'bucle central reactivo' (azul) unido a una proteasa (gris). Una vez que la proteasa intenta catalizar, se inhibe irreversiblemente . ( PDB : 1K9O ) | |||||||||||
| Identificadores | |||||||||||
| Símbolo | Serpin, SERPIN (símbolo raíz de la familia) | ||||||||||
| Pfam | PF00079 | ||||||||||
| Interprofesional | IPR000215 | ||||||||||
| PROSITIO | PDOC00256 | ||||||||||
| SCOP2 | 1hle / ALCANCE / SUPFAM | ||||||||||
| Diligenciamiento de conflictos | cd00172 | ||||||||||
| |||||||||||
Las serpinas son una superfamilia de proteínas con estructuras similares que se identificaron por primera vez por su actividad de inhibición de proteasas y se encuentran en todos los reinos de la vida . [1] [2] El acrónimo serpina se acuñó originalmente porque las primeras serpinas que se identificaron actúan sobre las serina proteasas similares a la quimotripsina ( inhibidores de la serina proteasa ) . [3] [4] [5] Son notables por su mecanismo de acción inusual, en el que inhiben irreversiblemente su proteasa objetivo al sufrir un gran cambio conformacional para interrumpir el sitio activo del objetivo . [6] [7] Esto contrasta con el mecanismo competitivo más común para los inhibidores de proteasas que se unen y bloquean el acceso al sitio activo de la proteasa. [8] [9]
La inhibición de la proteasa por las serpinas controla una serie de procesos biológicos, incluyendo la coagulación y la inflamación , y en consecuencia estas proteínas son el objetivo de la investigación médica . [10] Su cambio conformacional único también las hace de interés para las comunidades de investigación de biología estructural y plegamiento de proteínas . [7] [8] El mecanismo de cambio conformacional confiere ciertas ventajas, pero también tiene desventajas: las serpinas son vulnerables a mutaciones que pueden resultar en serpinopatías como el plegamiento incorrecto de proteínas y la formación de polímeros inactivos de cadena larga . [11] [12] La polimerización de serpinas no solo reduce la cantidad de inhibidor activo, sino que también conduce a la acumulación de polímeros, causando muerte celular y falla orgánica . [10]
Aunque la mayoría de las serpinas controlan las cascadas proteolíticas , algunas proteínas con una estructura de serpina no son inhibidores de enzimas , sino que realizan diversas funciones como almacenamiento (como en la clara de huevo - ovoalbúmina ), transporte como en las proteínas transportadoras de hormonas ( globulina transportadora de tiroxina , globulina transportadora de cortisol ) y chaperona molecular ( HSP47 ). [9] El término serpina también se utiliza para describir a estos miembros, a pesar de su función no inhibidora, ya que están relacionados evolutivamente. [1]
Historia
La actividad inhibidora de la proteasa en el plasma sanguíneo se informó por primera vez a fines del siglo XIX, [13] pero no fue hasta la década de 1950 que se aislaron las serpinas antitrombina y alfa 1-antitripsina , [14] con el posterior reconocimiento de su cercana homología familiar en 1979. [15] [16] Que pertenecían a una nueva familia de proteínas se hizo evidente en su posterior alineamiento con la proteína no inhibidora de clara de huevo ovoalbúmina , para dar lo que inicialmente se llamó la superfamilia alfa1-antitripsina-antitrombina III-ovoalbúmina de inhibidores de serina proteinasa, [17] pero que posteriormente se renombró sucintamente como Serpinas. [18] La caracterización inicial de la nueva familia se centró en la alfa1-antitripsina , una serpina presente en alta concentración en el plasma sanguíneo, cuyo trastorno genético común se demostró que causa una predisposición a la enfermedad pulmonar enfisema [19] y a la cirrosis hepática . [20] La identificación de las mutaciones S y Z [21] [22] responsables de la deficiencia genética y las posteriores alineaciones de secuencias de alfa1-antitripsina y antitrombina en 1982 condujeron al reconocimiento de las homologías cercanas de los sitios activos de las dos proteínas, [23] [24] centradas en una metionina [25] en alfa1-antitripsina como inhibidor de la elastasa tisular y en la arginina en antitrombina [26] como inhibidor de la trombina. [27]
El papel crítico del residuo del centro activo en la determinación de la especificidad de la inhibición de las serpinas fue confirmado inequívocamente por el hallazgo de que una mutación natural de la metionina del centro activo en la alfa1-antitripsina a una arginina, como en la antitrombina, resultó en un trastorno hemorrágico grave. [28] Esta especificidad de inhibición del centro activo también fue evidente en muchas otras familias de inhibidores de proteasas [7] pero las serpinas se diferenciaban de ellas en que eran proteínas mucho más grandes y también en poseer lo que pronto fue evidente como una capacidad inherente de sufrir un cambio de forma. La naturaleza de este cambio conformacional se reveló con la determinación en 1984 de la primera estructura cristalina de una serpina, la de la alfa1-antitripsina post-escisión. [29] Esto, junto con la posterior resolución de la estructura de la ovoalbúmina nativa (sin escindir) [30], indicó que el mecanismo inhibidor de las serpinas implicaba un notable cambio conformacional, con el movimiento del bucle peptídico expuesto que contiene el sitio reactivo y su incorporación como una cadena intermedia en la lámina beta plegada principal que caracteriza a la molécula de serpina. [31] [32] La evidencia temprana del papel esencial de este movimiento de bucle en el mecanismo inhibidor provino del hallazgo de que incluso aberraciones menores en los residuos de aminoácidos que forman la bisagra del movimiento en la antitrombina resultaban en enfermedad trombótica. [31] [33] La confirmación definitiva del desplazamiento vinculado de la proteasa diana por este movimiento de bucle fue proporcionada en 2000 por la estructura del complejo postinhibitorio de alfa1-antitripsina con tripsina, [6] mostrando cómo el desplazamiento resulta en la deformación e inactivación de la proteasa unida. Estudios estructurales posteriores han revelado una ventaja adicional del mecanismo conformacional [34] al permitir la modulación sutil de la actividad inhibitoria, como se observa notablemente a nivel de tejido [35] con las serpinas funcionalmente diversas en el plasma humano.
Se han identificado más de 1000 serpinas, incluidas 36 proteínas humanas, así como moléculas en todos los reinos de la vida ( animales , plantas , hongos , bacterias y arqueas ) y algunos virus . [36] [37] [38] La característica central de todas es un marco estrechamente conservado, que permite la alineación precisa de sus componentes estructurales y funcionales clave basados en la estructura de plantilla de la alfa1-antitripsina. [39] En la década de 2000, se introdujo una nomenclatura sistemática para categorizar a los miembros de la superfamilia de serpinas en función de sus relaciones evolutivas. [1] Por lo tanto, las serpinas son la superfamilia más grande y diversa de inhibidores de proteasa. [40]
Actividad

La mayoría de las serpinas son inhibidores de proteasas que se dirigen a las serina proteasas extracelulares similares a la quimotripsina . Estas proteasas poseen un residuo de serina nucleofílico en una tríada catalítica en su sitio activo . Algunos ejemplos son la trombina , la tripsina y la elastasa de neutrófilos humanos . [41] Las serpinas actúan como inhibidores irreversibles y suicidas al atrapar un intermediario del mecanismo catalítico de la proteasa. [6]
Algunas serpinas inhiben otras clases de proteasas, típicamente las cisteína proteasas , y se denominan "inhibidores de clase cruzada". Estas enzimas difieren de las serina proteasas en que utilizan un residuo de cisteína nucleofílico , en lugar de una serina , en su sitio activo. [42] No obstante, la química enzimática es similar y el mecanismo de inhibición por serpinas es el mismo para ambas clases de proteasas. [43] Los ejemplos de serpinas inhibidoras de clase cruzada incluyen serpina B4, un antígeno de carcinoma de células escamosas 1 (SCCA-1) y la proteína específica de la etapa de terminación nuclear mieloide y eritroide (MENT) de la serpina aviar, que inhiben a las cisteína proteasas similares a la papaína . [44] [45] [46]
Función biológica y localización
Inhibición de la proteasa
Aproximadamente dos tercios de las serpinas humanas desempeñan funciones extracelulares, inhibiendo las proteasas en el torrente sanguíneo para modular sus actividades. Por ejemplo, las serpinas extracelulares regulan las cascadas proteolíticas centrales para la coagulación sanguínea (antitrombina), las respuestas inflamatorias e inmunitarias (antitripsina, antiquimotripsina e inhibidor de C1 ) y la remodelación tisular (PAI-1) . [9] Al inhibir las proteasas de la cascada de señalización , también pueden afectar el desarrollo . [47] [48] La tabla de serpinas humanas (a continuación) proporciona ejemplos de la gama de funciones realizadas por la serpina humana, así como algunas de las enfermedades que resultan de la deficiencia de serpina.
Las dianas proteasas de las serpinas inhibidoras intracelulares han sido difíciles de identificar, ya que muchas de estas moléculas parecen desempeñar funciones superpuestas. Además, muchas serpinas humanas carecen de equivalentes funcionales precisos en organismos modelo como el ratón. Sin embargo, una función importante de las serpinas intracelulares puede ser la protección contra la actividad inapropiada de las proteasas dentro de la célula. [49] Por ejemplo, una de las serpinas intracelulares humanas mejor caracterizadas es la Serpin B9 , que inhibe la proteasa granular citotóxica granzima B. Al hacerlo, la Serpin B9 puede proteger contra la liberación inadvertida de granzima B y la activación prematura o no deseada de las vías de muerte celular . [50]
Algunos virus utilizan serpinas para interrumpir las funciones de las proteasas en su hospedador. La serpina viral CrmA (modificador de la respuesta a las citocinas A) de la viruela bovina se utiliza para evitar las respuestas inflamatorias y apoptóticas de las células hospedadoras infectadas. CrmA aumenta la infectividad al suprimir la respuesta inflamatoria de su hospedador a través de la inhibición del procesamiento de IL-1 e IL-18 por la cisteína proteasa caspasa -1. [51] En eucariotas , una serpina vegetal inhibe tanto las metacaspasas [52] como una cisteína proteasa similar a la papaína. [53]
Roles no inhibitorios
Las serpinas extracelulares no inhibidoras también desempeñan una amplia gama de funciones importantes. La globulina transportadora de tiroxina y la transcortina transportan las hormonas tiroxina y cortisol , respectivamente. [54] [55] La serpina no inhibidora ovoalbúmina es la proteína más abundante en la clara de huevo . Su función exacta es desconocida, pero se cree que es una proteína de almacenamiento para el feto en desarrollo . [56] La serpina de choque térmico 47 es una chaperona , esencial para el plegamiento adecuado del colágeno . Actúa estabilizando la triple hélice del colágeno mientras se procesa en el retículo endoplasmático . [57]
Algunas serpinas son inhibidores de proteasas y desempeñan funciones adicionales. Por ejemplo, el inhibidor de la proteasa de cisteína nuclear MENT , en las aves, también actúa como una molécula remodeladora de la cromatina en los glóbulos rojos de las aves . [45] [58]
Estructura
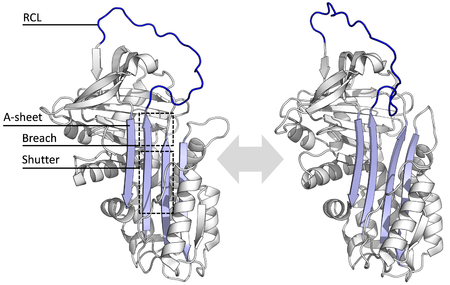
Todas las serpinas comparten una estructura (o pliegue) común, a pesar de sus variadas funciones. Todas tienen típicamente tres láminas β (llamadas A, B y C) y ocho o nueve hélices α (llamadas hA–hI). [29] [30] Las regiones más significativas para la función de las serpinas son la lámina A y el bucle central reactivo (RCL). La lámina A incluye dos cadenas β que están en una orientación paralela con una región entre ellas llamada "obturador" y una región superior llamada "brecha". El RCL forma la interacción inicial con la proteasa objetivo en moléculas inhibidoras. Se han resuelto estructuras que muestran que el RCL está completamente expuesto o parcialmente insertado en la lámina A, y se cree que las serpinas están en equilibrio dinámico entre estos dos estados. [8] El RCL también solo realiza interacciones temporales con el resto de la estructura y, por lo tanto, es muy flexible y está expuesto al solvente. [8]
Las estructuras de las serpinas que se han determinado abarcan varias conformaciones diferentes, lo que ha sido necesario para comprender su mecanismo de acción de múltiples pasos. Por lo tanto, la biología estructural ha desempeñado un papel central en la comprensión de la función y la biología de las serpinas. [8]
Cambio conformacional y mecanismo inhibitorio
Las serpinas inhibidoras no inhiben sus proteasas objetivo mediante el mecanismo competitivo típico ( llave y cerradura ) utilizado por la mayoría de los inhibidores de proteasas pequeñas (por ejemplo, inhibidores de tipo Kunitz ). En cambio, las serpinas utilizan un cambio conformacional inusual , que altera la estructura de la proteasa y le impide completar la catálisis. El cambio conformacional implica que el RCL se mueve al extremo opuesto de la proteína y se inserta en la hoja β A, formando una cadena β antiparalela adicional . Esto convierte la serpina de un estado estresado a un estado relajado de menor energía (transición de S a R). [7] [8] [61]
Las proteasas de serina y cisteína catalizan la escisión del enlace peptídico mediante un proceso de dos pasos. Inicialmente, el residuo catalítico de la tríada del sitio activo realiza un ataque nucleofílico sobre el enlace peptídico del sustrato. Esto libera el nuevo extremo N y forma un enlace éster covalente entre la enzima y el sustrato. [7] Este complejo covalente entre la enzima y el sustrato se denomina intermediario acil-enzima . Para los sustratos estándar , el enlace éster se hidroliza y el nuevo extremo C se libera para completar la catálisis. Sin embargo, cuando una serpina es escindida por una proteasa, experimenta rápidamente la transición de S a R antes de que se hidrolice el intermediario acil-enzima. [7] La eficiencia de la inhibición depende del hecho de que la tasa cinética relativa del cambio conformacional es varios órdenes de magnitud más rápida que la hidrólisis por la proteasa.
Como el RCL todavía está unido covalentemente a la proteasa a través del enlace éster, la transición de S a R empuja a la proteasa desde la parte superior a la parte inferior de la serpina y distorsiona la tríada catalítica. La proteasa distorsionada solo puede hidrolizar el intermediario enzimático acilo de manera extremadamente lenta, por lo que la proteasa permanece unida covalentemente durante días o semanas. [6] Las serpinas se clasifican como inhibidores irreversibles e inhibidores suicidas , ya que cada proteína serpina inactiva permanentemente una sola proteasa y solo puede funcionar una vez. [7]
Activación alostérica

La movilidad conformacional de las serpinas proporciona una ventaja clave sobre los inhibidores estáticos de proteasas de cerradura y llave. [34] En particular, la función de las serpinas inhibidoras puede regularse mediante interacciones alostéricas con cofactores específicos . Las estructuras cristalinas de rayos X de la antitrombina , el cofactor II de heparina , MENT y la antiquimotripsina murina revelan que estas serpinas adoptan una conformación en la que los dos primeros aminoácidos del RCL se insertan en la parte superior de la lámina A β . La conformación parcialmente insertada es importante porque los cofactores pueden cambiar conformacionalmente ciertas serpinas parcialmente insertadas a una forma completamente expulsada. [62] [63] Este reordenamiento conformacional hace que la serpina sea un inhibidor más eficaz.
El ejemplo arquetípico de esta situación es la antitrombina, que circula en el plasma en un estado relativamente inactivo parcialmente insertado. El residuo determinante de especificidad primario (la arginina P1) apunta hacia el cuerpo de la serpina y no está disponible para la proteasa. Al unirse a una secuencia de pentasacárido de alta afinidad dentro de la heparina de cadena larga , la antitrombina sufre un cambio conformacional, expulsión de RCL y exposición de la arginina P1. La forma de antitrombina unida al pentasacárido de heparina es, por lo tanto, un inhibidor más eficaz de la trombina y el factor Xa . [64] [65] Además, ambas proteasas de coagulación también contienen sitios de unión (llamados exositios ) para la heparina. Por lo tanto, la heparina también actúa como una plantilla para la unión tanto de la proteasa como de la serpina, acelerando aún más drásticamente la interacción entre las dos partes. Después de la interacción inicial, se forma el complejo de serpina final y se libera la fracción de heparina. Esta interacción es fisiológicamente importante. Por ejemplo, después de una lesión en la pared de un vaso sanguíneo, la heparina queda expuesta y la antitrombina se activa para controlar la respuesta de coagulación. La comprensión de la base molecular de esta interacción permitió el desarrollo de Fondaparinux , una forma sintética del pentasacárido de heparina que se utiliza como fármaco anticoagulante . [66] [67]
Conformación latente

Algunas serpinas experimentan espontáneamente la transición de S a R sin haber sido escindidas por una proteasa, para formar una conformación denominada estado latente. Las serpinas latentes no pueden interactuar con las proteasas y, por lo tanto, ya no son inhibidores de proteasas. El cambio conformacional a latencia no es exactamente el mismo que la transición de S a R de una serpina escindida. Dado que el RCL todavía está intacto, la primera hebra de la lámina C tiene que desprenderse para permitir la inserción completa del RCL. [68]
La regulación de la transición de latencia puede actuar como un mecanismo de control en algunas serpinas, como PAI-1 . Aunque PAI-1 se produce en la conformación inhibidora S, se "autoinactiva" cambiando al estado latente a menos que esté unido al cofactor vitronectina . [68] De manera similar, la antitrombina también puede convertirse espontáneamente al estado latente, como un mecanismo de modulación adicional a su activación alostérica por la heparina. [69] Finalmente, el extremo N-terminal de tengpin, una serpina de Thermoanaerobacter tengcongensis , es necesario para bloquear la molécula en el estado inhibidor nativo. La interrupción de las interacciones realizadas por la región N-terminal da como resultado un cambio conformacional espontáneo de esta serpina a la conformación latente. [70] [71]
Cambio conformacional en funciones no inhibitorias
Algunas serpinas no inhibidoras también utilizan el cambio conformacional de la serpina como parte de su función. Por ejemplo, la forma nativa (S) de la globulina transportadora de tiroxina tiene una alta afinidad por la tiroxina, mientras que la forma escindida (R) tiene una baja afinidad. De manera similar, la transcortina tiene una mayor afinidad por el cortisol cuando está en su estado nativo (S) que en su estado escindido (R). Por lo tanto, en estas serpinas, la escisión de RCL y la transición de S a R se han aprovechado para permitir la liberación del ligando, en lugar de la inhibición de la proteasa. [54] [55] [72]
En algunas serpinas, la transición de S a R puede activar eventos de señalización celular . En estos casos, una serpina que ha formado un complejo con su proteasa diana es reconocida por un receptor. El evento de unión conduce entonces a la señalización descendente por parte del receptor. [73] Por lo tanto, la transición de S a R se utiliza para alertar a las células sobre la presencia de actividad de proteasa. [73] Esto difiere del mecanismo habitual por el cual las serpinas afectan la señalización simplemente inhibiendo las proteasas involucradas en una cascada de señalización. [47] [48]
Degradación
Cuando una serpina inhibe una proteasa diana, forma un complejo permanente, que debe eliminarse. En el caso de las serpinas extracelulares, los complejos serpina-enzima finales se eliminan rápidamente de la circulación. Un mecanismo por el que esto ocurre en los mamíferos es a través de la proteína relacionada con el receptor de lipoproteína de baja densidad ( LRP ), que se une a los complejos inhibidores elaborados por la antitrombina, PA1-1 y la neuroserpina, lo que provoca la captación celular . [73] [74] De manera similar, la serpina necrótica de Drosophila se degrada en el lisosoma después de ser transportada a la célula por el receptor de lipoforina-1 (homólogo de la familia de receptores de LDL de los mamíferos ). [75]
Enfermedades y serpinopatías
Las serpinas están implicadas en una amplia gama de funciones fisiológicas, por lo que las mutaciones en los genes que las codifican pueden causar una variedad de enfermedades. Las mutaciones que cambian la actividad, la especificidad o las propiedades de agregación de las serpinas afectan su funcionamiento. La mayoría de las enfermedades relacionadas con las serpinas son el resultado de la polimerización de las serpinas en agregados, aunque también se producen otros tipos de mutaciones vinculadas a enfermedades. [8] [76] El trastorno de la deficiencia de alfa-1 antitripsina es una de las enfermedades hereditarias más comunes . [11] [77]
Inactividad o ausencia
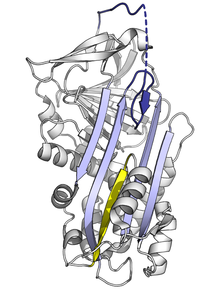
Dado que el pliegue de serpina estresado es de alta energía, las mutaciones pueden hacer que cambien incorrectamente a sus conformaciones de menor energía (por ejemplo, relajada o latente) antes de que hayan desempeñado correctamente su función inhibidora. [10]
Las mutaciones que afectan la velocidad o la extensión de la inserción de RCL en la lámina A pueden hacer que la serpina experimente su cambio conformacional de S a R antes de haber activado una proteasa. Dado que una serpina solo puede realizar este cambio conformacional una vez, la serpina resultante que no se activa queda inactiva y no puede controlar adecuadamente su proteasa objetivo. [10] [78] De manera similar, las mutaciones que promueven una transición inapropiada al estado latente monomérico causan enfermedad al reducir la cantidad de serpina inhibidora activa. Por ejemplo, las variantes de antitrombina vinculadas a la enfermedad wibble y wobble [79] , ambas promueven la formación del estado latente .
La estructura del mutante de antiquimotripsina (L55P) asociado a la enfermedad reveló otra "conformación δ" inactiva. En la conformación δ, cuatro residuos del RCL se insertan en la parte superior de la lámina β A. La mitad inferior de la lámina se llena como resultado de que una de las hélices α (la hélice F) cambia parcialmente a una conformación de cadena β, completando el enlace de hidrógeno de la lámina β. [80] No está claro si otras serpinas pueden adoptar este confórmero y si esta conformación tiene un papel funcional, pero se especula que la conformación δ puede ser adoptada por la globulina transportadora de tiroxina durante la liberación de tiroxina. [55] Las proteínas no inhibidoras relacionadas con las serpinas también pueden causar enfermedades cuando mutan. Por ejemplo, las mutaciones en SERPINF1 causan osteogénesis imperfecta tipo VI en humanos. [81]
En ausencia de una serpina requerida, la proteasa que normalmente regularía es hiperactiva, lo que conduce a patologías. [10] En consecuencia, la simple deficiencia de una serpina (por ejemplo, una mutación nula ) puede provocar una enfermedad. [82] Los knockouts de genes , particularmente en ratones , se utilizan experimentalmente para determinar las funciones normales de las serpinas por el efecto de su ausencia. [83]
Cambio de especificidad
En algunos casos poco frecuentes, un cambio de un solo aminoácido en el RCL de una serpina altera su especificidad para dirigirse a la proteasa equivocada. Por ejemplo, la mutación de antitripsina-Pittsburgh (M358R) hace que la serpina α1-antitripsina inhiba la trombina, lo que provoca un trastorno hemorrágico . [28]
Polimerización y agregación
La mayoría de las enfermedades causadas por serpinas se deben a la agregación de proteínas y se denominan "serpinopatías". [12] [80] Las serpinas son vulnerables a mutaciones causantes de enfermedades que promueven la formación de polímeros mal plegados debido a sus estructuras inherentemente inestables. [80] Las serpinopatías bien caracterizadas incluyen la deficiencia de α1-antitripsina (alfa-1), que puede causar enfisema familiar y, a veces , cirrosis hepática , ciertas formas familiares de trombosis relacionadas con la deficiencia de antitrombina , angioedema hereditario (AEH) de tipo 1 y 2 relacionado con la deficiencia del inhibidor de C1 y encefalopatía familiar con cuerpos de inclusión de neuroserpina (FENIB; un tipo raro de demencia causada por la polimerización de neuroserpina). [11] [12] [84]
Cada monómero del agregado de serpina existe en la conformación inactiva, relajada (con el RCL insertado en la lámina A). Por lo tanto, los polímeros son hiperestables a la temperatura e incapaces de inhibir las proteasas. Por lo tanto, las serpinopatías causan patologías de manera similar a otras proteopatías (por ejemplo, enfermedades priónicas ) a través de dos mecanismos principales. [11] [12] En primer lugar, la falta de serpina activa da como resultado una actividad descontrolada de la proteasa y la destrucción del tejido. En segundo lugar, los propios polímeros hiperestables obstruyen el retículo endoplásmico de las células que sintetizan serpinas, lo que finalmente resulta en muerte celular y daño tisular. En el caso de la deficiencia de antitripsina, los polímeros de antitripsina causan la muerte de las células hepáticas , lo que a veces resulta en daño hepático y cirrosis . Dentro de la célula, los polímeros de serpina se eliminan lentamente a través de la degradación en el retículo endoplásmico. [85] Sin embargo, los detalles de cómo los polímeros de serpina causan la muerte celular aún deben entenderse completamente. [11]
Se cree que los polímeros fisiológicos de serpinas se forman a través de eventos de intercambio de dominios , donde un segmento de una proteína serpina se inserta en otra. [86] Los intercambios de dominios ocurren cuando las mutaciones o los factores ambientales interfieren con las etapas finales del plegamiento de la serpina al estado nativo, lo que hace que los intermediarios de alta energía se plieguen incorrectamente. [87] Se han resuelto las estructuras de intercambio de dominios tanto de dímeros como de trímeros . En el dímero (de antitrombina), el RCL y parte de la lámina A se incorporan a la lámina A de otra molécula de serpina. [86] El trímero con dominio intercambiado (de antitripsina) se forma a través del intercambio de una región completamente diferente de la estructura, la lámina B (con el RCL de cada molécula insertado en su propia lámina A). [88] También se ha propuesto que las serpinas pueden formar intercambios de dominios insertando el RCL de una proteína en la lámina A de otra (polimerización de lámina A). [84] [89] Se cree que estas estructuras de dímeros y trímeros con dominios intercambiados son los componentes básicos de los agregados de polímeros que causan enfermedades, pero el mecanismo exacto aún no está claro. [86] [87] [88] [90]
Estrategias terapéuticas
Existen varios enfoques terapéuticos en uso o bajo investigación para tratar la serpinopatía más común: la deficiencia de antitripsina. [11] La terapia de aumento de antitripsina está aprobada para el enfisema grave relacionado con la deficiencia de antitripsina. [91] En esta terapia, la antitripsina se purifica del plasma de donantes de sangre y se administra por vía intravenosa (comercializada por primera vez como Prolastin ). [11] [92] Para tratar la enfermedad grave relacionada con la deficiencia de antitripsina, el trasplante de pulmón y hígado ha demostrado ser eficaz. [11] [93] En modelos animales, la orientación genética en células madre pluripotentes inducidas se ha utilizado con éxito para corregir un defecto de polimerización de antitripsina y restaurar la capacidad del hígado de los mamíferos para secretar antitripsina activa. [94] También se han desarrollado pequeñas moléculas que bloquean la polimerización de antitripsina in vitro . [95] [96]
Evolución
Las serpinas son la superfamilia más grande y más ampliamente distribuida de inhibidores de proteasa. [1] [40] Inicialmente se creyó que estaban restringidas a los organismos eucariotas , pero desde entonces se han encontrado en bacterias , arqueas y algunos virus . [36] [37] [97] Sigue sin estar claro si los genes procariotas son descendientes de una serpina procariota ancestral o el producto de la transferencia horizontal de genes desde eucariotas. La mayoría de las serpinas intracelulares pertenecen a un solo clado filogenético , ya sea que provengan de plantas o animales, lo que indica que las serpinas intracelulares y extracelulares pueden haber divergido antes que las plantas y los animales. [98] Las excepciones incluyen la serpina de choque térmico intracelular HSP47, que es una chaperona esencial para el plegamiento adecuado del colágeno , y los ciclos entre el cis-Golgi y el retículo endoplásmico . [57]
Se cree que la inhibición de la proteasa es la función ancestral, y que los miembros no inhibidores son el resultado de la neofuncionalización evolutiva de la estructura. El cambio conformacional de S a R también ha sido adaptado por algunas serpinas de unión para regular la afinidad por sus objetivos. [55]
Distribución
Animal
Humano
El genoma humano codifica 16 clados de serpinas, denominados serpinA a serpinP, incluidas 29 proteínas serpinas inhibidoras y 7 no inhibidoras. [9] [83] El sistema de denominación de serpinas humanas se basa en un análisis filogenético de aproximadamente 500 serpinas de 2001, con proteínas denominadas serpinXY, donde X es el clado de la proteína e Y el número de la proteína dentro de ese clado. [1] [36] [83] Las funciones de las serpinas humanas se han determinado mediante una combinación de estudios bioquímicos , trastornos genéticos humanos y modelos de ratones knockout . [83]
| Nombre del gen | Nombre común | Localización | Función / Actividad [9] [83] | Efecto de la deficiencia [9] [83] | Enfermedad humana | Localización cromosómica | Estructura de la proteína |
|---|---|---|---|---|---|---|---|
| SERPINA1 | α1-antitripsina | Extracelular | Inhibidor de la elastasa de neutrófilos humanos. [99] El fragmento C-terminal de SERPINA1 escindido puede inhibir la infección por VIH-1. [100] | La deficiencia produce enfisema y la polimerización cirrosis (serpinopatía). [11] [101] | 14q32.1 | 1QLP , 7API , 1D5S | |
| SERPINA2 | Proteína relacionada con la antitripsina | Extracelular | Posible pseudogen. [102] | 14q32.1 | |||
| SERPINA3 | α1-antiquimotripsina | Extracelular | Inhibidor de la catepsina G. [103] Funciones adicionales en la condensación de la cromatina en las células hepáticas. [104] | La mala regulación da lugar a la enfermedad de Alzheimer (serpinopatía). [105] | 14q32.1 | 1YXA , 2ACH | |
| SERPINA4 | Calistatina | Extracelular | Inhibidor de la calicreína, regulador de la función vascular. [106] [107] | El agotamiento en ratas hipertensas exacerba el daño renal y cardiovascular. [108] | 14q32.1 | ||
| SERPINA5 | Inhibidor de la proteína C | Extracelular | Inhibidor de la proteína C activa . [109] Papel intracelular en la prevención de la fagocitosis de bacterias. [110] | La eliminación del gen en ratones machos provoca infertilidad. [111] La acumulación ocurre en placas activas crónicas en la esclerosis múltiple . [112] | 14q32.1 | 2OL2 , 3B9F | |
| SERPINA6 | Transcortina | Extracelular | No inhibidor. Unión del cortisol. [54] | Deficiencia asociada a fatiga crónica. [113] | 14q32.1 | 2V6D , 2VDX , 2VDY | |
| SERPINA7 | Globulina transportadora de tiroxina | Extracelular | No inhibidor. Unión de tiroxina. [55] | La deficiencia causa hipotiroidismo. [114] [115] | Xq22.2 | 2CEO , 2RIV , 2RIW | |
| SERPINA8 | Angiotensinógeno | Extracelular | La escisión no inhibidora por la renina da como resultado la liberación de angiotensina I. [116] | La inactivación del gen en ratones provoca hipotensión. [117] | Variantes asociadas a la hipertensión. [118] [119] [120] | 1t42-t43 | 2X0B , 2WXW , 2WXX , 2WXY , 2WXZ , 2WY0 , 2WY1 |
| SERPINA9 | Centrina / GCET1 | Extracelular | Inhibición, mantenimiento de células B vírgenes. [121] [122] | Fuertemente expresado en la mayoría de los linfomas de células B. [123] [124] | 14q32.1 | ||
| SERPINA10 | Inhibidor de la proteasa relacionada con la proteína Z | Extracelular | Se une a la proteína Z e inactiva el factor Xa y el factor XIa . [125] | 14q32.1 | 3F1S , 3H5C | ||
| SERPINA11 | – | Probablemente extracelular | Desconocido | 14q32.13 | |||
| SERPINA12 | Vaspín | Extracelular | Inhibidor de la calicreína-7. Adipocitocina sensibilizante a la insulina. [126] | Niveles plasmáticos elevados asociados con diabetes tipo II. [127] | 14q32.1 | 4IF8 | |
| SERPINA13 | – | Probablemente extracelular | Desconocido | 14q32 | |||
| SERPINB1 | Inhibidor de la elastasa de neutrófilos monocíticos | Intracelular | Inhibidor de la elastasa de los neutrófilos. [128] | La eliminación del gen en ratones provoca un defecto de supervivencia de los neutrófilos y una deficiencia inmunitaria. [129] | 6p25 | 1HLE | |
| SERPINB2 | Inhibidor del activador del plasminógeno-2 | Intracelular/extracelular | Inhibidor de la uPA extracelular. Su función intracelular no está clara, pero puede proteger contra la infección viral. [130] | La deficiencia en ratones reduce la respuesta inmune a la infección por nematodos. [131] La eliminación del gen en ratones no causa ningún fenotipo obvio. [132] | 18q21.3 | 1 POR 7 | |
| SERPINB3 | Antígeno-1 del carcinoma de células escamosas (SCCA-1) | Intracelular | Inhibidor de las proteasas de cisteína similares a la papaína [44] y de las catepsinas K, L y S. [133] [134] | La eliminación en ratones de Serpinb3a (el homólogo murino de SERPINB3 y SERPINB4 humanos) ha reducido la producción de moco en un modelo murino de asma . [135] | 18q21.3 | 2ZV6 | |
| SERPINB4 | Antígeno-2 del carcinoma de células escamosas (SCCA-2) | Intracelular | Inhibidor de las serina proteasas similares a la quimotripsina, catepsina G y quimasa . [134] [136] | La eliminación en ratones de Serpinb3a (el homólogo murino de SERPINB3 y SERPINB4 humanos) ha reducido la producción de moco en un modelo murino de asma . [135] | 18q21.3 | ||
| SERPINB5 | Maspin | Intracelular | No inhibidor, función poco clara [137] [138] [139] ( ver también maspin ) | En un principio se informó que la inactivación del gen en ratones era letal, [140] pero posteriormente se demostró que no tenía un fenotipo obvio. [139] La expresión puede ser un indicador pronóstico que refleja la expresión de un gen supresor de tumores vecino (la fosfatasa PHLPP 1). [139] | 18q21.3 | 1WZ9 | |
| SERPINB6 | PI-6 | Intracelular | Inhibidor de la catepsina G. [141] | La eliminación del gen en ratones provoca pérdida de audición [142] y neutropenia leve . [143] | Deficiencia asociada a pérdida auditiva . [144] | 6p25 | |
| SERPINB7 | Megsin | Intracelular | Participa en la maduración de los megacariocitos. [145] | La sobreexpresión en ratones causa enfermedad renal. [146] La inactivación en ratones no causa anomalías histológicas. [146] | Mutaciones asociadas con la queratosis palmoplantar tipo Nagashima . [147] | 18q21.3 | |
| SERPINB8 | PI-8 | Intracelular | Posible inhibidor de la furina. [148] | 18q21.3 | |||
| SERPINB9 | PI-9 | Intracelular | Inhibidor de la granzima B de la proteasa granular citotóxica. [149] | La eliminación del gen en ratones provoca disfunción inmunológica. [150] [151] | 6p25 | ||
| SERPINB10 | Bomapina | Intracelular | Desconocido [152] | La eliminación del gen en ratones no provoca ningún fenotipo obvio (C57/BL6; cepa de laboratorio BC069938). | 18q21.3 | ||
| SERPINB11 | Intracelular | Desconocido [153] | La Serpinb11 murina es un inhibidor activo mientras que el ortólogo humano es inactivo. [153] La deficiencia en ponis está asociada con la enfermedad de separación de la pared del casco. [154] | 18q21.3 | |||
| SERPINB12 | Yukopin | Intracelular | Desconocido [155] | 18q21.3 | |||
| SERPINB13 | Hurpin / Alfiler de cabeza | Intracelular | Inhibidor de las cisteína proteasas similares a la papaína. [156] | 18q21.3 | |||
| SERPINC1 | Antitrombina | Extracelular | Inhibidor de la coagulación , específicamente del factor X , factor IX y trombina . [34] | Los knockouts en ratones son letales. [157] | La deficiencia produce trombosis y otros trastornos de la coagulación (serpinopatía). [158] [159] | 1t23-t21 | 2ANT , 2ZNH , 1AZX , 1TB6 , 2GD4 , 1T1F |
| SERPIND1 | Cofactor II de la heparina | Extracelular | Inhibidor de la trombina. [160] | Los knockouts en ratones son letales. [161] | 22t11 | 1JMJ , 1JMO | |
| SERPINA1 | Inhibidor del activador del plasminógeno 1 | Extracelular | Inhibidor de la trombina, uPA y TPa. [162] | 7q21.3-q22 | 1DVN , 1OC0 | ||
| SERPINA2 | Nexina derivada de la glía / Proteasa nexina I | Extracelular | Inhibidor de uPA y tPA. [163] | La expresión anormal conduce a la infertilidad masculina. [164] La falta de expresión en ratones causa epilepsia. [165] | 2q33-q35 | 4DY0 | |
| SERPINF1 | Factor derivado del epitelio pigmentario | Extracelular | Molécula antiangiogénica potente y no inhibidora. [166] Se ha informado que el PEDF se une al glicosaminoglicano hialuronano. [167] | La eliminación del gen en ratones afecta la vasculatura y la masa del páncreas y la próstata. [166] Promueve la renovación dependiente de Notch de las células madre neurales periventriculares adultas . [168] Las mutaciones en humanos causan osteogénesis imperfecta tipo VI. [81] | 17p13.3 | 1IMV | |
| SERPINF2 | α2-antiplasmina | Extracelular | Inhibidor de la plasmina, inhibidor de la fibrinólisis . [169] | Los ratones knockouts muestran un aumento de la fibrinólisis pero no de los trastornos hemorrágicos. [170] | La deficiencia causa un trastorno hemorrágico poco común. [171] [172] | 17pter-p12 | 2R9Y |
| SERPIENTE1 | Inhibidor del complemento 1 | Extracelular | Inhibidor de la esterasa C1. [173] | Varios polimorfismos asociados con la degeneración macular [174] y el angioedema hereditario . [175] | 11q11-q13.1 | 20 años | |
| SERPINH1 | Proteína de choque térmico de 47 kDa (HSP47) | Intracelular | Acompañante molecular no inhibidor en el plegamiento del colágeno. [57] | Los knockouts en ratones son letales. [176] | La mutación en humanos causa osteogénesis imperfecta grave . [177] [178] | 11p15 | 4AXY |
| SERPINI1 | Neuroserpina | Extracelular | Inhibidor de tPA, uPA y plasmina. [179] | La mutación causa demencia FENIB (serpinopatía). [180] [181] | 3t26 | 1JJO , 3FGQ , 3F5N , 3F02 | |
| SERPINI2 | Pancpin | Extracelular | Desconocido [182] | La deficiencia en ratones provoca insuficiencia pancreática a través de la pérdida de células acinares . [183] | 3t26 |
Serpinas especializadas de mamíferos
Se han identificado muchas serpinas de mamíferos que no comparten una ortología obvia con una contraparte de serpina humana. Los ejemplos incluyen numerosas serpinas de roedores (particularmente algunas de las serpinas intracelulares murinas ) así como las serpinas uterinas . El término serpina uterina se refiere a los miembros del clado de serpina A que están codificados por el gen SERPINA14. Las serpinas uterinas son producidas por el endometrio de un grupo restringido de mamíferos en el clado Laurasiatheria bajo la influencia de progesterona o estrógeno . [184] Probablemente no sean inhibidores funcionales de proteinasa y pueden funcionar durante el embarazo para inhibir las respuestas inmunes maternas contra el concepto o para participar en el transporte transplacentario. [185]
Insecto
El genoma de Drosophila melanogaster contiene 29 genes que codifican serpinas. El análisis de la secuencia de aminoácidos ha situado a 14 de estas serpinas en el clado Q de serpinas y tres en el clado K de serpinas, con las doce restantes clasificadas como serpinas huérfanas que no pertenecen a ningún clado. [186] El sistema de clasificación de clados es difícil de utilizar para las serpinas de Drosophila y en su lugar se ha adoptado un sistema de nomenclatura que se basa en la posición de los genes de serpinas en los cromosomas de Drosophila . Trece de las serpinas de Drosophila se presentan como genes aislados en el genoma (incluyendo Serpin-27A, ver más abajo), y las 16 restantes están organizadas en cinco grupos de genes que se presentan en las posiciones cromosómicas 28D (2 serpinas), 42D (5 serpinas), 43A (4 serpinas), 77B (3 serpinas) y 88E (2 serpinas). [186] [187] [188]
Los estudios sobre las serpinas de Drosophila revelan que la Serpin-27A inhibe la proteasa Easter (la proteasa final en la cascada proteolítica Nudel, Gastrulation Defective, Snake y Easter) y, por lo tanto, controla la formación de patrones dorsoventrales . Easter funciona para escindir Spätzle (un ligando de tipo quimiocina), lo que da como resultado una señalización mediada por toll . Además de su papel central en la formación de patrones embrionarios, la señalización toll también es importante para la respuesta inmune innata en los insectos. En consecuencia, la serpin-27A también funciona para controlar la respuesta inmune de los insectos. [48] [189] [190] En Tenebrio molitor (un escarabajo grande), una proteína (SPN93) que comprende dos dominios de serpina en tándem discretos funciona para regular la cascada proteolítica toll. [191]
Nematodo
El genoma del gusano nematodo C. elegans contiene 9 serpinas, todas las cuales carecen de secuencias señalizadoras y por lo tanto probablemente sean intracelulares. [192] Sin embargo, solo 5 de estas serpinas parecen funcionar como inhibidores de proteasas. [192] Una, SRP-6, realiza una función protectora y protege contra la disrupción lisosomal asociada a calpaína inducida por estrés . Además, SRP-6 inhibe las proteasas de cisteína lisosomales liberadas después de la ruptura lisosomal. En consecuencia, los gusanos que carecen de SRP-6 son sensibles al estrés. Más notablemente, los gusanos knock out de SRP-6 mueren cuando se colocan en agua (fenotipo letal por estrés hipoosmótico u Osl). Por lo tanto, se ha sugerido que los lisosomas juegan un papel general y controlable en la determinación del destino celular. [193]
Planta
Las serpinas vegetales estuvieron entre los primeros miembros de la superfamilia que se identificaron. [194] La proteína de cebada serpina Z es muy abundante en el grano de cebada y uno de los principales componentes proteicos de la cerveza. El genoma de la planta modelo, Arabidopsis thaliana, contiene 18 genes similares a las serpinas, aunque solo 8 de ellos son secuencias de serpinas de longitud completa.
Las serpinas vegetales son potentes inhibidores de las serina proteasas similares a la quimotripsina de mamíferos in vitro , siendo el ejemplo mejor estudiado la serpina Zx de cebada (BSZx), que es capaz de inhibir la tripsina y la quimotripsina, así como varios factores de coagulación sanguínea. [195] Sin embargo, los parientes cercanos de las serina proteasas similares a la quimotripsina están ausentes en las plantas. El RCL de varias serpinas del grano de trigo y del centeno contiene secuencias de repetición de poli-Q similares a las presentes en las proteínas de almacenamiento de prolamina del endospermo. [196] [197] Por lo tanto, se ha sugerido que las serpinas vegetales pueden funcionar para inhibir las proteasas de insectos o microbios que de otro modo digerirían las proteínas de almacenamiento del grano. En apoyo de esta hipótesis, se han identificado serpinas vegetales específicas en la savia del floema de las plantas de calabaza (CmPS-1) [198] y pepino. [199] [200] Aunque se observó una correlación inversa entre la regulación positiva de la expresión de CmPS-1 y la supervivencia de los pulgones, los experimentos de alimentación in vitro revelaron que el CmPS-1 recombinante no parecía afectar la supervivencia de los insectos. [198]
Se han propuesto funciones alternativas y objetivos de proteasas para las serpinas de las plantas. La serpina de Arabidopsis , AtSerpin1 (At1g47710; 3LE2 ), media el control del punto de ajuste sobre la muerte celular programada al dirigirse a la proteasa de cisteína similar a la papaína 'Responsive to Desiccation-21' (RD21). [53] [201] AtSerpin1 también inhibe las proteasas similares a la metacaspasa in vitro . [52] Otras dos serpinas de Arabidopsis , AtSRP2 (At2g14540) y AtSRP3 (At1g64030) parecen estar involucradas en las respuestas al daño del ADN. [202]
Hongo
Hasta la fecha se ha caracterizado una única serpina fúngica : la celpina de la cepa E2 de Piromyces spp . Piromyces es un género de hongos anaeróbicos que se encuentran en el intestino de los rumiantes y son importantes para la digestión de material vegetal. Se predice que la celpina es inhibidora y contiene dos dominios dockerin N-terminales además de su dominio serpina. Las dockerinas se encuentran comúnmente en proteínas que se localizan en el celulosoma fúngico , un gran complejo multiproteico extracelular que descompone la celulosa. [38] Por lo tanto, se sugiere que la celpina puede proteger el celulosoma contra las proteasas vegetales. Ciertas serpinas bacterianas se localizan de manera similar en el celulosoma. [203]
Procariota
Los genes de serpinas predichos se distribuyen esporádicamente en procariotas . Los estudios in vitro sobre algunas de estas moléculas han revelado que son capaces de inhibir las proteasas, y se sugiere que funcionan como inhibidores in vivo . Varias serpinas procariotas se encuentran en extremófilos . En consecuencia, y en contraste con las serpinas de mamíferos, estas moléculas poseen una resistencia elevada a la desnaturalización por calor. [204] [205] El papel preciso de la mayoría de las serpinas bacterianas sigue siendo oscuro, aunque la serpina de Clostridium thermocellum se localiza en el celulosoma . Se sugiere que el papel de las serpinas asociadas al celulosoma puede ser prevenir la actividad de proteasa no deseada contra el celulosoma. [203]
Viral
Las serpinas también son expresadas por virus como una forma de evadir la defensa inmune del huésped. [206] En particular, las serpinas expresadas por los virus de la viruela , incluyendo la viruela bovina (vaccinia) y la viruela del conejo (mixoma), son de interés debido a su uso potencial como terapias novedosas para trastornos inmunes e inflamatorios, así como terapia de trasplante. [207] [208] Serp1 suprime la respuesta inmune innata mediada por TLR y permite la supervivencia indefinida del aloinjerto cardíaco en ratas. [207] [209] Crma y Serp2 son ambos inhibidores de clase cruzada y se dirigen tanto a las serina (granzima B; aunque débilmente) como a las cisteína proteasas (caspasa 1 y caspasa 8). [210] [211] En comparación con sus contrapartes mamíferas, las serpinas virales contienen deleciones significativas de elementos de estructura secundaria. Específicamente, crmA carece de la hélice D así como de porciones significativas de las hélices A y E. [212]
Referencias
- ^ abcde Silverman GA, Bird PI, Carrell RW, Church FC, Coughlin PB, Gettins PG, Irving JA, Lomas DA, Luke CJ, Moyer RW, Pemberton PA, Remold-O'Donnell E, Salvesen GS, Travis J, Whisstock JC (septiembre de 2001). "Las serpinas son una superfamilia en expansión de proteínas estructuralmente similares pero funcionalmente diversas. Evolución, mecanismo de inhibición, nuevas funciones y una nomenclatura revisada". The Journal of Biological Chemistry . 276 (36): 33293–33296. doi : 10.1074/jbc.R100016200 . PMID 11435447.
- ^ Spence MA, Mortimer MD, Buckle AM, Minh BQ, Jackson CJ (junio de 2021). Echave J (ed.). "Un análisis filogenético exhaustivo de la superfamilia Serpin". Biología molecular y evolución . 38 (7): 2915–2929. doi :10.1093/molbev/msab081. PMC 8233489 . PMID 33744972.
- ^ Carrell RW, Boswell DR (1986). "Serpinas: la superfamilia de inhibidores de la proteinasa de serina plasmática". En Barrett AJ, Salvesen G (eds.). Inhibidores de la proteinasa . Monografías de investigación en fisiología celular y tisular. Vol. 12. Ámsterdam: Elsevier Science Publishers BV. págs. 403–420. ISBN 0-444-80763-2.
- ^ Silverman GA, Whisstock JC, Bottomley SP, Huntington JA, Kaiserman D, Luke CJ, Pak SC, Reichhart JM, Bird PI (agosto de 2010). "Las serpinas hacen gala de su fuerza: I. Poniendo freno a la proteólisis en diversos sistemas biológicos". The Journal of Biological Chemistry . 285 (32): 24299–24305. doi : 10.1074/jbc.R110.112771 . PMC 2915665 . PMID 20498369.
- ^ Whisstock JC, Silverman GA, Bird PI, Bottomley SP, Kaiserman D, Luke CJ, Pak SC, Reichhart JM, Huntington JA (agosto de 2010). "Las serpinas muestran su fuerza: II. Perspectivas estructurales sobre el reconocimiento, la polimerización y las funciones de transporte de las peptidasas diana". The Journal of Biological Chemistry . 285 (32): 24307–24312. doi : 10.1074/jbc.R110.141408 . PMC 2915666 . PMID 20498368.
- ^ abcd Huntington JA, Read RJ, Carrell RW (octubre de 2000). "La estructura de un complejo serpina-proteasa muestra inhibición por deformación". Nature . 407 (6806): 923–926. Bibcode :2000Natur.407..923H. doi :10.1038/35038119. PMID 11057674. S2CID 205009937.
- ^ abcdefg Gettins PG (diciembre de 2002). "Estructura, mecanismo y función de la serpina". Chemical Reviews . 102 (12): 4751–4804. doi :10.1021/cr010170. PMID 12475206.
- ^ abcdefg Whisstock JC, Bottomley SP (diciembre de 2006). "Gimnasia molecular: estructura, plegamiento y mal plegamiento de las serpinas". Current Opinion in Structural Biology . 16 (6): 761–768. doi :10.1016/j.sbi.2006.10.005. PMID 17079131.
- ^ abcdef Law RH, Zhang Q, McGowan S, Buckle AM, Silverman GA, Wong W, Rosado CJ, Langendorf CG, Pike RN, Bird PI, Whisstock JC (2006). "Una visión general de la superfamilia de las serpinas". Genome Biology . 7 (5): 216. doi : 10.1186/gb-2006-7-5-216 . PMC 1779521 . PMID 16737556.
- ^ abcde Stein PE, Carrell RW (febrero de 1995). "¿Qué nos dicen las serpinas disfuncionales sobre la movilidad molecular y la enfermedad?". Nature Structural Biology . 2 (2): 96–113. doi :10.1038/nsb0295-96. PMID 7749926. S2CID 21223825.
- ^ abcdefghi Janciauskiene SM, Bals R, Koczulla R, Vogelmeier C, Köhnlein T, Welte T (agosto de 2011). "El descubrimiento de la α1-antitripsina y su papel en la salud y la enfermedad". Medicina respiratoria . 105 (8): 1129–1139. doi : 10.1016/j.rmed.2011.02.002 . PMID 21367592.
- ^ abcd Carrell RW, Lomas DA (julio de 1997). "Enfermedad conformacional". Lancet . 350 (9071): 134–138. doi :10.1016/S0140-6736(97)02073-4. PMID 9228977. S2CID 39124185.
- ^ Fermi C, Pernossi L (diciembre de 1894). "Untersuchungen uber die enzima, Vergleichende Studie" [Estudios sobre la enzima, estudio comparativo] (PDF) . Zeitschrift für Hygiene und Infektionskrankheiten (en alemán) (18): 83–89. doi :10.1007/BF02216836. S2CID 24373770.
- ^ Schultze HU, Göllner I, Heide K, Schönenberger M, Schwick G (agosto de 1955). "Zur Kenntnis der alpha-globulin des menschlichen normal sueros" [Para el conocimiento de la alfa - globulina de los sueros normales humanos]. Zeitschrift für Naturforschung B (en alemán). 10 (8): 463. doi : 10.1515/znb-1955-0810 . S2CID 95960716.
- ^ Petersen TE, Dudeck-Wojciechowska G, Sottrup-Jensen L, Magnusson S (1979). "Estructura primaria de la antitrombina III (cofactor de la heparina): homología parcial entre la alfa-1-antitripsina y la antitrombina III". En Collen D, Wiman B, Verstraete M (eds.). Los inhibidores fisiológicos de la coagulación y la fibrinólisis . Ámsterdam: Elsevier . págs. 43–54.
- ^ Carrell R, Owen M, Brennan S, Vaughan L (diciembre de 1979). "Fragmento terminal carboxi de la alfa-1-antitripsina humana a partir de la escisión de la hidroxilamina: homología con la antitrombina III". Biochemical and Biophysical Research Communications . 91 (3): 1032–1037. doi :10.1016/0006-291X(79)91983-1. PMID 316698.
- ^ Hunt LT, Dayhoff MO (julio de 1980). "Una sorprendente nueva superfamilia de proteínas que contiene ovoalbúmina, antitrombina-III e inhibidor de la alfa 1-proteinasa". Comunicaciones de investigación bioquímica y biofísica . 95 (2): 864–871. doi :10.1016/0006-291X(80)90867-0. PMID 6968211.
- ^ Carrell RW, Jeppsson JO, Laurell CB, Brennan SO, Owen MC, Vaughan L, Boswell DR (julio de 1982). "Estructura y variación de la alfa 1-antitripsina humana". Naturaleza . 298 (5872): 329–334. doi :10.1016/0968-0004(85)90011-8. PMC 7172600 . PMID 7045697.
- ^ Laurell CB, Eriksson S (marzo de 2013). "El patrón electroforético de α1-globulina del suero en la deficiencia de α1-antitripsina. 1963". Copd . 10 (Supl 1): 3–8. doi : 10.3109/15412555.2013.771956 . PMID 23527532. S2CID 36366089.
- ^ Sharp HL, Bridges RA, Krivit W, Freier EF (junio de 1969). "Cirrosis asociada con deficiencia de alfa-1-antitripsina: un trastorno hereditario no reconocido previamente". The Journal of Laboratory and Clinical Medicine . 73 (6): 934–939. PMID 4182334.
- ^ "Alfa-1-antitripsina: anomalía molecular de la variante S". British Medical Journal . 1 (6002): 130–131. Enero de 1976. doi :10.1136/bmj.1.6002.130-a. PMC 1638590 . PMID 1082356.
- ^ Jeppsson JO (junio de 1976). "La sustitución del aminoácido Glu conduce a la lisina alfa1-antitripsina PiZ". FEBS Letters . 65 (2): 195–197. doi : 10.1016/0014-5793(76)80478-4 . PMID 1084290. S2CID 84576569.
- ^ Carrell RW, Jeppsson JO, Laurell CB, Brennan SO, Owen MC, Vaughan L, Boswell DR (julio de 1982). "Estructura y variación de la alfa 1-antitripsina humana". Nature . 298 (5872): 329–334. Bibcode :1982Natur.298..329C. doi :10.1038/298329a0. PMID 7045697. S2CID 11904305.
- ^ Carrell RW, Boswell DR, Brennan SO, Owen MC (marzo de 1980). "Sitio activo de la alfa 1-antitripsina: sitio homólogo en la antitrombina-III". Comunicaciones de investigación bioquímica y biofísica . 93 (2): 399–402. doi :10.1016/0006-291X(80)91090-6. PMID 6966929.
- ^ Johnson D, Travis J (octubre de 1978). "Evidencia estructural de metionina en el sitio reactivo del inhibidor de la proteinasa alfa-1 humana". The Journal of Biological Chemistry . 253 (20): 7142–7144. doi : 10.1016/S0021-9258(17)34475-7 . PMID 701239.
- ^ Jörnvall H, Fish WW, Björk I (octubre de 1979). "El sitio de escisión de la trombina en la antitrombina bovina". FEBS Letters . 106 (2): 358–362. Bibcode :1979FEBSL.106..358J. doi : 10.1016/0014-5793(79)80532-3 . PMID 499520. S2CID 32540550.
- ^ Egeberg O (junio de 1965). "Deficiencia hereditaria de antitrombina que causa trombofilia". Thrombosis et Diathesis Haemorrhagica . 13 (2): 516–530. doi :10.1055/s-0038-1656297. PMID 14347873. S2CID 42594050.
- ^ ab Owen MC, Brennan SO, Lewis JH, Carrell RW (septiembre de 1983). "Mutación de la antitripsina a antitrombina. alfa 1-antitripsina Pittsburgh (358 Met conduce a Arg), un trastorno hemorrágico mortal". The New England Journal of Medicine . 309 (12): 694–698. doi :10.1056/NEJM198309223091203. PMID 6604220.
- ^ ab Loebermann H, Tokuoka R, Deisenhofer J, Huber R (agosto de 1984). "Inhibidor de la proteinasa alfa 1 humana. Análisis de la estructura cristalina de dos modificaciones cristalinas, modelo molecular y análisis preliminar de las implicaciones para la función". Journal of Molecular Biology . 177 (3): 531–557. doi :10.1016/0022-2836(84)90298-5. PMID 6332197.
- ^ ab Stein PE, Leslie AG, Finch JT, Turnell WG, McLaughlin PJ, Carrell RW (septiembre de 1990). "Estructura cristalina de la ovoalbúmina como modelo para el centro reactivo de las serpinas". Nature . 347 (6288): 99–102. Bibcode :1990Natur.347...99S. doi :10.1038/347099a0. PMID 2395463. S2CID 4342263.
- ^ ab Carrell RW, Evans DL, Stein PE (octubre de 1991). "Centro reactivo móvil de serpinas y control de la trombosis". Nature . 353 (6344): 576–578. Bibcode :1991Natur.353..576C. doi : 10.1038/353576a0 . PMID 1922367. S2CID 4361304.
- ^ Mottonen J, Strand A, Symersky J, Sweet RM, Danley DE, Geoghegan KF, Gerard RD, Goldsmith EJ (enero de 1992). "Base estructural de la latencia en el inhibidor del activador del plasminógeno-1". Nature . 355 (6357): 270–273. Bibcode :1992Natur.355..270M. doi :10.1038/355270a0. PMID 1731226. S2CID 4365370.
- ^ Austin RC, Rachubinski RA, Ofosu FA, Blajchman MA (mayo de 1991). "Antitrombina-III-Hamilton, Ala 382 a Thr: una variante de la antitrombina-III que actúa como sustrato pero no como inhibidor de la alfa-trombina y el factor Xa". Blood . 77 (10): 2185–2189. doi : 10.1182/blood.V77.10.2185.2185 . PMID 2029579.
- ^ abc Huntington JA (agosto de 2006). "Serpinas que cambian de forma: ventajas de un mecanismo móvil". Tendencias en ciencias bioquímicas . 31 (8): 427–435. doi :10.1016/j.tibs.2006.06.005. PMID 16820297.
- ^ Carrell RW, Read RJ (febrero de 2017). "Cómo las serpinas transportan hormonas y regulan su liberación". Seminarios en biología celular y del desarrollo . 62 : 133–141. doi :10.1016/j.semcdb.2016.12.007. PMID 28027946.
- ^ abc Irving JA, Pike RN, Lesk AM, Whisstock JC (diciembre de 2000). "Filogenia de la superfamilia de las serpinas: implicaciones de los patrones de conservación de aminoácidos para la estructura y la función". Genome Research . 10 (12): 1845–1864. doi : 10.1101/gr.GR-1478R . PMID 11116082.
- ^ ab Irving JA, Steenbakkers PJ, Lesk AM, Op den Camp HJ, Pike RN, Whisstock JC (noviembre de 2002). "Serpinas en procariotas". Biología Molecular y Evolución . 19 (11): 1881–1890. doi : 10.1093/oxfordjournals.molbev.a004012 . PMID 12411597.
- ^ ab Steenbakkers PJ, Irving JA, Harhangi HR, Swinkels WJ, Akhmanova A, Dijkerman R, Jetten MS, van der Drift C, Whisstock JC, Op den Camp HJ (agosto de 2008). "Una serpina en el celulosoma del hongo anaeróbico Piromyces sp. cepa E2". Investigación micológica . 112 (Pt 8): 999–1006. doi :10.1016/j.mycres.2008.01.021. hdl : 2066/72679 . PMID 18539447.
- ^ Huber R, Carrell RW (noviembre de 1989). "Implicaciones de la estructura tridimensional de la alfa 1-antitripsina para la estructura y función de las serpinas". Bioquímica . 28 (23): 8951–8966. doi :10.1021/bi00449a001. PMID 2690952.
- ^ ab Rawlings ND, Tolle DP, Barrett AJ (marzo de 2004). "Familias evolutivas de inhibidores de peptidasa". The Biochemical Journal . 378 (Pt 3): 705–716. doi :10.1042/BJ20031825. PMC 1224039 . PMID 14705960.
- ^ Barrett AJ, Rawlings ND (abril de 1995). "Familias y clanes de serina peptidasas". Archivos de bioquímica y biofísica . 318 (2): 247–250. doi :10.1006/abbi.1995.1227. PMID 7733651.
- ^ Barrett AJ, Rawlings ND (mayo de 2001). "Líneas evolutivas de las peptidasas de cisteína". Química biológica . 382 (5): 727–733. doi : 10.1515/BC.2001.088 . PMID 11517925. S2CID 37306786.
- ^ Irving JA, Pike RN, Dai W, Brömme D, Worrall DM, Silverman GA, Coetzer TH, Dennison C, Bottomley SP, Whisstock JC (abril de 2002). "Evidencia de que la arquitectura de la serpina apoya intrínsecamente la inhibición de la proteasa de cisteína similar a la papaína: ingeniería de la alfa(1)-antitripsina para inhibir las proteasas de catepsina". Bioquímica . 41 (15): 4998–5004. doi :10.1021/bi0159985. PMID 11939796.
- ^ ab Schick C, Brömme D, Bartuski AJ, Uemura Y, Schechter NM, Silverman GA (noviembre de 1998). "El bucle del sitio reactivo de la serpina SCCA1 es esencial para la inhibición de la proteinasa de cisteína". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 95 (23): 13465–13470. Bibcode :1998PNAS...9513465S. doi : 10.1073/pnas.95.23.13465 . PMC 24842 . PMID 9811823.
- ^ ab McGowan S, Buckle AM, Irving JA, Ong PC, Bashtannyk-Puhalovich TA, Kan WT, Henderson KN, Bulynko YA, Popova EY, Smith AI, Bottomley SP, Rossjohn J, Grigoryev SA, Pike RN, Whisstock JC (julio de 2006). "Estructura cristalina de rayos X de MENT: evidencia de polímeros funcionales de hoja de bucle en condensación de cromatina". The EMBO Journal . 25 (13): 3144–3155. doi :10.1038/sj.emboj.7601201. PMC 1500978 . PMID 16810322.
- ^ Ong PC, McGowan S, Pearce MC, Irving JA, Kan WT, Grigoryev SA, Turk B, Silverman GA, Brix K, Bottomley SP, Whisstock JC, Pike RN (diciembre de 2007). "El ADN acelera la inhibición de la catepsina V humana por las serpinas". The Journal of Biological Chemistry . 282 (51): 36980–36986. doi : 10.1074/jbc.M706991200 . PMID 17923478.
- ^ ab Acosta H, Iliev D, Grahn TH, Gouignard N, Maccarana M, Griesbach J, Herzmann S, Sagha M, Climent M, Pera EM (marzo de 2015). "La serpina PN1 es un regulador de retroalimentación de la señalización de FGF en la formación de la capa germinal y del eje primario". Desarrollo . 142 (6): 1146–1158. doi : 10.1242/dev.113886 . PMID 25758225.
- ^ abc Hashimoto C, Kim DR, Weiss LA, Miller JW, Morisato D (diciembre de 2003). "Regulación espacial de la señalización del desarrollo por una serpina". Developmental Cell . 5 (6): 945–950. doi : 10.1016/S1534-5807(03)00338-1 . PMID 14667416.
- ^ Bird PI (febrero de 1999). "Regulación de las serina proteinasas de los gránulos leucocitarios proapoptóticos por serpinas intracelulares". Inmunología y biología celular . 77 (1): 47–57. doi :10.1046/j.1440-1711.1999.00787.x. PMID 10101686. S2CID 44268106.
- ^ Bird CH, Sutton VR, Sun J, Hirst CE, Novak A, Kumar S, Trapani JA, Bird PI (noviembre de 1998). "Regulación selectiva de la apoptosis: el inhibidor de la serpina proteinasa de linfocitos citotóxicos 9 protege contra la apoptosis mediada por la granzima B sin perturbar la vía de muerte celular Fas". Biología molecular y celular . 18 (11): 6387–6398. doi :10.1128/mcb.18.11.6387. PMC 109224 . PMID 9774654.
- ^ Ray CA, Black RA, Kronheim SR, Greenstreet TA, Sleath PR, Salvesen GS, Pickup DJ (mayo de 1992). "Inhibición viral de la inflamación: el virus de la viruela de las vacas codifica un inhibidor de la enzima convertidora de interleucina-1 beta". Cell . 69 (4): 597–604. doi :10.1016/0092-8674(92)90223-Y. PMID 1339309. S2CID 7398844.
- ^ ab Vercammen D, Belenghi B, van de Cotte B, Beunens T, Gavigan JA, De Rycke R, Brackenier A, Inzé D, Harris JL, Van Breusegem F (diciembre de 2006). "Serpin1 de Arabidopsis thaliana es un inhibidor suicida de la metacaspasa 9". Revista de biología molecular . 364 (4): 625–636. doi :10.1016/j.jmb.2006.09.010. PMID 17028019.
- ^ ab Lampl N, Budai-Hadrian O, Davydov O, Joss TV, Harrop SJ, Curmi PM, Roberts TH, Fluhr R (abril de 2010). "AtSerpin1 de Arabidopsis, estructura cristalina e interacción in vivo con su proteasa objetivo RESPONSIVA A LA DESICACIÓN-21 (RD21)". The Journal of Biological Chemistry . 285 (18): 13550–13560. doi : 10.1074/jbc.M109.095075 . PMC 2859516 . PMID 20181955.
- ^ abc Klieber MA, Underhill C, Hammond GL, Muller YA (octubre de 2007). "Globulina transportadora de corticosteroides, una base estructural para el transporte de esteroides y la liberación desencadenada por proteinasas". The Journal of Biological Chemistry . 282 (40): 29594–29603. doi : 10.1074/jbc.M705014200 . PMID 17644521.
- ^ abcde Zhou A, Wei Z, Read RJ, Carrell RW (septiembre de 2006). "Mecanismo estructural para el transporte y liberación de tiroxina en la sangre". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 103 (36): 13321–13326. Bibcode :2006PNAS..10313321Z. doi : 10.1073/pnas.0604080103 . PMC 1557382 . PMID 16938877.
- ^ Huntington JA, Stein PE (mayo de 2001). "Estructura y propiedades de la ovoalbúmina". Revista de cromatografía. B, Ciencias biomédicas y aplicaciones . 756 (1–2): 189–198. doi :10.1016/S0378-4347(01)00108-6. PMID 11419711.
- ^ abc Mala JG, Rose C (noviembre de 2010). "Interacciones de la proteína de choque térmico 47 con el colágeno y la respuesta al estrés: ¿un modelo de chaperona no convencional?". Ciencias de la vida . 87 (19–22): 579–586. doi :10.1016/j.lfs.2010.09.024. PMID 20888348.
- ^ Grigoryev SA, Bednar J, Woodcock CL (febrero de 1999). "MENT, una proteína de heterocromatina que media el plegamiento de la cromatina de orden superior, es un nuevo miembro de la familia de las serpinas". The Journal of Biological Chemistry . 274 (9): 5626–5636. doi : 10.1074/jbc.274.9.5626 . PMID 10026180.
- ^ Elliott PR, Lomas DA, Carrell RW, Abrahams JP (agosto de 1996). "Conformación inhibidora del bucle reactivo de la alfa 1-antitripsina". Nature Structural Biology . 3 (8): 676–681. doi :10.1038/nsb0896-676. PMID 8756325. S2CID 22976014.
- ^ Horvath AJ, Irving JA, Rossjohn J, Law RH, Bottomley SP, Quinsey NS, Pike RN, Coughlin PB, Whisstock JC (diciembre de 2005). "El ortólogo murino de la antiquimotripsina humana: un paradigma estructural para las serpinas del clado A3". The Journal of Biological Chemistry . 280 (52): 43168–43178. doi : 10.1074/jbc.M505598200 . PMID 16141197.
- ^ Whisstock JC, Skinner R, Carrell RW, Lesk AM (febrero de 2000). "Cambios conformacionales en serpinas: I. Las conformaciones nativas y escindidas de la alfa(1)-antitripsina". Journal of Molecular Biology . 296 (2): 685–699. doi :10.1006/jmbi.1999.3520. PMID 10669617.
- ^ Jin L, Abrahams JP, Skinner R, Petitou M, Pike RN, Carrell RW (diciembre de 1997). "La activación anticoagulante de la antitrombina por la heparina". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 94 (26): 14683–14688. Bibcode :1997PNAS...9414683J. doi : 10.1073/pnas.94.26.14683 . PMC 25092 . PMID 9405673.
- ^ Whisstock JC, Pike RN, Jin L, Skinner R, Pei XY, Carrell RW, Lesk AM (septiembre de 2000). "Cambios conformacionales en serpinas: II. El mecanismo de activación de la antitrombina por la heparina". Journal of Molecular Biology . 301 (5): 1287–1305. doi :10.1006/jmbi.2000.3982. PMID 10966821.
- ^ Li W, Johnson DJ, Esmon CT, Huntington JA (septiembre de 2004). "La estructura del complejo ternario antitrombina-trombina-heparina revela el mecanismo antitrombótico de la heparina". Nature Structural & Molecular Biology . 11 (9): 857–862. doi :10.1038/nsmb811. PMID 15311269. S2CID 28790576.
- ^ Johnson DJ, Li W, Adams TE, Huntington JA (mayo de 2006). "La estructura del factor Xa-heparina de la antitrombina-S195A revela el mecanismo alostérico de activación de la antitrombina". The EMBO Journal . 25 (9): 2029–2037. doi :10.1038/sj.emboj.7601089. PMC 1456925 . PMID 16619025.
- ^ Walenga JM, Jeske WP, Samama MM, Frapaise FX, Bick RL, Fareed J (marzo de 2002). "Fondaparinux: un pentasacárido de heparina sintético como nuevo agente antitrombótico". Opinión de expertos sobre fármacos en investigación . 11 (3): 397–407. doi :10.1517/13543784.11.3.397. PMID 11866668. S2CID 24796086.
- ^ Petitou M, van Boeckel CA (junio de 2004). "¡Un pentasacárido sintético que se une a la antitrombina III es ahora un fármaco! ¿Qué viene después?". Angewandte Chemie . 43 (24): 3118–3133. doi :10.1002/anie.200300640. PMID 15199558.
- ^ ab Lindahl TL, Sigurdardottir O, Wiman B (septiembre de 1989). "Estabilidad del inhibidor del activador del plasminógeno 1 (PAI-1)". Trombosis y hemostasia . 62 (2): 748–751. doi :10.1055/s-0038-1646895. PMID 2479113. S2CID 19433778.
- ^ Mushunje A, Evans G, Brennan SO, Carrell RW, Zhou A (diciembre de 2004). "Antitrombina latente y su detección, formación y recambio en la circulación". Journal of Thrombosis and Haemostasis . 2 (12): 2170–2177. doi : 10.1111/j.1538-7836.2004.01047.x . PMID 15613023. S2CID 43029244.
- ^ Zhang Q, Buckle AM, Law RH, Pearce MC, Cabrita LD, Lloyd GJ, Irving JA, Smith AI, Ruzyla K, Rossjohn J, Bottomley SP, Whisstock JC (julio de 2007). "El extremo N de la serpina, tengpin, funciona para atrapar el estado nativo metaestable". EMBO Reports . 8 (7): 658–663. doi :10.1038/sj.embor.7400986. PMC 1905895 . PMID 17557112.
- ^ Zhang Q, Law RH, Bottomley SP, Whisstock JC, Buckle AM (marzo de 2008). "Una base estructural para la polimerización en láminas C de bucle en serpinas". Journal of Molecular Biology . 376 (5): 1348–1359. doi :10.1016/j.jmb.2007.12.050. PMID 18234218.
- ^ Pemberton PA, Stein PE, Pepys MB, Potter JM, Carrell RW (noviembre de 1988). "Las globulinas transportadoras de hormonas sufren un cambio conformacional de serpinas en la inflamación". Nature . 336 (6196): 257–258. Bibcode :1988Natur.336..257P. doi :10.1038/336257a0. PMID 3143075. S2CID 4326356.
- ^ abc Cao C, Lawrence DA, Li Y, Von Arnim CA, Herz J, Su EJ, Makarova A, Hyman BT, Strickland DK, Zhang L (mayo de 2006). "El receptor endocítico LRP junto con tPA y PAI-1 coordina la migración de macrófagos dependiente de Mac-1". The EMBO Journal . 25 (9): 1860–1870. doi :10.1038/sj.emboj.7601082. PMC 1456942 . PMID 16601674.
- ^ Jensen JK, Dolmer K, Gettins PG (julio de 2009). "Especificidad de la unión de la proteína relacionada con el receptor de lipoproteína de baja densidad a diferentes estados conformacionales de las serpinas inhibidor del activador del plasminógeno-1 y la proteinasa nexina-1 del clado E". The Journal of Biological Chemistry . 284 (27): 17989–17997. doi : 10.1074/jbc.M109.009530 . PMC 2709341 . PMID 19439404.
- ^ Soukup SF, Culi J, Gubb D (junio de 2009). Rulifson E (ed.). "Captación de la serpina necrótica en Drosophila melanogaster a través del receptor de lipoforina-1". PLOS Genetics . 5 (6): e1000532. doi : 10.1371/journal.pgen.1000532 . PMC 2694266 . PMID 19557185.
- ^ Kaiserman D, Whisstock JC, Bird PI (diciembre de 2006). "Mecanismos de disfunción de serpinas en la enfermedad". Expert Reviews in Molecular Medicine . 8 (31): 1–19. doi :10.1017/S1462399406000184. PMID 17156576. S2CID 20760165.
- ^ de Serres FJ (noviembre de 2002). "Distribución racial y étnica mundial de la deficiencia de alfa1-antitripsina: resumen de un análisis de encuestas epidemiológicas genéticas publicadas". Chest . 122 (5): 1818–1829. doi :10.1378/chest.122.5.1818. PMID 12426287.
- ^ Hopkins PC, Carrell RW, Stone SR (agosto de 1993). "Efectos de las mutaciones en la región bisagra de las serpinas". Bioquímica . 32 (30): 7650–7657. doi :10.1021/bi00081a008. PMID 8347575.
- ^ Beauchamp NJ, Pike RN, Daly M, Butler L, Makris M, Dafforn TR, Zhou A, Fitton HL, Preston FE, Peake IR, Carrell RW (octubre de 1998). "Antitrombinas Wibble y Wobble (T85M/K): enfermedades conformacionales arquetípicas con transición latente in vivo, trombosis y activación de heparina". Blood . 92 (8): 2696–2706. doi :10.1182/blood.V92.8.2696. PMID 9763552.
- ^ abc Gooptu B, Hazes B, Chang WS, Dafforn TR, Carrell RW, Read RJ, Lomas DA (enero de 2000). "La conformación inactiva de la serpina alfa(1)-antiquimotripsina indica una inserción en dos etapas del bucle reactivo: implicaciones para la función inhibidora y la enfermedad conformacional". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 97 (1): 67–72. Bibcode :2000PNAS...97...67G. doi : 10.1073/pnas.97.1.67 . PMC 26617 . PMID 10618372.
- ^ ab Homan EP, Rauch F, Grafe I, Lietman C, Doll JA, Dawson B, Bertin T, Napierala D, Morello R, Gibbs R, White L, Miki R, Cohn DH, Crawford S, Travers R, Glorieux FH, Lee B (diciembre de 2011). "Las mutaciones en SERPINF1 causan osteogénesis imperfecta tipo VI". Revista de investigación ósea y mineral . 26 (12): 2798–2803. doi :10.1002/jbmr.487. PMC 3214246 . PMID 21826736.
- ^ Fay WP, Parker AC, Condrey LR, Shapiro AD (julio de 1997). "Deficiencia del inhibidor del activador del plasminógeno humano-1 (PAI-1): caracterización de una gran familia con una mutación nula en el gen PAI-1". Blood . 90 (1): 204–208. doi : 10.1182/blood.V90.1.204 . PMID 9207454.
- ^ abcdef Heit C, Jackson BC, McAndrews M, Wright MW, Thompson DC, Silverman GA, Nebert DW, Vasiliou V (octubre de 2013). "Actualización de la superfamilia de genes SERPIN humanos y de ratón". Human Genomics . 7 (1): 22. doi : 10.1186/1479-7364-7-22 . PMC 3880077 . PMID 24172014.
- ^ ab Lomas DA, Evans DL, Finch JT, Carrell RW (junio de 1992). "El mecanismo de acumulación de Z alfa 1-antitripsina en el hígado". Nature . 357 (6379): 605–607. Bibcode :1992Natur.357..605L. doi :10.1038/357605a0. PMID 1608473. S2CID 4359543.
- ^ Kroeger H, Miranda E, MacLeod I, Pérez J, Crowther DC, Marciniak SJ, Lomas DA (agosto de 2009). "La degradación asociada al retículo endoplasmático (ERAD) y la autofagia cooperan para degradar serpinas mutantes polimerogénicas". The Journal of Biological Chemistry . 284 (34): 22793–22802. doi : 10.1074/jbc.M109.027102 . PMC 2755687 . PMID 19549782.
- ^ abc Yamasaki M, Li W, Johnson DJ, Huntington JA (octubre de 2008). "La estructura cristalina de un dímero estable revela la base molecular de la polimerización de serpinas". Nature . 455 (7217): 1255–1258. Bibcode :2008Natur.455.1255Y. doi :10.1038/nature07394. PMID 18923394. S2CID 205215121.
- ^ ab Bottomley SP (septiembre de 2011). "La diversidad estructural en el plegamiento incorrecto de la α1-antitripsina". EMBO Reports . 12 (10): 983–984. doi :10.1038/embor.2011.187. PMC 3185355 . PMID 21921939.
- ^ ab Yamasaki M, Sendall TJ, Pearce MC, Whisstock JC, Huntington JA (septiembre de 2011). "Base molecular de la deficiencia de α1-antitripsina revelada por la estructura de un trímero de dominios intercambiados". EMBO Reports . 12 (10): 1011–1017. doi :10.1038/embor.2011.171. PMC 3185345 . PMID 21909074.
- ^ Chang WS, Whisstock J, Hopkins PC, Lesk AM, Carrell RW, Wardell MR (enero de 1997). "Importancia de la liberación de la cadena 1C para el mecanismo de polimerización de las serpinas inhibidoras". Protein Science . 6 (1): 89–98. doi :10.1002/pro.5560060110. PMC 2143506 . PMID 9007980.
- ^ Miranda E, Pérez J, Ekeowa UI, Hadzic N, Kalsheker N, Gooptu B, Portmann B, Belorgey D, Hill M, Chambers S, Teckman J, Alexander GJ, Marciniak SJ, Lomas DA (septiembre de 2010). "Un nuevo anticuerpo monoclonal para caracterizar polímeros patógenos en la enfermedad hepática asociada con la deficiencia de alfa1-antitripsina". Hepatología . 52 (3): 1078–1088. doi :10.1002/hep.23760. PMID 20583215. S2CID 8188156.
- ^ Sandhaus RA (octubre de 2004). "Deficiencia de alfa1-antitripsina . 6: tratamientos nuevos y emergentes para la deficiencia de alfa1-antitripsina". Tórax . 59 (10): 904–909. doi :10.1136/thx.2003.006551. PMC 1746849 . PMID 15454659.
- ^ Lewis EC (septiembre de 2012). "Ampliación de las indicaciones clínicas para la terapia con α(1)-antitripsina". Molecular Medicine . 18 (6): 957–970. doi :10.2119/molmed.2011.00196. PMC 3459478 . PMID 22634722.
- ^ Fregonese L, Stolk J (junio de 2008). "Deficiencia hereditaria de alfa-1-antitripsina y sus consecuencias clínicas". Orphanet Journal of Rare Diseases . 3 : 16. doi : 10.1186/1750-1172-3-16 . PMC 2441617 . PMID 18565211.
- ^ Yusa K, Rashid ST, Strick-Marchand H, Varela I, Liu PQ, Paschon DE, Miranda E, Ordóñez A, Hannan NR, Rouhani FJ, Darche S, Alexander G, Marciniak SJ, Fusaki N, Hasegawa M, Holmes MC , Di Santo JP, Lomas DA, Bradley A, Vallier L (octubre de 2011). "Corrección genética dirigida de la deficiencia de α1-antitripsina en células madre pluripotentes inducidas". Naturaleza . 478 (7369): 391–394. Código Bib :2011Natur.478..391Y. doi : 10.1038/naturaleza10424. PMC 3198846 . PMID 21993621.
- ^ Mallya M, Phillips RL, Saldanha SA, Gooptu B, Brown SC, Termine DJ, Shirvani AM, Wu Y, Sifers RN, Abagyan R, Lomas DA (noviembre de 2007). "Las moléculas pequeñas bloquean la polimerización de la Z alfa1-antitripsina y aumentan la eliminación de agregados intracelulares". Journal of Medicinal Chemistry . 50 (22): 5357–5363. doi :10.1021/jm070687z. PMC 2631427 . PMID 17918823.
- ^ Gosai SJ, Kwak JH, Luke CJ, Long OS, King DE, Kovatch KJ, Johnston PA, Shun TY, Lazo JS, Perlmutter DH, Silverman GA, Pak SC (noviembre de 2010). "Cribado automatizado de alto contenido de fármacos en animales vivos utilizando C. elegans que expresa la serpina α1-antitripsina Z propensa a la agregación". PLOS ONE . 5 (11): e15460. Bibcode :2010PLoSO...515460G. doi : 10.1371/journal.pone.0015460 . PMC 2980495 . PMID 21103396.
- ^ Cabrita LD, Irving JA, Pearce MC, Whisstock JC, Bottomley SP (septiembre de 2007). "La aeropina del extremófilo Pyrobaculum aerophilum evita la trampa del plegamiento incorrecto de la serpina". The Journal of Biological Chemistry . 282 (37): 26802–26809. doi : 10.1074/jbc.M705020200 . PMID 17635906.
- ^ Fluhr R, Lampl N, Roberts TH (mayo de 2012). "Inhibidores de la proteasa serpina en la biología vegetal". Physiologia Plantarum . 145 (1): 95–102. doi :10.1111/j.1399-3054.2011.01540.x. PMID 22085334.
- ^ Stoller JK, Aboussouan LS (2005). "Deficiencia de alfa1-antitripsina". Lancet . 365 (9478): 2225–2236. doi :10.1016/S0140-6736(05)66781-5. PMID 15978931. S2CID 54415934.
- ^ Münch J, Ständker L, Adermann K, Schulz A, Schindler M, Chinnadurai R, Pöhlmann S, Chaipan C, Biet T, Peters T, Meyer B, Wilhelm D, Lu H, Jing W, Jiang S, Forssmann WG, Kirchhoff F (abril de 2007). "Descubrimiento y optimización de un inhibidor natural de la entrada del VIH-1 dirigido al péptido de fusión gp41". Cell . 129 (2): 263–275. doi : 10.1016/j.cell.2007.02.042 . PMID 17448989.
- ^ Gooptu B, Dickens JA, Lomas DA (febrero de 2014). "La patología molecular y celular de la deficiencia de α₁-antitripsina". Tendencias en medicina molecular . 20 (2): 116–127. doi :10.1016/j.molmed.2013.10.007. PMID 24374162.
- ^ Seixas S, Suriano G, Carvalho F, Seruca R, Rocha J, Di Rienzo A (febrero de 2007). "Diversidad de secuencias en el subgrupo proximal 14q32.1 SERPIN: evidencia de selección natural que favorece la pseudogenización de SERPINA2". Biología molecular y evolución . 24 (2): 587–598. doi : 10.1093/molbev/msl187 . PMID 17135331.
- ^ Kalsheker NA (septiembre de 1996). "Alfa 1-antiquimotripsina". Revista internacional de bioquímica y biología celular . 28 (9): 961–964. doi :10.1016/1357-2725(96)00032-5. PMID 8930118. S2CID 11230631.
- ^ Santamaría M, Pardo-Saganta A, Alvarez-Asiain L, Di Scala M, Qian C, Prieto J, Avila MA (abril de 2013). "La α1-antiquimotripsina nuclear promueve la condensación de la cromatina e inhibe la proliferación de células de carcinoma hepatocelular humano". Gastroenterología . 144 (4): 818–828.e4. doi : 10.1053/j.gastro.2012.12.029 . PMID 23295442.
- ^ Zhang S, Janciauskiene S (abril de 2002). "Capacidad multifuncional de las proteínas: alfa1-antiquimotripsina y la correlación con la enfermedad de Alzheimer". Journal of Alzheimer's Disease . 4 (2): 115–122. doi :10.3233/JAD-2002-4206. PMID 12214135.
- ^ Chao J, Stallone JN, Liang YM, Chen LM, Wang DZ, Chao L (julio de 1997). "La calistatina es un nuevo vasodilatador potente". The Journal of Clinical Investigation . 100 (1): 11–17. doi :10.1172/JCI119502. PMC 508159 . PMID 9202051.
- ^ Miao RQ, Agata J, Chao L, Chao J (noviembre de 2002). "La calistatina es un nuevo inhibidor de la angiogénesis y el crecimiento tumoral". Blood . 100 (9): 3245–3252. doi : 10.1182/blood-2002-01-0185 . PMID 12384424.
- ^ Liu Y, Bledsoe G, Hagiwara M, Shen B, Chao L, Chao J (octubre de 2012). "El agotamiento de la callistatina endógena exacerba el estrés oxidativo renal y cardiovascular, la inflamación y la remodelación de órganos". Revista estadounidense de fisiología. Fisiología renal . 303 (8): F1230–F1238. doi :10.1152/ajprenal.00257.2012. PMC 3469672. PMID 22811485 .
- ^ Geiger M (marzo de 2007). "Inhibidor de la proteína C, una serpina con funciones dentro y fuera de la biología vascular". Trombosis y hemostasia . 97 (3): 343–347. doi :10.1160/th06-09-0488. PMID 17334499. S2CID 4828322.
- ^ Baumgärtner P, Geiger M, Zieseniss S, Malleier J, Huntington JA, Hochrainer K, Bielek E, Stoeckelhuber M, Lauber K, Scherfeld D, Schwille P, Wäldele K, Beyer K, Engelmann B (noviembre de 2007). "La fosfatidiletanolamina apoya de manera crítica la internalización del inhibidor de la proteína C que penetra en las células". La revista de biología celular . 179 (4): 793–804. doi :10.1083/jcb.200707165. PMC 2080921 . PMID 18025309.
- ^ Uhrin P, Dewerchin M, Hilpert M, Chrenek P, Schöfer C, Zechmeister-Machhart M, Krönke G, Vales A, Carmeliet P, Binder BR, Geiger M (diciembre de 2000). "La alteración del gen inhibidor de la proteína C provoca una alteración de la espermatogénesis y la infertilidad masculina". The Journal of Clinical Investigation . 106 (12): 1531–1539. doi :10.1172/JCI10768. PMC 381472 . PMID 11120760.
- ^ Han MH, Hwang SI, Roy DB, Lundgren DH, Price JV, Ousman SS, Fernald GH, Gerlitz B, Robinson WH, Baranzini SE, Grinnell BW, Raine CS, Sobel RA, Han DK, Steinman L (febrero de 2008). "El análisis proteómico de las lesiones activas de esclerosis múltiple revela objetivos terapéuticos". Nature . 451 (7182): 1076–1081. Bibcode :2008Natur.451.1076H. doi :10.1038/nature06559. PMID 18278032. S2CID 4421395.
- ^ Torpy DJ, Ho JT (agosto de 2007). "Polimorfismos del gen de la globulina transportadora de corticosteroides: implicaciones clínicas y vínculos con los trastornos de fatiga crónica idiopática". Endocrinología clínica . 67 (2): 161–167. doi : 10.1111/j.1365-2265.2007.02890.x . PMID 17547679. S2CID 43352358.
- ^ Bartalena L, Robbins J (1992). "Variaciones en las proteínas transportadoras de hormonas tiroideas y sus implicaciones clínicas". Tiroides . 2 (3): 237–245. doi :10.1089/thy.1992.2.237. PMID 1422238.
- ^ Persani L (septiembre de 2012). "Revisión clínica: hipotiroidismo central: desafíos patogénicos, diagnósticos y terapéuticos". The Journal of Clinical Endocrinology and Metabolism . 97 (9): 3068–3078. doi : 10.1210/jc.2012-1616 . PMID 22851492.
- ^ Kumar R, Singh VP, Baker KM (julio de 2007). "El sistema renina-angiotensina intracelular: un nuevo paradigma". Tendencias en endocrinología y metabolismo . 18 (5): 208–214. doi :10.1016/j.tem.2007.05.001. PMID 17509892. S2CID 24041932.
- ^ Tanimoto K, Sugiyama F, Goto Y, Ishida J, Takimoto E, Yagami K, Fukamizu A, Murakami K (diciembre de 1994). "Ratones con hipotensión y deficiencia de angiotensinógeno". The Journal of Biological Chemistry . 269 (50): 31334–31337. doi : 10.1016/S0021-9258(18)31697-1 . PMID 7989296.
- ^ Jeunemaitre X, Giménez-Roqueplo AP, Célérier J, Corvol P (1999). "Variantes de angiotensinógeno e hipertensión humana". Informes actuales de hipertensión . 1 (1): 31–41. doi :10.1007/s11906-999-0071-0. PMID 10981040. S2CID 42614761.
- ^ Sethi AA, Nordestgaard BG, Tybjaerg-Hansen A (julio de 2003). "Polimorfismo del gen del angiotensinógeno, angiotensinógeno plasmático y riesgo de hipertensión y cardiopatía isquémica: un metaanálisis". Arteriosclerosis, trombosis y biología vascular . 23 (7): 1269–1275. doi : 10.1161/01.ATV.0000079007.40884.5C . PMID 12805070.
- ^ Dickson ME, Sigmund CD (julio de 2006). "Base genética de la hipertensión: revisión del angiotensinógeno". Hipertensión . 48 (1): 14–20. doi : 10.1161/01.HYP.0000227932.13687.60 . PMID 16754793.
- ^ Frazer JK, Jackson DG, Gaillard JP, Lutter M, Liu YJ, Banchereau J , Capra JD, Pascual V (octubre de 2000). "Identificación de centerina: una nueva serpina restringida a células B del centro germinal humano". Revista Europea de Inmunología . 30 (10): 3039–3048. doi : 10.1002/1521-4141(200010)30:10<3039::AID-IMMU3039>3.0.CO;2-H . PMID 11069088.
- ^ Paterson MA, Horvath AJ, Pike RN, Coughlin PB (agosto de 2007). "Caracterización molecular de la centerina, una serpina de la célula del centro germinal". The Biochemical Journal . 405 (3): 489–494. doi :10.1042/BJ20070174. PMC 2267310 . PMID 17447896.
- ^ Paterson MA, Hosking PS, Coughlin PB (julio de 2008). "La expresión de la serpina centerina define un fenotipo de centro germinal en los linfomas de células B". American Journal of Clinical Pathology . 130 (1): 117–126. doi : 10.1309/9QKE68QU7B825A3U . PMID 18550480.
- ^ Ashton-Rickardt PG (abril de 2013). "Un papel emergente para los inhibidores de la serina proteasa en la inmunidad de los linfocitos T y más allá". Immunology Letters . 152 (1): 65–76. doi :10.1016/j.imlet.2013.04.004. PMID 23624075.
- ^ Han X, Fiehler R, Broze GJ (noviembre de 2000). "Caracterización del inhibidor de la proteasa dependiente de la proteína Z". Blood . 96 (9): 3049–3055. doi :10.1182/blood.V96.9.3049. PMID 11049983.
- ^ Hida K, Wada J, Eguchi J, Zhang H, Baba M, Seida A, Hashimoto I, Okada T, Yasuhara A, Nakatsuka A, Shikata K, Hourai S, Futami J, Watanabe E, Matsuki Y, Hiramatsu R, Akagi S, Makino H, Kanwar YS (julio de 2005). "Inhibidor de serina proteasa derivado del tejido adiposo visceral: una adipocitoquina sensibilizadora a la insulina única en la obesidad". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 102 (30): 10610–10615. Código Bib : 2005PNAS..10210610H. doi : 10.1073/pnas.0504703102 . PMC 1180799 . Número de modelo: PMID16030142.
- ^ Feng R, Li Y, Wang C, Luo C, Liu L, Chuo F, Li Q, Sun C (octubre de 2014). "Niveles más altos de vaspina en sujetos con obesidad y diabetes mellitus tipo 2: un metaanálisis". Diabetes Research and Clinical Practice . 106 (1): 88–94. doi :10.1016/j.diabres.2014.07.026. PMID 25151227.
- ^ Remold-O'Donnell E, Chin J, Alberts M (junio de 1992). "Secuencia y caracterización molecular del inhibidor de la elastasa de monocitos/neutrófilos humanos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 89 (12): 5635–5639. Bibcode :1992PNAS...89.5635R. doi : 10.1073/pnas.89.12.5635 . PMC 49347 . PMID 1376927.
- ^ Benarafa C, Priebe GP, Remold-O'Donnell E (agosto de 2007). "El inhibidor de la serina proteasa de neutrófilos serpinb1 preserva las funciones de defensa pulmonar en la infección por Pseudomonas aeruginosa". The Journal of Experimental Medicine . 204 (8): 1901–1909. doi :10.1084/jem.20070494. PMC 2118684 . PMID 17664292.
- ^ Antalis TM, La Linn M, Donnan K, Mateo L, Gardner J, Dickinson JL, Buttigieg K, Suhrbier A (junio de 1998). "El inhibidor de la activación del plasminógeno tipo 2 del inhibidor de la serina proteinasa (serpina) protege contra los efectos citopáticos virales mediante la preparación constitutiva con interferón alfa/beta". The Journal of Experimental Medicine . 187 (11): 1799–1811. doi :10.1084/jem.187.11.1799. PMC 2212304 . PMID 9607921.
- ^ Zhao A, Yang Z, Sun R, Grinchuk V, Netzel-Arnett S, Anglin IE, Driesbaugh KH, Notari L, Bohl JA, Madden KB, Urban JF, Antalis TM, Shea-Donohue T (junio de 2013). "SerpinB2 es fundamental para la inmunidad Th2 contra la infección por nematodos entéricos". Journal of Immunology . 190 (11): 5779–5787. doi :10.4049/jimmunol.1200293. PMC 4068334 . PMID 23630350.
- ^ Dougherty KM, Pearson JM, Yang AY, Westrick RJ, Baker MS, Ginsburg D (enero de 1999). "El gen inhibidor del activador del plasminógeno-2 no es necesario para el desarrollo o la supervivencia normales de los ratones". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 96 (2): 686–691. Bibcode :1999PNAS...96..686D. doi : 10.1073/pnas.96.2.686 . PMC 15197 . PMID 9892694.
- ^ Takeda A, Yamamoto T, Nakamura Y, Takahashi T, Hibino T (febrero de 1995). "El antígeno del carcinoma de células escamosas es un potente inhibidor de la cisteína proteinasa catepsina L". FEBS Letters . 359 (1): 78–80. Bibcode :1995FEBSL.359...78T. doi : 10.1016/0014-5793(94)01456-b . PMID 7851535. S2CID 35146299.
- ^ ab Turato C, Pontisso P (marzo de 2015). "SERPINB3 (inhibidor de la serpina peptidasa, clado B (ovoalbúmina), miembro 3)". Atlas de genética y citogenética en oncología y hematología . 19 (3): 202–209. doi :10.4267/2042/56413 (inactivo el 1 de noviembre de 2024). PMC 4430857 . PMID 25984243.
{{cite journal}}: CS1 maint: DOI inactivo a partir de noviembre de 2024 ( enlace ) - ^ ab Sivaprasad U, Askew DJ, Ericksen MB, Gibson AM, Stier MT, Brandt EB, Bass SA, Daines MO, Chakir J, Stringer KF, Wert SE, Whitsett JA, Le Cras TD, Wills-Karp M, Silverman GA, Khurana Hershey GK (enero de 2011). "Un papel no redundante del Serpinb3a de ratón en la inducción de la producción de moco en el asma". La Revista de Alergia e Inmunología Clínica . 127 (1): 254–61, 261.e1–6. doi :10.1016/j.jaci.2010.10.009. PMC 3058372 . PMID 21126757.
- ^ Schick C, Kamachi Y, Bartuski AJ, Cataltepe S, Schechter NM, Pemberton PA, Silverman GA (enero de 1997). "El antígeno 2 del carcinoma de células escamosas es una nueva serpina que inhibe las proteinasas similares a la quimotripsina catepsina G y la quimasa de los mastocitos". The Journal of Biological Chemistry . 272 (3): 1849–1855. doi : 10.1074/jbc.272.3.1849 . PMID 8999871.
- ^ Teoh SS, Whisstock JC, Bird PI (abril de 2010). "Maspin (SERPINB5) es una serpina intracelular obligada". The Journal of Biological Chemistry . 285 (14): 10862–10869. doi : 10.1074/jbc.M109.073171 . PMC 2856292 . PMID 20123984.
- ^ Zou Z, Anisowicz A, Hendrix MJ, Thor A, Neveu M, Sheng S, Rafidi K, Seftor E, Sager R (enero de 1994). "Maspin, una serpina con actividad supresora de tumores en células epiteliales mamarias humanas". Science . 263 (5146): 526–529. Bibcode :1994Sci...263..526Z. doi :10.1126/science.8290962. PMID 8290962.
- ^ abc Teoh SS, Vieusseux J, Prakash M, Berkowicz S, Luu J, Bird CH, Law RH, Rosado C, Price JT, Whisstock JC, Bird PI (2014). "Maspin no es necesario para el desarrollo embrionario o la supresión tumoral". Nature Communications . 5 : 3164. Bibcode :2014NatCo...5.3164T. doi :10.1038/ncomms4164. PMC 3905777 . PMID 24445777.
- ^ Gao F, Shi HY, Daughty C, Cella N, Zhang M (abril de 2004). "Maspin desempeña un papel esencial en el desarrollo embrionario temprano". Desarrollo . 131 (7): 1479–1489. doi : 10.1242/dev.01048 . PMID 14985257.
- ^ Scott FL, Hirst CE, Sun J, Bird CH, Bottomley SP, Bird PI (marzo de 1999). "El inhibidor intracelular de la serpina proteinasa 6 se expresa en monocitos y granulocitos y es un potente inhibidor de la proteasa de gránulos azurófilos, catepsina G". Blood . 93 (6): 2089–2097. doi :10.1182/blood.V93.6.2089.406k10_2089_2097. PMID 10068683.
- ^ Tan J, Prakash MD, Kaiserman D, Bird PI (julio de 2013). "La ausencia de SERPINB6A provoca pérdida auditiva neurosensorial con múltiples histopatologías en el oído interno del ratón". The American Journal of Pathology . 183 (1): 49–59. doi :10.1016/j.ajpath.2013.03.009. PMID 23669344.
- ^ Scarff KL, Ung KS, Nandurkar H, Crack PJ, Bird CH, Bird PI (mayo de 2004). "La interrupción dirigida de SPI3/Serpinb6 no produce defectos de desarrollo o crecimiento, disfunción leucocitaria o susceptibilidad a accidentes cerebrovasculares". Biología molecular y celular . 24 (9): 4075–4082. doi :10.1128/MCB.24.9.4075-4082.2004. PMC 387772 . PMID 15082799.
- ^ Sirmaci A, Erbek S, Price J, Huang M, Duman D, Cengiz FB, Bademci G, Tokgöz-Yilmaz S, Hişmi B, Ozdağ H, Oztürk B, Kulaksizoğlu S, Yildirim E, Kokotas H, Grigoriadou M, Petersen MB, Shahin H, Kanaan M, King MC, Chen ZY, Blanton SH, Liu XZ, Zuchner S, Akar N, Tekin M (mayo de 2010). "Una mutación truncada en SERPINB6 está asociada con pérdida auditiva neurosensorial autosómica recesiva no sindrómica". American Journal of Human Genetics . 86 (5): 797–804. doi :10.1016/j.ajhg.2010.04.004. PMC 2869020 . Número de modelo: PMID20451170.
- ^ Miyata T, Inagi R, Nangaku M, Imasawa T, Sato M, Izuhara Y, Suzuki D, Yoshino A, Onogi H, Kimura M, Sugiyama S, Kurokawa K (marzo de 2002). "La sobreexpresión de la serpina megsina induce la proliferación y expansión progresiva de las células mesangiales". The Journal of Clinical Investigation . 109 (5): 585–593. doi :10.1172/JCI14336. PMC 150894 . PMID 11877466.
- ^ ab Miyata T, Li M, Yu X, Hirayama N (mayo de 2007). "Gen de la megsina: su análisis genómico, funciones patobiológicas y perspectivas terapéuticas". Current Genomics . 8 (3): 203–208. doi :10.2174/138920207780833856. PMC 2435355 . PMID 18645605.
- ^ Kubo A (agosto de 2014). "Queratosis palmoplantar tipo Nagashima: un tipo asiático común causado por deficiencia del inhibidor de la proteasa SERPINB7". The Journal of Investigative Dermatology . 134 (8): 2076–2079. doi : 10.1038/jid.2014.156 . PMID 25029323.
- ^ Dahlen JR, Jean F, Thomas G, Foster DC, Kisiel W (enero de 1998). "Inhibición de furina recombinante soluble por el inhibidor de la proteinasa humana 8". The Journal of Biological Chemistry . 273 (4): 1851–1854. doi : 10.1074/jbc.273.4.1851 . PMID 9442015.
- ^ Sun J, Bird CH, Sutton V, McDonald L, Coughlin PB, De Jong TA, Trapani JA, Bird PI (noviembre de 1996). "Un inhibidor de la granzima B citosólica relacionado con el modificador de la respuesta a las citocinas del regulador apoptótico viral A está presente en los linfocitos citotóxicos". The Journal of Biological Chemistry . 271 (44): 27802–27809. doi : 10.1074/jbc.271.44.27802 . PMID 8910377.
- ^ Zhang M, Park SM, Wang Y, Shah R, Liu N, Murmann AE, Wang CR, Peter ME, Ashton-Rickardt PG (abril de 2006). "El inhibidor de la serina proteasa 6 protege a las células T citotóxicas de las lesiones autoinfligidas al garantizar la integridad de los gránulos citotóxicos". Inmunidad . 24 (4): 451–461. doi : 10.1016/j.immuni.2006.02.002 . PMID 16618603.
- ^ Rizzitelli A, Meuter S, Vega Ramos J, Bird CH, Mintern JD, Mangan MS, Villadangos J, Bird PI (octubre de 2012). "Los ratones deficientes en Serpinb9 (Spi6) presentan deficiencias en la presentación cruzada de antígenos mediada por células dendríticas". Inmunología y biología celular . 90 (9): 841–851. doi :10.1038/icb.2012.29. PMID 22801574. S2CID 39276036.
- ^ Riewald M, Chuang T, Neubauer A, Riess H, Schleef RR (febrero de 1998). "Expresión de bomapin, una nueva serpina humana, en la hematopoyesis normal/maligna y en las líneas celulares monocíticas THP-1 y AML-193". Blood . 91 (4): 1256–1262. doi : 10.1182/blood.V91.4.1256 . PMID 9454755.
- ^ ab Askew DJ, Cataltepe S, Kumar V, Edwards C, Pace SM, Howarth RN, Pak SC, Askew YS, Brömme D, Luke CJ, Whisstock JC, Silverman GA (agosto de 2007). "SERPINB11 es una nueva serpina intracelular no inhibidora. Los polimorfismos de un solo nucleótido comunes en el andamiaje perjudican el cambio conformacional". The Journal of Biological Chemistry . 282 (34): 24948–24960. doi : 10.1074/jbc.M703182200 . PMID 17562709.
- ^ Finno CJ, Stevens C, Young A, Affolter V, Joshi NA, Ramsay S, Bannasch DL (abril de 2015). "Variante de cambio de marco de lectura de SERPINB11 asociada con un nuevo fenotipo específico de pezuña en ponis de Connemara". PLOS Genetics . 11 (4): e1005122. doi : 10.1371/journal.pgen.1005122 . PMC 4395385 . PMID 25875171.
- ^ Askew YS, Pak SC, Luke CJ, Askew DJ, Cataltepe S, Mills DR, Kato H, Lehoczky J, Dewar K, Birren B, Silverman GA (diciembre de 2001). "SERPINB12 es un nuevo miembro de la familia ov-serpina humana que se expresa ampliamente e inhibe las serina proteinasas similares a la tripsina". The Journal of Biological Chemistry . 276 (52): 49320–49330. doi : 10.1074/jbc.M108879200 . PMID 11604408.
- ^ Welss T, Sun J, Irving JA, Blum R, Smith AI, Whisstock JC, Pike RN, von Mikecz A, Ruzicka T, Bird PI, Abts HF (junio de 2003). "La hurpina es un inhibidor selectivo de la catepsina L lisosomal y protege a los queratinocitos de la apoptosis inducida por la luz ultravioleta". Bioquímica . 42 (24): 7381–7389. doi :10.1021/bi027307q. PMID 12809493.
- ^ Ishiguro K, Kojima T, Kadomatsu K, Nakayama Y, Takagi A, Suzuki M, Takeda N, Ito M, Yamamoto K, Matsushita T, Kusugami K, Muramatsu T, Saito H (octubre de 2000). "La deficiencia completa de antitrombina en ratones produce letalidad embrionaria". The Journal of Clinical Investigation . 106 (7): 873–878. doi :10.1172/JCI10489. PMC 517819 . PMID 11018075.
- ^ Patnaik MM, Moll S (noviembre de 2008). "Deficiencia hereditaria de antitrombina: una revisión". Haemophilia . 14 (6): 1229–1239. doi : 10.1111/j.1365-2516.2008.01830.x . PMID 19141163. S2CID 20768425.
- ^ Huntington JA (julio de 2011). "Estructura, función y disfunción de la serpina". Journal of Thrombosis and Haemostasis . 9 (Supl 1): 26–34. doi : 10.1111/j.1538-7836.2011.04360.x . PMID 21781239. S2CID 1020630.
- ^ Vicente CP, He L, Pavão MS, Tollefsen DM (diciembre de 2004). "Actividad antitrombótica del sulfato de dermatán en ratones deficientes en cofactor II de heparina". Blood . 104 (13): 3965–3970. doi : 10.1182/blood-2004-02-0598 . PMID 15315969.
- ^ Aihara K, Azuma H, Akaike M, Ikeda Y, Sata M, Takamori N, Yagi S, Iwase T, Sumitomo Y, Kawano H, Yamada T, Fukuda T, Matsumoto T, Sekine K, Sato T, Nakamichi Y, Yamamoto Y, Yoshimura K, Watanabe T, Nakamura T, Oomizu A, Tsukada M, Hayashi H, Sudo T, Kato S, Matsumoto T (junio de 2007). "Letalidad embrionaria dependiente de la cepa y remodelación vascular exagerada en ratones con deficiencia de cofactor II de heparina". La Revista de Investigación Clínica . 117 (6): 1514-1526. doi :10.1172/JCI27095. PMC 1878511 . PMID 17549254.
- ^ Cale JM, Lawrence DA (septiembre de 2007). "Relaciones estructura-función del inhibidor del activador del plasminógeno-1 y su potencial como agente terapéutico". Current Drug Targets . 8 (9): 971–981. doi :10.2174/138945007781662337. PMID 17896949.
- ^ Lino MM, Atanasoski S, Kvajo M, Fayard B, Moreno E, Brenner HR, Suter U, Monard D (abril de 2007). "Los ratones que carecen de la proteasa nexina-1 muestran una recuperación estructural y funcional retardada después del aplastamiento del nervio ciático". The Journal of Neuroscience . 27 (14): 3677–3685. doi : 10.1523/JNEUROSCI.0277-07.2007 . PMC 6672422 . PMID 17409231.
- ^ Murer V, Spetz JF, Hengst U, Altrogge LM, de Agostini A, Monard D (marzo de 2001). "Defectos de fertilidad masculina en ratones que carecen del inhibidor de la proteasa serina nexina-1". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 98 (6): 3029–3033. Bibcode :2001PNAS...98.3029M. doi : 10.1073/pnas.051630698 . PMC 30601 . PMID 11248026.
- ^ Lüthi A, Van der Putten H, Botteri FM, Mansuy IM, Meins M, Frey U, Sansig G, Portet C, Schmutz M, Schröder M, Nitsch C, Laurent JP, Monard D (junio de 1997). "El inhibidor de serina proteasa endógeno modula la actividad epiléptica y la potenciación a largo plazo del hipocampo". La Revista de Neurociencia . 17 (12): 4688–4699. doi : 10.1523/JNEUROSCI.17-12-04688.1997 . PMC 6573330 . PMID 9169529.
- ^ ab Doll JA, Stellmach VM, Bouck NP, Bergh AR, Lee C, Abramson LP, Cornwell ML, Pins MR, Borensztajn J, Crawford SE (junio de 2003). "El factor derivado del epitelio pigmentario regula la vasculatura y la masa de la próstata y el páncreas". Nature Medicine . 9 (6): 774–780. doi :10.1038/nm870. PMID 12740569. S2CID 5967666.
- ^ Becerra SP, Perez-Mediavilla LA, Weldon JE, Locatelli-Hoops S, Senanayake P, Notari L, Notario V, Hollyfield JG (noviembre de 2008). "El factor derivado del epitelio pigmentario se une al ácido hialurónico. Mapeo de un sitio de unión del ácido hialurónico". The Journal of Biological Chemistry . 283 (48): 33310–33320. doi : 10.1074/jbc.M801287200 . PMC 2586245 . PMID 18805795.
- ^ Andreu-Agulló C, Morante-Redolat JM, Delgado AC, Fariñas I (diciembre de 2009). "El factor de nicho vascular PEDF modula la potencia dependiente de Notch en la zona subependimaria del adulto". Neurociencia de la Naturaleza . 12 (12): 1514-1523. doi :10.1038/nn.2437. PMID 19898467. S2CID 5332822.
- ^ Wiman B, Collen D (septiembre de 1979). "Sobre el mecanismo de la reacción entre la alfa 2-antiplasmina humana y la plasmina". The Journal of Biological Chemistry . 254 (18): 9291–9297. doi : 10.1016/S0021-9258(19)86843-6 . PMID 158022.
- ^ Lijnen HR, Okada K, Matsuo O, Collen D, Dewerchin M (abril de 1999). "La deficiencia del gen de alfa2-antiplasmina en ratones se asocia con un potencial fibrinolítico mejorado sin sangrado evidente". Blood . 93 (7): 2274–2281. doi :10.1182/blood.V93.7.2274. PMID 10090937.
- ^ Carpenter SL, Mathew P (noviembre de 2008). "Alfa2-antiplasmina y su deficiencia: fibrinólisis desequilibrada". Haemophilia . 14 (6): 1250–1254. doi : 10.1111/j.1365-2516.2008.01766.x . PMID 19141165. S2CID 205295156.
- ^ Favier R, Aoki N, de Moerloose P (julio de 2001). "Deficiencias congénitas del inhibidor de la alfa(2)-plasmina: una revisión". British Journal of Haematology . 114 (1): 4–10. doi : 10.1046/j.1365-2141.2001.02845.x . PMID 11472338. S2CID 71010865.
- ^ Beinrohr L, Harmat V, Dobó J, Lörincz Z, Gál P, Závodszky P (julio de 2007). "La estructura del dominio serpin del inhibidor de C1 revela el mecanismo probable de potenciación de la heparina y enfermedad conformacional". The Journal of Biological Chemistry . 282 (29): 21100–21109. doi : 10.1074/jbc.M700841200 . hdl : 10831/92835 . PMID 17488724.
- ^ Mollnes TE, Jokiranta TS, Truedsson L, Nilsson B, Rodriguez de Cordoba S, Kirschfink M (septiembre de 2007). "Análisis del complemento en el siglo XXI". Inmunología molecular . 44 (16): 3838–3849. doi :10.1016/j.molimm.2007.06.150. hdl : 10261/61732 . PMID 17768101.
- ^ Triggianese P, Chimenti MS, Toubi E, Ballanti E, Guarino MD, Perricone C, Perricone R (agosto de 2015). "El lado autoinmune del angioedema hereditario: perspectivas sobre la patogénesis". Autoimmunity Reviews . 14 (8): 665–669. doi :10.1016/j.autrev.2015.03.006. PMID 25827463.
- ^ Nagai N, Hosokawa M, Itohara S, Adachi E, Matsushita T, Hosokawa N, Nagata K (septiembre de 2000). "La letalidad embrionaria de ratones deficientes en la chaperona molecular hsp47 está asociada con defectos en la biosíntesis de colágeno". The Journal of Cell Biology . 150 (6): 1499–1506. doi :10.1083/jcb.150.6.1499. PMC 2150697 . PMID 10995453.
- ^ Marini JC, Reich A, Smith SM (agosto de 2014). "Osteogénesis imperfecta debida a mutaciones en genes no colagenosos: lecciones sobre la biología de la formación ósea". Current Opinion in Pediatrics . 26 (4): 500–507. doi :10.1097/MOP.0000000000000117. PMC 4183132 . PMID 25007323.
- ^ Byers PH, Pyott SM (1 de enero de 2012). "Formas heredadas recesivamente de osteogénesis imperfecta". Revisión anual de genética . 46 : 475–497. doi :10.1146/annurev-genet-110711-155608. PMID 23145505.
- ^ Osterwalder T, Cinelli P, Baici A, Pennella A, Krueger SR, Schrimpf SP, Meins M, Sonderegger P (enero de 1998). "El inhibidor de la serina proteinasa secretado axónicamente, la neuroserpina, inhibe los activadores del plasminógeno y la plasmina, pero no la trombina". The Journal of Biological Chemistry . 273 (4): 2312–2321. doi : 10.1074/jbc.273.4.2312 . PMID 9442076.
- ^ Crowther DC (julio de 2002). "Enfermedades conformacionales familiares y demencias". Human Mutation . 20 (1): 1–14. doi : 10.1002/humu.10100 . PMID 12112652. S2CID 22326349.
- ^ Belorgey D, Hägglöf P, Karlsson-Li S, Lomas DA (1 de marzo de 2007). "Plegamiento incorrecto de proteínas y serpinopatías". Prion . 1 (1): 15–20. doi :10.4161/pri.1.1.3974. PMC 2633702 . PMID 19164889.
- ^ Ozaki K, Nagata M, Suzuki M, Fujiwara T, Miyoshi Y, Ishikawa O, Ohigashi H, Imaoka S, Takahashi E, Nakamura Y (julio de 1998). "Aislamiento y caracterización de un nuevo gen específico del páncreas humano, pancpin, que se encuentra regulado a la baja en las células de cáncer de páncreas". Genes, cromosomas y cáncer . 22 (3): 179–185. doi :10.1002/(SICI)1098-2264(199807)22:3<179::AID-GCC3>3.0.CO;2-T. PMID 9624529. S2CID 9525421.
- ^ Loftus SK, Cannons JL, Incao A, Pak E, Chen A, Zerfas PM, Bryant MA, Biesecker LG, Schwartzberg PL, Pavan WJ (septiembre de 2005). "La apoptosis de células acinares en ratones deficientes en Serpini2 modela la insuficiencia pancreática". PLOS Genetics . 1 (3): e38. doi : 10.1371/journal.pgen.0010038 . PMC 1231717 . PMID 16184191.
- ^ Padua MB, Kowalski AA, Cañas MY, Hansen PJ (febrero de 2010). "La filogenia molecular de las serpinas uterinas y su relación con la evolución de la placentación". Revista FASEB . 24 (2): 526–537. doi : 10.1096/fj.09-138453 . PMID 19825977. S2CID 9248169.
- ^ Padua MB, Hansen PJ (octubre de 2010). "Evolución y función de las serpinas uterinas (SERPINA14)". Revista Estadounidense de Inmunología Reproductiva . 64 (4): 265–274. doi : 10.1111/j.1600-0897.2010.00901.x . PMID 20678169.
- ^ ab Reichhart JM (diciembre de 2005). "La punta de otro iceberg: las serpinas de Drosophila". Tendencias en biología celular . 15 (12): 659–665. doi :10.1016/j.tcb.2005.10.001. PMID 16260136.
- ^ Tang H, Kambris Z, Lemaitre B, Hashimoto C (octubre de 2008). "Una serpina que regula la melanización inmunitaria en el sistema respiratorio de Drosophila". Developmental Cell . 15 (4): 617–626. doi :10.1016/j.devcel.2008.08.017. PMC 2671232 . PMID 18854145.
- ^ Scherfer C, Tang H, Kambris Z, Lhocine N, Hashimoto C, Lemaitre B (noviembre de 2008). "Drosophila Serpin-28D regula la actividad de la fenoloxidasa de la hemolinfa y la pigmentación adulta". Biología del desarrollo . 323 (2): 189–196. doi : 10.1016/j.ydbio.2008.08.030 . PMID 18801354.
- ^ Rushlow C (enero de 2004). "Patrón dorsoventral: una serpina finalmente atrapada". Current Biology . 14 (1): R16–R18. Bibcode :2004CBio...14..R16R. doi : 10.1016/j.cub.2003.12.015 . PMID 14711428.
- ^ Ligoxygakis P, Roth S, Reichhart JM (diciembre de 2003). "Una serpina regula la formación del eje dorsal-ventral en el embrión de Drosophila". Current Biology . 13 (23): 2097–2102. Bibcode :2003CBio...13.2097L. doi : 10.1016/j.cub.2003.10.062 . PMID 14654000.
- ^ Jiang R, Zhang B, Kurokawa K, So YI, Kim EH, Hwang HO, Lee JH, Shiratsuchi A, Zhang J, Nakanishi Y, Lee HS, Lee BL (octubre de 2011). "El inhibidor de la serina proteasa de dominio doble de 93 kDa (Serpin) tiene una función reguladora en la cascada de señalización proteolítica Toll del escarabajo". The Journal of Biological Chemistry . 286 (40): 35087–35095. doi : 10.1074/jbc.M111.277343 . PMC 3186399 . PMID 21862574.
- ^ ab Pak SC, Kumar V, Tsu C, Luke CJ, Askew YS, Askew DJ, Mills DR, Brömme D, Silverman GA (abril de 2004). "SRP-2 es un inhibidor de clase cruzada que participa en el desarrollo postembrionario del nematodo Caenorhabditis elegans: caracterización inicial de las serpinas del clado L". The Journal of Biological Chemistry . 279 (15): 15448–15459. doi : 10.1074/jbc.M400261200 . PMID 14739286.
- ^ Luke CJ, Pak SC, Askew YS, Naviglia TL, Askew DJ, Nobar SM, Vetica AC, Long OS, Watkins SC, Stolz DB, Barstead RJ, Moulder GL, Brömme D, Silverman GA (septiembre de 2007). "Una serpina intracelular regula la necrosis inhibiendo la inducción y las secuelas de la lesión lisosomal". Cell . 130 (6): 1108–1119. doi :10.1016/j.cell.2007.07.013. PMC 2128786 . PMID 17889653.
- ^ Hejgaard J, Rasmussen SK, Brandt A, SvendsenI (1985). "Homología de secuencia entre la proteína Z del endospermo de la cebada y los inhibidores de la proteasa de la familia alfa-1-antitripsina". FEBS Lett . 180 (1): 89–94. Bibcode :1985FEBSL.180...89H. doi : 10.1016/0014-5793(85)80238-6 . S2CID 84790014.
- ^ Dahl SW, Rasmussen SK, Petersen LC, Hejgaard J (septiembre de 1996). "Inhibición de factores de coagulación por la serpina de cebada recombinante BSZx". FEBS Letters . 394 (2): 165–168. Bibcode :1996FEBSL.394..165D. doi : 10.1016/0014-5793(96)00940-4 . PMID 8843156.
- ^ Hejgaard J (enero de 2001). "Serpinas inhibidoras del grano de centeno con glutamina como residuos P1 y P2 en el centro reactivo". FEBS Letters . 488 (3): 149–153. Bibcode :2001FEBSL.488..149H. doi : 10.1016/S0014-5793(00)02425-X . PMID 11163762. S2CID 27933086.
- ^ Ostergaard H, Rasmussen SK, Roberts TH, Hejgaard J (octubre de 2000). "Serpinas inhibidoras del grano de trigo con centros reactivos que se asemejan a repeticiones ricas en glutamina de proteínas de almacenamiento de prolamina. Clonación y caracterización de cinco formas moleculares principales". The Journal of Biological Chemistry . 275 (43): 33272–33279. doi : 10.1074/jbc.M004633200 . PMID 10874043.
- ^ ab Yoo BC, Aoki K, Xiang Y, Campbell LR, Hull RJ, Xoconostle-Cázares B, Monzer J, Lee JY, Ullman DE, Lucas WJ (noviembre de 2000). "Caracterización de la serpina-1 del floema de Cucurbita maxima (CmPS-1). Un inhibidor de la elastasa regulado por el desarrollo". The Journal of Biological Chemistry . 275 (45): 35122–35128. doi : 10.1074/jbc.M006060200 . PMID 10960478.
- ^ la Cour Petersen M, Hejgaard J, Thompson GA, Schulz A (diciembre de 2005). "Las serpinas del floema de las cucurbitáceas son transmisibles por injerto y parecen ser resistentes al recambio en el complejo elemento criboso-célula acompañante". Journal of Experimental Botany . 56 (422): 3111–3120. doi : 10.1093/jxb/eri308 . PMID 16246856.
- ^ Roberts TH, Hejgaard J (febrero de 2008). "Serpinas en plantas y algas verdes". Genómica funcional e integradora . 8 (1): 1–27. doi :10.1007/s10142-007-0059-2. PMID 18060440. S2CID 22960858.
- ^ Lampl N, Alkan N, Davydov O, Fluhr R (mayo de 2013). "El control del punto de ajuste de la actividad de la proteasa RD21 por AtSerpin1 controla la muerte celular en Arabidopsis". The Plant Journal . 74 (3): 498–510. doi : 10.1111/tpj.12141 . PMID 23398119.
- ^ Ahn JW, Atwell BJ, Roberts TH (mayo de 2009). "Los genes de serpina AtSRP2 y AtSRP3 son necesarios para la sensibilidad del crecimiento normal a un agente alquilante de ADN en Arabidopsis". BMC Plant Biology . 9 : 52. doi : 10.1186/1471-2229-9-52 . PMC 2689219 . PMID 19426562.
- ^ ab Kang S, Barak Y, Lamed R, Bayer EA, Morrison M (junio de 2006). "El repertorio funcional de los celulosomas procariotas incluye la superfamilia de serpinas de inhibidores de la serina proteinasa". Microbiología molecular . 60 (6): 1344–1354. doi : 10.1111/j.1365-2958.2006.05182.x . PMID 16796673. S2CID 23738804.
- ^ Irving JA, Cabrita LD, Rossjohn J, Pike RN, Bottomley SP, Whisstock JC (abril de 2003). "La estructura cristalina de 1,5 A de una serpina procariota: control del cambio conformacional en un entorno calentado". Structure . 11 (4): 387–397. doi : 10.1016/S0969-2126(03)00057-1 . PMID 12679017.
- ^ Fulton KF, Buckle AM, Cabrita LD, Irving JA, Butcher RE, Smith I, Reeve S, Lesk AM, Bottomley SP, Rossjohn J, Whisstock JC (marzo de 2005). "La estructura cristalina de alta resolución de una serpina termoestable nativa revela el complejo mecanismo que sustenta la transición de estresada a relajada". The Journal of Biological Chemistry . 280 (9): 8435–8442. doi : 10.1074/jbc.M410206200 . PMID 15590653.
- ^ Turner PC, Moyer RW (septiembre de 2002). "Moduladores inmunitarios del virus de la viruela: perspectivas funcionales a partir de modelos animales". Virus Research . 88 (1–2): 35–53. doi :10.1016/S0168-1702(02)00119-3. PMID 12297326.
- ^ ab Richardson J, Viswanathan K, Lucas A (enero de 2006). "Serpinas, vasculatura y terapias virales". Frontiers in Bioscience . 11 : 1042–1056. doi : 10.2741/1862 . PMID 16146796.
- ^ Jiang J, Arp J, Kubelik D, Zassoko R, Liu W, Wise Y, Macaulay C, Garcia B, McFadden G, Lucas AR, Wang H (noviembre de 2007). "La inducción de supervivencia indefinida del injerto cardíaco se correlaciona con la regulación negativa de los receptores tipo Toll 2 y 4 después del tratamiento con inhibidor de la serina proteasa-1 (Serp-1)". Trasplante . 84 (9): 1158–1167. doi : 10.1097/01.tp.0000286099.50532.b0 . PMID 17998872. S2CID 20168458.
- ^ Dai E, Guan H, Liu L, Little S, McFadden G, Vaziri S, Cao H, Ivanova IA, Bocksch L, Lucas A (mayo de 2003). "Serp-1, una serpina antiinflamatoria viral, regula las respuestas de la serpina y la serina proteinasa celular a la lesión vascular". The Journal of Biological Chemistry . 278 (20): 18563–18572. doi : 10.1074/jbc.M209683200 . PMID 12637546.
- ^ Turner PC, Sancho MC, Thoennes SR, Caputo A, Bleackley RC, Moyer RW (agosto de 1999). "El Serp2 del virus mixoma es un inhibidor débil de la granzima B y de la enzima convertidora de interleucina-1 beta in vitro y, a diferencia de CrmA, no puede bloquear la apoptosis en células infectadas por el virus de la viruela bovina". Journal of Virology . 73 (8): 6394–6404. doi :10.1128/JVI.73.8.6394-6404.1999. PMC 112719 . PMID 10400732.
- ^ Munuswamy-Ramanujam G, Khan KA, Lucas AR (diciembre de 2006). "Reactivos antiinflamatorios virales: el potencial para el tratamiento de trastornos artríticos y vasculíticos". Objetivos farmacológicos para trastornos endocrinos, metabólicos e inmunológicos . 6 (4): 331–343. doi :10.2174/187153006779025720. PMID 17214579.
- ^ Renatus M, Zhou Q, Stennicke HR, Snipas SJ, Turk D, Bankston LA, Liddington RC, Salvesen GS (julio de 2000). "Estructura cristalina del supresor apoptótico CrmA en su forma escindida". Structure . 8 (7): 789–797. doi : 10.1016/S0969-2126(00)00165-9 . PMID 10903953.
Enlaces externos
- Molécula del mes de PDB Serpin
- Claudicación por inhibidor de la proteasa Merops (familia I4) Archivado el 8 de diciembre de 2016 en Wayback Machine.
- Serpinas en los encabezamientos de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Laboratorio James Whisstock en la Universidad de Monash
- Laboratorio de Jim Huntington Archivado el 30 de octubre de 2016 en Wayback Machine en la Universidad de Cambridge
- Laboratorio de Frank Church en la Universidad de Carolina del Norte en Chapel Hill
- Laboratorio Paul Declerck en la Katholieke Universiteit Leuven
- Laboratorio de Tom Roberts en la Universidad de Sydney
- Laboratorio Robert Fluhr en el Instituto de Ciencias Weizmann
- Laboratorio de Peter Gettins en la Universidad de Illinois en Chicago
- Resumen de toda la información estructural disponible en el PDB para UniProt : P01009 (Alfa-1-antitripsina humana) en el PDBe-KB .

