Gradiente electroquímico

Un gradiente electroquímico es un gradiente de potencial electroquímico , generalmente para un ion que puede moverse a través de una membrana . El gradiente consta de dos partes:
- El gradiente químico o diferencia en la concentración de soluto a través de una membrana.
- El gradiente eléctrico o diferencia de carga a través de una membrana.
Cuando hay concentraciones desiguales de un ion a través de una membrana permeable, el ion se moverá a través de la membrana desde el área de mayor concentración al área de menor concentración a través de la difusión simple . Los iones también llevan una carga eléctrica que forma un potencial eléctrico a través de una membrana. Si hay una distribución desigual de cargas a través de la membrana, entonces la diferencia en el potencial eléctrico genera una fuerza que impulsa la difusión de iones hasta que las cargas se equilibran en ambos lados de la membrana.
Los gradientes electroquímicos son esenciales para el funcionamiento de las baterías y otras celdas electroquímicas , la fotosíntesis y la respiración celular , y ciertos otros procesos biológicos.
Descripción general
La energía electroquímica es una de las muchas formas intercambiables de energía potencial a través de las cuales se puede conservar la energía . Aparece en la química electroanalítica y tiene aplicaciones industriales como baterías y celdas de combustible. En biología, los gradientes electroquímicos permiten que las células controlen la dirección en la que se mueven los iones a través de las membranas. En las mitocondrias y los cloroplastos , los gradientes de protones generan un potencial quimiosmótico que se utiliza para sintetizar ATP [ 1] y el gradiente de sodio-potasio ayuda a las sinapsis neuronales a transmitir información rápidamente. [ cita requerida ]
Un gradiente electroquímico tiene dos componentes: una concentración diferencial de carga eléctrica a través de una membrana y una concentración diferencial de especies químicas a través de esa misma membrana. En el primer efecto, la carga concentrada atrae cargas del signo opuesto; en el segundo, las especies concentradas tienden a difundirse a través de la membrana hasta igualar las concentraciones. La combinación de estos dos fenómenos determina la dirección termodinámicamente preferida para el movimiento de un ion a través de la membrana. [2] : 403 [3]
El efecto combinado se puede cuantificar como un gradiente en el potencial electroquímico termodinámico : [ cita requerida ] con
- μ i el potencial químico de la especie i
- z i la carga por ion de la especie i
- F , constante de Faraday (el potencial electroquímico se mide implícitamente en términos de mol )
- φ , el potencial eléctrico local .
A veces, se utiliza incorrectamente el término "potencial electroquímico" para describir el potencial eléctrico generado por un gradiente de concentración iónica, es decir, φ .
Un gradiente electroquímico es análogo a la presión del agua a través de una presa hidroeléctrica . Las rutas desbloqueadas por la membrana (por ejemplo, proteínas de transporte de membrana o electrodos ) corresponden a turbinas que convierten la energía potencial del agua en otras formas de energía física o química, y los iones que pasan a través de la membrana corresponden al agua que viaja hacia el río inferior. [ tono ] Por el contrario, la energía se puede utilizar para bombear agua hacia el lago por encima de la presa , y la energía química se puede utilizar para crear gradientes electroquímicos. [4] [5]
Química
El término se aplica normalmente en electroquímica , cuando se utiliza energía eléctrica en forma de voltaje aplicado para modular la favorabilidad termodinámica de una reacción química . En una batería, un potencial electroquímico que surge del movimiento de iones equilibra la energía de reacción de los electrodos. El voltaje máximo que puede producir una reacción de batería a veces se denomina potencial electroquímico estándar de esa reacción.
Contexto biológico
La generación de un potencial eléctrico transmembrana a través del movimiento de iones a través de una membrana celular impulsa procesos biológicos como la conducción nerviosa , la contracción muscular , la secreción hormonal y la sensibilidad . Por convención, los voltajes fisiológicos se miden en relación con la región extracelular; una célula animal típica tiene un potencial eléctrico interno de (−70)–(−50) mV. [2] : 464
Un gradiente electroquímico es esencial para la fosforilación oxidativa mitocondrial . El paso final de la respiración celular es la cadena de transporte de electrones , compuesta por cuatro complejos incrustados en la membrana mitocondrial interna. Los complejos I, III y IV bombean protones desde la matriz hasta el espacio intermembrana (IMS); por cada par de electrones que ingresa a la cadena, diez protones se translocan al IMS. El resultado es un potencial eléctrico de más de200 mV . La energía resultante del flujo de protones de regreso a la matriz es utilizada por la ATP sintasa para combinar fosfato inorgánico y ADP . [6] [2] : 743–745
De manera similar a la cadena de transporte de electrones, las reacciones dependientes de la luz de la fotosíntesis bombean protones hacia el lumen de los tilacoideos de los cloroplastos para impulsar la síntesis de ATP. El gradiente de protones se puede generar a través de la fotofosforilación cíclica o no cíclica. De las proteínas que participan en la fotofosforilación no cíclica, el fotosistema II (PSII), la plastiquinona y el complejo citocromo b 6 f contribuyen directamente a generar el gradiente de protones. Por cada cuatro fotones absorbidos por el PSII, ocho protones se bombean hacia el lumen. [2] : 769–770
Varios otros transportadores y canales iónicos desempeñan un papel en la generación de un gradiente electroquímico de protones. Uno es TPK 3 , un canal de potasio que se activa por Ca 2+ y conduce K + desde el lumen del tilacoide hasta el estroma , lo que ayuda a establecer el campo eléctrico . Por otro lado, el antiportador de eflujo de K + electroneutral (KEA 3 ) transporta K + al lumen del tilacoide y H + al estroma, lo que ayuda a establecer el gradiente de pH . [7]
Gradientes de iones

Como los iones están cargados, no pueden atravesar las membranas celulares mediante difusión simple. Dos mecanismos diferentes pueden transportar los iones a través de la membrana: transporte activo o pasivo . [ cita requerida ]
Un ejemplo de transporte activo de iones es la Na + -K + -ATPasa (NKA). La NKA se alimenta de la hidrólisis del ATP en ADP y un fosfato inorgánico; por cada molécula de ATP hidrolizada, se transportan tres Na + al exterior y dos K + al interior de la célula. Esto hace que el interior de la célula sea más negativo que el exterior y más concretamente genera un potencial de membrana V membrana de aproximadamente-60 mV . [5]
Un ejemplo de transporte pasivo son los flujos de iones a través de los canales de Na + , K + , Ca2 + y Cl− . A diferencia del transporte activo, el transporte pasivo se alimenta de la suma aritmética de la ósmosis (un gradiente de concentración) y un campo eléctrico (el potencial transmembrana). Formalmente, el cambio de energía libre de Gibbs molar asociado con un transporte exitoso es [ cita requerida ] donde R representa la constante de los gases , T representa la temperatura absoluta , z es la carga por ion y F representa la constante de Faraday . [2] : 464–465
En el ejemplo del Na + , ambos términos tienden a favorecer el transporte: el potencial eléctrico negativo dentro de la célula atrae al ion positivo y, dado que el Na + está concentrado fuera de la célula, la ósmosis favorece la difusión a través del canal de Na + hacia el interior de la célula. En el caso del K + , el efecto de la ósmosis se invierte: aunque los iones externos son atraídos por el potencial intracelular negativo, la entropía busca difundir los iones ya concentrados dentro de la célula. El fenómeno inverso (la ósmosis favorece el transporte, el potencial eléctrico se opone) puede lograrse para el Na + en células con potenciales transmembrana anormales: a+70 mV , el influjo de Na + se detiene; a potenciales más altos, se convierte en un eflujo. [ cita requerida ]
| Ion | Mamífero | Axón del calamar | S. cerevisiae | E. coli | Agua de mar | ||
|---|---|---|---|---|---|---|---|
| Celúla | Sangre | Celúla | Sangre | ||||
| K + | 100 - 140 | 4-5 | 400 | 10 - 20 | 300 | 30 - 300 | 10 |
| Na + | 5-15 | 145 | 50 | 440 | 30 | 10 | 500 |
| Mg2 + | 10 [a] 0,5 - 0,8 [b] | 1 - 1,5 | 50 | 30-100 [a] 0,01-1 [b] | 50 | ||
| Ca2 + | 10 −4 | 2,2 - 2,6 [c] 1,3 - 1,5 [d] | 10 −4 - 3×10 −4 | 10 | 2 | 3 [a] 10 −4 [b] | 10 |
| Cl − | 4 | 110 | 40 - 150 | 560 | 10 - 200 [e] | 500 | |
| X − (proteínas con carga negativa) | 138 | 9 | 300 - 400 | 5-10 | |||
| HCO3 − | 12 | 29 | |||||
| pH | 7.1 - 7.3 [12] | 7,35 a 7,45 [12] (pH normal de la sangre arterial) 6,9 - 7,8 [12] (rango general) | 7.2 - 7.8 [13] | 8.1 - 8.2 [14] | |||
- ^ abc Encuadernado
- ^ abc Gratis
- ^ Total
- ^ Ionizado
- ^ Depende del medio
Gradientes de protones
Los gradientes de protones, en particular, son importantes en muchos tipos de células como una forma de almacenamiento de energía. El gradiente se utiliza habitualmente para impulsar la ATP sintasa, la rotación flagelar o el transporte de metabolitos . [15] Esta sección se centrará en tres procesos que ayudan a establecer gradientes de protones en sus respectivas células: bacteriorodopsina y fotofosforilación no cíclica y fosforilación oxidativa. [ cita requerida ]
Bacteriorodopsina

La forma en que la bacteriorrodopsina genera un gradiente de protones en Archaea es a través de una bomba de protones . La bomba de protones depende de los transportadores de protones para impulsar protones desde el lado de la membrana con una baja concentración de H + al lado de la membrana con una alta concentración de H + . En la bacteriorrodopsina, la bomba de protones se activa por la absorción de fotones de longitud de onda de 568 nm , lo que conduce a la isomerización de la base de Schiff (SB) en la retina formando el estado K. Esto aleja a SB de Asp85 y Asp212, lo que provoca la transferencia de H + de la SB a Asp85 formando el estado M1. La proteína luego cambia al estado M2 separando Glu204 de Glu194 que libera un protón de Glu204 al medio externo. La SB es reprotonada por Asp96 que forma el estado N. Es importante que el segundo protón provenga de Asp96 ya que su estado desprotonado es inestable y se reprotona rápidamente con un protón del citosol . La protonación de Asp85 y Asp96 provoca la reisomerización del SB, formándose el estado O. Finalmente, la bacteriorrodopsina vuelve a su estado de reposo cuando Asp85 libera su protón a Glu204. [15] [16]
Fotofosforilación
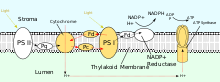
El PSII también depende de la luz para impulsar la formación de gradientes de protones en los cloroplastos, sin embargo, el PSII utiliza química redox vectorial para lograr este objetivo. En lugar de transportar físicamente protones a través de la proteína, las reacciones que requieren la unión de protones ocurrirán en el lado extracelular, mientras que las reacciones que requieren la liberación de protones ocurrirán en el lado intracelular. La absorción de fotones de longitud de onda de 680 nm se utiliza para excitar dos electrones en P 680 a un nivel de energía más alto. Estos electrones de mayor energía se transfieren a la plastoquinona unida a la proteína (PQ A ) y luego a la plastoquinona no unida (PQ B ). Esto reduce la plastoquinona (PQ) a plastoquinol (PQH 2 ) que se libera del PSII después de ganar dos protones del estroma. Los electrones en P 680 se reponen oxidando agua a través del complejo generador de oxígeno (OEC). Esto produce la liberación de O 2 y H + en el lumen, para una reacción total de [15]
Después de ser liberado del PSII, el PQH 2 viaja al complejo citocromo b 6 f , que luego transfiere dos electrones del PQH 2 a la plastocianina en dos reacciones separadas. El proceso que ocurre es similar al ciclo Q en el complejo III de la cadena de transporte de electrones. En la primera reacción, el PQH 2 se une al complejo en el lado del lumen y un electrón se transfiere al centro de hierro-azufre que luego lo transfiere al citocromo f que luego lo transfiere a la plastocianina. El segundo electrón se transfiere al hemo b L que luego lo transfiere al hemo b H que luego lo transfiere a PQ. En la segunda reacción, un segundo PQH 2 se oxida, agregando un electrón a otra plastocianina y PQ. Ambas reacciones juntas transfieren cuatro protones al lumen. [2] : 782–783 [17]
Fosforilación oxidativa

En la cadena de transporte de electrones, el complejo I (CI) cataliza la reducción de ubiquinona (UQ) a ubiquinol (UQH 2 ) mediante la transferencia de dos electrones del dinucleótido de nicotinamida y adenina reducido (NADH) que transloca cuatro protones desde la matriz mitocondrial al IMS: [18]
El complejo III (CIII) cataliza el ciclo Q. El primer paso implica la transferencia de dos electrones desde el UQH 2 reducido por CI a dos moléculas de citocromo c oxidado en el sitio Q o . En el segundo paso, dos electrones más reducen el UQ a UQH 2 en el sitio Q i . La reacción total es: [18]
El complejo IV (CIV) cataliza la transferencia de dos electrones del citocromo c reducido por CIII a la mitad de un oxígeno completo. Para utilizar un oxígeno completo en la fosforilación oxidativa se requiere la transferencia de cuatro electrones. El oxígeno consumirá entonces cuatro protones de la matriz para formar agua, mientras que otros cuatro protones se bombean al IMS para dar una reacción total [18].
Véase también
Referencias
- ^ Nath, Sunil; Villadsen, John (1 de marzo de 2015). "Revisión de la fosforilación oxidativa". Biotecnología y bioingeniería . 112 (3): 429–437. doi :10.1002/bit.25492. ISSN 1097-0290. PMID 25384602. S2CID 2598635.
- ^ abcdef Nelson, David; Cox, Michael (2013). Principios de bioquímica de Lehninger . Nueva York: WH Freeman. ISBN 978-1-4292-3414-6.
- ^ Yang, Huanghe; Zhang, Guohui; Cui, Jianmin (1 de enero de 2015). "Canales BK: múltiples sensores, una puerta de activación". Frontiers in Physiology . 6 : 29. doi : 10.3389/fphys.2015.00029 . PMC 4319557 . PMID 25705194.
- ^ Shattock, Michael J.; Ottolia, Michela; Bers, Donald M.; Blaustein, Mordecai P.; Boguslavskyi, Andrii; Bossuyt, Julie; Bridge, John HB; Chen-Izu, Ye; Clancy, Colleen E. (15 de marzo de 2015). "Intercambio de Na+/Ca2+ y Na+/K+-ATPasa en el corazón". Revista de fisiología . 593 (6): 1361–1382. doi :10.1113/jphysiol.2014.282319. ISSN 1469-7793. PMC 4376416 . PMID 25772291.
- ^ ab Aperia, Anita; Akkuratov, Evgeny E.; Fontana, Jacopo Maria; Brismar, Hjalmar (1 de abril de 2016). "Na+-K+-ATPasa, una nueva clase de receptores de membrana plasmática". Revista estadounidense de fisiología. Fisiología celular . 310 (7): C491–C495. doi : 10.1152/ajpcell.00359.2015 . ISSN 0363-6143. PMID 26791490.
- ^ Poburko, Damon; Demaurex, Nicolas (24 de abril de 2012). "Regulación del gradiente de protones mitocondriales mediante señales de Ca2+ citosólicas" (PDF) . Pflügers Archiv: Revista Europea de Fisiología . 464 (1): 19–26. doi :10.1007/s00424-012-1106-y. ISSN 0031-6768. PMID 22526460. S2CID 18133149.
- ^ Höhner, Ricarda; Aboukila, Ali; Kunz, Hans-Henning; Venema, Kees (1 de enero de 2016). "Gradientes de protones y procesos de transporte dependientes de protones en el cloroplasto". Frontiers in Plant Science . 7 : 218. doi : 10.3389/fpls.2016.00218 . PMC 4770017 . PMID 26973667.
- ^ Philips, Ron Milo & Ron. «» ¿Cuáles son las concentraciones de diferentes iones en las células?» . Consultado el 7 de junio de 2019 .
- ^ Lodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James (2000). "Tabla 15-1, Concentraciones típicas de iones en invertebrados y vertebrados". www.ncbi.nlm.nih.gov . Consultado el 7 de junio de 2019 .
- ^ "La siguiente tabla da una idea de las concentraciones de iones intra y extracelulares en un axón de calamar y una célula de mamífero". www.chm.bris.ac.uk . Consultado el 7 de junio de 2019 .
- ^ Diem K, Lenter C. Scientific Tables . Vol. 565 (Séptima edición). Basilea: Ciba-Geigy Limited. págs. 653–654. ISBN 978-3-9801244-0-9.
- ^ abc Spitzer, Kenneth W.; Vaughan-Jones, Richard D. (2003), Karmazyn, Morris; Avkiran, Metin; Fliegel, Larry (eds.), "Regulación del pH intracelular en células de mamíferos", El intercambiador de sodio-hidrógeno: de molécula a su papel en la enfermedad , Springer US, págs. 1–15, doi :10.1007/978-1-4615-0427-6_1, ISBN 9781461504276
- ^ Slonczewski, Joan L.; Wilks, Jessica C. (1 de agosto de 2007). "pH del citoplasma y periplasma de Escherichia coli: medición rápida mediante fluorimetría de proteína fluorescente verde". Journal of Bacteriology . 189 (15): 5601–5607. doi :10.1128/JB.00615-07. ISSN 0021-9193. PMC 1951819 . PMID 17545292.
- ^ Brewer, Peter G. (1 de septiembre de 2008). "Aumento de la acidez en el océano: el otro problema del CO2". doi :10.1038/scientificamericanearth0908-22.
{{cite journal}}: Requiere citar revista|journal=( ayuda ) - ^ abc Artillero, SEÑOR; Amin, Mahoma; Zhu, Xuyu; Lu, Jianxun (1 de agosto de 2013). "Mecanismos moleculares para generar gradientes de protones transmembrana". Biochimica et Biophysica Acta (BBA) - Bioenergética . Metales en Sistemas Bioenergéticos y Biomiméticos. 1827 (8–9): 892–913. doi :10.1016/j.bbabio.2013.03.001. PMC 3714358 . PMID 23507617.
- ^ Wickstrand, Cecilia; Dods, Robert; Royant, Antoine; Neutze, Richard (1 de marzo de 2015). "Bacteriorrodopsina: ¿Podrían ponerse de pie los intermediarios estructurales reales?". Biochimica et Biophysica Acta (BBA) - Temas generales . Bioquímica estructural y biofísica de proteínas de membrana. 1850 (3): 536–553. doi : 10.1016/j.bbagen.2014.05.021 . PMID 24918316.
- ^ Schöttler, Mark Aurel; Tóth, Szilvia Z.; Boulouis, Alix; Kahlau, Sabine (1 de mayo de 2015). "Dinámica de la estequiometría del complejo fotosintético en plantas superiores: biogénesis, función y recambio de la ATP sintasa y el complejo citocromo b 6 f". Journal of Experimental Botany . 66 (9): 2373–2400. doi : 10.1093/jxb/eru495 . ISSN 0022-0957. PMID 25540437.
- ^ abc Sun, Fei; Zhou, Qiangjun; Pang, Xiaoyun; Xu, Yingzhi; Rao, Zihe (1 de agosto de 2013). "Revelando diversos acoplamientos de transferencia de electrones y bombeo de protones en la cadena respiratoria mitocondrial". Current Opinion in Structural Biology . 23 (4): 526–538. doi :10.1016/j.sbi.2013.06.013. PMID 23867107.
- Campbell y Reece (2005). Biología . Pearson Benjamin Cummings. ISBN 978-0-8053-7146-8.
- Stephen T. Abedon, "Palabras y conceptos importantes del Capítulo 8, Campbell & Reece, 2002 (14/01/2005)", para Biología 113 en la Universidad Estatal de Ohio






