Organosulfato

En la química de los organosulfurados , los organosulfatos son una clase de compuestos orgánicos que comparten un grupo funcional común con la estructura R−O−SO−3. El núcleo SO 4 es un grupo sulfato y el grupo R es cualquier residuo orgánico . Todos los organosulfatos son formalmente ésteres derivados de alcoholes y ácido sulfúrico ( H 2 SO 4 ), aunque muchos no se preparan de esta manera. Muchos ésteres de sulfato se utilizan en detergentes y algunos son reactivos útiles . Los alquilsulfatos constan de una cadena de hidrocarburo hidrófoba , un grupo sulfato polar (que contiene un anión) y un catión o amina para neutralizar el grupo sulfato. Los ejemplos incluyen: lauril sulfato de sodio (también conocido como sal sódica del éster mono dodecílico del ácido sulfúrico) y sales de potasio y amonio relacionadas.
Aplicaciones
Los sulfatos de alquilo se utilizan comúnmente como surfactantes aniónicos en jabones líquidos y detergentes utilizados para limpiar lana, como limpiadores de superficies y como ingredientes activos en detergentes para ropa, champús y acondicionadores. También se pueden encontrar en productos para el hogar como pasta de dientes, antiácidos, cosméticos y alimentos. Generalmente se encuentran en productos de consumo en concentraciones que van del 3 al 20%. En 2003 se utilizaron aproximadamente 118.000 t/a de sulfatos de alquilo en los EE. UU. [1]
Organosulfatos sintéticos
Un ejemplo común es el lauril sulfato de sodio , con la fórmula CH 3 (CH 2 ) 11 OSO 3 Na. También son comunes en productos de consumo los ésteres de sulfato de alcoholes grasos etoxilados , como los derivados del alcohol laurílico . Un ejemplo es el lauril éter sulfato de sodio , un ingrediente de algunos cosméticos . [2]
El alquilsulfato se puede producir a partir de alcoholes, que a su vez se obtienen por hidrogenación de aceites y grasas animales o vegetales o mediante el proceso Ziegler o mediante síntesis oxo . Si se produce a partir de materias primas oleoquímicas o mediante el proceso Ziegler, la cadena de hidrocarburos del alcohol será lineal. Si se obtiene mediante el proceso oxo, aparecerá un bajo nivel de ramificación, generalmente con un grupo metilo o etilo en la posición C-2, que contiene cantidades pares e impares de cadenas alquílicas. [3] Estos alcoholes reaccionan con el ácido clorosulfúrico :
- ClSO3H + RCH2OH → RCH2OSO3H + HCl
Alternativamente, los alcoholes se pueden convertir en ésteres de semisulfato utilizando trióxido de azufre : [4]
- SO3 + RCH2OH → RCH2OSO3H
Rutas de laboratorio
Se pueden preparar organosulfatos especializados mediante la oxidación de fenoles con persulfato de Elbs y la oxidación de anilinas con Boyland-Sims .
Sulfatos de dialquilo

Una familia menos común de organosulfatos tiene la fórmula RO-SO 2 -OR'. Se preparan a partir de ácido sulfúrico y alcohol. Los principales ejemplos son el sulfato de dietilo y el sulfato de dimetilo , líquidos incoloros que se utilizan como reactivos en la síntesis orgánica . Estos compuestos son agentes alquilantes potencialmente peligrosos . Los dialquilsulfatos no se encuentran en la naturaleza. [5]
Ésteres de sulfato naturales
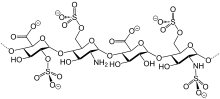
Existen varias clases de ésteres de sulfato en la naturaleza. Especialmente comunes son los derivados de azúcar como el sulfato de queratán , el sulfato de condroitina y el anticoagulante heparina . [6] Las modificaciones postraduccionales de algunas proteínas implican sulfatación, a menudo en el grupo fenol de los residuos de tirosina . [7] Un sulfato esteroide es el sulfato de estradiol , un precursor latente de la hormona estrógeno.
Una parte importante del azufre del suelo se encuentra en forma de ésteres de sulfato. [8]
Metabolismo
El sulfato es un anión inerte, por lo que la naturaleza lo activa mediante la formación de derivados éster de adenosina 5'-fosfosulfato (APS) y 3'-fosfoadenosina-5'-fosfosulfato (PAPS). Muchos organismos utilizan estas reacciones con fines metabólicos o para la biosíntesis de compuestos de azufre necesarios para la vida. [9] La formación e hidrólisis de ésteres de sulfato naturales son catalizadas por sulfatasas (también conocidas como sulfohidrolasas). [5]
Seguridad
Debido a que se utilizan ampliamente en productos comerciales, los aspectos de seguridad de los organosulfatos se investigan en profundidad. [10]
Salud humana
Los alquilsulfatos, si se ingieren, se absorben bien y se metabolizan en un sulfato C3, C4 o C5 y un metabolito adicional. El mayor irritante de los alquilsulfatos es el laurilsulfato de sodio, con un umbral antes de la irritación a una concentración del 20%. Los surfactantes en productos de consumo suelen estar mezclados, lo que reduce la probabilidad de irritación. Según la OCDE TG 406, no se encontró que los alquilsulfatos en estudios con animales fueran sensibilizadores de la piel. [10] [11]
Los estudios de laboratorio no han demostrado que los sulfatos de alquilo sean genotóxicos , mutagénicos o cancerígenos . No se han encontrado efectos reproductivos a largo plazo. [12]
Ambiente
El principal destino del sulfato de alquilo de los productos comerciales usados son las aguas residuales. Se ha medido que la concentración de sulfatos de alquilo en los efluentes de las plantas de tratamiento de aguas residuales (PTAR) es de 10 microgramos por litro (5,8 × 10 −9 oz/cu in) y menor. Los sulfatos de alquilo se biodegradan fácilmente, probablemente incluso antes de llegar a la PTAR. Una vez en la planta de tratamiento, se eliminan rápidamente por biodegradación . Se descubrió que los invertebrados son el grupo trófico más sensible a los sulfatos de alquilo. Se descubrió que el laurilsulfato de sodio probado en Uronema parduczi , un protozoo, tenía el valor de efecto más bajo, con una EC5 a las 20 h de 0,75 miligramos por litro (2,7 × 10 −8 lb/cu in). Las pruebas de exposición crónica con C 12 a C 18 con el invertebrado Ceriodaphnia dubia encontraron que la toxicidad más alta es con C 14 ( NOEC fue de 0,045 mg/L).
En términos de estabilidad térmica, los sulfatos de alquilo se degradan mucho antes de alcanzar su punto de ebullición debido a la baja presión de vapor (para C 8-18 de 10-11 a 10-15 hPa). La sorción del suelo es proporcional a la longitud de la cadena de carbono, y una longitud de 14 o más tiene la tasa de sorción más alta. Se ha encontrado que las concentraciones en el suelo varían de 0,0035 a 0,21 miligramos por kilogramo (5,6 × 10 −8 a 3,4 × 10 −6 oz/lb) de peso seco.
Referencias
- ^ CEH (octubre de 2004). «Tensioactivos, detergentes domésticos y sus materias primas». Informe de investigación de mercados del CEH .
- ^ Eduard Smulders, Wolfgang von Rybinski, Eric Sung, Wilfried Rähse, Josef Steber, Frederike Wiebel, Anette Nordskog "Detergentes para ropa" en la Enciclopedia de química industrial de Ullmann 2007, Wiley-VCH, Weinheim. doi :10.1002/14356007.a08_315.pub2.
- ^ Klaus Noweck, Wolfgang Grafahrend, "Alcoholes grasos" en la Enciclopedia de química industrial de Ullmann 2006, Wiley-VCH, Weinheim. doi :10.1002/14356007.a10_277.pub2
- ^ Holmberg, Krister (2019). "Surfactantes". Ullmann's Encyclopedia of Industrial Chemistry . págs. 1–56. doi :10.1002/14356007.a25_747.pub2. ISBN 978-3-527-30673-2.
- ^ ab Cleland, W. Wallace; Hengge, Alvan C. (2006). "Mecanismos enzimáticos de transferencia de fosfato y sulfato". Chemical Reviews . 106 (8): 3252–3278. doi :10.1021/cr050287o. PMID 16895327.
- ^ JW Fitzgerald (1976). "Formación e hidrólisis de ésteres de sulfato: un aspecto potencialmente importante, aunque a menudo ignorado, del ciclo del azufre en suelos aeróbicos". Bacteriological Reviews . 40 (3): 698–721. doi :10.1128/br.40.3.698-721.1976. PMC 413977 . PMID 791238.
- ^ Moore, Kevin L. (2003). "La biología y la enzimología de la o-sulfatación de la tirosina proteica". Journal of Biological Chemistry . 278 (27): 24243–24246. doi : 10.1074/jbc.R300008200 . PMID 12730193.
- ^ Scherer, HW (2001). "Azufre en la producción de cultivos: artículo invitado". Revista Europea de Agronomía . 14 (2): 81–111. doi :10.1016/S1161-0301(00)00082-4.
- ^ MT Madigan, JM Martinko, J. Parker "Biología de microorganismos de Brock" Prentice Hall, 1997. ISBN 0-13-520875-0 .
- ^ ab SDA/Alkylsulfate Consortium (2007). "SIDS Initial Assessment Profile. SIAM 25: Alkyl Sulfates, Alkane Sulfonates, and α-Olefin sulfonates" (PDF) . OCDE SIDS . Helsinki. Archivado desde el original (PDF) el 2016-03-03 . Consultado el 2011-10-14 .
- ^ DE/ICCA (2009). "Perfil de evaluación inicial de los SIDS SIAM 25: sulfatos de alquilo, sulfonatos de alcano y sulfonatos de α-olefina". OCDE .
- ^ Wibbertmann, A; Mangelsdorf, I.; Gamon, K.; Sedlak, R. (2011). "Propiedades toxicológicas y evaluación de riesgos de la categoría de surfactantes aniónicos: sulfatos de alquilo, sulfonatos de alcanos primarios y sulfonato de α-olefina". Ecotoxicología y seguridad ambiental . 74 (5): 1089–1106. doi :10.1016/j.ecoenv.2011.02.007. PMID 21463896.