Ácido fosfatídico
Los ácidos fosfatídicos son fosfolípidos aniónicos importantes para la señalización celular y la activación directa de los canales iónicos regulados por lípidos . La hidrólisis del ácido fosfatídico da lugar a una molécula de glicerol y otra de ácido fosfórico y a dos moléculas de ácidos grasos. Constituyen aproximadamente el 0,25 % de los fosfolípidos de la bicapa. [1]
Estructura

El ácido fosfatídico consta de una cadena principal de glicerol , con, en general, un ácido graso saturado unido al carbono -1, un ácido graso insaturado unido al carbono -2 y un grupo fosfato unido al carbono -3. [2] [3]
Formación y degradación
Además de la síntesis de novo, el PA se puede formar de tres maneras:
- Por la fosfolipasa D (PLD), a través de la hidrólisis del enlace PO de la fosfatidilcolina (PC) para producir PA y colina . [4]
- Por la fosforilación del diacilglicerol (DAG) por la DAG quinasa (DAGK).
- Por la acilación del ácido lisofosfatídico por la lisoPA-aciltransferasa (LPAAT); esta es la vía más común . [5]
La vía del glicerol 3-fosfato para la síntesis de novo de PA se muestra aquí:
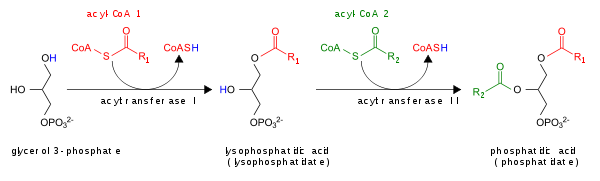
Además, el PA puede convertirse en DAG por las fosfohidrolasas de fosfato lipídico (LPP) [6] [7] o en liso-PA por la fosfolipasa A (PLA).
Roles en la célula
El papel del PA en la célula se puede dividir en tres categorías:
- El PA es el precursor de la biosíntesis de muchos otros lípidos.
- Las propiedades físicas del PA influyen en la curvatura de la membrana.
- El PA actúa como un lípido de señalización, reclutando proteínas citosólicas a las membranas apropiadas (por ejemplo, esfingosina quinasa 1 [8] ).
- El PA juega un papel muy importante en la fototransducción en Drosophila . [9]
- PA es un ligando lipídico que regula los canales iónicos. [10] Véase también canales iónicos regulados por lípidos .
Las tres primeras funciones no son mutuamente excluyentes. Por ejemplo, la PA puede estar involucrada en la formación de vesículas al promover la curvatura de la membrana y reclutar las proteínas para llevar a cabo la tarea, mucho más desfavorable desde el punto de vista energético, de formación del cuello y pinzamiento.
Funciones en la biosíntesis
El PA es un lípido celular vital que actúa como precursor biosintético para la formación (directa o indirectamente) de todos los lípidos de acilglicerol en la célula. [11]
En las células de mamíferos y levaduras , se conocen dos vías diferentes para la síntesis de novo de PA, la vía del glicerol 3-fosfato o la vía del fosfato de dihidroxiacetona. En las bacterias, solo está presente la primera vía, y las mutaciones que la bloquean son letales, lo que demuestra la importancia del PA. En las células de mamíferos y levaduras, donde las enzimas en estas vías son redundantes, la mutación de cualquier enzima no es letal. Sin embargo, vale la pena señalar que in vitro , las diversas aciltransferasas exhiben diferentes especificidades de sustrato con respecto a los acil-CoA que se incorporan al PA. Diferentes aciltransferasas también tienen diferentes distribuciones intracelulares, como el retículo endoplasmático (RE), las mitocondrias o los peroxisomas, y concentraciones locales de ácidos grasos activados. Esto sugiere que las diversas aciltransferasas presentes en las células de mamíferos y levaduras pueden ser responsables de producir diferentes grupos de PA. [11]
La conversión de PA en diacilglicerol (DAG) por las LPP es el paso de compromiso para la producción de fosfatidilcolina (PC), fosfatidiletanolamina (PE) y fosfatidilserina (PS). Además, el DAG también se convierte en CDP-DAG, que es un precursor del fosfatidilglicerol (PG), el fosfatidilinositol (PI) y los fosfoinosítidos (PIP, PIP 2 , PIP 3 ). [11]
Las concentraciones de PA se mantienen en niveles extremadamente bajos en la célula gracias a la actividad de potentes LPP [6] . Estas convierten el PA en DAG muy rápidamente y, como el DAG es el precursor de tantos otros lípidos, también se metaboliza rápidamente en otros lípidos de membrana. Esto significa que cualquier aumento en la producción de PA puede ir acompañado, con el tiempo, de un aumento correspondiente en las LPP y en las enzimas que metabolizan el DAG.
Por lo tanto, el PA es esencial para la síntesis de lípidos y la supervivencia celular, aunque, en condiciones normales, se mantiene en niveles muy bajos en la célula.
Propiedades biofísicas
El PA es un fosfolípido único porque tiene un pequeño grupo de cabeza altamente cargado que está muy cerca de la estructura principal de glicerol. Se sabe que el PA desempeña funciones tanto en la fisión de vesículas [12] como en la fusión [13] , y estas funciones pueden estar relacionadas con las propiedades biofísicas del PA.
En los sitios de gemación o fusión de la membrana, la membrana se vuelve o está muy curvada. Un evento importante en la gemación de vesículas, como los transportadores del Golgi , es la creación y el posterior estrechamiento del cuello de la membrana. Los estudios han sugerido que este proceso puede estar impulsado por lípidos y han postulado un papel central para DAG debido a su forma molecular, igualmente única. La presencia de dos cadenas de acilo pero ningún grupo de cabeza da como resultado una gran curvatura negativa en las membranas. [14]
El LPAAT BARS-50 también ha sido implicado en la gemación del Golgi. [12] Esto sugiere que la conversión de lisoPA en PA podría afectar la curvatura de la membrana. La actividad de LPAAT duplica el número de cadenas de acilo, aumentando en gran medida el área de la sección transversal del lípido que se encuentra "dentro" de la membrana mientras que el grupo de cabeza de la superficie permanece inalterado. Esto puede dar como resultado una curvatura de membrana más negativa. Investigadores de la Universidad de Utrecht han analizado el efecto de lisoPA frente a PA en la curvatura de la membrana midiendo el efecto que estos tienen en la temperatura de transición de PE de bicapas lipídicas a fases no lamelares utilizando 31 P-NMR. [15] Se demostró que la curvatura inducida por estos lípidos depende no solo de la estructura de lisoPA frente a PA, sino también de propiedades dinámicas, como la hidratación de los grupos de cabeza y las interacciones intermoleculares e intramoleculares. Por ejemplo, Ca 2+ puede interactuar con dos PA para formar un complejo neutro pero muy curvado. La neutralización de las cargas repulsivas de los grupos de cabeza y la ausencia de cualquier impedimento estérico permiten fuertes interacciones intermoleculares entre las cadenas de acilo, lo que resulta en microdominios ricos en PA. Por lo tanto, in vitro , los cambios fisiológicos en el pH, la temperatura y las concentraciones de cationes tienen fuertes efectos en la curvatura de la membrana inducida por PA y lisoPA. [15] La interconversión de lisoPA, PA y DAG, y los cambios en el pH y la concentración de cationes, pueden causar la flexión y desestabilización de la membrana, desempeñando un papel directo en la fisión de la membrana simplemente en virtud de sus propiedades biofísicas. Sin embargo, aunque se ha demostrado que PA y lisoPA afectan la curvatura de la membrana in vitro ; su papel in vivo no está claro.
Las funciones de lisoPA, PA y DAG en la promoción de la curvatura de la membrana no excluyen su función en el reclutamiento de proteínas a la membrana. Por ejemplo, el requerimiento de Ca 2+ para la fusión de liposomas complejos no se ve afectado en gran medida por la adición de anexina I, aunque se reduce con PLD. Sin embargo, con anexina I y PLD, el grado de fusión se mejora en gran medida y el requerimiento de Ca 2+ se reduce casi 1000 veces a niveles casi fisiológicos. [13]
Por lo tanto, las funciones metabólicas, biofísicas, de reclutamiento y de señalización del PA pueden estar interrelacionadas.
Papel en la señalización
El PA se mantiene bajo en la mayor parte de la membrana para estallar transitoriamente y señalizar localmente en alta concentración. [16] Por ejemplo, los canales TREK-1 se activan por asociación local con PLD y producción de PA. [17] La constante de disociación de PA para TREK-1 es aproximadamente 10 micromolar. [18] La unión relativamente débil combinada con una baja concentración de PA en la membrana permite que el canal se apague. La alta concentración local para la activación sugiere al menos algunas restricciones en la difusión local de lípidos. La baja concentración masiva de PA combinada con altas ráfagas locales es lo opuesto a la señalización PIP2. PIP2 se mantiene relativamente alto en la membrana y luego se hidroliza transitoriamente cerca de una proteína para reducir transitoriamente la señalización PIP2. [19] La señalización de PA refleja la señalización PIP2 en que la concentración masiva de lípido de señalización no necesita cambiar para ejercer un efecto local potente en una proteína objetivo.
Como se describió anteriormente, la PLD hidroliza la PC para formar PA y colina . Debido a que la colina es muy abundante en la célula, la actividad de la PLD no afecta significativamente los niveles de colina; y es poco probable que la colina desempeñe algún papel en la señalización. [ cita requerida ]
El papel de la activación de PLD en numerosos contextos de señalización, combinado con la falta de un papel para la colina, sugiere que el PA es importante en la señalización. Sin embargo, el PA se convierte rápidamente en DAG, y también se sabe que el DAG es una molécula de señalización. Esto plantea la pregunta de si el PA tiene algún papel directo en la señalización o si simplemente actúa como precursor para la producción de DAG. [20] [21] Si se descubre que el PA actúa solo como precursor de DAG, entonces se puede plantear la pregunta de por qué las células deberían producir DAG utilizando dos enzimas cuando contienen el PLC que podría producir DAG en un solo paso.
La PA producida por PLD o por DAGK se puede distinguir mediante la adición de [γ- 32 P]ATP. Esto mostrará si el grupo fosfato se deriva de la actividad de la quinasa o si se origina a partir de la PC. [22]
Aunque el PA y el DAG son interconvertibles, no actúan en las mismas vías. Los estímulos que activan el PLD no activan las enzimas que se encuentran aguas abajo del DAG, y viceversa. Por ejemplo, se ha demostrado que la adición de PLD a las membranas da como resultado la producción de PA marcado con [ 32P ] y de fosfoinosítidos marcados con [ 32P ]. [23] La adición de inhibidores de DAGK elimina la producción de PA marcado con [ 32P ], pero no la producción de fosfoinosítidos estimulada por el PLD.
Es posible que, aunque el PA y el DAG sean interconvertibles, se mantengan grupos separados de lípidos señalizadores y no señalizadores. Los estudios han sugerido que la señalización del DAG está mediada por el DAG poliinsaturado, mientras que el PA derivado de PLD es monoinsaturado o saturado. Por lo tanto, el PA saturado/monoinsaturado funcional se puede degradar hidrolizándolo para formar DAG saturado/monoinsaturado no funcional, mientras que el DAG poliinsaturado funcional se puede degradar convirtiéndolo en PA poliinsaturado no funcional. [20] [24]
Este modelo sugiere que los efectores de PA y DAG deberían ser capaces de distinguir lípidos con los mismos grupos de cabeza pero con diferentes cadenas de acilo. Aunque algunas proteínas de unión a lípidos son capaces de insertarse en las membranas y podrían reconocer hipotéticamente el tipo de cadena de acilo o las propiedades resultantes de la membrana, muchas proteínas de unión a lípidos son citosólicas y se localizan en la membrana uniéndose solo a los grupos de cabeza de los lípidos. Tal vez las diferentes cadenas de acilo puedan afectar el ángulo del grupo de cabeza en la membrana. Si este es el caso, sugiere que un dominio de unión de PA no solo debe ser capaz de unirse específicamente a PA, sino que también debe ser capaz de identificar aquellos grupos de cabeza que están en el ángulo correcto. Cualquiera que sea el mecanismo, dicha especificidad es posible. Se observa en la DAGK de los testículos de cerdo que es específica para DAG poliinsaturado [25] y en dos LPP de hepatocitos de rata que desfosforilan diferentes especies de PA con diferentes actividades. [26] Además, se ha demostrado que la estimulación de la actividad de SK1 por PS in vitro varía en gran medida según se utilicen especies de PS dioleoil (C18:1), diestearoil (C18:0) o 1-estearoil, 2-oleoil. [27] Por lo tanto, parece que, aunque PA y DAG son interconvertibles, las diferentes especies de lípidos pueden tener diferentes actividades biológicas; y esto puede permitir que los dos lípidos mantengan vías de señalización separadas.
Medición de la producción de PA
Como el PA se convierte rápidamente en DAG, su vida en la célula es muy corta. Esto significa que es difícil medir la producción de PA y, por lo tanto, estudiar el papel del PA en la célula. Sin embargo, la actividad de PLD se puede medir mediante la adición de alcoholes primarios a la célula. [28] Luego, la PLD lleva a cabo una reacción de transfosfatidilación, en lugar de hidrólisis, produciendo alcoholes fosfatidílicos en lugar de PA. Los alcoholes fosfatidílicos son puntos muertos metabólicos y se pueden extraer y medir fácilmente. Por lo tanto, se puede medir la actividad de PLD y la producción de PA (si no el PA en sí) y, al bloquear la formación de PA, se puede inferir la participación de PA en los procesos celulares.
Interactuadores de proteínas
Referencias
- ^ Welti, R; Li, W; Li, M; Sang, Y; Biesiada, H; Zhou, HE; Rajashekar, CB; Williams, TD; Wang, X (30 de agosto de 2002). "Perfilado de lípidos de membrana en respuestas de estrés de plantas. Función de la fosfolipasa D alfa en cambios lipídicos inducidos por congelación en Arabidopsis". The Journal of Biological Chemistry . 277 (35): 31994–2002. doi : 10.1074/jbc.M205375200 . PMID 12077151.
- ^ William W. Christie. «Ácido fosfatídico, ácido lisofosfatídico y lípidos relacionados». Archivado desde el original el 23 de octubre de 2004. Consultado el 5 de noviembre de 2009 .
- ^ Schroeder, R.; Londres, E.; Brown, D. (diciembre de 1994). "Las interacciones entre cadenas de acilo saturadas confieren resistencia a los detergentes a los lípidos y a las proteínas ancladas a glicosilfosfatidilinositol (GPI): las proteínas ancladas a GPI en liposomas y células muestran un comportamiento similar". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 91 (25): 12130–12134. Bibcode :1994PNAS...9112130S. doi : 10.1073/pnas.91.25.12130 . PMC 45390 . PMID 7991596.
- ^ Liscovitch M, Czarny M, Fiucci G, Tang X (febrero de 2000). "Fosfolipasa D: biología molecular y celular de una nueva familia de genes". Biochem. J. 345 ( 3): 401–15. doi :10.1042/0264-6021:3450401. PMC 1220771. PMID 10642495 .
- ↑ Devlin, TM 2004. Bioquímica , 4ª edición. Reverté, Barcelona. ISBN 84-291-7208-4
- ^ ab Brindley DN, Waggoner DW (mayo de 1996). "Fosfatidato fosfohidrolasa y transducción de señales". Química. Lípidos . 80 (1–2): 45–57. doi :10.1016/0009-3084(96)02545-5. PMID 8681429.
- ^ Brindley DN, Waggoner DW (septiembre de 1998). "Fosfohidrolasas de fosfato lipídico de mamíferos". J. Biol. Chem . 273 (38): 24281–4. doi : 10.1074/jbc.273.38.24281 . PMID 9733709.
- ^ Delon C, Manifava M, Wood E, et al. (octubre de 2004). "La esfingosina quinasa 1 es un efector intracelular del ácido fosfatídico". J. Biol. Chem . 279 (43): 44763–74. doi : 10.1074/jbc.M405771200 . PMID 15310762.
- ^ P, Raghu (agosto de 2012). "Señalización lipídica en fotorreceptores de Drosophila". Biochim Biophys Acta . 1821 (8): 1154–1165. doi :10.1016/j.bbalip.2012.03.008. PMID 22487656.
- ^ Robinson, CV; Rohacs, T; Hansen, SB (septiembre de 2019). "Herramientas para comprender la regulación lipídica a nanoescala de los canales iónicos". Tendencias en ciencias bioquímicas . 44 (9): 795–806. doi :10.1016/j.tibs.2019.04.001. PMC 6729126 . PMID 31060927.
- ^ abc Athenstaedt K, Daum G (noviembre de 1999). "Ácido fosfatídico, un intermediario clave en el metabolismo lipídico". Eur. J. Biochem . 266 (1): 1–16. doi : 10.1046/j.1432-1327.1999.00822.x . PMID 10542045.
- ^ ab Weigert R, Silletta MG, Spanò S, et al. (noviembre de 1999). "CtBP/BARS induce la fisión de las membranas del aparato de Golgi mediante la acilación del ácido lisofosfatídico". Nature . 402 (6760): 429–33. Bibcode :1999Natur.402..429W. doi :10.1038/46587. PMID 10586885. S2CID 4423468.
- ^ ab Blackwood RA, Smolen JE, Transue A, et al. (abril de 1997). "La actividad de la fosfolipasa D facilita la agregación y fusión inducida por Ca2+ de liposomas complejos". Am. J. Physiol . 272 (4 Pt 1): C1279–85. doi :10.1152/ajpcell.1997.272.4.C1279. PMID 9142853.
- ^ Shemesh T, Luini A, Malhotra V, Burger KN, Kozlov MM (diciembre de 2003). "Constricción por prefisión de los transportadores tubulares de Golgi impulsada por el metabolismo lipídico local: un modelo teórico". Biophys. J . 85 (6): 3813–27. Bibcode :2003BpJ....85.3813S. doi :10.1016/S0006-3495(03)74796-1. PMC 1303683 . PMID 14645071. Archivado desde el original el 2008-05-07.
- ^ ab Kooijman EE, Chupin V, de Kruijff B, Burger KN (marzo de 2003). "Modulación de la curvatura de la membrana por ácido fosfatídico y ácido lisofosfatídico". Traffic . 4 (3): 162–74. doi : 10.1034/j.1600-0854.2003.00086.x . PMID 12656989.
- ^ Robinson, CV; Rohacs, T; Hansen, SB (septiembre de 2019). "Herramientas para comprender la regulación lipídica a nanoescala de los canales iónicos". Tendencias en ciencias bioquímicas . 44 (9): 795–806. doi :10.1016/j.tibs.2019.04.001. PMC 6729126 . PMID 31060927.
- ^ Comoglio, Y; Levitz, J; Kienzler, MA; Lesage, F; Isacoff, EY; Sandoz, G (16 de septiembre de 2014). "La fosfolipasa D2 regula específicamente los canales de potasio TREK a través de la interacción directa y la producción local de ácido fosfatídico". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 111 (37): 13547–52. Bibcode :2014PNAS..11113547C. doi : 10.1073/pnas.1407160111 . PMC 4169921 . PMID 25197053.
- ^ Cabanos, C; Wang, M; Han, X; Hansen, SB (8 de agosto de 2017). "Un ensayo de unión fluorescente soluble revela el antagonismo de PIP2 de los canales TREK-1". Cell Reports . 20 (6): 1287–1294. doi :10.1016/j.celrep.2017.07.034. PMC 5586213 . PMID 28793254.
- ^ Pavel, MA; Chung, HW; Petersen, EN; Hansen, SB (octubre de 2019). "Mecanismo polimodal para la inhibición del canal de K+ relacionado con TWIK por anestésico local". Anestesia y analgesia . 129 (4): 973–982. doi : 10.1213/ANE.0000000000004216 . PMID 31124840.
- ^ ab Hodgkin MN, Pettitt TR, Martin A, Michell RH, Pemberton AJ, Wakelam MJ (junio de 1998). "Diacilgliceroles y fosfatidatos: ¿qué especies moleculares son mensajeros intracelulares?". Trends Biochem. Sci . 23 (6): 200–4. doi :10.1016/S0968-0004(98)01200-6. PMID 9644971.
- ^ Wakelam MJ (diciembre de 1998). "Diacilglicerol: ¿cuándo es un mensajero intracelular?". Biochim. Biophys. Acta . 1436 (1–2): 117–26. doi :10.1016/S0005-2760(98)00123-4. PMID 9838074.
- ^ Cockcroft S, Baldwin JM, Allan D (julio de 1984). "La polifosfoinosítido fosfodiesterasa activada por Ca2+ de las membranas de neutrófilos humanos y de conejo". Biochem. J . 221 (2): 477–82. doi :10.1042/bj2210477. PMC 1144062 . PMID 6089740.
- ^ Moritz A, De Graan PN, Gispen WH, Wirtz KW (abril de 1992). "El ácido fosfatídico es un activador específico de la fosfatidilinositol-4-fosfato quinasa". J. Biol. Chem . 267 (11): 7207–10. doi : 10.1016/S0021-9258(18)42504-5 . PMID 1313792.
- ^ Bocckino SB, Blackmore PF, Wilson PB, Exton JH (noviembre de 1987). "Acumulación de fosfatidato en hepatocitos tratados con hormonas a través de un mecanismo de fosfolipasa D". J. Biol. Chem . 262 (31): 15309–15. doi : 10.1016/S0021-9258(18)48176-8 . PMID 3117799.
- ^ Hodgkin MN, Gardner SD, Rose S, Paterson A, Martin A, Wakelam MJ (marzo de 1997). "Purificación y caracterización de la quinasa sn-1-estearoil-2-araquidonoilglicerol de testículos de cerdo". Biochem. J . 322 (Pt 2): 529–34. doi :10.1042/bj3220529. PMC 1218222 . PMID 9065773.
- ^ Fleming IN, Yeaman SJ (junio de 1995). "Purificación y caracterización de la fosfohidrolasa del ácido fosfatídico insensible a la N-etilmaleimida (PAP2) del hígado de rata". Biochem. J . 308 (Pt 3): 983–9. doi :10.1042/bj3080983. PMC 1136819 . PMID 8948459.
- ^ Olivera A, Rosenthal J, Spiegel S (marzo de 1996). "Efecto de los fosfolípidos ácidos sobre la esfingosina quinasa". J. Cell. Biochem . 60 (4): 529–37. doi :10.1002/(SICI)1097-4644(19960315)60:4<529::AID-JCB9>3.0.CO;2-U. PMID 8707892. S2CID 34752646.
- ^ Morris AJ, Frohman MA, Engebrecht J (octubre de 1997). "Medición de la actividad de la fosfolipasa D". Anal. Biochem . 252 (1): 1–9. doi :10.1006/abio.1997.2299. PMID 9324933.
- ^ Wiczer, Brian M; Thomas, George (27 de marzo de 2012). "Fosfolipasa D y mTORC1: los nutrientes son lo que los une". Sci. Signal . 5 (217): pe13. doi :10.1126/scisignal.2003019. PMID 22457329. S2CID 206671479.
- ^ Cabanos, C; Wang, M; Han, X; Hansen, SB (8 de agosto de 2017). "Un ensayo de unión fluorescente soluble revela el antagonismo de PIP2 de los canales TREK-1". Cell Reports . 20 (6): 1287–1294. doi :10.1016/j.celrep.2017.07.034. PMC 5586213 . PMID 28793254.
- ^ Hite, RK; Butterwick, JA; MacKinnon, R (6 de octubre de 2014). "Modulación del ácido fosfatídico de la función del sensor de voltaje del canal Kv". eLife . 3 . doi : 10.7554/eLife.04366 . PMC 4212207 . PMID 25285449.
- ^ Hansen, SB; Tao, X; MacKinnon, R (28 de agosto de 2011). "Base estructural de la activación de PIP2 del canal rectificador de entrada clásico de K+ Kir2.2". Nature . 477 (7365): 495–8. Bibcode :2011Natur.477..495H. doi :10.1038/nature10370. PMC 3324908 . PMID 21874019.