Ley de Hess
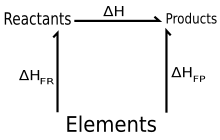
La ley de suma de calor constante de Hess , también conocida simplemente como ley de Hess , es una relación en química física y termodinámica [1] que lleva el nombre de Germain Hess , un químico y médico ruso nacido en Suiza que la publicó en 1840. La ley establece que el cambio de entalpía total durante el curso completo de una reacción química es independiente de la secuencia de pasos tomados. [2] [3]
La ley de Hess se entiende ahora como una expresión del hecho de que la entalpía de un proceso químico es independiente del camino tomado desde el estado inicial al final (es decir, la entalpía es una función de estado ). De acuerdo con la primera ley de la termodinámica , el cambio de entalpía en un sistema debido a una reacción a presión constante es igual al calor absorbido (o el negativo del calor liberado), que se puede determinar por calorimetría para muchas reacciones. Los valores generalmente se indican para reacciones con las mismas temperaturas y presiones iniciales y finales (mientras que se permite que las condiciones varíen durante el curso de las reacciones). La ley de Hess se puede utilizar para determinar la energía total requerida para una reacción química que se puede dividir en pasos sintéticos que son individualmente más fáciles de caracterizar. Esto permite la compilación de entalpías estándar de formación , que se pueden usar para predecir el cambio de entalpía en síntesis complejas.
Teoría
La ley de Hess establece que el cambio de entalpía en una reacción química es el mismo independientemente de si la reacción se lleva a cabo en un solo paso o en varios pasos, siempre que los estados inicial y final de los reactivos y productos sean los mismos. La entalpía es una propiedad extensiva , lo que significa que su valor es proporcional al tamaño del sistema. [4] Debido a esto, el cambio de entalpía es proporcional al número de moles que participan en una reacción dada.
En otras palabras, si un cambio químico se produce por varias vías diferentes, el cambio de entalpía total es el mismo, independientemente de la vía por la que se produzca el cambio químico (siempre que las condiciones iniciales y finales sean las mismas). Si esto no fuera cierto, entonces se podría violar la primera ley de la termodinámica .
La ley de Hess permite calcular la variación de entalpía (Δ H ) de una reacción incluso cuando no se puede medir directamente. Esto se logra realizando operaciones algebraicas básicas basadas en las ecuaciones químicas de las reacciones utilizando valores determinados previamente para las entalpías de formación.
La combinación de ecuaciones químicas conduce a una ecuación neta o global. Si se conocen los cambios de entalpía para todas las ecuaciones de la secuencia, su suma será el cambio de entalpía para la ecuación neta. Si el cambio de entalpía neto es negativo ( ), la reacción es exotérmica y es más probable que sea espontánea ; los valores positivos de Δ H corresponden a reacciones endotérmicas . ( La entropía también juega un papel importante en la determinación de la espontaneidad, ya que algunas reacciones con un cambio de entalpía positivo son, no obstante, espontáneas debido a un aumento de entropía en el sistema de reacción).
Uso de entalpías de formación
La ley de Hess establece que los cambios de entalpía son aditivos. Por lo tanto, el valor de la entalpía estándar de reacción se puede calcular a partir de las entalpías estándar de formación de productos y reactivos de la siguiente manera:
Aquí, la primera suma se aplica a todos los productos y la segunda a todos los reactivos, y son los coeficientes estequiométricos de los productos y reactivos respectivamente, y son las entalpías estándar de formación de los productos y reactivos respectivamente, y el superíndice o indica los valores de estado estándar . Esto puede considerarse como la suma de dos reacciones (reales o ficticias):
- Reactivos → Elementos (en sus estados estándar)
y Elementos → Productos
Ejemplos
- Dado:
- C grafito + O 2 → CO 2 ( g ) ( Δ H = −393,5 kJ/mol) (paso directo)
- C grafito + 1/2 O 2 → CO( g ) (Δ H = −110,5 kJ/mol)
- CO( g ) +1/2 O 2 → CO 2 ( g ) (Δ H = −283,0 kJ/mol)
La reacción (a) es la suma de las reacciones (b) y (c), para las cuales el Δ H total = −393,5 kJ/mol, que es igual a Δ H en (a).
- Dado:
- B2O3 ( s ) + 3H2O ( g ) → 3O2 ( g ) + B2H6 ( g ) ( ΔH = 2035 kJ/ mol )
- H2O ( l ) → H2O ( g ) ( ΔH = 44 kJ/mol)
- H 2 ( g ) + 1/2 O 2 ( g ) → H 2 O ( l ) (Δ H = −286 kJ/mol)
- 2B( s ) + 3H 2 ( g ) → B 2 H 6 ( g ) (Δ H = 36 kJ/mol)
- 2B( s ) + 3 /2O2 ( g ) → B2O3 ( s )
- B2H6 ( g )+3O2 ( g ) → B2O3 ( s ) + 3H2O ( g ) ( ΔH = 2035 × (−1) = −2035 kJ / mol )
- 3H2O ( g ) → 3H2O ( l ) (Δ H = 44 × (−3) = −132 kJ/mol)
- 3H 2 O( l ) → 3H 2 ( g ) + (3/2) O 2 ( g ) (Δ H = −286 × (−3) = 858 kJ/mol)
- 2B( s ) + 3H 2 ( g ) → B 2 H 6 ( g ) (Δ H = 36 kJ/mol)
- 2B( s ) + 3/2 O 2 ( g ) → B 2 O 3 ( s ) (Δ H = −1273 kJ/mol)
Extensión a la energía libre y la entropía
Los conceptos de la ley de Hess se pueden ampliar para incluir cambios en la entropía y en la energía libre de Gibbs , ya que también son funciones de estado . El ciclo termodinámico de Bordwell es un ejemplo de una extensión de este tipo que aprovecha los equilibrios y potenciales redox fácilmente medibles para determinar valores de energía libre de Gibbs inaccesibles experimentalmente . La combinación de valores Δ G o de los ciclos termodinámicos de Bordwell y valores Δ H o encontrados con la ley de Hess puede ser útil para determinar valores de entropía que no se han medido directamente y, por lo tanto, deben calcularse a través de caminos alternativos.
Para la energía libre:
En el caso de la entropía , la situación es un poco diferente. Como la entropía se puede medir como un valor absoluto, no relativo a los de los elementos en sus estados de referencia (como con Δ H o y Δ G o ), no es necesario utilizar la entropía de formación; simplemente se utilizan las entropías absolutas para productos y reactivos:
Aplicaciones
La ley de Hess es útil para determinar las entalpías de los siguientes: [2]
- Calores de formación de intermedios inestables como CO (g) y NO (g) .
- Cambios de calor en transiciones de fase y transiciones alotrópicas .
- Energías reticulares de sustancias iónicas mediante la construcción de ciclos de Born-Haber si se conoce la afinidad electrónica para formar el anión, o
- Afinidades electrónicas utilizando un ciclo de Born-Haber con una energía reticular teórica .
Véase también
Referencias
- ^ "5.6: Ley de Hess". Chemistry LibreTexts . 2014-11-18 . Consultado el 2024-11-09 .
- ^ ab Mannam Krishnamurthy; Subba Rao Naidu (2012). "7". En Lokeswara Gupta (ed.). Química para ISEET - Volumen 1, Parte A (edición de 2012). Hyderabad, India : Varsity Education Management Limited. pág. 244.
- ^ "Ley de Hess - Conservación de la energía". Universidad de Waterloo. Archivado desde el original el 9 de enero de 2015. Consultado el 12 de enero de 2014 .
- ^ Engel, Thomas; Reid, Philip (2006). Química física . Pearson / Benjamin Cummings. pág. 6. ISBN 0-8053-3842-XUna variable
... proporcional al tamaño del sistema se denomina variable extensiva.
- Chakrabarty, DK (2001). Introducción a la química física . Mumbai: Alpha Science. Págs. 34-37. ISBN. 1-84265-059-9.
Lectura adicional
- Leicester, Henry M. (1951). "Germain Henri Hess y los fundamentos de la termoquímica". Revista de Educación Química . 28 (11): 581–583. Bibcode :1951JChEd..28..581L. doi :10.1021/ed028p581.
Enlaces externos
- El artículo de Hess (1840) en el que se basa su ley (en el sitio de ChemTeam)
- Un experimento de la Ley de Hess Archivado el 3 de marzo de 2016 en Wayback Machine.









