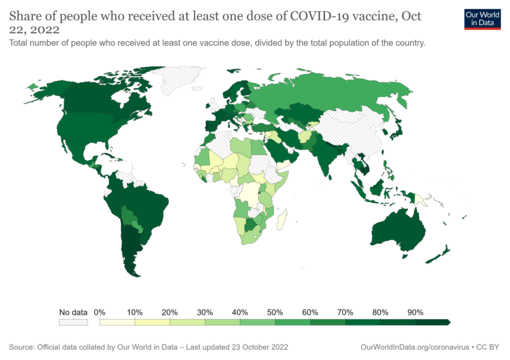
- Porcentaje de personas que han recibido al menos una dosis de la vacuna contra la COVID-19 en relación con la población total de un país. La fecha está en el mapa. Fuente de Commons.
- Dosis de vacuna contra la COVID-19 administradas por cada 100 personas por país. La fecha está en el mapa. Fuente de Commons.
Vacuna para el COVID-19
This article may require cleanup to meet Wikipedia's quality standards. The specific problem is: This article is not following summary style and buries information on the latest vaccines. (September 2024) |
| Descripción de la vacuna | |
|---|---|
| Objetivo | SARS-CoV-2 |
| Tipo de vacuna | ARNm, viral, inactivado, proteína |
| Datos clínicos | |
| Vías de administración | Intramuscular |
| Código ATC | |
| Identificadores | |
| Araña química |
|
| Part of a series on the |
| COVID-19 pandemic |
|---|
 |
|
 COVID-19 portal COVID-19 portal |
Una vacuna contra la COVID‑19 es una vacuna destinada a proporcionar inmunidad adquirida contra el coronavirus 2 del síndrome respiratorio agudo severo ( SARS-CoV-2 ), el virus que causa la enfermedad por coronavirus 2019 ( COVID‑19 ).
Antes de la pandemia de COVID-19 , existía un conjunto establecido de conocimientos sobre la estructura y función de los coronavirus que causan enfermedades como el síndrome respiratorio agudo severo ( SARS ) y el síndrome respiratorio de Oriente Medio ( MERS ). Este conocimiento aceleró el desarrollo de varias plataformas de vacunas a principios de 2020. [1] El enfoque inicial de las vacunas contra el SARS-CoV-2 era prevenir enfermedades sintomáticas, a menudo graves. [2] En 2020, se desarrollaron las primeras vacunas contra la COVID-19 y se pusieron a disposición del público mediante autorizaciones de emergencia [3] y aprobaciones condicionales. [4] [5] Inicialmente, la mayoría de las vacunas contra la COVID-19 eran vacunas de dos dosis, con la excepción de las vacunas de dosis única Convidecia [6] y la vacuna contra la COVID-19 de Janssen [3], y las vacunas con esquemas de tres dosis, Razi Cov Pars [7] y Soberana . [8] Sin embargo, se ha descubierto que la inmunidad de las vacunas disminuye con el tiempo, por lo que es necesario que las personas reciban dosis de refuerzo de la vacuna para mantener la protección contra la COVID-19. [3]
Las vacunas contra la COVID-19 han sido ampliamente reconocidas por su papel en la reducción de la propagación de la COVID-19 y la reducción de la gravedad y la mortalidad causadas por la COVID-19. [3] [9] Según un estudio de junio de 2022, las vacunas contra la COVID-19 evitaron entre 14,4 y 19,8 millones de muertes adicionales en 185 países y territorios entre el 8 de diciembre de 2020 y el 8 de diciembre de 2021. [10] Muchos países implementaron planes de distribución por fases que priorizaron a quienes tenían mayor riesgo de complicaciones, como los ancianos, y a quienes tenían un alto riesgo de exposición y transmisión, como los trabajadores de la salud. [11] [12]
Los efectos secundarios comunes de las vacunas contra la COVID-19 incluyen dolor, enrojecimiento, sarpullido, inflamación en el lugar de la inyección, fatiga, dolor de cabeza, mialgia (dolor muscular) y artralgia (dolor en las articulaciones), que se resuelven sin tratamiento médico en unos pocos días. [13] [14] La vacunación contra la COVID-19 es segura para las personas embarazadas o en período de lactancia. [15]
Hasta el 12 de agosto de 2024 [update], se han administrado 13.720 millones de dosis de vacunas contra la COVID-19 en todo el mundo, según informes oficiales de los organismos nacionales de salud pública . [16] En diciembre de 2020, los países habían pedido por adelantado más de 10.000 millones de dosis de vacunas, [17] y aproximadamente la mitad de las dosis adquiridas por países de altos ingresos que comprenden el 14% de la población mundial. [18]
A pesar del desarrollo extremadamente rápido de vacunas eficaces de ARNm y de vectores virales , no se ha logrado la equidad mundial en materia de vacunas. También se ha recomendado el desarrollo y uso de vacunas de virus inactivados completos (WIV) y de proteínas, especialmente para su uso en países en desarrollo . [19] [20]
El Premio Nobel de Fisiología o Medicina de 2023 fue otorgado a Katalin Karikó y Drew Weissman por el desarrollo de vacunas de ARNm efectivas contra la COVID-19. [21] [22] [23]
Fondo
- Dosis de la vacuna contra la COVID-19 administradas por continente hasta el 11 de octubre de 2021. En el caso de las vacunas que requieren múltiples dosis, se contabiliza cada dosis individual. Como una misma persona puede recibir más de una dosis, la cantidad de dosis puede ser mayor que la cantidad de personas en la población.
- Mapa que muestra la proporción de la población completamente vacunada contra la COVID-19 en relación con la población total de un país [nota 1]
.jpg/440px-COVID_Vaccine_(50745583447).jpg)

Antes de la COVID‑19, nunca se había producido una vacuna para una enfermedad infecciosa en menos de varios años, y no existía ninguna vacuna para prevenir una infección por coronavirus en humanos. [24] Sin embargo, se han producido vacunas contra varias enfermedades animales causadas por coronavirus, incluido (a partir de 2003) el virus de la bronquitis infecciosa en aves, el coronavirus canino y el coronavirus felino . [25] Los proyectos anteriores para desarrollar vacunas para virus de la familia Coronaviridae que afectan a los humanos se han dirigido al síndrome respiratorio agudo severo (SARS) y al síndrome respiratorio de Oriente Medio (MERS). Las vacunas contra el SARS [26] y el MERS [27] se han probado en animales no humanos .
Según estudios publicados en 2005 y 2006, la identificación y el desarrollo de nuevas vacunas y medicamentos para tratar el SARS era una prioridad para los gobiernos y las agencias de salud pública de todo el mundo en ese momento. [28] [29] [30] No existe una cura o vacuna protectora que haya demostrado ser segura y eficaz contra el SARS en humanos. [31] [32] Tampoco existe una vacuna probada contra el MERS. [33] Cuando el MERS se hizo frecuente, se creyó que la investigación existente sobre el SARS podría proporcionar una plantilla útil para desarrollar vacunas y terapias contra una infección por MERS-CoV. [31] [34] En marzo de 2020, había una vacuna contra el MERS (basada en ADN) que completó los ensayos clínicos de fase I en humanos, [35] y otras tres en curso, todas ellas vacunas con vector viral: dos con vector adenoviral (ChAdOx1-MERS, BVRS-GamVac) y una con vector MVA (MVA-MERS-S). [36]
Las vacunas que utilizan un virus inactivo o debilitado que se ha cultivado en huevos suelen tardar más de una década en desarrollarse. [37] [38] En cambio, el ARNm es una molécula que se puede fabricar rápidamente, y la investigación sobre el ARNm para combatir enfermedades comenzó décadas antes de la pandemia de COVID-19 por parte de científicos como Drew Weissman y Katalin Karikó , que realizaron pruebas en ratones. Moderna comenzó a realizar pruebas en humanos de una vacuna de ARNm en 2015. [37] También se desarrollaron vacunas de vector viral para la pandemia de COVID-19 después de que la tecnología fuera aprobada previamente para el ébola. [37]
Como se han autorizado o autorizado varias vacunas contra la COVID-19 para su uso, se está evaluando la efectividad de la vacuna en el mundo real (RWE) mediante estudios de casos y controles y de observación. [39] [40] Un estudio está investigando la protección duradera contra el SARS-CoV-2 que brindan las vacunas de ARNm. [41] [42]
Tecnologías de vacunas
.jpg/440px-Vaccine_candidate_mechanisms_for_SARS-CoV-2_(49948301838).jpg)

En julio de 2021, al menos nueve plataformas tecnológicas diferentes estaban en investigación y desarrollo para crear una vacuna eficaz contra la COVID-19. [44] [45] La mayoría de las plataformas de vacunas candidatas en ensayos clínicos se centran en la proteína de pico del coronavirus (proteína S) y sus variantes como antígeno principal de la infección por COVID-19, [44] ya que la proteína S desencadena fuertes respuestas inmunitarias de células B y T. [46] [47] Sin embargo, también se están investigando otras proteínas del coronavirus para el desarrollo de vacunas, como la nucleocápside , porque también inducen una respuesta robusta de las células T y sus genes están más conservados y se recombinan con menos frecuencia (en comparación con Spike). [47] [48] [49] Las futuras generaciones de vacunas contra la COVID-19 que puedan dirigirse a regiones genómicas más conservadas también actuarán como seguro contra la manifestación de escenarios catastróficos relacionados con la futura trayectoria evolutiva del SARS-CoV-2, o cualquier epidemia/pandemia de coronavirus similar. [50]
Las plataformas desarrolladas en 2020 involucraron tecnologías de ácidos nucleicos ( ARN mensajero modificado con nucleósidos y ADN ), vectores virales no replicantes , péptidos , proteínas recombinantes , virus vivos atenuados y virus inactivados . [24] [44] [51] [52]
Muchas de las tecnologías de vacunas que se están desarrollando para la COVID-19 no son como las vacunas contra la gripe , sino que utilizan estrategias de "próxima generación" para atacar con precisión los mecanismos de infección de la COVID-19. [44] [51] [52] Varias de las vacunas sintéticas utilizan una mutación 2P para bloquear la proteína de pico en su configuración de prefusión, estimulando una respuesta inmunitaria adaptativa al virus antes de que se adhiera a una célula humana. [53] Las plataformas de vacunas en desarrollo pueden mejorar la flexibilidad para la manipulación de antígenos y la eficacia para atacar los mecanismos de infección de la COVID-19 en subgrupos de población susceptibles, como los trabajadores de la salud, los ancianos, los niños, las mujeres embarazadas y las personas con sistemas inmunitarios debilitados . [44] [51]
vacunas de ARNm
.jpg/440px-RNA_vaccine_illustration_(en).jpg)
Varias vacunas contra la COVID-19, como las de Pfizer-BioNTech y Moderna , utilizan ARN para estimular una respuesta inmunitaria. Cuando se introduce en el tejido humano, la vacuna contiene ARN autorreplicante o ARN mensajero (ARNm), que hacen que las células expresen la proteína de pico del SARS-CoV-2 . Esto enseña al cuerpo a identificar y destruir el patógeno correspondiente. Las vacunas de ARN suelen utilizar ARN mensajero modificado con nucleósidos . La administración del ARNm se logra mediante una coformulación de la molécula en nanopartículas lipídicas , que protegen las cadenas de ARN y ayudan a su absorción en las células. [54] [55] [56] [57]
Las vacunas de ARN son las primeras vacunas contra la COVID-19 autorizadas en el Reino Unido, Estados Unidos y la Unión Europea. [58] [59] Las vacunas autorizadas de este tipo incluyen las vacunas Pfizer-BioNTech
Las reacciones alérgicas graves son poco frecuentes. En diciembre de 2020, la administración de 1.893.360 primeras dosis de la vacuna Pfizer-BioNTech contra la COVID-19 dio lugar a 175 casos de reacciones alérgicas graves, de las cuales 21 fueron anafilaxia . [66] En las 4.041.396 administraciones de dosis de la vacuna Moderna contra la COVID-19 en diciembre de 2020 y enero de 2021, solo se notificaron diez casos de anafilaxia. [66] Las nanopartículas lipídicas (LNP) fueron probablemente las responsables de las reacciones alérgicas. [66]
Vacunas de vectores de adenovirus
Estas vacunas son ejemplos de vacunas de vector viral no replicante que utilizan una cubierta de adenovirus que contiene ADN que codifica una proteína del SARS-CoV-2. [67] [68] Las vacunas basadas en vectores virales contra la COVID-19 no son replicantes, lo que significa que no generan nuevas partículas virales, sino que producen solo el antígeno que provoca una respuesta inmunitaria sistémica. [67]
Las vacunas autorizadas de este tipo incluyen la vacuna COVID-19 de Oxford-AstraZeneca ,
Convidecia y Janssen son vacunas de una sola dosis que ofrecen una logística menos complicada y pueden almacenarse en refrigeración normal durante varios meses. [75] [76]
Sputnik V utiliza Ad26 para su primera dosis, que es la misma que la única dosis de Janssen, y Ad5 para la segunda dosis, que es la misma que la única dosis de Convidecia. [77]
En agosto de 2021, los desarrolladores de Sputnik V propusieron, en vista del aumento de casos de Delta, que Pfizer probara el componente Ad26 (denominado su versión "Light") [78] como una inyección de refuerzo. [79]
Vacunas de virus inactivados
Las vacunas inactivadas consisten en partículas virales que se cultivan y luego se eliminan mediante un método como el calor o el formaldehído para perder la capacidad de producir enfermedades y al mismo tiempo seguir estimulando una respuesta inmunitaria. [80]
Las vacunas de virus inactivados autorizadas en China incluyen la vacuna china CoronaVac [81] [82] [83] y las vacunas Sinopharm BIBP
Vacunas de subunidades
Las vacunas de subunidades presentan uno o más antígenos sin introducir partículas patógenas completas. Los antígenos implicados suelen ser subunidades proteicas , pero pueden ser cualquier fragmento molecular del patógeno. [90]
Las vacunas autorizadas de este tipo incluyen la vacuna peptídica EpiVacCorona ,
La vacuna V451 se encontraba en ensayos clínicos que se interrumpieron después de descubrirse que podría causar resultados incorrectos en pruebas de VIH posteriores.
Vacunas de partículas similares a virus
Las vacunas autorizadas de este tipo incluyen la vacuna Novavax COVID‑19 . [19] [104]
Otros tipos
Otros tipos de vacunas que se encuentran en ensayos clínicos incluyen vacunas de plásmidos de ADN múltiples , [105]
Los científicos investigaron si las vacunas existentes para enfermedades no relacionadas podrían preparar el sistema inmunológico y reducir la gravedad de las infecciones por COVID-19. [114] Hay evidencia experimental de que la vacuna BCG para la tuberculosis tiene efectos no específicos en el sistema inmunológico, pero no hay evidencia de que esta vacuna sea efectiva contra la COVID-19. [115]
Lista de vacunas autorizadas
| Nombre común | Tipo (tecnología) | País natal | Primera autorización | Notas |
|---|---|---|---|---|
| Autorizado en más de 10 países y por la OMS | ||||
| Oxford-AstraZeneca | Vector de adenovirus | Reino Unido, Suecia | Diciembre de 2020 | |
| Pfizer–BioNTech | ARN | Alemania, Estados Unidos | Diciembre de 2020 | Versiones originales y variantes de Omicron |
| Janssen (Johnson & Johnson) | Vector de adenovirus | Estados Unidos, Países Bajos | Febrero de 2021 | |
| Moderna | ARN | Estados Unidos | Diciembre de 2020 | Versiones originales y variantes de Omicron |
| Sinopharm BIBP | Inactivado | Porcelana | Julio de 2020 | |
| Novavax | Subunidad / partícula similar a un virus | Estados Unidos | Diciembre de 2021 | Una “vacuna de nanopartículas recombinantes” [116] |
| Covaxina | Inactivado | India | Enero de 2021 | |
| Vacuna contra la corona | Inactivado | Porcelana | Agosto de 2020 | Baja eficacia en estudios de replicación y con ciertas variantes |
| Sanofi-GSK | Subunidad | Francia, Reino Unido | Noviembre de 2022 | Basado en la variante Beta |
| Autorizado en más de 10 países | ||||
| Sputnik V | Vector de adenovirus | Rusia | Agosto de 2020 | |
| Valneva | Inactivado | Francia, Austria | Abril de 2022 | |
| Luz del Sputnik | Vector de adenovirus | Rusia | Mayo de 2021 | |
| Autorizado en 2 a 10 países | ||||
| Convidecia | Vector de adenovirus | Porcelana | Junio de 2020 | |
| Medicamento contra la hepatitis B de Sinopharm | Inactivado | Porcelana | Febrero de 2021 | Menor eficacia |
| Abdala | Subunidad | Cuba | Julio de 2021 | |
| EpiVacCorona | Subunidad | Rusia | Octubre de 2020 | |
| Zifivax | Subunidad | Porcelana | Marzo de 2021 | |
| Soberana 02 | Subunidad | Cuba, Irán | Junio 2021 | |
| vacuna contra la covid-19 | Inactivado | Rusia | Febrero de 2021 | |
| Medigen | Subunidad | Taiwán | Julio de 2021 | |
| QazCovid-en | Inactivado | Kazajstán | Abril 2021 | |
| Minhai | Inactivado | Porcelana | Mayo de 2021 | En proceso de ensayos clínicos |
| COVIran Barekat | Inactivado | Irán | Junio 2021 | |
| Soberana Plus | Subunidad | Cuba | Agosto de 2021 | |
| vacuna contra el corbemax | Subunidad | India, Estados Unidos | Diciembre de 2021 | |
| Autorizado en 1 país | ||||
| Academia China de Ciencias Médicas | Inactivado | Porcelana | Junio 2021 | |
| Covid-19 | ADN | India | Agosto de 2021 | |
| FAJRAVAC | Inactivado | Irán | Septiembre 2021 | |
| Covax-19 | Subunidad | Australia, Irán | Octubre de 2021 | |
| Pares del condado de Razi | Subunidad | Irán | Octubre de 2021 | |
| Turkovac | Inactivado | Pavo | Diciembre de 2021 | |
| CNBG de Sinopharm | Subunidad | Porcelana | Diciembre de 2021 | Basado en variantes originales, Beta y Kappa |
| CoVLP | Partícula parecida a un virus | Canadá, Reino Unido | Febrero de 2022 | |
| Noora | Subunidad | Irán | Marzo de 2022 | |
| Covione del cielo | Subunidad | Corea del Sur | Junio de 2022 | |
| Walvax | ARN | Porcelana | Septiembre de 2022 | Se concedió la aprobación para uso de emergencia en Indonesia en septiembre de 2022 |
| iNCOVACC | Vector de adenovirus | India | Septiembre de 2022 | Vacuna nasal |
| V-01 | Subunidad | Porcelana | Septiembre de 2022 | |
| Gemcovac | ARN | India | Octubre de 2022 | Vacuna de ARN autoamplificante |
| IndoVac | Subunidad | Indonesia | Octubre de 2022 | |
| LUNAR-COV19 | ARN | Estados Unidos, Singapur | Noviembre de 2023 | Vacuna de ARN autoamplificante |
Métodos de entrega
La mayoría de las vacunas contra el coronavirus se administran mediante inyección, y se están estudiando otros métodos de administración de vacunas para futuras vacunas contra el coronavirus.
Intranasal
Las vacunas intranasales se dirigen a la inmunidad de la mucosa nasal , que es un portal para la entrada del virus al cuerpo. [117] [118] Estas vacunas están diseñadas para estimular los factores inmunes nasales , como la IgA . [117] Además de inhibir el virus, las vacunas nasales facilitan la administración porque no se utilizan agujas (o no se produce fobia a las agujas ). [118] [119]
Se están realizando ensayos clínicos con diversas vacunas intranasales contra la COVID-19. La primera vacuna intranasal autorizada fue Razi Cov Pars en Irán a fines de octubre de 2021. [120] El primer componente viral de la vacuna Sputnik V fue autorizado en Rusia como Sputnik Nasal en abril de 2022. [121] En septiembre de 2022, India y China aprobaron dos vacunas nasales contra la COVID-19 ( iNCOVACC y Convidecia ), que pueden (como refuerzos) [122] también reducir la transmisión [123] [124] (potencialmente a través de la inmunidad esterilizante). [123] En diciembre de 2022, China aprobó una segunda vacuna intranasal como refuerzo, cuyo nombre comercial es Pneucolin . [125]
Autólogo
Aivita Biomedical está desarrollando un kit experimental de vacunas contra la COVID-19 a partir de células dendríticas autólogas , en el que la vacuna se prepara e incuba en el punto de atención utilizando células del receptor previsto. [126] La vacuna se encuentra en fase I y II de pequeños estudios clínicos. [126] [127] [128]
Vacuna universal
Una vacuna universal contra el coronavirus sería eficaz contra todos los coronavirus y posiblemente otros virus. [129] [130] El concepto fue respaldado públicamente por el director del NIAID , Anthony Fauci , el virólogo Jeffery K. Taubenberger y David M. Morens. [131] En marzo de 2022, la Casa Blanca publicó el "Plan Nacional de Preparación para el COVID-19", que recomendaba acelerar el desarrollo de una vacuna universal contra el coronavirus. [132]
En el Instituto de Investigación del Ejército Walter Reed se está desarrollando un intento de crear una vacuna de este tipo . Utiliza una nanopartícula basada en ferritina de pico (SpFN). Esta vacuna comenzó un ensayo clínico de fase I en abril de 2022. [133] Los resultados de este ensayo se publicaron en mayo de 2024. [134] Otras vacunas universales que han entrado en ensayos clínicos incluyen OVX033 (Francia), [135] PanCov (Francia), [136] pEVAC-PS (Reino Unido), [137] y VBI-2902 (Canadá). [138]
Otra estrategia consiste en unir fragmentos de vacunas de múltiples cepas a una estructura de nanopartículas . Una teoría es que se puede vacunar contra una gama más amplia de cepas si se apunta al dominio de unión al receptor, en lugar de a toda la proteína de la espícula . [139]
Formulación
A partir de septiembre de 2020 [update], once de los candidatos a vacunas en desarrollo clínico utilizan adyuvantes para mejorar la inmunogenicidad. [44] Un adyuvante inmunológico es una sustancia formulada con una vacuna para elevar la respuesta inmune a un antígeno , como el virus COVID-19 o el virus de la influenza. [140] Específicamente, un adyuvante puede usarse en la formulación de un candidato a vacuna COVID-19 para aumentar su inmunogenicidad y eficacia para reducir o prevenir la infección por COVID-19 en individuos vacunados. [140] [141] Los adyuvantes utilizados en la formulación de la vacuna COVID-19 pueden ser particularmente efectivos para tecnologías que utilizan el virus COVID-19 inactivado y vacunas basadas en proteínas recombinantes o basadas en vectores. [141] Las sales de aluminio, conocidas como " alumbre ", fueron el primer adyuvante utilizado para vacunas autorizadas y son el adyuvante de elección en aproximadamente el 80% de las vacunas con adyuvante. [141] El adyuvante de alumbre inicia diversos mecanismos moleculares y celulares para mejorar la inmunogenicidad, incluida la liberación de citocinas proinflamatorias. [140] [141]
En junio de 2024, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) informó a los fabricantes de las vacunas contra la COVID-19 autorizadas y autorizadas que las vacunas contra la COVID-19 (Fórmula 2024-2025) que se utilizarán en los Estados Unidos a partir del otoño de 2024 deben ser vacunas monovalentes JN.1. [142]
Planificación y desarrollo
Desde enero de 2020, el desarrollo de vacunas se ha acelerado gracias a una colaboración sin precedentes en la industria farmacéutica multinacional y entre gobiernos. [44]
Se evalúan múltiples pasos a lo largo de todo el camino de desarrollo, incluidos: [24] [143]
- el nivel de toxicidad aceptable de la vacuna (su seguridad),
- Dirigido a poblaciones vulnerables,
- la necesidad de avances en la eficacia de las vacunas,
- la duración de la protección de la vacunación,
- sistemas de administración especiales (como oral o nasal, en lugar de inyección),
- régimen de dosis,
- características de estabilidad y almacenamiento,
- autorización de uso de emergencia antes de la concesión formal de licencia,
- Fabricación óptima para escalar a miles de millones de dosis, y
- difusión de la vacuna autorizada.
Desafíos
El desarrollo de la vacuna contra la COVID-19 ha enfrentado varios desafíos singulares.
Los programas de salud pública [¿ quiénes? ] han sido descritos como "[una] carrera para vacunar a los individuos" con las vacunas de la primera ola. [144]
Los plazos para realizar investigaciones clínicas (que normalmente son procesos secuenciales que requieren años) se están comprimiendo en ensayos de seguridad, eficacia y dosificación que se realizan simultáneamente durante meses, lo que potencialmente compromete la garantía de seguridad. [145] [146] Por ejemplo, los desarrolladores de vacunas chinos y el Centro para el Control y la Prevención de Enfermedades de China comenzaron sus esfuerzos en enero de 2020, [147] y en marzo estaban buscando numerosos candidatos en plazos cortos. [145] [148]
Se esperaba que el rápido desarrollo y la urgencia de producir una vacuna para la pandemia de COVID-19 aumentaran los riesgos y la tasa de fracaso en la entrega de una vacuna segura y eficaz. [51] [52] [149] Además, la investigación en las universidades se ve obstaculizada por el distanciamiento físico y el cierre de laboratorios. [150] [151]
Las vacunas deben pasar por varias fases de ensayos clínicos para comprobar su seguridad, inmunogenicidad , eficacia, niveles de dosis y efectos adversos de la vacuna candidata. [152] [153] Los desarrolladores de vacunas tienen que invertir recursos a nivel internacional para encontrar suficientes participantes para los ensayos clínicos de fase II-III cuando el virus ha demostrado ser un " objetivo móvil " de tasas de transmisión cambiantes entre países y dentro de ellos, lo que obliga a las empresas a competir por los participantes de los ensayos. [154]
Los organizadores de ensayos clínicos también pueden encontrarse con personas que no están dispuestas a vacunarse debido a su reticencia a vacunarse [155] o a su incredulidad en la ciencia de la tecnología de la vacuna y su capacidad para prevenir la infección. [156] A medida que se desarrollan nuevas vacunas durante la pandemia de COVID-19, la autorización de las vacunas candidatas contra la COVID-19 [ ¿quién? ] requiere la presentación de un expediente completo de información sobre el desarrollo y la calidad de fabricación. [157] [158] [159]
Organizaciones
A nivel internacional, el Acelerador del acceso a las herramientas contra la COVID-19 es una iniciativa del G20 y la Organización Mundial de la Salud (OMS) anunciada en abril de 2020. [160] [161] Se trata de una estructura de apoyo interdisciplinaria que permite a los socios compartir recursos y conocimientos. Está compuesta por cuatro pilares, cada uno de ellos gestionado por dos o tres socios colaboradores: Vacunas (también llamado " COVAX "), Diagnóstico, Terapéutica y Conector de Sistemas de Salud. [162] El "Plan de I+D (para el) nuevo coronavirus" de la OMS de abril de 2020 documentó un "ensayo clínico controlado aleatorizado individual, internacional y multicéntrico de gran tamaño" para permitir "la evaluación concurrente de los beneficios y riesgos de cada vacuna candidata prometedora en un plazo de 3 a 6 meses desde su puesta a disposición para el ensayo". La coalición de vacunas de la OMS priorizará qué vacunas deberían pasar a los ensayos clínicos de fase II y III y determinará protocolos armonizados de fase III para todas las vacunas que alcancen la etapa fundamental del ensayo . [163]
Los gobiernos nacionales también han participado en el desarrollo de vacunas. Canadá anunció la financiación de 96 proyectos para el desarrollo y producción de vacunas en empresas y universidades canadienses, con planes de establecer un "banco de vacunas" que podría utilizarse si se produce otro brote de coronavirus, [164] apoyar los ensayos clínicos y desarrollar cadenas de fabricación y suministro de vacunas. [165]
China proporcionó préstamos a bajo interés a un desarrollador de vacunas a través de su banco central y "rápidamente puso terrenos a disposición de la empresa" para construir plantas de producción. [146] Tres empresas de vacunas e institutos de investigación chinos reciben apoyo del gobierno para financiar la investigación, realizar ensayos clínicos y fabricar. [166]
En abril de 2020, el gobierno del Reino Unido formó un grupo de trabajo sobre la vacuna contra la COVID-19 para estimular los esfuerzos locales encaminados a acelerar el desarrollo de una vacuna mediante colaboraciones entre industrias, universidades y organismos gubernamentales. El grupo de trabajo sobre la vacuna del Reino Unido contribuyó a todas las fases del desarrollo, desde la investigación hasta la fabricación. [167]
En Estados Unidos, la Autoridad de Investigación y Desarrollo Biomédico Avanzado (BARDA), una agencia federal que financia tecnología para combatir enfermedades, anunció inversiones para apoyar el desarrollo de la vacuna estadounidense contra la COVID-19 y la fabricación de los candidatos más prometedores. [146] [168] En mayo de 2020, el gobierno anunció la financiación de un programa de vía rápida llamado Operation Warp Speed . [169] [170] Para marzo de 2021, BARDA había financiado aproximadamente 19.300 millones de dólares en el desarrollo de la vacuna contra la COVID-19. [171]
Las grandes compañías farmacéuticas con experiencia en la producción de vacunas a gran escala, entre ellas Johnson & Johnson , AstraZeneca y GlaxoSmithKline (GSK), formaron alianzas con empresas de biotecnología , gobiernos y universidades para acelerar el progreso hacia vacunas efectivas. [146] [145]
Investigación clínica
La investigación clínica de las vacunas contra la COVID-19 utiliza la investigación clínica para establecer las características de las vacunas contra la COVID-19. Estas características incluyen la eficacia, la efectividad y la seguridad. A noviembre de 2022 [update], 40 vacunas están autorizadas por al menos una autoridad reguladora nacional para uso público: [172] [173]
En junio de 2022 [update], 353 vacunas candidatas se encuentran en diversas etapas de desarrollo, 135 de ellas en investigación clínica , incluidas 38 en ensayos de fase I , 32 en ensayos de fase I-II , 39 en ensayos de fase III y 9 en desarrollo de fase IV . [172]Complicaciones post-vacunación
Los eventos embólicos y trombóticos posteriores a la vacunación, denominados trombocitopenia trombótica inmunitaria inducida por la vacuna (VITT), [174] [175] [176] [177] [178] trombocitopenia inmunitaria protrombótica inducida por la vacuna (VIPIT), [179] síndrome de trombosis con trombocitopenia (TTS), [180] [177] [178] trombocitopenia y trombosis inmunitarias inducidas por la vacuna (VITT), [178] o trombocitopenia trombótica asociada a la vacuna (VATT), [178] son tipos raros de síndromes de coagulación sanguínea que se observaron inicialmente en varias personas que habían recibido previamente la vacuna Oxford–AstraZeneca COVID‑19 (AZD1222) [a] durante la pandemia de COVID‑19 . [179] [185] Posteriormente también se describió en la vacuna Janssen COVID-19 (Johnson & Johnson), lo que llevó a la suspensión de su uso hasta que se reevaluara su seguridad. [186] El 5 de mayo de 2022, la FDA publicó un boletín que limitaba el uso de la vacuna Janssen a casos muy específicos debido a una nueva reevaluación de los riesgos del síndrome de Tourette, aunque la FDA también declaró en el mismo boletín que los beneficios de la vacuna superan los riesgos. [187]
En abril de 2021, AstraZeneca y la Agencia Europea de Medicamentos (EMA) actualizaron su información para los profesionales sanitarios sobre AZD1222, diciendo que "se considera plausible" que exista una relación causal entre la vacunación y la aparición de trombosis en combinación con trombocitopenia y que, "aunque tales reacciones adversas son muy raras, superaron lo que se esperaría en la población general". [185] [188] [189] [190] AstraZeneca inicialmente negó el vínculo, diciendo que "no aceptamos que el TTS sea causado por la vacuna a un nivel genérico". Sin embargo, en documentos legales presentados en febrero de 2024, AstraZeneca finalmente admitió que su vacuna "puede, en casos muy raros, causar TTS". [191] [192]Historia

El SARS-CoV-2 (coronavirus 2 del síndrome respiratorio agudo severo), el virus que causa la COVID-19 , fue aislado a fines de 2019. [193] Su secuencia genética se publicó el 11 de enero de 2020, lo que desencadenó una respuesta internacional urgente para prepararse para un brote y acelerar el desarrollo de una vacuna preventiva contra la COVID-19. [194] [195] [196] Desde 2020, el desarrollo de vacunas se ha acelerado mediante una colaboración sin precedentes en la industria farmacéutica multinacional y entre gobiernos. [197] Para junio de 2020, corporaciones, gobiernos, organizaciones internacionales de salud y grupos de investigación universitarios invirtieron decenas de miles de millones de dólares para desarrollar docenas de vacunas candidatas y preparar programas globales de vacunación para inmunizar contra la infección por COVID-19. [195] [198] [199] [200] Según la Coalición para las Innovaciones en Preparación para Epidemias (CEPI), la distribución geográfica del desarrollo de la vacuna contra la COVID-19 muestra que las entidades de América del Norte tienen alrededor del 40% de la actividad, en comparación con el 30% en Asia y Australia, el 26% en Europa y algunos proyectos en América del Sur y África. [194] [197]
En febrero de 2020, la Organización Mundial de la Salud (OMS) afirmó que no esperaba que una vacuna contra el SARS-CoV-2 estuviera disponible en menos de 18 meses. [201] El virólogo Paul Offit comentó que, en retrospectiva, el desarrollo de una vacuna segura y eficaz en 11 meses fue una hazaña notable. [202] La tasa de infección de COVID-19 en rápido crecimiento en todo el mundo durante 2020 estimuló las alianzas internacionales y los esfuerzos gubernamentales para organizar urgentemente los recursos para fabricar múltiples vacunas en plazos más cortos, [203] y cuatro vacunas candidatas entraron en evaluación humana en marzo (véase la vacuna COVID-19 § Estado de los ensayos y la autorización). [194] [204]
El 24 de junio de 2020, China aprobó la vacuna CanSino para uso limitado en el ejército y dos vacunas de virus inactivados para uso de emergencia en ocupaciones de alto riesgo. [205] El 11 de agosto de 2020, Rusia anunció la aprobación de su vacuna Sputnik V para uso de emergencia, aunque un mes después solo se habían distribuido pequeñas cantidades de la vacuna para su uso fuera del ensayo de fase 3. [206]
El 20 de noviembre de 2020, la asociación Pfizer-BioNTech presentó una solicitud de Autorización de Uso de Emergencia (EUA) a la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) para la vacuna de ARNm BNT162b2 (ingrediente activo tozinameran ). [207] [208] El 2 de diciembre de 2020, la Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA) del Reino Unido otorgó la aprobación regulatoria temporal para la vacuna Pfizer-BioNTech , [209] [210] convirtiéndose en el primer país en aprobar la vacuna y el primer país del mundo occidental en aprobar el uso de cualquier vacuna COVID-19. [211] [212] [213] Al 21 de diciembre de 2020, muchos países y la Unión Europea [214] habían autorizado o aprobado la vacuna Pfizer-BioNTech COVID-19. Baréin y los Emiratos Árabes Unidos otorgaron la autorización de comercialización de emergencia para la vacuna Sinopharm BIBP . [215] [216] El 11 de diciembre de 2020, la FDA otorgó una EUA para la vacuna Pfizer–BioNTech contra la COVID-19. [217] Una semana después, otorgaron una EUA para el ARNm-1273 (ingrediente activo elasomero ), la vacuna de Moderna. [218] [219] [220] [221]
El 31 de marzo de 2021, el gobierno ruso anunció que había registrado la primera vacuna contra la COVID-19 para animales. [222] Denominada Carnivac-Cov , es una vacuna inactivada para animales carnívoros, incluidas las mascotas, destinada a prevenir las mutaciones que ocurren durante la transmisión interespecies del SARS-CoV-2. [223]
En octubre de 2022, China comenzó a administrar una vacuna oral desarrollada por CanSino Biologics utilizando su modelo de adenovirus. [224]
A pesar de la disponibilidad de vacunas de ARNm y de vectores virales , no se ha logrado la equidad mundial en materia de vacunas. Se ha recomendado el desarrollo y uso continuo de vacunas de virus inactivados completos (WIV) y de proteínas , especialmente para su uso en países en desarrollo , para frenar nuevas oleadas de la pandemia. [225] [226]En noviembre de 2021, la Agencia Reguladora de Medicamentos y Productos Sanitarios del Reino Unido publicó las secuencias de nucleótidos completas de las vacunas de AstraZeneca y Pfizer/BioNTech en respuesta a una solicitud de libertad de información . [227] [228]
Eficacia

La evidencia del uso de vacunas durante la pandemia muestra que la vacunación puede reducir la infección y es más eficaz para prevenir los síntomas graves de COVID-19 y la muerte, pero es menos eficaz para prevenir la COVID-19 leve. La eficacia disminuye con el tiempo, pero se puede mantener con dosis de refuerzo. [230] En 2021, los CDC informaron que las personas no vacunadas tenían 10 veces más probabilidades de ser hospitalizadas y 11 veces más probabilidades de morir que las personas completamente vacunadas. [231] [232]
Los CDC informaron que la efectividad de la vacuna cayó del 91% contra la variante Alfa al 66% contra la variante Delta. [233] Un experto afirmó que "aquellos que se infectan después de la vacunación todavía no se enferman ni mueren como sucedía antes de la vacunación". [234] A fines de agosto de 2021, la variante Delta representaba el 99 por ciento de los casos en EE. UU. y se descubrió que duplicaba el riesgo de enfermedad grave y hospitalización para quienes aún no estaban vacunados. [235]
En noviembre de 2021, un estudio del ECDC estimó que se habían salvado 470.000 vidas mayores de 60 años desde el inicio de la campaña de vacunación en la región europea. [236]
El 10 de diciembre de 2021, la Agencia de Seguridad Sanitaria del Reino Unido informó que los primeros datos indicaban una reducción de 20 a 40 veces en la actividad neutralizante de Omicron en sueros de vacunados con 2 dosis de Pfizer en relación con las cepas anteriores. Después de una dosis de refuerzo (generalmente con una vacuna de ARNm), [237] la efectividad de la vacuna contra la enfermedad sintomática fue del 100% .70%–75% , y se esperaba que la eficacia contra enfermedades graves fuera mayor. [238]
Según datos de los CDC de principios de diciembre de 2021, “los adultos no vacunados tenían aproximadamente 97 veces más probabilidades de morir de COVID-19 que las personas completamente vacunadas que habían recibido dosis de refuerzo”. [239]
Un metaanálisis que investigó las diferencias entre las vacunas contra la COVID-19 en personas inmunodeprimidas reveló que las personas con un sistema inmunológico debilitado tienen menos capacidad para producir anticuerpos neutralizantes. Por ejemplo, los receptores de trasplantes de órganos necesitan tres vacunas para lograr la seroconversión . [240] Un estudio sobre la respuesta serológica a las vacunas de ARNm entre pacientes con linfoma, leucemia y mieloma reveló que una cuarta parte de los pacientes no producían anticuerpos mensurables, lo que variaba según el tipo de cáncer. [241]
En febrero de 2023, una revisión sistemática en The Lancet afirmó que la protección brindada por la infección era comparable a la de la vacunación, aunque con un mayor riesgo de enfermedad grave y muerte por la enfermedad de una infección inicial. [242]
Un estudio de enero de 2024 de los CDC encontró que mantenerse al día con las vacunas podría reducir el riesgo de accidentes cerebrovasculares, coágulos de sangre y ataques cardíacos relacionados con COVID-19 en personas de 65 años o más o con una condición que las hace más vulnerables a dichas condiciones. [243] [244]Un análisis que involucró a más de 20 millones de adultos encontró que las personas vacunadas tenían un menor riesgo de COVID prolongada en comparación con aquellos que no habían recibido la vacuna contra la COVID-19. [245] [246]
Duración de la inmunidad
A partir de 2021, la evidencia disponible muestra que las personas completamente vacunadas y aquellas previamente infectadas con SARS-CoV-2 tienen un riesgo bajo de infección posterior durante al menos seis meses. [247] [248] [249] No hay datos suficientes para determinar un umbral de título de anticuerpos que indique cuándo un individuo está protegido de la infección. [247] Múltiples estudios muestran que los títulos de anticuerpos están asociados con la protección a nivel de población, pero los títulos de protección individuales siguen siendo desconocidos. [247] Para algunas poblaciones, como los ancianos y los inmunodeprimidos , los niveles de protección pueden reducirse después de la vacunación y la infección. [247] La evidencia disponible indica que el nivel de protección puede no ser el mismo para todas las variantes del virus . [247]
A partir de diciembre de 2021, no existen pruebas autorizadas o aprobadas por la FDA que los proveedores o el público puedan usar para determinar si una persona está protegida contra la infección de manera confiable. [247]
En marzo de 2022, la protección de los residentes de edad avanzada contra enfermedades graves, hospitalización y muerte en residencias de ancianos inglesas fue alta inmediatamente después de la vacunación, pero la protección disminuyó significativamente en los meses posteriores a la vacunación. [250] La protección entre el personal de las residencias de ancianos, que era más joven, disminuyó mucho más lentamente. [250] Se recomiendan dosis de refuerzo regulares para las personas mayores, y las dosis de refuerzo para los residentes de las residencias de ancianos cada seis meses parecen razonables. [250]
Los Centros para el Control y la Prevención de Enfermedades de Estados Unidos (CDC) recomiendan una cuarta dosis de la vacuna de ARNm de Pfizer a partir de marzo de 2022 [update]para "determinadas personas inmunodeprimidas y personas mayores de 50 años". [251] [252]
Evasión inmunitaria por variantes
A diferencia de otras variantes investigadas anteriormente, la variante ómicron del SARS-CoV-2 [253] [254] [255] [256] [257] y sus subvariantes BA.4/5 [258] han evadido la inmunidad inducida por las vacunas, lo que puede provocar infecciones posvacunación a pesar de la vacunación reciente. No obstante, se cree que las vacunas brindan protección contra enfermedades graves, hospitalizaciones y muertes debido a la variante ómicron. [259]
Ajustes de la vacuna
En junio de 2022, Pfizer y Moderna desarrollaron vacunas bivalentes para proteger contra el SARS-CoV-2 de tipo salvaje y la variante ómicron. Las vacunas bivalentes son bien toleradas y ofrecen una inmunidad a la ómicron superior a las vacunas de ARNm anteriores. [260] En septiembre de 2022, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) autorizó las vacunas bivalentes. [261] [262] [263]
En junio de 2023, la FDA recomendó a los fabricantes que la formulación 2023-2024 de las vacunas contra la COVID-19 para su uso en los EE. UU. se actualizara para que fuera una vacuna monovalente contra la COVID-19 que utilizara el linaje XBB.1.5 de la variante Ómicron. [264] [265] En junio de 2024, la FDA recomendó a los fabricantes que la formulación 2024-2025 de las vacunas contra la COVID-19 para su uso en los EE. UU. se actualizara para que fuera una vacuna monovalente contra la COVID-19 que utilizara el linaje JN.1. [266]
En octubre de 2024, el Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA) emitió una opinión positiva para actualizar la composición de Bimervax, una vacuna dirigida a la subvariante Omicron XBB.1.16. [267]Eficacia contra la transmisión
A partir de 2022, las personas completamente vacunadas con infecciones posvacunación con la variante delta (B.1.617.2) del SARS-CoV-2 tienen una carga viral máxima similar a los casos no vacunados y pueden transmitir la infección en entornos domésticos. [268]
Mezclar y combinar
Según los estudios, la combinación de dos vacunas diferentes contra la COVID‑19, también llamada vacunación heteróloga , vacunación cruzada o método de combinación, brinda protección equivalente a la de las vacunas de ARNm, incluida la protección contra la variante Delta . Las personas que reciben la combinación de dos vacunas diferentes producen respuestas inmunitarias fuertes, con efectos secundarios no peores que los causados por los regímenes estándar. [269] [270]
Eventos adversos
Para la mayoría de las personas, los efectos secundarios, también llamados efectos adversos , de las vacunas contra la COVID-19 son leves y se pueden controlar en casa. Los efectos adversos de la vacunación contra la COVID-19 son similares a los de otras vacunas, y los efectos adversos graves son poco frecuentes. [271] [272] Los efectos adversos de la vacuna son más frecuentes que los del placebo, pero los grupos de placebo de los ensayos de la vacuna aún informaron efectos adversos que pueden atribuirse al efecto nocebo . [273]
Todas las vacunas que se administran mediante inyección intramuscular , incluidas las vacunas contra la COVID-19, tienen efectos secundarios relacionados con el traumatismo leve asociado con el procedimiento y la introducción de una sustancia extraña en el cuerpo. [274] Estos incluyen dolor, enrojecimiento, sarpullido e inflamación en el lugar de la inyección. Otros efectos secundarios comunes incluyen fatiga, dolor de cabeza, mialgia (dolor muscular) y artralgia (dolor articular), todos los cuales generalmente se resuelven sin tratamiento médico en unos pocos días. [13] [14] Como cualquier otra vacuna, algunas personas son alérgicas a uno o más ingredientes de las vacunas contra la COVID-19. Los efectos secundarios típicos son más fuertes y más comunes en personas más jóvenes y en dosis posteriores, y hasta el 20% de las personas informan un nivel disruptivo de efectos secundarios después de la segunda dosis de una vacuna de ARNm. [275] Estos efectos secundarios son menos comunes o más débiles en las vacunas inactivadas . [275] El agrandamiento de los ganglios linfáticos relacionado con la vacunación contra la COVID-19 ocurre en el 11,6% de quienes recibieron una dosis de la vacuna y en el 16% de quienes recibieron dos dosis. [276]
Los experimentos realizados en ratones muestran que las inyecciones intramusculares de nanopartículas de excipiente lipídico (una sustancia inactiva que sirve como vehículo o medio) hacen que las partículas entren en el plasma sanguíneo y en muchos órganos, con concentraciones más altas en el hígado y concentraciones más bajas en el bazo, las glándulas suprarrenales y los ovarios. La concentración más alta de nanopartículas se encontró en el propio lugar de la inyección. [277]
La vacunación contra la COVID-19 es segura para las personas que amamantan. [15] Se han reportado cambios temporales en el ciclo menstrual de mujeres jóvenes. Sin embargo, estos cambios son "pequeños en comparación con la variación natural y se revierten rápidamente". [278] En un estudio, las mujeres que recibieron ambas dosis de una vacuna de dos dosis durante el mismo ciclo menstrual (una situación atípica) pueden ver que su siguiente período comienza un par de días más tarde. Tienen aproximadamente el doble del riesgo habitual de un retraso clínicamente significativo (alrededor del 10% de estas mujeres, en comparación con aproximadamente el 4% de las mujeres no vacunadas). [278] La duración del ciclo vuelve a la normalidad después de dos ciclos menstruales posteriores a la vacunación. [278] Las mujeres que recibieron dosis en ciclos separados tuvieron aproximadamente la misma variación natural en la duración del ciclo que las mujeres no vacunadas. [278] Se han reportado otros efectos menstruales temporales, como un sangrado menstrual más abundante de lo normal después de la vacunación. [278]
Los eventos adversos graves asociados con las vacunas contra la COVID-19 son generalmente poco frecuentes, pero de gran interés para el público. [279] Las bases de datos oficiales de eventos adversos notificados incluyen
- VigiBase de la Organización Mundial de la Salud ;
- el Sistema de Notificación de Reacciones Adversas a las Vacunas de los Estados Unidos (VAERS);
- el sistema de tarjeta amarilla del Reino Unido ;
- el sistema EudraVigilance de la Agencia Europea de Medicamentos , que gestiona una transferencia periódica de datos sobre presuntas reacciones adversas a medicamentos que se producen en la UE al Centro de Vigilancia de Uppsala de la OMS . [280]
La mayor conciencia pública de estos sistemas de notificación y los requisitos de notificación adicionales en virtud de las normas de autorización de uso de emergencia de la FDA de EE. UU. han aumentado los eventos adversos notificados. [281] Los efectos secundarios graves son un área de estudio en curso y se han asignado recursos para tratar de comprenderlos mejor. [282] [283] [284] Las investigaciones actuales indican que la tasa y el tipo de efectos secundarios son de menor riesgo que la infección. Por ejemplo, aunque la vacunación puede desencadenar algunos efectos secundarios, los efectos experimentados a partir de una infección podrían ser peores. Los efectos secundarios neurológicos por contraer COVID-19 son cientos de veces más probables que los de la vacunación. [285]
Los efectos graves raros documentados incluyen:
- anafilaxia , un tipo grave de reacción alérgica . [286] La anafilaxia afecta a una persona por cada 250.000 a 400.000 dosis administradas. [275] [287]
- coágulos de sangre ( trombosis ). [286] Estas trombocitopenia y trombosis inmunitarias inducidas por la vacuna están asociadas con vacunas que utilizan un sistema de adenovirus (Janssen y Oxford-AstraZeneca). [286] Estas afectan a aproximadamente una persona por cada 100.000. [275]
- miocarditis y pericarditis , o inflamación del corazón. [286] Existe un riesgo poco común de miocarditis (inflamación del músculo cardíaco) o pericarditis (inflamación de la membrana que recubre el corazón) después de las vacunas de ARNm contra la COVID-19 (Moderna o Pfizer-BioNTech). Se estima que el riesgo de miocarditis después de la vacunación contra la COVID-19 es de 0,3 a 5 casos por cada 100 000 personas, y el riesgo más alto se da en varones jóvenes. [288] En un estudio poblacional israelí a nivel nacional (en el que se administró exclusivamente la vacuna Pfizer-BioNTech), la tasa de incidencia de miocarditis fue de 54 casos de 2,5 millones de receptores de la vacuna, con una tasa de incidencia general de 2 casos por cada 100 000 personas, y la incidencia más alta se observó en varones jóvenes (de 16 a 29 años) con 10 casos por cada 100 000 receptores de la vacuna. De los casos de miocarditis observados, el 76% fueron de gravedad leve, con un caso de shock cardiogénico (insuficiencia cardíaca) y una muerte (en una persona con una afección cardíaca preexistente) notificados dentro del período de seguimiento de 83 días. [289] Las vacunas contra la COVID-19 pueden proteger contra la miocarditis debido a una infección posterior por COVID-19. [290] El riesgo de miocarditis y pericarditis es significativamente mayor (hasta 11 veces mayor con respecto a la miocarditis) después de la infección por COVID-19 en comparación con la vacunación contra la COVID-19, con la posible excepción de los hombres más jóvenes (menores de 40 años) que pueden tener un mayor riesgo de miocarditis después de la segunda vacuna de ARNm de Moderna (97 casos adicionales de miocarditis por cada millón de personas vacunadas). [290]
- trombocitopenia trombótica y otras enfermedades autoinmunes, que se han notificado como eventos adversos después de la vacuna COVID-19. [291]
Hay informes poco frecuentes de cambios subjetivos en la audición, incluido el tinnitus , después de la vacunación. [287] [292] [293] [294]
Sociedad y cultura
Distribución
Nota sobre la tabla de esta sección: número y porcentaje de personas que han recibido al menos una dosis de la vacuna contra la COVID-19 (a menos que se indique lo contrario). Puede incluir la vacunación de no ciudadanos, lo que puede hacer que los totales superen el 100 % de la población local. La tabla se actualiza diariamente mediante un bot. [nota 2]
| Ubicación | Vacunado [b] | Porcentaje [c] | |
|---|---|---|---|
| Mundo [d] [e] | 5.645.247.500 | 70,70% | |
 | China [f] | 1.318.026.800 | 92,48% |
 | India | 1.027.438.900 | 72,08% |
 | Unión Europea [g] | 338.481.060 | 75,43% |
 | Estados Unidos [h] | 270.227.170 | 79,12% |
 | Indonesia | 204.419.400 | 73,31% |
 | Brasil | 189.643.420 | 90,17% |
 | Pakistán | 165.567.890 | 67,94% |
 | Bangladés | 151.507.170 | 89,45% |
 | Japón | 104.740.060 | 83,79% |
 | México | 97.179.496 | 75,56% |
 | Nigeria | 93.829.430 | 42,05% |
 | Vietnam | 90.497.670 | 90,79% |
 | Rusia | 89.081.600 | 61,19% |
 | Filipinas | 82.684.776 | 72,55% |
 | Irán | 65.199.830 | 72,83% |
 | Alemania | 64.876.300 | 77,15% |
 | Pavo | 57.941.052 | 66,55% |
 | Tailandia | 57.005.496 | 79,47% |
 | Egipto | 56.907.320 | 50,53% |
 | Francia | 54.677.680 | 82,50% |
 | Reino Unido | 53.806.964 | 78,92% |
 | Etiopía | 52.489.510 | 41,86% |
 | Italia [i] | 50.936.720 | 85,44% |
 | Corea del Sur | 44.764.956 | 86,45% |
 | Colombia | 43.012.176 | 83,13% |
 | Birmania | 41.551.930 | 77,30% |
 | Argentina | 41.529.056 | 91,46% |
 | España | 41.351.230 | 86,46% |
 | Canadá | 34.742.936 | 89,49% |
 | Tanzania | 34.434.932 | 53,21% |
 | Perú | 30.563.708 | 91,30% |
 | Malasia | 28.138.564 | 81,10% |
 | Nepal | 27.883.196 | 93,83% |
 | Arabia Saudita | 27.041.364 | 84,04% |
 | Marruecos | 25.020.168 | 67,03% |
 | Sudáfrica | 24.210.952 | 38,81% |
 | Polonia | 22.984.544 | 59,88% |
 | Mozambique | 22.869.646 | 70,03% |
 | Australia | 22.231.734 | 84,85% |
 | Venezuela | 22.157.232 | 78,54% |
 | Uzbekistán | 22.094.470 | 63,24% |
 | Taiwán | 21.899.240 | 93,51% |
 | Uganda | 20.033.188 | 42,34% |
 | Afganistán | 19.151.368 | 47,20% |
 | Chile | 18.088.516 | 92,51% |
 | Sri Lanka | 17.143.760 | 75,08% |
 | República Democrática del Congo | 17.045.720 | 16,65% |
 | Angola | 16.550.642 | 46,44% |
 | Ucrania | 16.267.198 | 39,63% |
 | Ecuador | 15.345.791 | 86,10% |
 | Camboya | 15.316.670 | 89,04% |
 | Sudán | 15.207.452 | 30,79% |
 | Kenia | 14.494.372 | 26,72% |
 | Ghana | 13.864.186 | 41,82% |
 | Costa de Marfil | 13.568.372 | 44,64% |
 | Países Bajos | 12.582.081 | 70,27% |
 | Zambia | 11.711.565 | 58,11% |
 | Irak | 11.332.925 | 25,72% |
 | Ruanda | 10.884.714 | 79,74% |
 | Kazajstán | 10.858.101 | 54,20% |
 | Cuba | 10.805.570 | 97,70% |
 | Emiratos Árabes Unidos | 9.991.089 | 97,55% |
 | Portugal | 9.821.414 | 94,28% |
 | Bélgica | 9.261.641 | 79,55% |
 | Somalia | 8.972.167 | 50,40% |
 | Guatemala | 8.937.923 | 50,08% |
 | Túnez | 8.896.848 | 73,41% |
 | Guinea | 8.715.641 | 62,01% |
 | Grecia | 7.938.031 | 76,24% |
 | Argelia | 7.840.131 | 17,24% |
 | Suecia | 7.775.726 | 74,14% |
 | Zimbabue | 7.525.882 | 46,83% |
 | República Dominicana | 7.367.193 | 65,60% |
 | Bolivia | 7.361.008 | 60,95% |
 | Israel | 7.055.466 | 77,51% |
 | República Checa | 6.982.006 | 65,42% |
 | Hong Kong | 6.920.057 | 92,69% |
 | Austria | 6.899.873 | 76,12% |
 | Honduras | 6.596.213 | 63,04% |
 | Bielorrusia | 6.536.392 | 71,25% |
 | Hungría | 6.420.354 | 66,30% |
 | Nicaragua | 6.404.524 | 95,15% |
 | Níger | 6.248.483 | 24,69% |
 | Suiza | 6.096.911 | 69,34% |
 | Burkina Faso | 6.089.089 | 27,05% |
 | Laos | 5.888.649 | 77,90% |
 | Sierra Leona | 5.676.123 | 68,58% |
 | Rumania | 5.474.507 | 28,56% |
 | Malaui | 5.433.538 | 26,42% |
 | Azerbaiyán | 5.373.253 | 52,19% |
 | Tayikistán | 5.328.277 | 52,33% |
 | Singapur | 5.287.005 | 93,58% |
 | Chad | 5.147.667 | 27,89% |
 | Jordán | 4.821.579 | 42,83% |
 | Dinamarca | 4.746.522 | 80,41% |
 | El Salvador | 4.659.970 | 74,20% |
 | Costa Rica | 4.650.636 | 91,52% |
 | Turkmenistán | 4.614.869 | 63,83% |
 | Finlandia | 4.524.288 | 81,24% |
 | Malí | 4.354.292 | 18,87% |
 | Noruega | 4.346.995 | 79,66% |
 | Sudán del Sur | 4.315.127 | 39,15% |
 | Nueva Zelanda | 4.302.330 | 83,84% |
 | República de Irlanda | 4.112.237 | 80,47% |
 | Paraguay | 3.995.915 | 59,11% |
 | Liberia | 3.903.802 | 72,65% |
 | Camerún | 3.753.733 | 13,58% |
 | Panamá | 3.746.041 | 85,12% |
 | Benín | 3.697.190 | 26,87% |
 | Kuwait | 3.457.498 | 75,33% |
 | Serbia | 3.354.075 | 49,39% |
 | Siria | 3.295.630 | 14,67% |
 | Omán | 3.279.632 | 69,33% |
 | Uruguay | 3.010.464 | 88,78% |
 | Katar | 2.852.178 | 98,61% |
 | Eslovaquia | 2.840.017 | 51,89% |
 | Líbano | 2.740.227 | 47,70% |
 | Madagascar | 2.710.365 | 8,90% |
 | Senegal | 2.684.696 | 15,21% |
 | República Centroafricana | 2.600.389 | 51,01% |
 | Croacia | 2.323.025 | 59,46% |
 | Libia | 2.316.327 | 32,07% |
 | Mongolia | 2.284.018 | 67,45% |
 | Ir | 2.255.579 | 24,81% |
 | Bulgaria | 2.155.863 | 31,58% |
 | Mauritania | 2.103.754 | 43,15% |
 | Palestina | 2.012.767 | 37,94% |
 | Lituania | 1.958.299 | 69,52% |
 | Botsuana | 1.951.054 | 79,96% |
 | Kirguistán | 1.736.541 | 24,97% |
 | Georgia | 1.654.504 | 43,60% |
 | Albania | 1.349.255 | 47,72% |
 | Letonia | 1.346.184 | 71,57% |
 | Eslovenia | 1.265.802 | 59,84% |
 | Bahréin | 1.241.174 | 80,94% |
 | Armenia | 1.150.915 | 39,95% |
 | Mauricio | 1.123.773 | 88,06% |
 | Moldavia | 1.109.524 | 36,50% |
 | Yemen | 1.050.202 | 2,75% |
 | Lesoto | 1.014.073 | 44,36% |
 | Bosnia y Herzegovina | 943.394 | 29,44% |
 | Kosovo | 906.858 | 52,79% |
 | Timor Oriental | 886.838 | 64,77% |
 | Estonia | 870,202 | 64,46% |
 | Jamaica | 859.773 | 30,28% |
 | Macedonia del Norte | 854.570 | 46,44% |
 | Trinidad y Tobago | 754.399 | 50,43% |
 | Guinea-Bissau | 747.057 | 35,48% |
 | Fiyi | 712.025 | 77,44% |
 | Bután | 699.116 | 89,52% |
 | República del Congo | 695.760 | 11,53% |
 | Macao | 679.703 | 96,50% |
 | Gambia | 674.314 | 25,58% |
 | Chipre | 671.193 | 71,37% |
 | Namibia | 629.767 | 21,79% |
 | Eswatini | 526.050 | 43,16% |
 | Haití | 521.396 | 4,53% |
 | Guayana | 497.550 | 60,56% |
 | Luxemburgo | 481.957 | 73,77% |
 | Malta | 478.953 | 90,68% |
 | Brunéi | 451.149 | 99,07% |
 | Comoras | 438.825 | 52,60% |
 | Yibuti | 421.573 | 37,07% |
 | Maldivas | 399.308 | 76,19% |
 | Papúa Nueva Guinea | 382.020 | 3,74% |
 | Cabo Verde | 356.734 | 68,64% |
 | Islas Salomón | 343.821 | 44,02% |
 | Gabón | 311.244 | 12,80% |
 | Islandia | 309.770 | 81,44% |
 | Chipre del Norte | 301.673 | 78,80% |
 | Montenegro | 292.783 | 47,63% |
 | Guinea Ecuatorial | 270.109 | 14,98% |
 | Surinam | 267.820 | 42,98% |
 | Belice | 258.473 | 64,18% |
 | Nueva Caledonia | 192.375 | 67,00% |
 | Samoa | 191.403 | 88,91% |
 | Polinesia Francesa | 190.908 | 68,09% |
 | Vanuatu | 176.624 | 56,42% |
 | Bahamas | 174.810 | 43,97% |
 | Barbados | 163.853 | 58,04% |
 | Santo Tomé y Príncipe | 140.256 | 61,97% |
 | Curazao | 108.601 | 58,59% |
 | Kiribati | 100.900 | 77,33% |
 | Aruba | 90,546 | 84,00% |
 | Seychelles | 88.520 | 70,52% |
 | Tonga | 87.375 | 83,17% |
 | Jersey | 84.365 | 81,52% |
 | Isla de Man | 69.560 | 82,67% |
 | Antigua y Barbuda | 64.290 | 69,24% |
 | Islas Caimán | 62.113 | 86,74% |
 | Santa Lucía | 60.140 | 33,64% |
 | Andorra | 57.913 | 72,64% |
 | Guernsey | 54.223 | 85,06% |
 | islas Bermudas | 48.554 | 74,96% |
 | Granada | 44.241 | 37,84% |
 | Gibraltar | 42.175 | 112,08% |
 | Islas Feroe | 41.715 | 77,19% |
 | Tierra Verde | 41.227 | 73,60% |
 | San Vicente y las Granadinas | 37.532 | 36,77% |
 | Burundi | 36.909 | 0,28% |
 | San Cristóbal y Nieves | 33.794 | 72,32% |
 | Dominica | 32.995 | 49,36% |
 | Islas Turcas y Caicos | 32.815 | 71,54% |
 | San Martín | 29.788 | 70,65% |
 | Mónaco | 28.875 | 74,14% |
 | Liechtenstein | 26.771 | 68,06% |
 | San Marino | 26.357 | 77,26% |
 | Islas Vírgenes Británicas | 19,466 | 50,77% |
 | Caribe Neerlandés | 19,109 | 66,69% |
 | Islas Cook | 15.112 | 102,48% |
 | Nauru | 13.106 | 110,87% |
 | Anguila | 10,858 | 76,45% |
 | Tuvalu | 9,763 | 97,51% |
 | Wallis y Futuna | 7.150 | 62,17% |
 | Santa Elena, Ascensión y Tristán de Acuña | 4.361 | 81,23% |
 | Islas Malvinas | 2.632 | 74,88% |
 | Tokelau | 2.203 | 95,29% |
 | Montserrat | 2.104 | 47,01% |
 | Niue | 1.638 | 88,83% |
 | Islas Pitcairn | 47 | 100,00% |
 | Corea del Norte | 0 | 0,00% |
| |||
Hasta el 12 de agosto de 2024 [update], se han administrado 13.530 millones de dosis de vacunas contra la COVID-19 en todo el mundo, y el 70,6 por ciento de la población mundial ha recibido al menos una dosis. [296] [297] Si bien en ese momento se administraban 4,19 millones de vacunas diariamente, solo el 22,3 por ciento de las personas en los países de bajos ingresos habían recibido al menos una primera vacuna en septiembre de 2022, según informes oficiales de las agencias nacionales de salud, que son recopilados por Our World in Data . [298]
Durante una pandemia con la rapidez y la escala de los casos de COVID-19 en 2020, organizaciones internacionales como la Organización Mundial de la Salud (OMS) y la Coalición para las Innovaciones en Preparación para Epidemias (CEPI), los desarrolladores de vacunas, los gobiernos y la industria evaluaron la distribución de la(s) vacuna(s) final(es). [299] Los países individuales que producen una vacuna pueden verse persuadidos de favorecer al mejor postor para la fabricación o de brindar un servicio de primera clase a su propio país. [300] [301] [302] Los expertos enfatizan que las vacunas autorizadas deben estar disponibles y ser asequibles para las personas que están en la primera línea de la atención médica y las más necesitadas. [300] [302]
En abril de 2020, se informó que el Reino Unido acordó trabajar con otros 20 países y organizaciones globales, incluidos Francia, Alemania e Italia, para encontrar una vacuna y compartir los resultados, y que los ciudadanos del Reino Unido no tendrían acceso preferencial a ninguna nueva vacuna COVID-19 desarrollada por universidades del Reino Unido financiadas por los contribuyentes. [303] Varias empresas planearon fabricar inicialmente una vacuna a precios artificialmente bajos y luego aumentar los precios para obtener rentabilidad más adelante si se necesitan vacunaciones anuales y a medida que los países crean existencias para necesidades futuras. [302]
La OMS se había fijado el objetivo de vacunar al 40% de la población de todos los países para finales de 2021 y al 70% para mediados de 2022, [304] pero muchos países no alcanzaron el objetivo del 40% a finales de 2021. [305] [306]Acceso
Los países tienen un acceso extremadamente desigual a la vacuna contra la COVID-19. No se ha logrado la equidad en materia de vacunas , ni siquiera se ha aproximado a ella. La inequidad ha perjudicado tanto a los países con acceso deficiente como a los países con buen acceso. [19] [20] [307]
Los países se comprometieron a comprar dosis de las vacunas contra la COVID-19 antes de que estuvieran disponibles. Aunque los países de altos ingresos representan solo el 14% de la población mundial, al 15 de noviembre de 2020, habían acordado comprar el 51% de todas las dosis vendidas previamente. Algunos países de altos ingresos compraron más dosis de las que serían necesarias para vacunar a toda su población. [18]
.jpg/440px-Fábrica_do_DF_produz_vacina_Sputnik_V_(50874839072).jpg)
En enero de 2021, el Director General de la OMS, Tedros Adhanom Ghebreyesus, advirtió sobre los problemas que existen en la distribución equitativa: “Se han administrado más de 39 millones de dosis de vacunas en al menos 49 países de altos ingresos. En un país de bajos ingresos, solo se han administrado 25 dosis. No 25 millones, ni 25 mil, solo 25” . [308]

En marzo de 2021, se reveló que Estados Unidos intentó convencer a Brasil de no comprar la vacuna Sputnik V contra la COVID-19, por temor a la "influencia rusa" en América Latina. [309] Según se informa, algunas naciones involucradas en disputas territoriales de larga data han visto bloqueado el acceso a las vacunas por naciones competidoras; Palestina ha acusado a Israel de bloquear la entrega de vacunas a Gaza , mientras que Taiwán ha sugerido que China ha obstaculizado sus esfuerzos por adquirir dosis de vacunas. [310] [311] [312]
Una dosis única de las vacunas contra la COVID-19 de AstraZeneca costaría 47 libras egipcias (EGP), y las autoridades las están vendiendo a entre 100 y 200 EGP. Un informe de la Fundación Carnegie para la Paz Internacional citó la tasa de pobreza en Egipto en torno al 29,7 por ciento, lo que representa aproximadamente 30,5 millones de personas, y afirmó que alrededor de 15 millones de egipcios no podrían acceder al lujo de la vacunación. Un abogado de derechos humanos, Khaled Ali, presentó una demanda contra el gobierno, obligándolo a proporcionar vacunas gratuitas a todos los miembros del público. [313]

Según el inmunólogo Anthony Fauci , las cepas mutantes del virus y la distribución limitada de vacunas plantean riesgos continuos, y dijo: "Tenemos que vacunar a todo el mundo, no solo a nuestro propio país". [314] Edward Bergmark y Arick Wierson están pidiendo un esfuerzo de vacunación global y escribieron que la mentalidad de "yo primero" de las naciones más ricas podría, en última instancia, ser contraproducente porque la propagación del virus en los países más pobres conduciría a más variantes, contra las cuales las vacunas podrían ser menos efectivas. [315]
En marzo de 2021, Estados Unidos, Gran Bretaña, los estados miembros de la Unión Europea y algunos otros miembros de la Organización Mundial del Comercio (OMC) bloquearon una iniciativa de más de ochenta países en desarrollo para renunciar a los derechos de patente de las vacunas contra la COVID-19 en un esfuerzo por impulsar la producción de vacunas para las naciones pobres. [316] El 5 de mayo de 2021, el gobierno estadounidense bajo la presidencia de Joe Biden anunció que apoya la renuncia a las protecciones de propiedad intelectual para las vacunas contra la COVID-19. [317] Los miembros del Parlamento Europeo han respaldado una moción que exige el levantamiento temporal de los derechos de propiedad intelectual para las vacunas contra la COVID-19. [318]

En una reunión celebrada en abril de 2021, el comité de emergencia de la Organización Mundial de la Salud abordó las preocupaciones sobre la persistente inequidad en la distribución mundial de vacunas. [319] Aunque el 9 por ciento de la población mundial vive en los 29 países más pobres, estos países habían recibido solo el 0,3% de todas las vacunas administradas hasta mayo de 2021. [320] En marzo de 2021, la agencia de periodismo brasileña Agência Pública informó que el país vacunó a aproximadamente el doble de personas que se declaran blancas que negras y señaló que la mortalidad por COVID-19 es mayor en la población negra. [321]
En mayo de 2021, UNICEF hizo un llamamiento urgente a los países industrializados para que mancomunaran su capacidad excedente de vacunas contra la COVID-19 para compensar la brecha de 125 millones de dosis en el programa COVAX . El programa dependía principalmente de la vacuna contra la COVID-19 de Oxford-AstraZeneca producida por el Serum Institute de la India , que enfrentó graves problemas de suministro debido al aumento de las necesidades nacionales de vacunas en la India entre marzo y junio de 2021. Solo se puede distribuir de manera eficiente una cantidad limitada de vacunas, y el déficit de vacunas en América del Sur y partes de Asia se debe a la falta de donaciones oportunas de los países más ricos. Las organizaciones de ayuda internacional han señalado a Nepal, Sri Lanka y las Maldivas, así como a la Argentina, el Brasil y algunas partes del Caribe, como zonas problemáticas donde escasean las vacunas. A mediados de mayo de 2021, UNICEF también criticó el hecho de que la mayoría de las donaciones propuestas de vacunas de Moderna y Pfizer no estaban previstas para su entrega hasta la segunda mitad de 2021 o principios de 2022. [322]

En julio de 2021, los jefes del Grupo Banco Mundial, el Fondo Monetario Internacional, la Organización Mundial de la Salud y la Organización Mundial del Comercio dijeron en una declaración conjunta: "Mientras muchos países luchan contra nuevas variantes y una tercera ola de infecciones por COVID-19, acelerar el acceso a las vacunas se vuelve aún más crítico para poner fin a la pandemia en todas partes y lograr un crecimiento de base amplia. Estamos profundamente preocupados por las vacunas, terapias, diagnósticos y apoyo para las entregas disponibles para los países en desarrollo". [323] [324] En julio de 2021, The BMJ informó que los países habían desechado más de 250.000 dosis de vacunas porque la oferta excedió la demanda y las leyes estrictas impidieron compartir las vacunas. [325] Una encuesta de The New York Times encontró que más de un millón de dosis de vacunas habían sido desechadas en diez estados de EE. UU. porque las regulaciones federales prohíben retirarlas, impidiendo su redistribución en el extranjero. [326] Además, las dosis donadas cerca de su vencimiento a menudo no pueden ser administradas con la suficiente rapidez por los países receptores y terminan teniendo que ser descartadas. [327] Para ayudar a superar este problema, el Primer Ministro de la India, Narendra Modi , anunció que pondrían a disposición de la comunidad global su plataforma de gestión de vacunación digital, CoWIN . También anunció que la India también publicaría el código fuente de la aplicación de rastreo de contactos Aarogya Setu para desarrolladores de todo el mundo. Alrededor de 142 países, incluidos Afganistán, Bangladesh, Bután, Maldivas, Guyana, Antigua y Barbuda, San Cristóbal y Nieves y Zambia, expresaron su interés en la aplicación para la gestión de la COVID. [328] [329]
Amnistía Internacional y Oxfam Internacional han criticado el apoyo a los monopolios de vacunas por parte de los gobiernos de los países productores, señalando que esto está aumentando drásticamente el precio de las dosis cinco veces y, a menudo, mucho más, creando una barrera económica para el acceso de los países pobres. [330] [331] Médicos Sin Fronteras (Médicos sin Fronteras) también ha criticado los monopolios de vacunas y ha pedido repetidamente su suspensión, apoyando la exención de los ADPIC . La exención se propuso por primera vez en octubre de 2020 y cuenta con el apoyo de la mayoría de los países, pero se retrasó por la oposición de la UE (especialmente Alemania; los principales países de la UE como Francia, Italia y España apoyan la exención), [332] el Reino Unido, Noruega y Suiza, entre otros. MSF convocó un Día de Acción en septiembre de 2021 para presionar la reunión de Ministros de la OMC en noviembre, que se esperaba que discutiera la exención de propiedad intelectual de los ADPIC . [333] [334] [335]

En agosto de 2021, para reducir la distribución desigual entre países ricos y pobres, la OMS pidió una moratoria sobre las dosis de refuerzo al menos hasta finales de septiembre. Sin embargo, en agosto, el gobierno de Estados Unidos anunció planes para ofrecer dosis de refuerzo ocho meses después del curso inicial a la población general, comenzando por los grupos prioritarios. Antes del anuncio, la OMS criticó duramente este tipo de decisiones, citando la falta de evidencia de la necesidad de refuerzos, excepto para pacientes con afecciones específicas. En ese momento, la cobertura de la vacuna con al menos una dosis era del 58% en los países de altos ingresos y solo del 1,3% en los países de bajos ingresos, y 1,14 millones de estadounidenses ya habían recibido una dosis de refuerzo no autorizada. Los funcionarios estadounidenses argumentaron que la disminución de la eficacia contra la enfermedad leve y moderada podría indicar una protección reducida contra la enfermedad grave en los próximos meses. Israel, Francia, Alemania y el Reino Unido también han comenzado a planificar refuerzos para grupos específicos. [336] [337] [338] En septiembre de 2021, más de 140 exlíderes mundiales y premios Nobel, incluido el expresidente de Francia François Hollande , el exprimer ministro del Reino Unido Gordon Brown , la exprimera ministra de Nueva Zelanda Helen Clark y el profesor Joseph Stiglitz , pidieron a los candidatos a ser el próximo canciller alemán que se declararan a favor de renunciar a las normas de propiedad intelectual para las vacunas COVID-19 y transferir tecnologías de vacunas. [339] En noviembre de 2021, los sindicatos de enfermería de 28 países presentaron una apelación formal ante las Naciones Unidas por la negativa del Reino Unido, la UE, Noruega, Suiza y Singapur a renunciar temporalmente a las patentes de las vacunas COVID-19. [340]
Durante su primer viaje internacional, el presidente del Perú , Pedro Castillo , intervino en el septuagésimo sexto período de sesiones de la Asamblea General de las Naciones Unidas el 21 de septiembre de 2021, proponiendo la creación de un tratado internacional firmado por los líderes mundiales y las empresas farmacéuticas para garantizar el acceso universal a las vacunas, argumentando que “La batalla contra la pandemia nos ha demostrado el fracaso de la comunidad internacional a la hora de cooperar bajo el principio de solidaridad”. [341] [342]
La optimización del beneficio social de la vacunación puede beneficiarse de una estrategia adaptada al estado de la pandemia, la demografía de un país, la edad de los receptores, la disponibilidad de vacunas y el riesgo individual de enfermedad grave. [12] En el Reino Unido, el intervalo entre la dosis principal y la de refuerzo se amplió para vacunar a la mayor cantidad de personas lo antes posible. [343] Muchos países están empezando a dar una dosis de refuerzo adicional a los inmunodeprimidos [344] [345] y a los ancianos, [346] y la investigación predice un beneficio adicional de personalizar las dosis de la vacuna en el contexto de una disponibilidad limitada de la vacuna cuando una ola de variantes de preocupación del virus golpea a un país. [347]
A pesar del desarrollo extremadamente rápido de vacunas eficaces de ARNm y de vectores virales , no se ha logrado la equidad en materia de vacunas . [19] La Organización Mundial de la Salud pidió que el 70 por ciento de la población mundial estuviera vacunada para mediados de 2022, pero a marzo de 2022, se estimó que solo el uno por ciento de las 10 mil millones de dosis administradas en todo el mundo se habían administrado en países de bajos ingresos. [348] Es posible que se necesiten 6 mil millones de vacunas adicionales para llenar los vacíos de acceso a las vacunas, en particular en los países en desarrollo. Dada la disponibilidad proyectada de vacunas más nuevas, también se recomienda el desarrollo y uso de vacunas de virus inactivados completos (WIV) y basadas en proteínas. Organizaciones como la Red de Fabricantes de Vacunas de Países en Desarrollo podrían ayudar a respaldar la producción de dichas vacunas en los países en desarrollo, con menores costos de producción y mayor facilidad de implementación. [19] [349]
Si bien las vacunas reducen sustancialmente la probabilidad y la gravedad de la infección, aún es posible que las personas completamente vacunadas contraigan y propaguen la COVID-19. [350] Los organismos de salud pública han recomendado que las personas vacunadas sigan utilizando medidas preventivas (usar mascarillas, mantener la distancia social, lavarse las manos) para evitar infectar a otras personas, especialmente a las personas vulnerables, en particular en áreas con alta propagación comunitaria. Los gobiernos han indicado que dichas recomendaciones se reducirán a medida que aumenten las tasas de vacunación y disminuya la propagación comunitaria. [351]
Ciencias económicas
Además, una distribución desigual de las vacunas profundizará la desigualdad y exagerará la brecha entre ricos y pobres y revertirá décadas de avances en materia de desarrollo humano logrados con mucho esfuerzo.
— Naciones Unidas, Vacunas contra la COVID-19: aumento de la desigualdad y millones de personas vulnerables [352]
La inequidad en materia de vacunas daña la economía mundial y altera la cadena de suministro global . [307] La mayoría de las vacunas estaban reservadas para los países ricos; a septiembre de 2021 [update], [352] algunos países tienen más vacunas de las que se necesitan para vacunar completamente a sus poblaciones. [18] Cuando las personas están subvacunadas, mueren innecesariamente, sufren discapacidades y viven bajo restricciones de confinamiento, no pueden suministrar los mismos bienes y servicios. Esto perjudica por igual a las economías de los países subvacunados y sobrevacunados. Como los países ricos tienen economías más grandes, pueden perder más dinero por la inequidad en materia de vacunas que los pobres, [307] aunque estos últimos perderán un mayor porcentaje del PIB y experimentarán efectos a más largo plazo. [353] Se estima que los países de altos ingresos obtendrían 4,80 dólares estadounidenses por cada dólar gastado en dar vacunas a los países de bajos ingresos. [307]
El Fondo Monetario Internacional considera que la brecha en materia de vacunas entre las naciones ricas y pobres es un serio obstáculo para la recuperación económica mundial. [354] La inequidad en materia de vacunas afecta desproporcionadamente a los estados que proporcionan refugio, ya que tienden a ser más pobres, y los refugiados y las personas desplazadas son económicamente más vulnerables incluso dentro de esos estados de bajos ingresos, por lo que han sufrido más económicamente por la inequidad en materia de vacunas. [355] [19]
Responsabilidad
Varios gobiernos acordaron proteger a empresas farmacéuticas como Pfizer y Moderna de demandas por negligencia relacionadas con las vacunas (y tratamientos) contra la COVID-19, como en pandemias anteriores , cuando los gobiernos también asumieron la responsabilidad por dichas demandas.
En Estados Unidos, estas protecciones de responsabilidad entraron en vigor el 4 de febrero de 2020, cuando el Secretario de Salud y Servicios Humanos, Alex Azar , publicó un aviso de declaración en virtud de la Ley de Preparación Pública y Emergencias (PREP Act) para contramedidas médicas contra la COVID-19, que abarca "cualquier vacuna, utilizada para tratar, diagnosticar, curar, prevenir o mitigar la COVID-19, o la transmisión del SARS-CoV-2 o un virus que mute a partir de ella". La declaración excluye "las reclamaciones de responsabilidad que aleguen negligencia por parte de un fabricante al crear una vacuna, o negligencia por parte de un proveedor de atención médica al recetar la dosis incorrecta, salvo que haya una mala conducta intencional". En otras palabras, salvo que haya una "mala conducta intencional", estas empresas no pueden ser demandadas por daños monetarios por cualquier lesión que ocurra entre 2020 y 2024 por la administración de vacunas y tratamientos relacionados con la COVID-19. [356] La declaración entrará en vigor en los Estados Unidos hasta el 1 de octubre de 2024. [356]
En diciembre de 2020, el gobierno del Reino Unido otorgó a Pfizer una indemnización legal por su vacuna contra la COVID-19. [357]
En la Unión Europea, las vacunas contra la COVID-19 recibieron una autorización de comercialización condicional, que no exime a los fabricantes de reclamaciones por responsabilidad civil y administrativa. [358] Las autorizaciones de comercialización condicionales de la UE se cambiaron a autorizaciones estándar en septiembre de 2022. [359] Si bien los contratos de compra con los fabricantes de vacunas siguen siendo secretos, no contienen exenciones de responsabilidad, ni siquiera por efectos secundarios no conocidos en el momento de la autorización. [360]
La Oficina de Periodismo de Investigación , una organización de noticias sin fines de lucro, informó en una investigación que funcionarios anónimos en algunos países, como Argentina y Brasil, dijeron que Pfizer exigió garantías contra los costos de los casos legales debido a los efectos adversos en forma de exenciones de responsabilidad y activos soberanos como reservas bancarias federales, edificios de embajadas o bases militares, yendo más allá de lo que se esperaba de otros países, como Estados Unidos. [361] Durante la investigación parlamentaria sobre la pandemia en Brasil , el representante de Pfizer dijo que sus términos para Brasil son los mismos que para todos los demás países con los que ha firmado acuerdos. [362]
El 13 de diciembre de 2022, el gobernador de Florida, Ron DeSantis , dijo que solicitaría a la Corte Suprema del estado que convocara a un gran jurado para investigar posibles violaciones con respecto a las vacunas COVID-19, [363] y declaró que su gobierno podría obtener "los datos ya sea que [las empresas] quieran darlos o no". [364]
El 30 de noviembre de 2023, el estado estadounidense de Texas demandó a Pfizer en virtud del artículo 17.47 de la Ley de Prácticas Comerciales Engañosas de Texas , alegando que la empresa engañó al público sobre su vacuna contra la Covid-19 al ocultar riesgos mientras hacía afirmaciones falsas sobre su eficacia. [365] [366] El 17 de junio de 2024, el estado estadounidense de Kansas demandó de manera similar a Pfizer en virtud de la Ley de Protección al Consumidor de Kansas , haciendo acusaciones similares. [367]
Controversia
En junio de 2021, un informe reveló que la vacuna UB-612 , desarrollada por Covaxx, con sede en Estados Unidos, era una empresa con fines de lucro iniciada por el fundador de Blackwater , Erik Prince . En una serie de mensajes de texto a Paul Behrends, el colaborador cercano reclutado para el proyecto Covaxx, Prince describió las posibilidades de generar ganancias al vender las vacunas contra la COVID-19. Covaxx no proporcionó datos de los ensayos clínicos sobre seguridad o eficacia que realizó en Taiwán. La responsabilidad de crear redes de distribución fue asignada a una entidad con sede en Abu Dhabi, que se mencionaba como "Windward Capital" en el membrete de Covaxx, pero que en realidad era Windward Holdings. El único accionista de la empresa, que manejaba "actividades profesionales, científicas y técnicas", era Erik Prince. En marzo de 2021, Covaxx recaudó 1.350 millones de dólares en una colocación privada. [368]
Desinformación y vacilación

En muchos países, la difusión de diversas afirmaciones y perspectivas sobre las vacunas contra la COVID-19 ha provocado un amplio debate público. Entre ellas, se incluyen preocupaciones sobre los posibles efectos secundarios, diferentes interpretaciones de cómo responde el sistema inmunitario a la vacunación y debates sobre el desarrollo y la distribución de las vacunas contra la COVID-19. Además, también han surgido historias como la de que la COVID-19 está vinculada a la tecnología 5G y otra información debatida. [370] Esta difusión de información, incluido el contenido de los defensores de la vacunación, puede haber influido en las actitudes de las personas hacia la vacunación. En respuesta, los gobiernos y las organizaciones privadas de todo el mundo han introducido medidas para fomentar o exigir la vacunación, como loterías, [ 371] mandatos [372] y entrada gratuita a eventos. [373] Estas medidas han alimentado aún más los debates sobre su legalidad y eficacia. [374]
En Estados Unidos, algunos científicos biomédicos destacados que apoyan públicamente la vacunación han informado haber recibido amenazas y acoso a través de correos electrónicos y redes sociales por parte de personas que se oponen a la vacunación. [375]El Departamento de Defensa de los Estados Unidos (DoD) emprendió una campaña de desinformación en Filipinas, que luego se expandió a Asia Central y Oriente Medio, que buscaba desacreditar a China, en particular su vacuna Sinovac , difundiendo hashtags de #ChinaIsTheVirus y publicaciones que afirmaban que la vacuna Sinovac contenía gelatina de cerdo y, por lo tanto, era haram o estaba prohibida a los efectos de la ley islámica. [376]
Véase también
- Desarrollo de fármacos contra la COVID-19
- Investigación sobre la reutilización de medicamentos contra la COVID-19
Notas
- ^ "Mapas de vacunación (OWID)". Our World in Data . Archivado desde el original el 21 de diciembre de 2021. Mathieu E, Ritchie H, Rodés-Guirao L, Appel C, Giattino C, Hasell J, et al. (5 de marzo de 2020). «Preguntas frecuentes sobre datos». Our World in Data . Archivado desde el original el 10 de marzo de 2021.
- ^ Los datos de la tabla se actualizan automáticamente a diario mediante un bot; consulte la Plantilla:Datos de COVID-19 para obtener más información. Desplácese hacia abajo más allá de la tabla para encontrar la documentación y la referencia principal. Consulte también: Categoría:Plantillas de tablas de pandemia de COVID-19 actualizadas automáticamente .
Referencias
- ^ Li YD, Chi WY, Su JH, Ferrall L, Hung CF, Wu TC (diciembre de 2020). "Desarrollo de vacunas contra el coronavirus: desde el SARS y el MERS hasta la COVID-19". Revista de ciencias biomédicas . 27 (1): 104. doi : 10.1186/s12929-020-00695-2 . PMC 7749790 . PMID 33341119.
- ^ Subbarao K (julio de 2021). "El éxito de las vacunas contra el SARS-CoV-2 y los desafíos futuros". Cell Host & Microbe . 29 (7): 1111–1123. doi : 10.1016/j.chom.2021.06.016 . PMC 8279572 . PMID 34265245.
- ^ abcd Rogers K (11 de mayo de 2022). «Vacuna contra la COVID-19». Encyclopædia Britannica . Archivado desde el original el 12 de junio de 2022. Consultado el 12 de junio de 2022 .
- ^ "Swissmedic autoriza la primera vacuna contra la COVID-19 en Suiza" (Comunicado de prensa). Agencia Suiza de Productos Terapéuticos (Swissmedic) . 18 de diciembre de 2020. Archivado desde el original el 2 de mayo de 2021. Consultado el 5 de julio de 2022 .
- ^ "EMA recomienda la autorización de la primera vacuna contra la COVID-19 en la UE". Agencia Europea de Medicamentos (EMA) (Nota de prensa). 21 de diciembre de 2020. Archivado desde el original el 30 de enero de 2021 . Consultado el 21 de diciembre de 2020 .
- ^ "La vacuna contra la COVID-19 Ad5-nCoV-S [recombinante] de CanSino Biologics: lo que necesita saber". www.who.int . Consultado el 12 de julio de 2024 .
- ^ Dodaran MS, Banihashemi SR, Es-haghi A, Mehrabadi MH, Nofeli M, Mokarram AR, et al. (16 de febrero de 2023). "Inmunogenicidad y seguridad de una vacuna combinada intramuscular/intranasal con proteína de espiga recombinante (RCP) contra la COVID-19 en adultos sanos de entre 18 y 55 años: un ensayo de fase I aleatorizado, doble ciego y controlado con placebo". Vacunas . 11 (2): 455. doi : 10.3390/vaccines11020455 . PMC 9961243 . PMID 36851334.
- ^ Puga-Gómez R, Ricardo-Delgado Y, Rojas-Iriarte C, Céspedes-Henriquez L, Piedra-Bello M, Vega-Mendoza D, et al. (enero de 2023). "Ensayo clínico abierto de fase I/II de la vacuna conjugada con toxoide tetánico y dominio de unión al receptor del SARS-CoV-2 (FINLAY-FR-2) en combinación con la vacuna con proteína del dominio de unión al receptor (FINLAY-FR-1A) en niños" . Revista Internacional de Enfermedades Infecciosas . 126 : 164-173. doi :10.1016/j.ijid.2022.11.016. PMC 9673084 . PMID 36403819 . Consultado el 28 de junio de 2024 .
- ^ Mallapaty S, Callaway E, Kozlov M, Ledford H, Pickrell J, Van Noorden R (diciembre de 2021). "Cómo las vacunas contra la COVID dieron forma a 2021 en ocho gráficos poderosos". Nature . 600 (7890): 580–583. Bibcode :2021Natur.600..580M. doi : 10.1038/d41586-021-03686-x . PMID 34916666. S2CID 245262732.
- ^ Watson OJ, Barnsley G, Toor J, Hogan AB, Winskill P, Ghani AC (junio de 2022). "Impacto global del primer año de vacunación contra la COVID-19: un estudio de modelado matemático". The Lancet Infectious Diseases . 22 (9): 1293–1302. doi : 10.1016/s1473-3099(22)00320-6 . PMC 9225255 . PMID 35753318.
- ^ Beaumont P (18 de noviembre de 2020). «Vacuna contra la COVID-19: ¿a quiénes están priorizando los países para las primeras dosis?». The Guardian . ISSN 0261-3077. Archivado desde el original el 18 de enero de 2021. Consultado el 26 de diciembre de 2020 .
- ^ ab Wang H, Xu R, Qu S, Schwartz M, Adams A, Chen X (octubre de 2021). "Inequidades sanitarias en la vacunación contra la COVID-19 entre los ancianos: caso de Connecticut". Revista de infecciones y salud pública . 14 (10): 1563–1565. doi :10.1016/j.jiph.2021.07.013. PMC 8491089 . PMID 34326008. S2CID 236515442.
- ^ ab Documento de referencia sobre la vacuna ARNm-1273 (Moderna) contra la COVID-19 (informe). Organización Mundial de la Salud (OMS). Febrero de 2021. hdl : 10665/339218 . OMS/2019-nCoV/vacunas/Recomendación_SAGE/ARNm-1273/antecedentes/2021.1. Archivado desde el original el 13 de junio de 2021 . Consultado el 24 de julio de 2021 .
- ^ ab «Documento de referencia sobre la vacuna ARNm-1273 (Moderna) contra la COVID-19». Organización Mundial de la Salud (OMS). Archivado desde el original el 26 de enero de 2022. Consultado el 23 de enero de 2022 .
- ^ ab "Embarazo, lactancia materna, fertilidad y vacunación contra el coronavirus (COVID-19)". NHS. 5 de octubre de 2022. Archivado desde el original el 15 de octubre de 2022 . Consultado el 15 de octubre de 2022 .
- ^ Richie H, Ortiz-Ospina E, Beltekian D, Methieu E, Hasell J, Macdonald B, et al. (marzo de 2020). «Vacunas contra el coronavirus (COVID-19): estadísticas e investigación». Our World in Data . Archivado desde el original el 10 de marzo de 2021. Consultado el 7 de febrero de 2021 .
- ^ Mullard A (noviembre de 2020). "Cómo se están distribuyendo las vacunas contra la COVID en todo el mundo". Nature . doi :10.1038/d41586-020-03370-6. PMID 33257891. S2CID 227246811.
- ^ abc So AD, Woo J (diciembre de 2020). "Reserva de vacunas contra la enfermedad por coronavirus 2019 para acceso global: análisis transversal". BMJ . 371 : m4750. doi : 10.1136/bmj.m4750 . PMC 7735431 . PMID 33323376.
- ^ abcdef Hotez PJ, Bottazzi ME (enero de 2022). "Vacunas contra la COVID-19 basadas en proteínas y virus completamente inactivados". Revista Anual de Medicina . 73 (1): 55–64. doi : 10.1146/annurev-med-042420-113212 . ISSN 0066-4219. PMID 34637324. S2CID 238747462.
- ^ ab Ye Y, Zhang Q, Wei X, Cao Z, Yuan HY, Zeng DD (febrero de 2022). "El acceso equitativo a las vacunas contra la COVID-19 supone una diferencia vital para todos los países". Nature Human Behaviour . 6 (2): 207–216. doi : 10.1038/s41562-022-01289-8 . PMC 8873023 . PMID 35102361.
- ^ "El Premio Nobel de Fisiología o Medicina 2023". NobelPrize.org . Archivado desde el original el 4 de octubre de 2023. Consultado el 3 de octubre de 2023 .
- ^ "Científicos húngaros y estadounidenses ganan el Nobel por descubrimientos de vacunas contra la COVID-19". Reuters . 2 de octubre de 2023. Archivado desde el original el 8 de octubre de 2023 . Consultado el 3 de octubre de 2023 .
- ^ «El Premio Nobel de Fisiología o Medicina 2023». NobelPrize.org . Archivado desde el original el 4 de febrero de 2024. Consultado el 3 de octubre de 2023 .
- ^ abc Gates B (30 de abril de 2020). «La carrera por la vacuna explicada: lo que necesita saber sobre la vacuna contra la COVID-19». The Gates Notes. Archivado desde el original el 14 de mayo de 2020. Consultado el 2 de mayo de 2020 .
- ^ Cavanagh D (diciembre de 2003). "Desarrollo de una vacuna contra el síndrome respiratorio agudo severo: experiencias de vacunación contra el coronavirus de la bronquitis infecciosa aviar". Patología aviar . 32 (6): 567–582. doi : 10.1080/03079450310001621198 . PMC 7154303 . PMID 14676007.
- ^ Gao W, Tamin A, Soloff A, D'Aiuto L, Nwanegbo E, Robbins PD y col. (Diciembre de 2003). "Efectos de una vacuna contra el coronavirus asociada al SARS en monos". Lanceta . 362 (9399): 1895–1896. doi : 10.1016/S0140-6736(03)14962-8 . PMC 7112457 . PMID 14667748.
- ^ Kim E, Okada K, Kenniston T, Raj VS, AlHajri MM, Farag EA, et al. (octubre de 2014). "Inmunogenicidad de una vacuna adenoviral contra el coronavirus del síndrome respiratorio de Oriente Medio en ratones BALB/c". Vaccine . 32 (45): 5975–5982. doi : 10.1016/j.vaccine.2014.08.058 . PMC 7115510 . PMID 25192975.
- ^ Greenough TC, Babcock GJ, Roberts A, Hernandez HJ, Thomas WD, Coccia JA, et al. (febrero de 2005). "Desarrollo y caracterización de un anticuerpo monoclonal humano neutralizante del coronavirus asociado al síndrome respiratorio agudo severo que proporciona inmunoprofilaxis eficaz en ratones". The Journal of Infectious Diseases . 191 (4): 507–514. doi : 10.1086/427242 . PMC 7110081 . PMID 15655773.
- ^ Tripp RA, Haynes LM, Moore D, Anderson B, Tamin A, Harcourt BH, et al. (septiembre de 2005). "Anticuerpos monoclonales contra el coronavirus asociado al SARS (SARS-CoV): identificación de anticuerpos neutralizantes y reactivos a las proteínas virales S, N, M y E". Journal of Virological Methods . 128 (1–2): 21–28. doi :10.1016/j.jviromet.2005.03.021. PMC 7112802 . PMID 15885812.
- ^ Roberts A, Thomas WD, Guarner J, Lamirande EW, Babcock GJ, Greenough TC, et al. (marzo de 2006). "La terapia con un anticuerpo monoclonal humano neutralizante del coronavirus asociado al síndrome respiratorio agudo severo reduce la gravedad de la enfermedad y la carga viral en hámsteres sirios dorados". The Journal of Infectious Diseases . 193 (5): 685–692. doi :10.1086/500143. PMC 7109703 . PMID 16453264.
- ^ ab Jiang S, Lu L, Du L (enero de 2013). "Aún es necesario desarrollar vacunas y terapias contra el SARS". Future Virology . 8 (1): 1–2. doi :10.2217/fvl.12.126. PMC 7079997 . PMID 32201503.
- ^ «SARS (síndrome respiratorio agudo severo)». Servicio Nacional de Salud. 5 de marzo de 2020. Archivado desde el original el 9 de marzo de 2020 . Consultado el 31 de enero de 2020 .
- ^ Shehata MM, Gomaa MR, Ali MA, Kayali G (junio de 2016). "Coronavirus causante del síndrome respiratorio de Oriente Medio: una revisión exhaustiva". Frontiers of Medicine . 10 (2): 120–136. doi :10.1007/s11684-016-0430-6. PMC 7089261 . PMID 26791756.
- ^ Butler D (octubre de 2012). "Los veteranos del SARS se enfrentan al coronavirus". Nature . 490 (7418): 20. Bibcode :2012Natur.490...20B. doi : 10.1038/490020a . PMID 23038444.
- ^ Modjarrad K, Roberts CC, Mills KT, Castellano AR, Paolino K, Muthumani K, et al. (septiembre de 2019). "Seguridad e inmunogenicidad de una vacuna de ADN contra el coronavirus del síndrome respiratorio de Oriente Medio: un ensayo de fase 1, abierto, de un solo brazo y con escalada de dosis". The Lancet. Enfermedades infecciosas . 19 (9): 1013–1022. doi : 10.1016/S1473-3099(19)30266-X . PMC 7185789 . PMID 31351922.
- ^ Yong CY, Ong HK, Yeap SK, Ho KL, Tan WS (2019). "Avances recientes en el desarrollo de vacunas contra el síndrome respiratorio por coronavirus de Oriente Medio". Frontiers in Microbiology . 10 : 1781. doi : 10.3389/fmicb.2019.01781 . PMC 6688523 . PMID 31428074.
- ^ abc Loftus P, Hopkins JS, Pancevski B (17 de noviembre de 2020). «Moderna y Pfizer están reinventando las vacunas, empezando por la COVID». The Wall Street Journal . Archivado desde el original el 6 de noviembre de 2021. Consultado el 4 de octubre de 2021 .
- ^ Sharma O, Sultan AA, Ding H, Triggle CR (14 de octubre de 2020). "Una revisión del progreso y los desafíos del desarrollo de una vacuna contra la COVID-19". Frontiers in Immunology . 11 : 585354. doi : 10.3389/fimmu.2020.585354 . PMC 7591699 . PMID 33163000.
- ^ Bok K, Sitar S, Graham BS, Mascola JR (agosto de 2021). "Desarrollo acelerado de la vacuna contra la COVID-19: hitos, lecciones y perspectivas". Inmunidad . 54 (8): 1636–1651. doi :10.1016/j.immuni.2021.07.017. PMC 8328682 . PMID 34348117.
- ^ Lewis T. "La nueva vacuna de refuerzo contra la COVID podría salvarle la vida; póngase una ahora, dice un experto de la FDA". Scientific American . Archivado desde el original el 7 de noviembre de 2022 . Consultado el 8 de noviembre de 2022 .
- ^ Turner JS, O'Halloran JA, Kalaidina E, Kim W, Schmitz AJ, Zhou JQ, et al. (agosto de 2021). "Las vacunas de ARNm del SARS-CoV-2 inducen respuestas persistentes del centro germinal humano". Nature . 596 (7870): 109–113. Bibcode :2021Natur.596..109T. doi : 10.1038/s41586-021-03738-2 . PMC 8935394 . PMID 34182569.
- ^ "Estudio revela que las vacunas Pfizer y Moderna probablemente produzcan inmunidad duradera" . The New York Times . 28 de junio de 2021. Archivado desde el original el 28 de junio de 2021 . Consultado el 23 de enero de 2022 .
- ^ Flanagan KL, Best E, Crawford NW, Giles M, Koirala A, Macartney K, et al. (2020). "Progresos y dificultades en la búsqueda de vacunas eficaces contra el SARS-CoV-2 (COVID-19)". Frontiers in Immunology . 11 : 579250. doi : 10.3389/fimmu.2020.579250 . PMC 7566192 . PMID 33123165.
- ^ abcdefg Le TT, Cramer JP, Chen R, Mayhew S (octubre de 2020). "Evolución del panorama de desarrollo de la vacuna contra la COVID-19". Nature Reviews. Drug Discovery . 19 (10): 667–68. doi : 10.1038/d41573-020-00151-8 . PMID 32887942. S2CID 221503034.
- ^ ab "Rastreador de vacunas contra la COVID-19 (Actualizar URL)". London School of Hygiene & Tropical Medicine . 12 de julio de 2021. Archivado desde el original el 11 de octubre de 2020 . Consultado el 10 de marzo de 2021 .
- ^ Arbeitman CR, Rojas P, Ojeda-May P, Garcia ME (septiembre de 2021). "La proteína de pico del SARS-CoV-2 es vulnerable a campos eléctricos moderados". Nature Communications . 12 (1): 5407. arXiv : 2103.12733 . Bibcode :2021NatCo..12.5407A. doi : 10.1038/s41467-021-25478-7 . PMC 8437970 . PMID 34518528.
- ^ ab Grifoni A, Weiskopf D, Ramirez SI, Mateus J, Dan JM, Moderbacher CR, et al. (junio de 2020). "Objetivos de las respuestas de las células T al coronavirus SARS-CoV-2 en humanos con enfermedad COVID-19 e individuos no expuestos". Celúla . 181 (7): 1489–1501.e15. doi : 10.1016/j.cell.2020.05.015. PMC 7237901 . PMID 32473127.
- ^ Dutta NK, Mazumdar K, Gordy JT (junio de 2020). Dutch RE (ed.). "La proteína de la nucleocápside del SARS-CoV-2: un objetivo para el desarrollo de vacunas". Journal of Virology . 94 (13). doi :10.1128/JVI.00647-20. PMC 7307180 . PMID 32546606.
- ^ Nikolaidis M, Markoulatos P, Van de Peer Y, Oliver SG, Amoutzias GD (octubre de 2021). Hepp C (ed.). "El vecindario del gen Spike es un punto de acceso para la recombinación homóloga y no homóloga intertípica modular en los genomas del coronavirus". Biología molecular y evolución . 39 : msab292. doi :10.1093/molbev/msab292. PMC 8549283 . PMID 34638137.
- ^ Amoutzias GD, Nikolaidis M, Tryfonopoulou E, Chlichlia K, Markoulatos P, Oliver SG (enero de 2022). "La notable plasticidad evolutiva de los coronavirus por mutación y recombinación: perspectivas para la pandemia de COVID-19 y las futuras trayectorias evolutivas del SARS-CoV-2". Viruses . 14 (1): 78. doi : 10.3390/v14010078 . PMC 8778387 . PMID 35062282.
- ^ abcd Thanh Le T, Andreadakis Z, Kumar A, Gómez Román R, Tollefsen S, Saville M, et al. (mayo de 2020). "El panorama del desarrollo de la vacuna contra la COVID-19". Nature Reviews. Drug Discovery . 19 (5): 305–06. doi : 10.1038/d41573-020-00073-5 . PMID 32273591.
- ^ abc Diamond MS, Pierson TC (mayo de 2020). "Los desafíos del desarrollo de vacunas contra un nuevo virus durante una pandemia". Cell Host & Microbe . 27 (5): 699–703. doi :10.1016/j.chom.2020.04.021. PMC 7219397 . PMID 32407708.
- ^ Cross R (29 de septiembre de 2020). «El pequeño cambio en las vacunas contra la COVID-19». Chemical & Engineering News . Vol. 98, núm. 38. Archivado desde el original el 16 de febrero de 2021 . Consultado el 15 de abril de 2021 .
- ^ Krammer F (octubre de 2020). «Vacunas contra el SARS-CoV-2 en desarrollo». Nature . 586 (7830): 516–527. Bibcode :2020Natur.586..516K. doi : 10.1038/s41586-020-2798-3 . PMID 32967006. S2CID 221887746.
- ^ Park KS, Sun X, Aikins ME, Moon JJ (febrero de 2021). "Sistemas de administración de vacunas no virales contra la COVID-19". Advanced Drug Delivery Reviews . 169 : 137–151. doi :10.1016/j.addr.2020.12.008. ISSN 0169-409X. PMC 7744276 . PMID 33340620.
- ^ Kowalski PS, Rudra A, Miao L, Anderson DG (abril de 2019). "Entrega del mensajero: avances en tecnologías para la administración terapéutica de ARNm". Terapia molecular . 27 (4): 710–728. doi :10.1016/j.ymthe.2019.02.012. PMC 6453548 . PMID 30846391.
- ^ Verbeke R, Lentacker I, De Smedt SC, Dewitte H (octubre de 2019). "Tres décadas de desarrollo de vacunas de ARN mensajero". Nano Today . 28 : 100766. doi :10.1016/j.nantod.2019.100766. hdl : 1854/LU-8628303 . S2CID 202221207. Archivado desde el original el 9 de octubre de 2021 . Consultado el 17 de enero de 2021 .
- ^ "Recomendaciones del ACIP sobre la vacuna contra la COVID-19". Centros para el Control y la Prevención de Enfermedades (CDC) de EE. UU . Archivado desde el original el 3 de noviembre de 2021. Consultado el 18 de febrero de 2021 .
- ^ "Vacunas seguras contra la COVID-19 para los europeos". Comisión Europea . Archivado desde el original el 4 de noviembre de 2021. Consultado el 19 de febrero de 2021 .
- ^ "Resumen de la decisión regulatoria – Vacuna Pfizer–BioNTech contra la COVID-19". Health Canada, Gobierno de Canadá. 9 de diciembre de 2020. Archivado desde el original el 30 de enero de 2021. Consultado el 9 de diciembre de 2020 .
- ^ "Estudio para describir la seguridad, tolerabilidad, inmunogenicidad y eficacia de las vacunas candidatas de ARN contra la COVID-19 en adultos sanos". ClinicalTrials.gov . 30 de abril de 2020. NCT04368728. Archivado desde el original el 11 de octubre de 2020 . Consultado el 14 de julio de 2020 .
- ^ "Un ensayo multicéntrico de fase I/II, de 2 partes y con aumento de dosis que investiga la seguridad e inmunogenicidad de cuatro vacunas profilácticas de ARN del SARS-CoV-2 contra la COVID-19 utilizando diferentes regímenes de dosificación en adultos sanos". Registro de ensayos clínicos de la UE . 14 de abril de 2020. EudraCT 2020-001038-36. Archivado desde el original el 22 de abril de 2020. Consultado el 22 de abril de 2020 .
- ^ "Un estudio para evaluar la eficacia, seguridad e inmunogenicidad de la vacuna ARNm-1273 en adultos mayores de 18 años para prevenir la COVID-19". ClinicalTrials.gov . 14 de julio de 2020. NCT04470427. Archivado desde el original el 11 de octubre de 2020 . Consultado el 27 de julio de 2020 .
- ^ Palca J (27 de julio de 2020). «La vacuna candidata contra la COVID-19 se someterá a pruebas generalizadas en Estados Unidos», NPR. Archivado desde el original el 11 de octubre de 2020. Consultado el 27 de julio de 2020 .
- ^ "Los datos finales de CureVac del ensayo de fase 2b/3 de la vacuna candidata de primera generación contra la COVID-19, CVnCoV, demuestran protección en el grupo de edad de 18 a 60 años". CureVac (nota de prensa). 30 de junio de 2021. Archivado desde el original el 12 de octubre de 2021 . Consultado el 2 de julio de 2021 .
- ^ abc Moghimi SM (marzo de 2021). "Reacciones alérgicas y anafilaxia a las vacunas contra la COVID-19 basadas en LNP". Terapia molecular . 29 (3): 898–900. doi :10.1016/j.ymthe.2021.01.030. PMC 7862013 . PMID 33571463.
- ^ ab "¿Qué son las vacunas basadas en vectores virales y cómo podrían utilizarse contra la COVID-19?". Gavi, la Alianza para las Vacunas (GAVI). 2020. Archivado desde el original el 11 de noviembre de 2021. Consultado el 26 de enero de 2021 .
- ^ "Entender las vacunas contra la COVID-19 con vectores virales". Centros para el Control y la Prevención de Enfermedades (CDC) de EE. UU . . 13 de abril de 2021. Archivado desde el original el 13 de noviembre de 2021 . Consultado el 19 de abril de 2021 .
- ^ "Investigación de una vacuna contra la COVID-19". ClinicalTrials.gov . 26 de mayo de 2020. NCT04400838. Archivado desde el original el 11 de octubre de 2020 . Consultado el 14 de julio de 2020 .
- ^ "Estudio de fase 2/3 para determinar la eficacia, seguridad e inmunogenicidad de la vacuna candidata contra la enfermedad por coronavirus (COVID-19) ChAdOx1 nCoV-19". Registro de ensayos clínicos de la UE . 21 de abril de 2020. EudraCT 2020-001228-32. Archivado desde el original el 5 de octubre de 2020. Consultado el 3 de agosto de 2020 .
- ^ O'Reilly P (mayo de 2020). "Un estudio de fase III para investigar una vacuna contra la COVID-19". Registro ISRCTN . doi : 10.1186/ISRCTN89951424 .
- ^ Corum J, Carl Z (8 de enero de 2021). «Cómo funciona la vacuna de Gamaleya». The New York Times . Archivado desde el original el 20 de abril de 2021. Consultado el 27 de enero de 2021 .
- ^ "Un estudio de Ad26.COV2.S en adultos". 4 de agosto de 2020. Archivado desde el original el 16 de septiembre de 2020 . Consultado el 23 de agosto de 2020 .
- ^ "Un estudio de Ad26.COV2.S para la prevención de la COVID-19 mediada por SARS-CoV-2 en participantes adultos". Biblioteca Nacional de Medicina de EE. UU. Archivado desde el original el 26 de septiembre de 2020.
- ^ Johnson C, McGinley L. «Johnson & Johnson solicita autorización de emergencia de la FDA para una vacuna de una sola dosis contra el coronavirus». The Washington Post . Archivado desde el original el 5 de febrero de 2021. Consultado el 10 de febrero de 2021 .
- ^ "No se trata solo de Johnson & Johnson: China tiene una vacuna contra la COVID-19 de una sola dosis que tiene una eficacia del 65%". Fortune . Archivado desde el original el 8 de agosto de 2021 . Consultado el 28 de febrero de 2021 .
- ^ Wu S, Zhong G, Zhang J, Shuai L, Zhang Z, Wen Z, et al. (agosto de 2020). "Una dosis única de una vacuna con vector de adenovirus proporciona protección contra el SARS-CoV-2". Nat Commun . 11 (1): 4081. Bibcode :2020NatCo..11.4081W. doi :10.1038/s41467-020-17972-1. PMC 7427994 . PMID 32796842.
- ^ "La vacuna monodosis Sputnik Light ha sido autorizada para su uso en Rusia". Sputnik V (Nota de prensa). Archivado desde el original el 14 de noviembre de 2021 . Consultado el 12 de agosto de 2021 .
- ^ Sputnik V [@sputnikvaccine] (6 de mayo de 2021). "Presentamos un nuevo miembro de la familia Sputnik: ¡Sputnik Light, una vacuna de dosis única! Es una vacuna revolucionaria contra la COVID-19 de una sola dosis con una eficacia del 80%, superior a la de muchas vacunas de dos dosis. Sputnik Light duplicará las tasas de vacunación y ayudará a controlar los picos epidémicos https://t.co/BCybe8yYWU" ( Tweet ). Archivado desde el original el 8 de mayo de 2022. Consultado el 8 de diciembre de 2022 en Twitter .
- ^ Petrovsky N, Aguilar JC (octubre de 2004). "Adyuvantes de vacunas: estado actual y tendencias futuras". Inmunología y biología celular . 82 (5): 488–496. doi :10.1111/j.0818-9641.2004.01272.x. PMID 15479434. S2CID 154670.
- ^ "Estudio de seguridad e inmunogenicidad de la vacuna inactivada para la prevención de la infección por SARS-CoV-2 (COVID-19) (Renqiu)". ClinicalTrials.gov . 12 de mayo de 2020. NCT04383574. Archivado desde el original el 11 de octubre de 2020 . Consultado el 14 de julio de 2020 .
- ^ "Ensayo clínico de eficacia y seguridad de la vacuna adsorbida contra la COVID-19 (inactivada) de Sinovac en profesionales sanitarios (PROFISCOV)". ClinicalTrials.gov . 2 de julio de 2020. NCT04456595. Archivado desde el original el 11 de octubre de 2020 . Consultado el 3 de agosto de 2020 .
- ^ PT. Bio Farma (agosto de 2020). «Estudio de fase III, ciego para el observador, aleatorizado y controlado con placebo sobre la eficacia, seguridad e inmunogenicidad de la vacuna inactivada contra el SARS-COV-2 en adultos sanos de entre 18 y 59 años en Indonesia». Registri Penyakit Indonesia . Archivado desde el original el 11 de octubre de 2020 . Consultado el 15 de agosto de 2020 .
- ^ Chen W, Al Kaabi N (julio de 2020). «Un ensayo clínico de fase III para la vacuna inactivada contra la neumonía por el nuevo coronavirus (COVID-19) (células Vero)». Registro de ensayos clínicos chino . Archivado desde el original el 11 de octubre de 2020. Consultado el 15 de agosto de 2020 .
- ^ Ivanova P (20 de febrero de 2021). «Rusia aprueba su tercera vacuna contra la COVID-19, CoviVac». Reuters . Archivado desde el original el 28 de febrero de 2021. Consultado el 11 de abril de 2021 .
- ^ "Kazajstán lanza su propia vacuna contra la COVID-19". Reuters . 27 de abril de 2021. Archivado desde el original el 4 de noviembre de 2021 . Consultado el 2 de julio de 2021 .
- ^ "La agencia FarsNews de Irán autoriza la inyección de emergencia de una vacuna casera contra el coronavirus". Agencia de Noticias Fars . 14 de junio de 2021. Archivado desde el original el 9 de octubre de 2021. Consultado el 25 de agosto de 2021 .
- ^ "Vacuna VLA2001 contra la COVID-19". Precision Vaccinations . 31 de diciembre de 2020. Archivado desde el original el 13 de enero de 2021 . Consultado el 11 de enero de 2021 .
- ^ "Estudio de búsqueda de dosis para evaluar la seguridad, la tolerabilidad y la inmunogenicidad de una vacuna candidata contra el virus Sars-Cov-2 con adyuvante inactivado contra la COVID-19 en adultos sanos". Biblioteca Nacional de Medicina de EE. UU. 30 de diciembre de 2020. Archivado desde el original el 14 de febrero de 2021. Consultado el 11 de enero de 2021 .
- ^ "Módulo 2 – Vacunas de subunidades". Conceptos básicos de seguridad de las vacunas de la OMS . Archivado desde el original el 8 de agosto de 2021. Consultado el 17 de enero de 2021 .
- ^ "Estudio de la seguridad, reactogenicidad e inmunogenicidad de la vacuna "EpiVacCorona" para la prevención de la COVID-19 (EpiVacCorona)". ClinicalTrials.gov . 22 de septiembre de 2020. NCT04368988. Archivado desde el original el 29 de junio de 2021 . Consultado el 16 de noviembre de 2020 .
- ^ "La vacuna MVC contra la COVID-19 obtiene la autorización EUA de Taiwán". Medigen Vaccine Biologics . Archivado desde el original el 27 de noviembre de 2021. Consultado el 7 de agosto de 2021 .
- ^ Achom D (28 de diciembre de 2021). «India aprueba dos nuevas vacunas y la píldora Covid de Merck: 10 puntos». NDTV.com . Archivado desde el original el 28 de diciembre de 2021. Consultado el 19 de enero de 2022 .
- ^ Bottazzi ME, Hotez PJ (30 de diciembre de 2021). "Una vacuna contra la COVID para todos". Scientific American . Archivado desde el original el 30 de diciembre de 2021. Consultado el 19 de enero de 2022 .
- ^ "VidPrevtyn Beta". Agencia Europea de Medicamentos (EMA) . 4 de noviembre de 2022. Archivado desde el original el 11 de noviembre de 2022. Consultado el 12 de noviembre de 2022 .El texto se ha copiado de esta fuente, cuyos derechos de autor pertenecen a la Agencia Europea de Medicamentos. Se autoriza la reproducción siempre que se cite la fuente.
- ^ "EMA recomienda la aprobación de VidPrevtyn Beta como vacuna de refuerzo contra la COVID-19". Agencia Europea de Medicamentos (EMA) (Nota de prensa). 10 de noviembre de 2022. Archivado desde el original el 12 de noviembre de 2022 . Consultado el 12 de noviembre de 2022 .El texto se ha copiado de esta fuente, cuyos derechos de autor pertenecen a la Agencia Europea de Medicamentos. Se autoriza la reproducción siempre que se cite la fuente.
- ^ "La vacuna Irán-Cuba entra en la fase tres de ensayos clínicos". Tehran Times . 26 de abril de 2021. Archivado desde el original el 19 de julio de 2021 . Consultado el 7 de septiembre de 2021 .
- ^ Barrie R (31 de marzo de 2023). «El refuerzo de Hipra contra la Covid-19 recibe la aprobación de la EMA y entra en un panorama incierto». Tecnología farmacéutica . Archivado desde el original el 10 de abril de 2023. Consultado el 9 de abril de 2023 .
- ^ «Bimervax EPAR». Agencia Europea de Medicamentos . 5 de abril de 2023. Archivado desde el original el 8 de abril de 2023. Consultado el 9 de abril de 2023 .
- ^ «Medicamentos contra la COVID-19». Agencia Europea de Medicamentos (EMA) . 14 de octubre de 2024. Consultado el 14 de octubre de 2024 .
- ^ "Estudio sobre la seguridad, la tolerabilidad y la respuesta inmunitaria de la vacuna Sclamp contra el SARS-CoV-2 (COVID-19) en adultos sanos". ClinicalTrials.gov . 3 de agosto de 2020. NCT04495933. Archivado desde el original el 11 de octubre de 2020 . Consultado el 4 de agosto de 2020 .
- ^ "Los ensayos de vacunas en Australia se detuvieron debido a falsos positivos de VIH". Deutsche Welle . 11 de diciembre de 2020. Archivado desde el original el 26 de enero de 2021 . Consultado el 9 de enero de 2023 .
- ^ "Covid: la vacuna australiana abandonada por una respuesta falsa al VIH". BBC News Online . 11 de diciembre de 2020. Archivado desde el original el 16 de enero de 2021 . Consultado el 9 de abril de 2023 .
- ^ "Evaluación de la seguridad e inmunogenicidad de una vacuna de nanopartículas contra el SARS-CoV-2 rS (COVID-19) con o sin adyuvante Matrix-M". ClinicalTrials.gov . 30 de abril de 2020. NCT04368988. Archivado desde el original el 14 de julio de 2020 . Consultado el 14 de julio de 2020 .
- ^ "Estudio clínico prospectivo, aleatorizado y adaptativo de fase I/II para evaluar la seguridad e inmunogenicidad de la vacuna candidata contra el nuevo coronavirus −2019-nCov de M/s Cadila Healthcare Limited por vía intradérmica en sujetos sanos". India: Registro de ensayos clínicos. 15 de diciembre de 2020. CTRI/2020/07/026352. Archivado desde el original el 22 de noviembre de 2020.
- ^ "Seguridad, tolerabilidad e inmunogenicidad de INO-4800 para COVID-19 en voluntarios sanos". ClinicalTrials.gov . 7 de abril de 2020. NCT04336410. Archivado desde el original el 11 de octubre de 2020 . Consultado el 14 de julio de 2020 .
- ^ "IVI, INOVIO y KNIH se asociarán con CEPI en un ensayo clínico de fase I/II de la vacuna de ADN contra la COVID-19 de INOVIO en Corea del Sur". Instituto Internacional de Vacunas. 16 de abril de 2020. Archivado desde el original el 24 de septiembre de 2020. Consultado el 23 de abril de 2020 .
- ^ "Estudio de la vacuna de ADN contra la COVID-19 (AG0301-COVID19)". ClinicalTrials.gov . 9 de julio de 2020. NCT04463472. Archivado desde el original el 11 de octubre de 2020 . Consultado el 14 de julio de 2020 .
- ^ "Estudio de seguridad e inmunogenicidad de GX-19, una vacuna de ADN preventiva contra la COVID-19 en adultos sanos". ClinicalTrials.gov . 24 de junio de 2020. NCT04445389. Archivado desde el original el 11 de octubre de 2020 . Consultado el 14 de julio de 2020 .
- ^ "Genexine de Corea del Sur comienza los ensayos en humanos de la vacuna contra el coronavirus". Reuters. 19 de junio de 2020. Archivado desde el original el 11 de octubre de 2020. Consultado el 25 de junio de 2020 .
- ^ Chang LJ (marzo de 2020). "Seguridad e inmunidad de la vacuna aAPC contra la COVID-19". ClinicalTrials.gov . NCT04299724. Archivado desde el original el 11 de octubre de 2020. Consultado el 14 de julio de 2020 .
- ^ "Inmunidad y seguridad de la vacuna sintética minigénica contra la COVID-19". ClinicalTrials.gov . Febrero de 2020. NCT04276896. Archivado desde el original el 11 de octubre de 2020. Consultado el 14 de julio de 2020 .
- ^ "Estudio de fase I/II aleatorizado, multicéntrico, controlado con placebo y de aumento de dosis para evaluar la seguridad, inmunogenicidad y eficacia potencial de una vacuna rVSV-SARS-CoV-2-S (IIBR-100) en adultos". ClinicalTrials.gov . Noviembre de 2020. NCT04608305. Archivado desde el original el 3 de mayo de 2021 . Consultado el 2 de enero de 2021 .
- ^ Johnson CY, Mufson S (11 de junio de 2020). «¿Pueden las vacunas antiguas del botiquín de la ciencia protegerse del coronavirus?». The Washington Post . ISSN 0190-8286. Archivado desde el original el 11 de junio de 2020. Consultado el 31 de diciembre de 2020 .
- ^ "Vacunación con bacilo de Calmette-Guérin (BCG) y COVID-19". Organización Mundial de la Salud (OMS) . 12 de abril de 2020. Archivado desde el original el 30 de abril de 2020. Consultado el 1 de mayo de 2020 .
- ^ "Novavax atiende las urgentes necesidades sanitarias mundiales". Novavax. Archivado desde el original el 12 de mayo de 2021. Consultado el 30 de enero de 2021 .
- ^ ab Mudgal R, Nehul S, Tomar S (diciembre de 2020). "Perspectivas para la vacuna mucosal: cerrando la puerta al SARS-CoV-2". Vacunas e inmunoterapias humanas . 16 (12): 2921–2931. doi :10.1080/21645515.2020.1805992. PMC 7544966 . PMID 32931361.
- ^ ab Rhee JH (2020). "Enfoques actuales y nuevos para la administración de vacunas por vía mucosa". Vacunas por vía mucosa . Elsevier. págs. 325–356. doi :10.1016/b978-0-12-811924-2.00019-5. ISBN . 9780128119242. Número de pieza 7149853 .
- ^ "Vacuna viva atenuada contra la influenza [LAIV] (vacuna contra la influenza en aerosol nasal)". Centros para el Control y la Prevención de Enfermedades (CDC) de EE. UU. 3 de agosto de 2021. Archivado desde el original el 14 de octubre de 2019. Consultado el 8 de septiembre de 2021 .
- ^ "Dos vacunas de fabricación nacional reciben licencia de uso de emergencia". Tehran Times . 1 de noviembre de 2021 . Consultado el 5 de junio de 2024 .
- ^ Maksimova K. "Una científica del Centro Gamaleya habló sobre los beneficios de la vacuna nasal contra el coronavirus". sibmeda.ru . Consultado el 5 de junio de 2024 .
- ^ "Se han aprobado dos vacunas inhalables contra la covid, pero aún no sabemos qué tan buenas son". MIT Technology Review . Archivado desde el original el 21 de octubre de 2022 . Consultado el 21 de octubre de 2022 .
- ^ ab Waltz E (septiembre de 2022). "China e India aprueban las vacunas nasales contra la COVID: ¿son un cambio radical?". Nature . 609 (7927): 450. Bibcode :2022Natur.609..450W. doi : 10.1038/d41586-022-02851-0 . PMID 36071228. S2CID 252121594.
- ^ Dhama K, Dhawan M, Tiwari R, Emran TB, Mitra S, Rabaan AA y col. (noviembre de 2022). "Vacunas intranasales COVID-19: avances actuales, ventajas, perspectivas y desafíos". Vacunas humanas e inmunoterapias . 18 (5): 2045853. doi : 10.1080/21645515.2022.2045853. PMC 8935456 . PMID 35258416.
- ^ "关于印发新冠病毒疫苗第二剂次加强免疫接种实施方案的通知" (en chino). Comisión Nacional de Salud . 14 de diciembre de 2022 . Consultado el 14 de diciembre de 2022 .
- ^ ab Nistor GI, Dillman RO, Robles RM, Langford JL, Poole AJ, Sofro MA, et al. (agosto de 2022). "Una vacuna de células dendríticas personal contra la COVID-19 elaborada en el punto de atención: viabilidad, seguridad y respuestas inmunitarias celulares específicas de antígeno". Vacunas humanas e inmunoterapias . 18 (6): 2100189. doi : 10.1080/21645515.2022.2100189 . PMC 9746383. PMID 36018753 .
- ^ "Vacuna de células dendríticas, AV-COVID-19, para prevenir la infección por COVID-19". ClinicalTrials.gov . 30 de diciembre de 2020. Archivado desde el original el 13 de mayo de 2022 . Consultado el 5 de septiembre de 2022 .
- ^ "Vacuna preventiva de células dendríticas, AV-COVID-19, en sujetos no infectados activamente con COVID-19". ClinicalTrials.gov . 16 de agosto de 2021. Archivado desde el original el 18 de junio de 2022 . Consultado el 5 de septiembre de 2022 .
- ^ Mullin E (9 de junio de 2021). «Una vacuna 'universal' contra el coronavirus para prevenir la próxima pandemia». Scientific American . Archivado desde el original el 20 de diciembre de 2021. Consultado el 20 de diciembre de 2021 .
- ^ Joi P (13 de julio de 2021). «¿Podría una vacuna universal contra el coronavirus convertirse pronto en realidad?». GAVI . Archivado desde el original el 20 de diciembre de 2021. Consultado el 20 de diciembre de 2021 .
- ^ Bush E (15 de diciembre de 2021). "Fauci impulsa una vacuna universal contra el coronavirus". Noticias NBC . Archivado desde el original el 20 de diciembre de 2021 . Consultado el 20 de diciembre de 2021 .
- ^ "Plan nacional de preparación para la COVID-19" (PDF) . La Casa Blanca. Marzo de 2022. págs. 9, 21, 29. Archivado desde el original (PDF) el 26 de marzo de 2022 . Consultado el 29 de marzo de 2022 .
- ^ "Comienza el ensayo clínico de fase 1 de la vacuna contra la COVID-19 desarrollada por WRAIR". 5 de abril de 2022. Archivado desde el original el 11 de julio de 2022 . Consultado el 11 de julio de 2022 .
- ^ Ober Shepherd BL, Scott PT, Hutter JN, Lee C, McCauley MD, Guzman I, et al. (Grupo de estudio EID-030) (junio de 2024). "Vacuna de nanopartículas de ferritina de pico recombinante contra el SARS-CoV-2 adyuvada con la formulación de liposomas del ejército que contiene monofosforil lípido A y QS-21: un ensayo clínico de fase 1, aleatorizado, doble ciego, controlado con placebo, el primero en humanos". The Lancet. Microbio . 5 (6): e581–e593. doi :10.1016/S2666-5247(23)00410-X. PMC 11192176. PMID 38761816.
- ^ "Primer estudio en humanos para evaluar la seguridad y la inmunogenicidad de tres niveles de dosis de la vacuna candidata contra el coronavirus OVX033 en voluntarios sanos". clinicaltrials.gov . Consultado el 30 de agosto de 2024 .
- ^ "Seguridad e inmunogenicidad de una vacuna bivalente contra la COVID-19 con subunidad de proteína CD40.RBDv, con o sin adyuvante, como refuerzo en voluntarios". clinicaltrials.gov . Consultado el 30 de agosto de 2024 .
- ^ "Estudio de fase I de la vacuna contra el coronavirus pEVAC-PS". www.isrctn.com . Consultado el 30 de agosto de 2024 .
- ^ "Seguridad, tolerabilidad e inmunogenicidad de la vacuna candidata trivalente contra el coronavirus VBI-2901a". clinicaltrials.gov . Institutos Nacionales de Salud . Consultado el 30 de agosto de 2024 .
- ^ Haridy R (7 de julio de 2022). «Otra vacuna universal contra el coronavirus se prepara para ensayos en humanos». New Atlas . Archivado desde el original el 11 de julio de 2022 . Consultado el 11 de julio de 2022 .
- ^ abc Tregoning JS, Russell RF, Kinnear E (marzo de 2018). "Vacunas antigripales con adyuvante". Vacunas e inmunoterapias humanas . 14 (3): 550–564. doi :10.1080/21645515.2017.1415684. PMC 5861793. PMID 29232151 .
- ^ abcd Wang J, Peng Y, Xu H, Cui Z, Williams RO (agosto de 2020). "La carrera por la vacuna contra la COVID-19: desafíos y oportunidades en la formulación de vacunas". AAPS PharmSciTech . 21 (6): 225. doi :10.1208/s12249-020-01744-7. PMC 7405756 . PMID 32761294.
- ^ "Vacunas contra la COVID-19 actualizadas para su uso en Estados Unidos a partir del otoño de 2024". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 5 de junio de 2024. Consultado el 19 de junio de 2024 .
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ Simpson S, Kaufmann MC, Glozman V, Chakrabarti A (mayo de 2020). "Enfermedad X: acelerando el desarrollo de contramedidas médicas para la próxima pandemia". The Lancet. Enfermedades infecciosas . 20 (5): e108–15. doi : 10.1016/S1473-3099(20)30123-7 . PMC 7158580 . PMID 32197097.
- ^ Zabaleta N, Dai W, Bhatt U, Hérate C, Maisonnasse P, Chichester JA, et al. (agosto de 2021). "Una vacuna contra la COVID-19 de dosis única, estable a temperatura ambiente y basada en AAV proporciona inmunogenicidad y protección duraderas en primates no humanos". Cell Host & Microbe . 29 (9): 1437–1453.e8. doi :10.1016/j.chom.2021.08.002. PMC 8346325 . PMID 34428428. S2CID 231676030.
- ^ abc Sanger DE, Kirkpatrick DD, Zimmer C, Thomas K, Wee SL (2 de mayo de 2020). «Con la creciente presión, se intensifica la carrera mundial por una vacuna». The New York Times . ISSN 0362-4331. Archivado desde el original el 11 de mayo de 2020. Consultado el 2 de mayo de 2020 .
- ^ abcd Steenhuysen J, Eisler P, Martell A, Nebehay S (27 de abril de 2020). «Informe especial: Países y empresas arriesgan miles de millones en la carrera por la vacuna contra el coronavirus». Reuters. Archivado desde el original el 15 de mayo de 2020. Consultado el 2 de mayo de 2020 .
- ^ Jeong-ho L, Zheng W, Zhou L (26 de enero de 2020). «Científicos chinos compiten por desarrollar una vacuna a medida que aumenta el número de muertos por coronavirus». South China Morning Post . Archivado desde el original el 26 de enero de 2020. Consultado el 28 de enero de 2020 .
- ^ Wee SL (4 de mayo de 2020). «La campaña de vacunación contra el coronavirus en China fortalece a una industria en problemas». The New York Times . ISSN 0362-4331. Archivado desde el original el 4 de mayo de 2020. Consultado el 4 de mayo de 2020 .
- ^ Thorp HH (marzo de 2020). "Prometer poco y entregar mucho". Science . 367 (6485): 1405. Bibcode :2020Sci...367.1405T. doi : 10.1126/science.abb8492 . PMID 32205459. S2CID 214628067.
- ^ Blackwell T (20 de abril de 2020). "Los investigadores de la vacuna contra la COVID-19 afirman que el confinamiento por la pandemia está poniendo muchos obstáculos graves a su trabajo". National Post . Archivado desde el original el 24 de abril de 2020 . Consultado el 3 de mayo de 2020 .
- ^ Chen J (4 de mayo de 2020). "La COVID-19 ha cerrado los laboratorios. Podría poner en riesgo a una generación de investigadores". Stat . Archivado desde el original el 6 de mayo de 2020. Consultado el 4 de mayo de 2020 .
- ^ "Seguridad de las vacunas: vacunas". Departamento de Salud y Servicios Humanos de Estados Unidos. Archivado desde el original el 22 de abril de 2020. Consultado el 13 de abril de 2020 .
- ^ "El proceso de desarrollo de fármacos". Administración de Alimentos y Medicamentos de Estados Unidos (FDA). 4 de enero de 2018. Archivado desde el original el 22 de febrero de 2020. Consultado el 12 de abril de 2020 .
- ^ Cohen J (junio de 2020). «Las vacunas contra la pandemia están a punto de enfrentarse a la prueba real». Science . 368 (6497): 1295–96. Bibcode :2020Sci...368.1295C. doi : 10.1126/science.368.6497.1295 . PMID 32554572. S2CID 219911109.
- ^ Dubé E, Laberge C, Guay M, Bramadat P, Roy R, Bettinger J (agosto de 2013). "Vacunación: una descripción general". Vacunas humanas e inmunoterapias . 9 (8): 1763–73. doi :10.4161/hv.24657. PMC 3906279 . PMID 23584253.
- ^ Howard J, Stracqualursi V (18 de junio de 2020). «Fauci advierte que el 'sesgo anticientífico' es un problema en Estados Unidos». CNN . Archivado desde el original el 21 de junio de 2020. Consultado el 21 de junio de 2020 .
- ^ «Vacunas: procedimiento de autorización de emergencia». Agencia Europea de Medicamentos (EMA). 2020. Archivado desde el original el 24 de septiembre de 2020. Consultado el 21 de agosto de 2020 .
- ^ Byrne J (19 de octubre de 2020). «Vacuna Moderna contra la COVID-19 en proceso de revisión continua en Canadá y la UE». BioPharma-Reporter.com, William Reed Business Media Ltd. Archivado desde el original el 25 de febrero de 2021. Consultado el 25 de noviembre de 2020 .
- ^ Dangerfield K (20 de noviembre de 2020). «Pfizer solicita el uso de emergencia de la vacuna contra el coronavirus en Estados Unidos. ¿Y en Canadá?». Global News . Archivado desde el original el 25 de enero de 2021. Consultado el 25 de noviembre de 2020 .
- ^ "El G20 lanza una iniciativa para las herramientas sanitarias necesarias para combatir el coronavirus". The Globe and Mail . 25 de abril de 2020. Archivado desde el original el 27 de abril de 2020 . Consultado el 1 de febrero de 2021 .
- ^ "Acceso a las herramientas contra la COVID-19 (ACT) Accelerator" (PDF) . Organización Mundial de la Salud (OMS). 24 de abril de 2020. Archivado (PDF) del original el 25 de abril de 2020 . Consultado el 1 de febrero de 2021 .
- ^ "El Acelerador ACT: preguntas frecuentes (FAQ)". Organización Mundial de la Salud (OMS). 2020. Archivado desde el original el 4 de mayo de 2021. Consultado el 16 de diciembre de 2020 .
- ^ "Actualización sobre el ensayo Solidaridad de la OMS: acelerar la obtención de una vacuna segura y eficaz contra la COVID-19". Organización Mundial de la Salud (OMS). 27 de abril de 2020. Archivado desde el original el 30 de abril de 2020. Consultado el 2 de mayo de 2020.
Es fundamental que evaluemos tantas vacunas como sea posible, ya que no podemos predecir cuántas resultarán viables. Para aumentar las posibilidades de éxito (dado el alto nivel de deserción durante el desarrollo de las vacunas), debemos probar todas las vacunas candidatas hasta que fracasen. [La] OMS está trabajando para garantizar que todas ellas tengan la posibilidad de ser probadas en la etapa inicial de desarrollo. Los resultados sobre la eficacia de cada vacuna se esperan en un plazo de tres a seis meses, y esta evidencia, combinada con los datos sobre seguridad, informará las decisiones sobre si se puede utilizar en una escala más amplia.
- ^ Abedi M (23 de marzo de 2020). «Canadá gastará 192 millones de dólares en el desarrollo de la vacuna contra la COVID-19». Global News . Archivado desde el original el 9 de abril de 2020 . Consultado el 24 de marzo de 2020 .
- ^ "Respuesta de investigación del Gobierno de Canadá a la COVID-19". Gobierno de Canadá. 23 de abril de 2020. Archivado desde el original el 13 de mayo de 2020. Consultado el 4 de mayo de 2020 .
- ^ Takada N, Satake M (2 de mayo de 2020). «Estados Unidos y China desatan sus billeteras en la carrera por la vacuna contra el coronavirus». Nikkei Asian Review . Archivado desde el original el 10 de mayo de 2020. Consultado el 3 de mayo de 2020 .
- ^ Morriss E (22 de abril de 2020). "Government launches coronavirus vaccine taskforce as human clinical trials start". Pharmafield. Archivado desde el original el 26 de junio de 2020. Consultado el 3 de mayo de 2020 .
- ^ Kuznia R, Polglase K, Mezzofiore G (1 de mayo de 2020). "En busca de una vacuna, Estados Unidos hace una 'gran apuesta' por una empresa con tecnología no probada". CNN . Archivado desde el original el 13 de mayo de 2020. Consultado el 2 de mayo de 2020 .
- ^ Cohen J (mayo de 2020). "El esfuerzo estadounidense por desarrollar una vacuna a la velocidad de la luz sale de las sombras". Science . 368 (6492): 692–93. Bibcode :2020Sci...368..692C. doi : 10.1126/science.368.6492.692 . PMID 32409451.
- ^ Sink J, Fabian J, Griffin R (15 de mayo de 2020). «Trump presenta líderes de 'Warp Speed' para acelerar la vacuna contra el COVID-19». Bloomberg. Archivado desde el original el 21 de mayo de 2020. Consultado el 15 de mayo de 2020 .
- ^ LaHucik K (17 de junio de 2021). «Estados Unidos inyecta más de 3.000 millones de dólares en la investigación de la COVID-19 para desarrollar una píldora antiviral en un año». Fierce Biotech . Archivado desde el original el 9 de octubre de 2021. Consultado el 11 de julio de 2021 .
- ^ ab "Rastreador de vacunas contra la COVID-19 (Actualizar URL)". vac-lshtm.shinyapps.io . London School of Hygiene & Tropical Medicine . 12 de julio de 2021 . Consultado el 10 de marzo de 2021 .
- ^ "Vacunas aprobadas". Rastreador de vacunas contra la COVID-19, Universidad McGill. 12 de julio de 2021.
- ^ Greinacher A, Thiele T, Warkentin TE, Weisser K, Kyrle PA, Eichinger S (junio de 2021). "Trombocitopenia trombótica después de la vacunación ChAdOx1 nCov-19". La Revista de Medicina de Nueva Inglaterra . 384 (22): 2092–101. doi : 10.1056/NEJMoa2104840 . PMC 8095372 . PMID 33835769.
- ^ Cines DB, Bussel JB (junio de 2021). "Trombocitopenia trombótica inmunitaria inducida por la vacuna contra el SARS-CoV-2". The New England Journal of Medicine . 384 (23): 2254–2256. doi : 10.1056/NEJMe2106315 . PMC 8063912 . PMID 33861524.
- ^ Liu Y, Shao Z, Wang H (diciembre de 2021). "Trombocitopenia trombótica inmunitaria inducida por la vacuna contra el SARS-CoV-2". Investigación sobre la trombosis . 209 : 75–79. doi :10.1016/j.thromres.2021.12.002. PMC 8647389 . PMID 34894531.
- ^ ab Klok FA, Pai M, Huisman MV, Makris M (noviembre de 2021). "Trombocitopenia trombótica inmunitaria inducida por la vacuna". The Lancet. Hematología . 9 (1): e73–e80. doi : 10.1016 /S2352-3026(21)00306-9. PMC 8585488. PMID 34774202.
Aunque inicialmente se utilizaron varios términos para describir el síndrome... el término que ha ganado un uso generalizado es trombocitopenia trombótica inmunitaria inducida por la vacuna (VITT). También se ha utilizado el síndrome de trombosis con trombocitopenia, pero es un término más general que puede ser causado por otras afecciones.
- ^ abcd Warkentin TE, Pai M (octubre de 2021). "Editorial sobre el seguimiento a largo plazo de Thaler et al. después del tratamiento exitoso de la trombocitopenia inmunitaria protrombótica inducida por la vacuna. Thromb Res 2021 en prensa". Investigación sobre la trombosis . 207 : 158–160. doi :10.1016/j.thromres.2021.10.007. PMID 34757250. S2CID 239574011.
Creemos que el nombre "VITT" funciona bien... el término denota claramente las características clave del trastorno... proporciona una mnemotecnia útil para el reconocimiento de la enfermedad en la secuencia habitual de eventos... no es necesario que la trombosis esté presente... "TTS"... tiene una utilidad clínica limitada, ya que muchas afecciones... se presentan con el dúo de trombosis y trombocitopenia
- ^ ab "Uso de la vacuna AstraZeneca contra la COVID-19 en adultos jóvenes" (Comunicado de prensa). Health Canada. 29 de marzo de 2021. Archivado desde el original el 11 de octubre de 2021 . Consultado el 2 de abril de 2021 .
- ^ Long B, Bridwell R, Gottlieb M (noviembre de 2021). "Síndrome de trombosis con trombocitopenia asociado a las vacunas contra la COVID-19". The American Journal of Emergency Medicine . 49 : 58–61. doi :10.1016/j.ajem.2021.05.054. PMC 8143907 . PMID 34062319.
- ^ "Vacuna AstraZeneca contra la COVID-19 (AZD1222)" (PDF) . Reunión de emergencia del ACIP sobre la COVID-19 . AstraZeneca. 27 de enero de 2021. Archivado (PDF) del original el 27 de enero de 2021 . Consultado el 16 de abril de 2021 .
- ^ «EPAR de Vaxzevria (anteriormente vacuna contra la COVID-19 de AstraZeneca)». Agencia Europea de Medicamentos (EMA) . 25 de enero de 2021. Archivado desde el original el 21 de abril de 2021. Consultado el 16 de abril de 2021.
El nombre de la vacuna se cambió a Vaxzevria el 25 de marzo de 2021
.Vaxzevria (vacuna contra la COVID‑19 (ChAdOx1-S recombinante) EMA/182334/2021 Archivado el 15 de abril de 2021 en Wayback Machine . El texto se copió de esta fuente cuyo copyright corresponde a la Agencia Europea de Medicamentos. Se autoriza la reproducción siempre que se cite la fuente. - ^ "Vacuna contra el coronavirus ChAdOx1 nCoV-19 (recombinante) - Covishield". Serum Institute Of India . Archivado desde el original el 19 de abril de 2021. Consultado el 16 de abril de 2021 .
- ^ "AstraZeneca ChAdOx1-S/nCoV-19 [recombinante], vacuna contra la COVID-19". Organización Mundial de la Salud (OMS) . Archivado desde el original el 28 de noviembre de 2021. Consultado el 28 de noviembre de 2021 .
- ^ ab «Actualización sobre seguridad de la vacuna contra la COVID-19: Vaxzevria» (PDF) . Agencia Europea de Medicamentos (EMA). 28 de marzo de 2021. Archivado (PDF) del original el 13 de abril de 2021. Consultado el 31 de marzo de 2021 .
- ^ Marks P. "Declaración conjunta de los CDC y la FDA sobre la vacuna contra la COVID-19 de Johnson & Johnson". Archivado desde el original el 20 de mayo de 2021. Consultado el 13 de abril de 2021 .
- ^ "Actualización sobre el coronavirus (COVID-19): la FDA limita el uso de la vacuna Janssen contra la COVID-19 a determinadas personas". Administración de Alimentos y Medicamentos de EE. UU . . 5 de mayo de 2022. Archivado desde el original el 7 de mayo de 2022 . Consultado el 7 de mayo de 2022 .
- ^ Director médico de AstraZeneca AB (13 de abril de 2021). «Comunicación directa a profesionales sanitarios (DHPC): Vaxzevria (anteriormente vacuna COVID-19 de AstraZeneca): relación entre la vacuna y la aparición de trombosis en combinación con trombocitopenia» (PDF) . Agencia Europea de Medicamentos (EMA). Archivado (PDF) del original el 18 de julio de 2022. Consultado el 13 de abril de 2021 .
- ^ "Investigación y análisis: vacuna contra el coronavirus: resumen semanal de los informes de Tarjeta Amarilla". Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA). 1 de abril de 2021. Archivado desde el original el 20 de mayo de 2021. Consultado el 3 de abril de 2020 .
- ^ EMA (7 de abril de 2021). Conferencia de prensa de la EMA del 7 de abril: Conclusión de la evaluación del Comité de Evaluación de Riesgos de Farmacovigilancia (PRAC) de la vacuna COVID-19 de AstraZeneca y eventos tromboembólicos. Agencia Europea de Medicamentos (EMA) . Archivado desde el original el 7 de abril de 2021. Consultado el 7 de abril de 2021 en Youtube.
- ^ Agencias (29 de abril de 2024). "Informe: AstraZeneca admitió en un documento judicial que la vacuna contra el Covid puede causar efectos secundarios poco frecuentes [NSTTV] | New Straits Times". NST Online . Archivado desde el original el 30 de abril de 2024 . Consultado el 29 de abril de 2024 .
- ^ "Por primera vez, AstraZeneca admite que su vacuna contra el Covid puede causar coágulos sanguíneos poco comunes". The Independent . 30 de abril de 2024. Archivado desde el original el 30 de abril de 2024 . Consultado el 30 de abril de 2024 .
- ^ «Cronología de la Organización Mundial de la Salud – COVID-19». Organización Mundial de la Salud (OMS). 27 de abril de 2020. Archivado desde el original el 29 de abril de 2020. Consultado el 2 de mayo de 2020 .
- ^ abc Thanh Le T, Andreadakis Z, Kumar A, Gómez Román R, Tollefsen S, Saville M, et al. (mayo de 2020). "El panorama del desarrollo de la vacuna contra la COVID-19". Nature Reviews. Descubrimiento de fármacos . 19 (5): 305–306. doi : 10.1038/d41573-020-00073-5 . PMID: 32273591.
- ^ ab Gates B (febrero de 2020). "Respondiendo al Covid-19: ¿Una pandemia que ocurre una vez cada siglo?". The New England Journal of Medicine . 382 (18): 1677–79. doi : 10.1056/nejmp2003762 . PMID 32109012.
- ^ Fauci AS, Lane HC, Redfield RR (marzo de 2020). «Covid-19: navegando por lo desconocido». The New England Journal of Medicine . 382 (13): 1268–69. doi : 10.1056/nejme2002387 . PMC 7121221 . PMID 32109011.
- ^ ab Le TT, Cramer JP, Chen R, Mayhew S (octubre de 2020). "Evolución del panorama de desarrollo de la vacuna contra la COVID-19". Nature Reviews. Drug Discovery . 19 (10): 667–668. doi : 10.1038/d41573-020-00151-8 . PMID 32887942. S2CID 221503034.
- ^ Weintraub R, Yadav P, Berkley S (2 de abril de 2020). «Una vacuna contra la COVID-19 necesitará una distribución equitativa y global». Harvard Business Review . ISSN 0017-8012. Archivado desde el original el 9 de junio de 2020. Consultado el 9 de junio de 2020 .
- ^ "La pandemia de COVID-19 revela los riesgos de depender del sector privado para obtener vacunas que salvan vidas, dice un experto". CBC Radio . 8 de mayo de 2020. Archivado desde el original el 13 de mayo de 2020 . Consultado el 8 de junio de 2020 .
- ^ Ahmed DD (4 de junio de 2020). «El acuerdo entre Oxford y AstraZeneca en materia de COVID-19 refuerza la 'soberanía de las vacunas'». Stat . Archivado desde el original el 12 de junio de 2020. Consultado el 8 de junio de 2020 .
- ^ Grenfell R, Drew T (14 de febrero de 2020). "Por qué la OMS dice que faltan 18 meses para que haya una vacuna contra el coronavirus". Business Insider . Archivado desde el original el 5 de diciembre de 2020. Consultado el 11 de noviembre de 2020 .
- ^ Offit P (13 de febrero de 2021). "TWiV 720: Offit se ocupa de las vacunas". Podcast de esta semana en virología . Canal de Youtube de Vincent Racaniello. Archivado del original el 25 de mayo de 2021. Consultado el 14 de julio de 2021 .
- ^ "Actualización sobre el ensayo Solidaridad de la OMS: acelerar la obtención de una vacuna segura y eficaz contra la COVID-19". Organización Mundial de la Salud (OMS). 27 de abril de 2020. Archivado desde el original el 30 de abril de 2020. Consultado el 2 de mayo de 2020.
Es fundamental que evaluemos tantas vacunas como sea posible, ya que no podemos predecir cuántas resultarán viables. Para aumentar las posibilidades de éxito (dado el alto nivel de deserción durante el desarrollo de las vacunas), debemos probar todas las vacunas candidatas hasta que fracasen. [La] OMS está trabajando para garantizar que todas ellas tengan la posibilidad de ser probadas en la etapa inicial de desarrollo. Los resultados sobre la eficacia de cada vacuna se esperan en un plazo de tres a seis meses y esta evidencia, combinada con los datos sobre seguridad, informarán las decisiones sobre si se puede utilizar a mayor escala.
- ^ Yamey G, Schäferhoff M, Hatchett R, Pate M, Zhao F, McDade KK (mayo de 2020). "Garantizar el acceso global a las vacunas contra la COVID-19". Lancet . 395 (10234): 1405–06. doi : 10.1016/S0140-6736(20)30763-7 . PMC 7271264 . PMID 32243778.
La CEPI estima que el desarrollo de hasta tres vacunas en los próximos 12 a 18 meses requerirá una inversión de al menos 2000 millones
de dólares estadounidenses
. Esta estimación incluye
ensayos clínicos de fase 1 de ocho vacunas candidatas, la progresión de hasta seis candidatas a ensayos de fase
2 y
3, la finalización de los requisitos regulatorios y de calidad para al menos tres vacunas y la mejora de la capacidad de fabricación mundial para tres vacunas.
- ^ "La OMS 'respaldó el uso de emergencia por parte de China' de vacunas experimentales contra la COVID-19". South China Morning Post . 25 de septiembre de 2020. Archivado desde el original el 26 de septiembre de 2020 . Consultado el 26 de septiembre de 2020 .
- ^ Kramer AE (19 de septiembre de 2020). «Rusia tarda en administrar la vacuna contra el virus a pesar de la aprobación del Kremlin». The New York Times . ISSN 0362-4331. Archivado desde el original el 27 de septiembre de 2020. Consultado el 28 de septiembre de 2020 .
- ^ "Pfizer y BioNTech presentarán hoy a la FDA de EE. UU. una solicitud de autorización de uso de emergencia para la vacuna contra la COVID-19". Pfizer (nota de prensa). 20 de noviembre de 2020. Archivado desde el original el 29 de enero de 2021. Consultado el 20 de noviembre de 2020 .
- ^ Park A (20 de noviembre de 2020). «Exclusiva: el director ejecutivo de Pfizer analiza la presentación de la primera solicitud de autorización de la vacuna contra la COVID-19 a la FDA». Time . Archivado desde el original el 29 de enero de 2021 . Consultado el 20 de noviembre de 2020 .
- ^ "Información para profesionales sanitarios sobre la vacuna contra la COVID-19 de Pfizer/BioNTech". Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA) . 8 de diciembre de 2020. Archivado desde el original el 15 de marzo de 2021. Consultado el 13 de diciembre de 2020 .
- ^ "Condiciones de autorización para la vacuna contra la COVID-19 de Pfizer/BioNTech". Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA) . 3 de diciembre de 2020. Archivado desde el original el 26 de febrero de 2021. Consultado el 19 de diciembre de 2020 .
- ^ "El organismo regulador de medicamentos del Reino Unido da su aprobación para la primera vacuna contra la COVID-19 del Reino Unido". Agencia Reguladora de Medicamentos y Productos Sanitarios, Gobierno del Reino Unido. 2 de diciembre de 2020. Archivado desde el original el 17 de marzo de 2021. Consultado el 2 de diciembre de 2020 .
- ^ Mueller B (2 de diciembre de 2020). «Reino Unido aprueba la vacuna Pfizer contra el coronavirus, una primicia en Occidente». The New York Times . Archivado desde el original el 28 de enero de 2021. Consultado el 2 de diciembre de 2020 .
- ^ Roberts M (2 de diciembre de 2020). «Vacuna Pfizer contra el Covid aprobada para su uso la próxima semana en el Reino Unido». BBC News Online . Archivado desde el original el 2 de diciembre de 2020. Consultado el 2 de diciembre de 2020 .
- ^ "Preguntas y respuestas: vacunación contra la COVID-19 en la UE". Comisión Europea . 21 de diciembre de 2020. Archivado desde el original el 29 de enero de 2021 . Consultado el 21 de diciembre de 2020 .
- ^ "Bahréin es el segundo país del mundo en aprobar la vacuna Pfizer/BioNTech contra la COVID-19". Agencia de Noticias de Bahréin. 4 de diciembre de 2020. Archivado desde el original el 17 de diciembre de 2020. Consultado el 9 de diciembre de 2020 .
- ^ "Emiratos Árabes Unidos: el Ministerio de Salud anuncia una eficacia de la vacuna del 86 por ciento". Gulf News . Archivado desde el original el 24 de diciembre de 2020 . Consultado el 9 de diciembre de 2020 .
- ^ Thomas K, LaFraniere S, Weiland N, Goodnough A, Haberman M (12 de diciembre de 2020). «La FDA aprueba la vacuna Pfizer y se enviarán millones de dosis de inmediato». The New York Times . Archivado desde el original el 12 de diciembre de 2020. Consultado el 12 de diciembre de 2020 .
- ^ "La FDA toma medidas adicionales en la lucha contra el COVID-19 al emitir una autorización de uso de emergencia para la segunda vacuna contra el COVID-19". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) (Comunicado de prensa). Archivado desde el original el 17 de marzo de 2021 . Consultado el 18 de diciembre de 2020 .
- ^ Oliver SE, Gargano JW, Marin M, Wallace M, Curran KG, Chamberland M, et al. (enero de 2021). "Recomendación provisional del Comité Asesor sobre Prácticas de Inmunización para el uso de la vacuna Moderna contra la COVID-19 - Estados Unidos, diciembre de 2020" (PDF) . MMWR. Informe semanal de morbilidad y mortalidad . 69 (5152): 1653–56. doi : 10.15585/mmwr.mm695152e1 . PMC 9191904 . PMID 33382675. S2CID 229945697. Archivado (PDF) del original el 9 de febrero de 2021 . Consultado el 18 de enero de 2021 .
- ^ Lovelace Jr B (19 de diciembre de 2020). "La FDA aprueba una segunda vacuna contra el Covid para uso de emergencia y autoriza la distribución de Moderna en EE. UU.", CNBC. Archivado desde el original el 26 de enero de 2021. Consultado el 19 de diciembre de 2020 .
- ^ Corum J, Zimmer C (17 de diciembre de 2020). «Cómo funciona la vacuna Oxford-AstraZeneca». The New York Times . Archivado desde el original el 5 de enero de 2022. Consultado el 2 de mayo de 2021 .
- ^ Tétrault-Farber M, Vasilyeva G (31 de marzo de 2021). «Rusia registra la primera vacuna del mundo contra la COVID-19 para animales». Reuters . Archivado desde el original el 17 de diciembre de 2021. Consultado el 4 de abril de 2021 .
- ^ "В России зарегистрировали первую в мире вакцину против COVID-19 для животных" [La primera vacuna COVID-19 para animales del mundo se registró en Rusia]. TASS (en ruso). Moscú. 31 de marzo de 2021. Archivado desde el original el 19 de mayo de 2021 . Consultado el 19 de mayo de 2021 .
- ^ MORITSUGU K (26 de octubre de 2022). "¿Miedo a las agujas? China usa vacuna inhalable contra el COVID-19". AP NEWS . Consultado el 2 de noviembre de 2022 .
- ^ Hotez PJ, Bottazzi ME (enero de 2022). "Vacunas contra la COVID-19 basadas en proteínas y virus completamente inactivados". Revisión anual de medicina . 73 (1): 55–64. doi : 10.1146/annurev-med-042420-113212 . PMID 34637324. S2CID 238747462.
- ^ Ye Y, Zhang Q, Wei X, Cao Z, Yuan HY, Zeng DD (febrero de 2022). "El acceso equitativo a las vacunas contra la COVID-19 supone una diferencia vital para todos los países". Nature Human Behaviour . 6 (2): 207–216. doi : 10.1038/s41562-022-01289-8 . PMC 8873023 . PMID 35102361.
- ^ Lee Proctor, Secuencias de bases de nucleótidos completas para todas las vacunas COVID aprobadas por la MRHA, WhatDoTheyKnow , Wikidata Q109371097
- ^ Taylor R (2 de noviembre de 2021). «Secuencias de vacunas contra la COVID-19 publicadas a través de WhatDoTheyKnow». mySociety . Archivado desde el original el 5 de noviembre de 2021. Consultado el 2 de noviembre de 2021 .
- ^ "Datos sobre la mortalidad por COVID-19 según el estado de vacunación". Our World in Data (datos de los CDC). Abril de 2023. Archivado desde el original el 16 de octubre de 2023.
Fuente de los datos: Centros para el Control y la Prevención de Enfermedades, Equipo de Vigilancia y Análisis de Avances en Vacunas.
- ^ Yang ZR, Jiang YW, Li FX, Liu D, Lin TF, Zhao ZY, et al. (abril de 2023). "Eficacia de las vacunas contra el SARS-CoV-2 y la relación dosis-respuesta con tres anticuerpos principales: una revisión sistemática y un metanálisis de ensayos controlados aleatorizados". The Lancet. Microbio . 4 (4): e236–e246. doi :10.1016/S2666-5247(22)00390-1. PMC 9974155 . PMID 36868258.
- ^ Holcombe M, Waldrop T (11 de septiembre de 2021). «Estudio de los CDC: los no vacunados tienen 11 veces más probabilidades de morir por Covid-19». CNN . Consultado el 11 de septiembre de 2021 .
- ^ Scobie HM, Johnson AG, Suthar AB, Severson R, Alden NB, Balter S, et al. (septiembre de 2021). "Monitoreo de la incidencia de casos, hospitalizaciones y muertes por COVID-19, por estado de vacunación - 13 jurisdicciones de EE. UU., del 4 de abril al 17 de julio de 2021" (PDF) . MMWR. Informe semanal de morbilidad y mortalidad . 70 (37): 1284–1290. doi : 10.15585/mmwr.mm7037e1 . PMC 8445374 . PMID 34529637.
- ^ Fowlkes A, Gaglani M, Groover K, Thiese MS, Tyner H, Ellingson K (agosto de 2021). "Efectividad de las vacunas contra la COVID-19 en la prevención de la infección por SARS-CoV-2 entre los trabajadores de primera línea antes y durante el predominio de la variante B.1.617.2 (Delta): ocho ubicaciones en EE. UU., diciembre de 2020-agosto de 2021" ( PDF) . MMWR. Informe semanal de morbilidad y mortalidad . 70 (34): 1167–1169. doi : 10.15585/mmwr.mm7034e4 . PMC 8389394. PMID 34437521.
- ^ Schreiber M, Chayka K, Chayka K, Beyerstein L, Beyerstein L, Wilson J, et al. (1 de julio de 2021). "El mensaje urgente de la variante Delta de Covid para Estados Unidos". The New Republic . ISSN 0028-6583. Archivado desde el original el 28 de agosto de 2021 . Consultado el 28 de octubre de 2021 .
- ^ "Entre los no vacunados, la variante Delta duplica con creces el riesgo de hospitalización". Los Angeles Times . 28 de agosto de 2021. Archivado desde el original el 8 de noviembre de 2021.
- ^ "OMS/ECDC: Casi medio millón de vidas salvadas gracias a la vacunación contra la COVID-19 en menos de un año". 25 de noviembre de 2021.
- ^ "Vacuna de refuerzo contra el coronavirus (COVID-19)". NHS . Servicio digital del gobierno. 17 de septiembre de 2021 . Consultado el 11 de diciembre de 2021 .
- ^ Variantes preocupantes del SARS-CoV-2 y variantes bajo investigación en Inglaterra, informe técnico n.º 31 (PDF) (Informe). Public Health England. 10 de diciembre de 2021. págs. 3–5, 20–22. GOV-10645. Archivado (PDF) del original el 18 de diciembre de 2021. Consultado el 10 de diciembre de 2021 .
- ^ Gore D (9 de febrero de 2022). "Últimos datos de los CDC: los adultos no vacunados tienen 97 veces más probabilidades de morir de COVID-19 que los adultos que recibieron la vacuna de refuerzo". FactCheck.org . Consultado el 11 de febrero de 2022 .
- ^ Lee AR, Wong SY, Chai LY, Lee SC, Lee MX, Muthiah MD, et al. (marzo de 2022). "Eficacia de las vacunas contra la covid-19 en pacientes inmunodeprimidos: revisión sistemática y metanálisis". BMJ . 376 : e068632. doi :10.1136/bmj-2021-068632. PMC 8889026 . PMID 35236664.
- ^ Greenberger LM, Saltzman LA, Senefeld JW, Johnson PW, DeGennaro LJ, Nichols GL (agosto de 2021). "Respuesta de anticuerpos a las vacunas contra el SARS-CoV-2 en pacientes con neoplasias hematológicas". Cancer Cell . 39 (8): 1031–1033. doi :10.1016/j.ccell.2021.07.012. PMC 8295014 . PMID 34331856.
- ^ Stein C, Nassereldine H, Sorensen RJ, Amlag JO, Bisignano C, Byrne S, et al. (febrero de 2023). "Protección contra la reinfección tras una infección anterior por SARS-CoV-2: una revisión sistemática y un metanálisis". The Lancet . 401 (10379): 833–842. doi :10.1016/S0140-6736(22)02465-5. ISSN 0140-6736. PMC 9998097 . PMID 36930674.
- ^ Payne AB (2024). "Eficacia de las vacunas bivalentes de ARNm contra la COVID-19 en la prevención de eventos tromboembólicos relacionados con la COVID-19 entre los beneficiarios de Medicare de 65 años o más y aquellos con enfermedad renal en etapa terminal: Estados Unidos, septiembre de 2022-marzo de 2023". MMWR. Informe semanal de morbilidad y mortalidad . 73 (1): 16–23. doi :10.15585/mmwr.mm7301a4. ISSN 0149-2195. PMC 10794061 . PMID 38206877. Archivado desde el original el 14 de enero de 2024 . Consultado el 14 de enero de 2024 .
- ^ Mole B (12 de enero de 2024). «Las vacunas contra la COVID protegen contra los accidentes cerebrovasculares y los ataques cardíacos relacionados con la COVID, según un estudio». Ars Technica . Archivado desde el original el 14 de enero de 2024 . Consultado el 14 de enero de 2024 .
- ^ Català M, Mercadé-Besora N, Kolde R, Trinh NT, Roel E, Burn E, et al. (Marzo de 2024). "La eficacia de las vacunas COVID-19 para prevenir síntomas prolongados de COVID: estudio de cohorte escalonada de datos del Reino Unido, España y Estonia". La lanceta. Medicina Respiratoria . 12 (3): 225–236. doi : 10.1016/s2213-2600(23)00414-9 . PMID 38219763.
- ^ "Las vacunas reducen el riesgo de COVID-19 prolongado". NIHR Evidence . 2024. doi : 10.3310/nihrevidence_63203 .
- ^ abcdef «Resumen científico: inmunidad inducida por la infección y la vacuna contra el SARS-CoV-2». Centros para el Control y la Prevención de Enfermedades (CDC) . 29 de octubre de 2021. Archivado desde el original el 4 de diciembre de 2021. Consultado el 4 de diciembre de 2021 .
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ Levin EG, Lustig Y, Cohen C, Fluss R, Indenbaum V, Amit S, et al. (diciembre de 2021). "Respuesta humoral inmunitaria menguante a la vacuna BNT162b2 contra la COVID-19 a lo largo de 6 meses". The New England Journal of Medicine . 385 (24): e84. doi : 10.1056/NEJMoa2114583 . PMC 8522797 . PMID 34614326.
- ^ "Vacuna de refuerzo contra la COVID-19". Centros para el Control y la Prevención de Enfermedades . 29 de noviembre de 2021. Archivado desde el original el 21 de agosto de 2021. Consultado el 4 de diciembre de 2021 .
- ^ abc Devlin H (18 de marzo de 2022). «La inmunidad al COVID disminuye drásticamente en los residentes de residencias de ancianos en Inglaterra, según un estudio». The Guardian . Archivado desde el original el 23 de marzo de 2022 . Consultado el 12 de mayo de 2022 .
- ^ Kimball S. "Los CDC recomiendan una cuarta dosis de la vacuna Pfizer y Moderna contra el Covid para personas de 50 años o más". CNBC . Archivado desde el original el 3 de septiembre de 2022 . Consultado el 22 de agosto de 2022 .
- ^ "Enfermedad por coronavirus 2019". Centros para el Control y la Prevención de Enfermedades (Comunicado de prensa). 29 de marzo de 2022. Archivado desde el original el 1 de septiembre de 2022 . Consultado el 22 de agosto de 2022 .
- ^ Wang R, Chen J, Wei GW (diciembre de 2021). "Mecanismos de la evolución del SARS-CoV-2 que revelan mutaciones resistentes a las vacunas en Europa y América" (PDF) . The Journal of Physical Chemistry Letters . 12 (49): 11850–11857. doi :10.1021/acs.jpclett.1c03380. PMC 8672435 . PMID 34873910. Archivado (PDF) del original el 18 de diciembre de 2021 . Consultado el 27 de enero de 2022 .
- ^ "Los hallazgos del estudio sugieren que la propagación de Omicron puede atribuirse a la evasión inmunitaria en lugar de a un aumento de la transmisibilidad". News-Medical.net . 5 de enero de 2022. Archivado desde el original el 21 de enero de 2022 . Consultado el 17 de enero de 2022 .
- ^ Cao Y, Wang J, Jian F, Xiao T, Song W, Yisimayi A, et al. (febrero de 2022). "Omicron escapa a la mayoría de los anticuerpos neutralizantes existentes contra el SARS-CoV-2". Nature . 602 (7898): 657–663. doi :10.1038/d41586-021-03796-6. PMC 8866119 . PMID 35016194. S2CID 245455422.
- ^ Liu L, Iketani S, Guo Y, Chan JF, Wang M, Liu L, et al. (febrero de 2022). "Evasión sorprendente de anticuerpos manifestada por la variante ómicron del SARS-CoV-2". Nature . 602 (7898): 676–681. doi : 10.1038/d41586-021-03826-3 . PMID 35016198. S2CID 245462866.
- ^ Mohsin M, Mahmud S (mayo de 2022). "Variante ómicron del SARS-CoV-2 preocupante: una revisión sobre su transmisibilidad, evasión inmunitaria, reinfección y gravedad". Medicina . 101 (19): e29165. doi :10.1097/MD.0000000000029165. PMC 9276130 . PMID 35583528. S2CID 248858919.
- ^ "¿Cuánto tiempo después de contraer COVID-19 se puede volver a contraer?". ABC News . 2 de mayo de 2022. Archivado desde el original el 9 de julio de 2022 . Consultado el 24 de junio de 2022 .
- ^ "Variante ómicron: lo que necesita saber". Centros para el Control y la Prevención de Enfermedades . 20 de diciembre de 2021. Archivado desde el original el 27 de enero de 2022. Consultado el 27 de enero de 2022 .
- ^ Shin DH, Smith DM, Choi JY (2022). "Variante preocupante ómicron del SARS-CoV-2: todo lo que quería saber sobre ómicron pero tenía miedo de preguntar". Revista Médica Yonsei . 63 (11): 977–983. doi :10.3349/ymj.2022.0383. PMC 9629902 . PMID 36303305.
- ^ "Refuerzos de la vacuna contra la COVID-19". Administración de Alimentos y Medicamentos de Estados Unidos (FDA). 27 de septiembre de 2022. Archivado desde el original el 8 de octubre de 2022 . Consultado el 8 de octubre de 2022 .
- ^ "Vacunas Moderna contra la COVID-19". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 7 de octubre de 2022. Archivado desde el original el 7 de octubre de 2022. Consultado el 8 de octubre de 2022 .
- ^ "Vacunas Pfizer-BioNTech contra la COVID-19". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 3 de octubre de 2022. Archivado desde el original el 8 de octubre de 2022. Consultado el 8 de octubre de 2022 .
- ^ "Vacunas contra la COVID-19 actualizadas para su uso en Estados Unidos a partir del otoño de 2023". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 15 de junio de 2023. Archivado desde el original el 17 de junio de 2023. Consultado el 16 de junio de 2023 .
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ Recomendación para la fórmula 2023-2024 de vacunas contra la COVID-19 en EE.UU. (PDF) (Informe). Administración de Alimentos y Medicamentos de EE.UU. (FDA). 16 de junio de 2023. Archivado desde el original el 16 de junio de 2023 . Consultado el 16 de junio de 2023 .
- ^ "Vacunas contra la COVID-19 actualizadas para su uso en Estados Unidos a partir del otoño de 2024". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 5 de junio de 2024. Archivado desde el original el 18 de junio de 2024. Consultado el 19 de junio de 2024 .
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ "Aspectos destacados de la reunión del Comité de Medicamentos de Uso Humano (CHMP) del 14 al 17 de octubre de 2024". Agencia Europea de Medicamentos (EMA) . 18 de octubre de 2024. Consultado el 21 de octubre de 2024 .El texto se ha copiado de esta fuente, cuyos derechos de autor pertenecen a la Agencia Europea de Medicamentos. Se autoriza la reproducción siempre que se cite la fuente.
- ^ Singanayagam A, Hakki S, Dunning J, Madon KJ, Crone MA, Koycheva A, et al. (febrero de 2022). "Transmisión comunitaria y cinética de la carga viral de la variante delta (B.1.617.2) del SARS-CoV-2 en individuos vacunados y no vacunados en el Reino Unido: un estudio de cohorte longitudinal prospectivo". The Lancet. Enfermedades infecciosas . 22 (2): 183–195. doi :10.1016/S1473-3099(21)00648-4. PMC 8554486 . PMID 34756186.
- ^ Callaway E (octubre de 2021). "Las vacunas contra la COVID-19 que se combinan superan la prueba de eficacia". Nature . doi :10.1038/d41586-021-02853-4. PMID 34675430. S2CID 239455075.
- ^ Rashedi R, Samieefar N, Masoumi N, Mohseni S, Rezaei N (abril de 2022). "Mezcla y combinación de vacunas COVID-19: el concepto, la eficacia y las dudas". Revista de Virología Médica . 94 (4): 1294-1299. doi :10.1002/jmv.27463. PMC 8661746 . PMID 34796525.
- ^ Kouhpayeh H, Ansari H (agosto de 2022). "Eventos adversos posteriores a la vacunación contra la COVID-19: una revisión sistemática y un metanálisis". Inmunofarmacología internacional . 109 : 108906. doi :10.1016/j.intimp.2022.108906. PMC 9148928 . PMID 35671640.
- ^ Graña C, Ghosn L, Evrenoglou T, Jarde A, Minozzi S, Bergman H, et al. (diciembre de 2022). "Eficacia y seguridad de las vacunas contra la COVID-19". Base de datos Cochrane de revisiones sistemáticas . 12 (12): CD015477. doi :10.1002/14651858.CD015477. PMC 9726273 . PMID 36473651.
- ^ Haas JW, Bender FL, Ballou S, Kelley JM, Wilhelm M, Miller FG, et al. (enero de 2022). "Frecuencia de eventos adversos en los grupos placebo de los ensayos de la vacuna COVID-19: una revisión sistemática y un metanálisis". JAMA Network Open . 5 (1): e2143955. doi :10.1001/jamanetworkopen.2021.43955. PMC 8767431 . PMID 35040967.
- ^ Polania Gutierrez JJ, Munakomi S (enero de 2020). "Inyección intramuscular". StatPearls . Treasure Island (FL): StatPearls Publishing. PMID 32310581. Archivado desde el original el 8 de diciembre de 2020. Consultado el 24 de julio de 2021 .
- ^ abcd Huang Z, Su Y, Zhang T, Xia N (febrero de 2022). "Una revisión de la seguridad y eficacia de las vacunas actuales contra la COVID-19". Frontiers of Medicine . 16 (1): 39–55. doi :10.1007/s11684-021-0893-y. PMC 8815389 . PMID 35122210.
- ^ Tu W, Gierada DS, Joe BN (mayo de 2021). "Linfoadenopatía relacionada con la vacunación contra la COVID-19: qué hay que tener en cuenta". Radiología. Imágenes del cáncer . 3 (3): e210038. doi :10.1148/rycan.2021210038. PMC 8049171. PMID 33874733 .
- ^ "Informe de evaluación no clínica: vacuna contra la COVID-19 basada en BNT162b2 [ARNm]" (PDF) . Departamento de Salud de Australia: Administración de Productos Terapéuticos . Archivado (PDF) del original el 28 de marzo de 2023 . Consultado el 25 de marzo de 2023 .
- ^ abcde Male V (enero de 2022). "Menstruación y vacunación contra la covid-19". BMJ . 376 : o142. doi : 10.1136/bmj.o142 . hdl : 10044/1/94577 . PMID 35082132. S2CID 246287912.
- ^ Montgomery J, Ryan M, Engler R, Hoffman D, McClenathan B, Collins L, et al. (octubre de 2021). "Miocarditis tras la inmunización con vacunas de ARNm contra la COVID-19 en miembros del ejército de EE. UU.", JAMA Cardiology . 6 (10): 1202–06. doi : 10.1001/jamacardio.2021.2833 . PMC 8243257 . PMID 34185045.
- ^ «Organización Mundial de la Salud (OMS)». 17 de septiembre de 2018. Archivado desde el original el 4 de octubre de 2023. Consultado el 19 de septiembre de 2023 .
- ^ McDonald J (23 de diciembre de 2021). "Aumento de los informes de VAERS sobre la COVID-19 debido a los requisitos de notificación y al intenso escrutinio de las vacunas administradas de forma generalizada". FactCheck.org . Archivado desde el original el 20 de mayo de 2022 . Consultado el 20 de mayo de 2022 .
- ^ "Tratamiento del síndrome posvacunación". Deutsche Welle . 11 de octubre de 2022. Archivado desde el original el 17 de abril de 2023.
- ^ "Spezialsprechstunde Post-Vax" [Consulta especial post-Vac]. Universitätsklinikum Giessen und Marburg (UKGM) (en alemán). Archivado desde el original el 4 de mayo de 2023.
- ^ "Corona-Impfschäden: Uniklinik Marburg öffnet eigene Ambulanz" [Daños de la vacuna Corona: el Hospital Universitario de Marburg abre su propia clínica ambulatoria]. Frankfurter Allgemeine Zeitung GmbH (en alemán). 3 de abril de 2023. Archivado desde el original el 8 de marzo de 2024.
- ^ Frontera JA, Tamborska AA, Doheim MF, García-Azorin D, Gezegen H, Guekht A, et al. (Marzo de 2022). "Eventos neurológicos informados después de las vacunas COVID-19: un análisis de VAERS". Anales de Neurología . 91 (6): 756–771. doi : 10.1002/ana.26339 . PMC 9082459 . PMID 35233819.
- ^ abcd Altmann DM, Boyton RJ (marzo de 2022). «Vacunación contra la COVID-19: el camino por delante». Science . 375 (6585): 1127–1132. Bibcode :2022Sci...375.1127A. doi :10.1126/science.abn1755. PMID 35271316. S2CID 247384207.
- ^ Actualización de seguridad de las vacunas contra la COVID-19 (PDF) (Informe). Archivado (PDF) del original el 3 de agosto de 2022 . Consultado el 6 de septiembre de 2022 .
- ^ Basso C (octubre de 2022). "Miocarditis". The New England Journal of Medicine . 387 (16): 1488–1500. doi :10.1056/NEJMra2114478. hdl : 11577/3479721 . PMID 36260793. S2CID 240234869.
- ^ Witberg G, Barda N, Hoss S, Richter I, Wiessman M, Aviv Y, et al. (diciembre de 2021). "Miocarditis después de la vacunación contra la COVID-19 en una gran organización sanitaria". The New England Journal of Medicine . 385 (23): 2132–2139. doi :10.1056/NEJMoa2110737. PMC 8531986 . PMID 34614329. S2CID 238421512.
- ^ ab Patone M, Mei XW, Handunnetthi L, Dixon S, Zaccardi F, Shankar-Hari M, et al. (septiembre de 2022). "Riesgo de miocarditis después de dosis secuenciales de la vacuna contra la COVID-19 e infección por SARS-CoV-2 por edad y sexo". Circulation . 146 (10): 743–754. doi :10.1161/CIRCULATIONAHA.122.059970. PMC 9439633 . PMID 35993236.
- ^ Chen Y, Xu Z, Wang P, Li XM, Shuai ZW, Ye DQ, et al. (abril de 2022). "Fenómenos autoinmunes de nueva aparición posteriores a la vacunación contra la COVID-19". Inmunología . 165 (4): 386–401. doi : 10.1111/imm.13443 . PMID 34957554. S2CID 245522029.
- ^ Jafari Z, Kolb BE, Mohajerani MH (marzo de 2022). "Pérdida auditiva, tinnitus y mareos en la COVID-19: una revisión sistemática y un metanálisis". Revista Canadiense de Ciencias Neurológicas . 49 (2): 184–195. doi : 10.1017/cjn.2021.63 . PMC 8267343 . PMID 33843530.
- ^ Slomski A (mayo de 2022). "Estudios examinan el riesgo de pérdida auditiva después de la vacunación contra la COVID-19". JAMA . 327 (17): 1641. doi : 10.1001/jama.2022.6719 . PMID 35503358. S2CID 248502943.
- ^ Dorney I, Bobak L, Otteson T, Kaelber DC (septiembre de 2022). "Prevalencia de tinnitus de nueva aparición después de la vacunación contra la COVID-19 en comparación con otras vacunas". The Laryngoscope . 133 (7): 1722–1725. doi :10.1002/lary.30395. PMC 9539087 . PMID 36098476.
- ^ Mathieu E, Ritchie H , Rodés-Guirao L, Appel C, Giattino C, Hasell J, et al. (2020-2024). "Pandemia de coronavirus (COVID-19)". Nuestro mundo en datos . Consultado el 20 de octubre de 2024 .
- ^ Mathieu E, Ritchie H, Rodés-Guirao L, Appel C, Giattino C, Hasell J, et al. (2020). "Pandemia de coronavirus (COVID-19)". Nuestro mundo en datos . Consultado el 14 de noviembre de 2023 .
- ^ Mathieu E, Ritchie H, Ortiz-Ospina E, Roser M, Hasell J, Appel C, et al. (2021). "Una base de datos global de vacunas contra la COVID-19". Nature Human Behaviour . 5 (7): 947–953. doi : 10.1038/s41562-021-01122-8 . PMID 33972767.
- ^ Richie H, Ortiz-Ospina E, Beltekian D, Methieu E, Hasell J, Macdonald B, et al. (1 de septiembre de 2021). «Vacunas contra el coronavirus (COVID-19): estadísticas e investigación». Our World in Data . Archivado desde el original el 10 de marzo de 2021. Consultado el 26 de enero de 2021 .
- ^ "Actualización sobre el ensayo Solidaridad de la OMS: acelerar una vacuna segura y eficaz contra la COVID-19". Organización Mundial de la Salud (OMS). 27 de abril de 2020. Archivado desde el original el 30 de abril de 2020. Consultado el 2 de mayo de 2020.
Es fundamental que evaluemos tantas vacunas como sea posible, ya que no podemos predecir cuántas resultarán viables. Para aumentar las posibilidades de éxito (dado el alto nivel de deserción durante el desarrollo de las vacunas), debemos probar todas las vacunas candidatas hasta que fracasen. La
Organización Mundial de la Salud
(OMS) está trabajando para garantizar que todas ellas tengan la posibilidad de ser probadas en la etapa inicial de desarrollo. Los resultados sobre la eficacia de cada vacuna se esperan en un plazo de tres a seis meses y esta evidencia, combinada con los datos sobre seguridad, informarán las decisiones sobre si se puede utilizar en una escala más amplia.
- ^ ab Gates B (abril de 2020). "Respuesta al COVID-19: ¿una pandemia que se da una vez cada siglo?". The New England Journal of Medicine . 382 (18): 1677–1679. doi : 10.1056/nejmp2003762 . PMID 32109012.
- ^ Weintraub R, Yadav P, Berkley S (2 de abril de 2020). «Una vacuna contra la COVID-19 necesitará una distribución equitativa y global». Harvard Business Review . ISSN 0017-8012. Archivado desde el original el 9 de junio de 2020. Consultado el 9 de junio de 2020 .
- ^ abc Steenhuysen J, Eisler P, Martell A, Nebehay S (27 de abril de 2020). «Informe especial: Países y empresas arriesgan miles de millones en la carrera por la vacuna contra el coronavirus». Reuters. Archivado desde el original el 15 de mayo de 2020. Consultado el 2 de mayo de 2020 .
- ^ Gartner A, Roberts L (3 de mayo de 2020). «¿Qué tan cerca estamos de una vacuna contra el coronavirus? Últimas noticias sobre los ensayos en el Reino Unido». The Telegraph . ISSN 0307-1235. Archivado desde el original el 4 de mayo de 2020 . Consultado el 3 de mayo de 2020 .
- ^ "La OMS y la ONU establecen medidas para cumplir los objetivos mundiales de vacunación contra la COVID-19". Organización Mundial de la Salud (OMS). 7 de octubre de 2021. Archivado desde el original el 31 de diciembre de 2021 . Consultado el 31 de diciembre de 2021 .
- ^ «COVID-19: La OMS pide a los países que vacunen al 70% de su población a mediados de 2022». 29 de diciembre de 2021. Archivado desde el original el 31 de diciembre de 2021 . Consultado el 31 de diciembre de 2021 .
- ^ "Vacunas contra la COVID-19: los países africanos no alcanzan el objetivo de la OMS". BBC . 31 de diciembre de 2021. Archivado desde el original el 31 de diciembre de 2021 . Consultado el 31 de diciembre de 2021 .
- ^ abcd Editores de The Lancet Infectious Diseases (septiembre de 2021). "Equidad de la vacuna contra la COVID-19 y dosis de refuerzo". The Lancet Infectious Diseases . 21 (9): 1193. doi :10.1016/S1473-3099(21)00486-2. PMC 8360703 . PMID 34391506.
- ^ Adhanom Ghebreyesus T (18 de enero de 2021). «Discurso inaugural del Director General de la OMS en la 148.ª reunión del Consejo Ejecutivo». Organización Mundial de la Salud (OMS) . Archivado desde el original el 12 de noviembre de 2021. Consultado el 25 de enero de 2021 .
- ^ "Estados Unidos presionó a Brasil para que abandonara la vacuna rusa Sputnik V". The Brazilian Report . 15 de marzo de 2021. Archivado desde el original el 15 de marzo de 2021 . Consultado el 21 de marzo de 2021 .
- ^ Holmes O (16 de febrero de 2021). "Israel bloqueó la entrada de vacunas contra el Covid a Gaza, dicen los palestinos". The Guardian . Archivado desde el original el 16 de febrero de 2021 . Consultado el 17 de febrero de 2021 .
- ^ Rasgon A (4 de febrero de 2021). «El éxito de la vacuna israelí desencadena un debate sobre las desigualdades palestinas» . The New York Times . Archivado desde el original el 28 de diciembre de 2021. Consultado el 17 de febrero de 2021 .
- ^ Horton C (17 de febrero de 2021). "Taiwán está preocupado por la posibilidad de que China haya bloqueado la compra de vacunas". Bloomberg . Archivado desde el original el 17 de febrero de 2021 . Consultado el 17 de febrero de 2021 .
- ^ "Jugando a la política con la pobreza: la estrategia de Sisi para la vacuna contra la COVID-19". Carnegie Endowment for International Peace . Archivado desde el original el 28 de febrero de 2021. Consultado el 25 de febrero de 2021 .
- ^ Strazewski L (9 de febrero de 2021). "Dr. Fauci: Las variantes revelan que la vacunación contra la COVID-19 es una tarea global". Asociación Médica Estadounidense . Archivado desde el original el 10 de octubre de 2021. Consultado el 4 de marzo de 2021 .
- ^ Bergmark E, Wierson A (26 de febrero de 2021). «Opinión: Sin un plan mundial de vacunación, las variantes del coronavirus podrían provocar un número incalculable de muertes». CNN . Archivado desde el original el 19 de octubre de 2021. Consultado el 4 de marzo de 2021 .
- ^ Blenkinsop P, Maclean W, Ellis A (10 de marzo de 2021). "Rich, developing countries wrangle over COVID vaccine patents". Reuters . Archivado desde el original el 11 de marzo de 2021. Consultado el 19 de junio de 2021 .
- ^ Macias AM, Breuninger K, Franck (5 de mayo de 2021). «Estados Unidos respalda la renuncia a las protecciones de patentes para las vacunas contra el Covid, citando la crisis sanitaria mundial». CNBC . Archivado desde el original el 5 de mayo de 2021. Consultado el 5 de mayo de 2021 .
- ^ Sánchez Nicolás E (11 de junio de 2021). «Aumenta la presión sobre la UE para que respalde la exención de patentes de vacunas de la OMC». EUobserver . Archivado desde el original el 19 de octubre de 2021 . Consultado el 14 de junio de 2021 .
- ^ "La OMS se opone a la prueba de vacunación contra la Covid-19 para viajes internacionales". South China Morning Post . 20 de abril de 2021. Archivado desde el original el 3 de mayo de 2021 . Consultado el 17 de mayo de 2021 .
- ^ Goodman PS, Mandavilli A, Robbins R, Stevis-Gridneff M (15 de mayo de 2021). "¿Qué haría falta para vacunar al mundo contra la COVID?" . The New York Times . ISSN 0362-4331. Archivado desde el original el 15 de mayo de 2021. Consultado el 17 de mayo de 2021 .
- ^ Muniz B, Fonseca B, Fernandes L, Pina R (15 de marzo de 2021). "Brasil registra duas vezes mais pessoas brancas vacinadas que negras" [Brasil registra el doble de blancos vacunados que de negros]. Agência Pública (en portugués brasileño). Archivado desde el original el 15 de marzo de 2021 . Consultado el 28 de mayo de 2021 .
- ^ Schnirring L (17 de mayo de 2021). "Las agencias de la ONU hacen un llamado urgente para obtener dosis de vacunas de COVAX". CIDRAP . Archivado desde el original el 31 de octubre de 2021 . Consultado el 15 de junio de 2021 .
- ^ "Primera reunión del Grupo de trabajo sobre vacunas, terapias y medios de diagnóstico contra la COVID-19 para países en desarrollo". Organización Mundial de la Salud (OMS) . 30 de junio de 2021. Archivado desde el original el 19 de octubre de 2021. Consultado el 5 de julio de 2021 .
- ^ Tapper J, McKie R (3 de julio de 2021). «Las vacunas 'han sido superadas por las variantes', advierte la OMS, ya que Delta está presente en 98 países». The Guardian . Archivado desde el original el 21 de octubre de 2021. Consultado el 5 de julio de 2021 .
- ^ Mahase E (julio de 2021). "Covid-19: los países abandonan las vacunas a medida que la demanda cae y resulta difícil compartirlas". BMJ . 374 : n1893. doi : 10.1136/bmj.n1893 . PMID 34315725. S2CID 236457553.
- ^ Levin D (1 de agosto de 2021). «Estados Unidos está desperdiciando dosis de vacunas, incluso cuando los casos aumentan y otros países sufren escasez». The New York Times . Archivado desde el original el 9 de agosto de 2021. Consultado el 10 de agosto de 2021 .
- ^ "Vacunas contra la COVID-19: por qué algunos estados africanos no pueden utilizar sus vacunas". BBC News . 8 de junio de 2021. Archivado desde el original el 14 de noviembre de 2021 . Consultado el 20 de agosto de 2021 .
- ^ Das S (5 de julio de 2021). "CoWIN se vuelve global: India hace que la tecnología sea de código abierto, 142 naciones muestran interés". Business Standard India . Archivado desde el original el 25 de marzo de 2022 . Consultado el 25 de marzo de 2022 .
- ^ "Aarogya Setu ahora es de código abierto". pib.gov.in (Comunicado de prensa). 26 de mayo de 2020. Archivado desde el original el 26 de junio de 2020 . Consultado el 18 de julio de 2023 .
- ^ "El apoyo del G7 a los monopolios farmacéuticos pone en peligro millones de vidas" (Comunicado de prensa). Amnistía Internacional. 10 de junio de 2021. Archivado desde el original el 19 de octubre de 2021 . Consultado el 20 de agosto de 2021 .
- ^ "Los monopolios de las vacunas hacen que el coste de vacunar al mundo contra la COVID sea al menos cinco veces más caro de lo que podría ser" (Nota de prensa). Oxfam Internacional. 29 de julio de 2021. Archivado desde el original el 10 de enero de 2022. Consultado el 20 de agosto de 2021 .
- ^ Stiglitz J (15 de diciembre de 2021). «Si Olaf Scholz se toma en serio el progreso, debe respaldar una exención de patentes para las vacunas contra el Covid». The Guardian . Archivado desde el original el 15 de diciembre de 2021. Consultado el 15 de diciembre de 2021 .
- ^ "Los países no deben dejar pasar otra oportunidad para avanzar en la exención global para superar los monopolios de herramientas médicas para combatir la COVID-19". Médicos Sin Fronteras (MSF) . 13 de septiembre de 2021. Archivado desde el original el 10 de octubre de 2021 . Consultado el 23 de septiembre de 2021 .
- ^ "MSF pide que no se patenten ni se lucre con los medicamentos y vacunas contra la COVID-19 / No a la especulación con los medicamentos y vacunas contra la COVID-19, dice MSF". Médicos Sin Fronteras (MSF) Internacional . Archivado desde el original el 26 de noviembre de 2021. Consultado el 23 de septiembre de 2021 .
- ^ "Los gobiernos deben actuar rápidamente en relación con el consenso que apoya la medida histórica de suspender los monopolios durante la pandemia / COVID-19: los gobiernos deben generar consenso en torno a la exención". Médicos Sin Fronteras (MSF) Internacional . Archivado desde el original el 23 de octubre de 2021. Consultado el 23 de septiembre de 2021 .
- ^ "La OMS tiene razón al pedir una suspensión temporal de las dosis de refuerzo de la vacuna contra la COVID". Nature . 596 (7872): 317. Agosto 2021. Bibcode :2021Natur.596..317.. doi : 10.1038/d41586-021-02219-w . PMID 34404945. S2CID 237199262.
- ^ "La OMS critica la prisa de los países ricos por administrar las dosis de refuerzo contra el Covid mientras millones de personas en todo el mundo carecen de la primera dosis". France 24 . Agence France-Presse. 18 de agosto de 2021. Archivado desde el original el 2 de noviembre de 2021 . Consultado el 21 de agosto de 2021 .
- ^ Kramer J (18 de agosto de 2021). «Estados Unidos planea autorizar dosis de refuerzo, pero muchos ya recibieron una tercera dosis». National Geographic . Archivado desde el original el 10 de octubre de 2021 . Consultado el 21 de agosto de 2021 .
- ^ «Más de 140 ex jefes de Estado y premios Nobel piden a los candidatos a canciller alemán que renuncien a las normas de propiedad intelectual para las vacunas contra la COVID-19». Oxfam Internacional (Comunicado de prensa). 14 de septiembre de 2021. Archivado desde el original el 19 de octubre de 2021 . Consultado el 22 de septiembre de 2021 .
- ^ Walker P (29 de noviembre de 2021). «Los sindicatos de enfermería de todo el mundo piden que la ONU actúe sobre las patentes de las vacunas contra la COVID-19». The Guardian . Archivado desde el original el 29 de noviembre de 2021. Consultado el 29 de noviembre de 2021 .
- ^ Psaledakis D (22 de septiembre de 2021). "El pedido de los países en desarrollo a los ricos del mundo en la ONU: detengan el acaparamiento de vacunas". Reuters . Archivado desde el original el 10 de noviembre de 2021. Consultado el 29 de septiembre de 2021 .
- ^ Empresa Peruana de Servicios Editoriales SA EDITORA PERÚ (21 de septiembre de 2021). "Perú: Presidente sugiere acuerdo global en ONU que garantice acceso universal a vacunas". Andina (en español). Archivado desde el original el 30 de octubre de 2021 . Consultado el 29 de septiembre de 2021 .
- ^ Baraniuk C (febrero de 2021). "Covid-19: cómo la implementación de la vacuna en el Reino Unido ha tenido éxito hasta ahora". BMJ . 372 : n421. doi : 10.1136/bmj.n421 . PMID 33602672. S2CID 231946710.
- ^ "Dosis adicional de la vacuna de ARNm contra la COVID-19 para pacientes inmunodeprimidos". Centros para el Control y la Prevención de Enfermedades (CDC) de EE. UU . . 13 de agosto de 2021. Archivado desde el original el 7 de octubre de 2021 . Consultado el 16 de agosto de 2021 .
- ^ "Francia planea distribuir dosis de refuerzo de la vacuna contra el Covid, pero solo para los más vulnerables". France 24 . 4 de agosto de 2021. Archivado desde el original el 22 de octubre de 2021 . Consultado el 16 de agosto de 2021 .
- ^ "Israel ofrecerá una tercera dosis de refuerzo contra la COVID a los ciudadanos mayores". Associated Press . 29 de julio de 2021. Archivado desde el original el 31 de octubre de 2021 . Consultado el 16 de agosto de 2021 .
- ^ Hunziker P (julio de 2021). «Vacunación contra la COVID-19 con dosis personalizadas en una ola de variantes del virus que son motivo de preocupación: intercambiar la eficacia individual por el beneficio social». Precision Nanomedicine . 4 (3): 805–820. doi : 10.33218/001c.26101 . Archivado desde el original el 9 de octubre de 2021 . Consultado el 16 de agosto de 2021 .
- ^ "Un análisis de la ONU muestra un vínculo entre la falta de equidad en materia de vacunas y la ampliación de la brecha de pobreza". Noticias ONU . 28 de marzo de 2022. Archivado desde el original el 12 de abril de 2022 . Consultado el 14 de abril de 2022 .
- ^ "DCVMN". Red de fabricantes de vacunas de países en desarrollo . Archivado desde el original el 26 de abril de 2022. Consultado el 26 de abril de 2022 .
- ^ Thompson MG, Burgess JL, Naleway AL, Tyner HL, Yoon SK, Meece J, et al. (abril de 2021). "Estimaciones provisionales de la eficacia de las vacunas BNT162b2 y mRNA-1273 COVID-19 en la prevención de la infección por SARS-CoV-2 entre el personal sanitario, los socorristas y otros trabajadores esenciales y de primera línea: ocho ubicaciones de EE. UU., diciembre de 2020-marzo de 2021" (PDF) . MMWR Morb Mortal Wkly Rep . 70 (13): 495–500. doi : 10.15585/mmwr.mm7013e3 . PMC 8022879 . PMID 33793460. Archivado (PDF) del original el 28 de agosto de 2021 . Recuperado el 9 de junio de 2021 .
- ^ "Cuando esté completamente vacunado". Centros para el Control y la Prevención de Enfermedades de EE. UU. (CDC) . 11 de febrero de 2020. Archivado desde el original el 28 de julio de 2021. Consultado el 29 de abril de 2021 .
- ^ ab «Vacunas contra la COVID: aumento de la desigualdad y millones de personas vulnerables». Naciones Unidas. 19 de septiembre de 2021. Archivado desde el original el 31 de diciembre de 2021. Consultado el 30 de octubre de 2021 .
- ^ "Impacto de la inequidad en materia de vacunas en la recuperación económica". Programa de las Naciones Unidas para el Desarrollo. Archivado desde el original el 3 de noviembre de 2021. Consultado el 30 de octubre de 2021 .
- ^ Elliott L (5 de octubre de 2021). «El FMI recorta las previsiones económicas mundiales porque la pandemia 'obstaculiza' el crecimiento». The Guardian . Archivado desde el original el 27 de octubre de 2021. Consultado el 6 de octubre de 2021 .
- ^ "Los refugiados se enfrentan a graves consecuencias por la falta de financiación para hacer frente al COVID-19, advierte el ACNUR". Naciones Unidas. 17 de septiembre de 2021. Archivado desde el original el 30 de octubre de 2021 . Consultado el 30 de octubre de 2021 .
- ^ ab Azar A (4 de febrero de 2020). "Aviso de declaración en virtud de la Ley de preparación pública y de emergencias para contramedidas médicas contra la COVID-19". Archivado desde el original el 25 de abril de 2020. Consultado el 22 de abril de 2020 .
- ^ Lintern S (2 de diciembre de 2020). "El gobierno del Reino Unido protege a Pfizer de acciones legales por la vacuna contra el coronavirus". The Independent . Archivado desde el original el 5 de mayo de 2021. Consultado el 8 de mayo de 2021 .
- ^ "Preguntas y respuestas: Autorización condicional de comercialización de vacunas contra la COVID-19 en la UE". Comisión Europea . 11 de diciembre de 2020. Pregunta: ¿Cuál es la diferencia de responsabilidad entre la Autorización condicional de comercialización de la UE y las Autorizaciones de uso de emergencia?. Archivado desde el original el 4 de octubre de 2021 . Consultado el 29 de diciembre de 2020 .
- ^ "EMA recomienda autorizaciones de comercialización estándar para las vacunas Comirnaty y Spikevax contra la COVID-19". Agencia Europea de Medicamentos . 16 de septiembre de 2022. Archivado desde el original el 16 de septiembre de 2022 . Consultado el 7 de octubre de 2022 .
- ^ Haahr T (7 de septiembre de 2020). "COVID-19: los eurodiputados quieren vacunas seguras, transparencia total y responsabilidad para las empresas". Parlamento Europeo . La Sra. Gallina destacó que las negociaciones con las empresas habían sido difíciles, pero subrayó que las empresas que desarrollan y fabrican vacunas contra la COVID-19 sí serían responsables de acuerdo con las leyes actuales y, si algo sale mal, podrían ser llevadas a los tribunales. Esto también se aplica a la compensación por defectos ocultos. Archivado desde el original el 13 de octubre de 2021 . Consultado el 29 de diciembre de 2020 .
- ^ "Investigación: farmacéutica 'intimidaba' a naciones latinoamericanas". Al Jazeera . 11 de marzo de 2021. Archivado desde el original el 31 de octubre de 2021 . Consultado el 15 de junio de 2021 .
- ^ Barcellos R (13 de mayo de 2021). "Carlos Murillo diz que cláusulas críticas pelo Brasil valem em 110 países" [Carlos Murillo dice que las cláusulas críticas para Brasil son válidas en 110 países]. CNN Brasil (en portugues). Archivado desde el original el 28 de junio de 2021 . Consultado el 15 de junio de 2021 .
- ^ "El gobernador Ron DeSantis solicita a la Corte Suprema de Florida la creación de un gran jurado estatal sobre las vacunas contra la COVID-19 y anuncia la creación de un comité de integridad de la salud pública". www.flgov.com . Archivado desde el original el 14 de diciembre de 2022 . Consultado el 14 de diciembre de 2022 .
- ^ "El gobernador de Florida solicita una investigación del gran jurado sobre las vacunas contra el Covid". www.theguardian.com . 13 de diciembre de 2022. Archivado desde el original el 13 de diciembre de 2022 . Consultado el 14 de diciembre de 2022 .
- ^ Stempel J (30 de noviembre de 2023). "Texas demanda a Pfizer por afirmaciones sobre la vacuna contra el COVID". Reuters .
- ^ Harper BK (30 de noviembre de 2023). "El fiscal general de Texas demanda a Pfizer, alegando que las vacunas no acabaron con la pandemia lo suficientemente rápido". The Texas Tribune .
- ^ Pierson B (18 de junio de 2024). "Kansas acusa a Pfizer de engañar al público sobre la vacuna COVID en una demanda". Reuters .
- ^ "El fundador de Blackwater, Prince, asume un papel en la empresa de vacunas contra la COVID". Reuters . 4 de junio de 2021. Archivado desde el original el 9 de octubre de 2021 . Consultado el 4 de junio de 2021 .
- ^ ab Leonhardt D (11 de marzo de 2024). «El cuarto aniversario de la pandemia de Covid». The New York Times . Archivado desde el original el 11 de marzo de 2024."Los datos excluyen a Alaska. Fuentes: CDC Wonder; Edison Research. (Gráfico) Por The New York Times . La fuente del gráfico se atribuye a Ashley Wu.
- ^ Lynas M (20 de abril de 2020). «COVID: Las 10 principales teorías conspirativas actuales». Alliance for Science . Consultado el 4 de octubre de 2021 .
- ^ Burakovsky A (28 de agosto de 2021). "La respuesta de Rusia al COVID-19 se vio frenada por la renuencia de la población a recibir la vacuna nacional". KRQE . Consultado el 20 de septiembre de 2021 .
- ^ "Un pase Covid arrasa en Francia". WLFI News . Archivado desde el original el 20 de septiembre de 2021 . Consultado el 20 de septiembre de 2021 .
- ^ "MLB ofrece entradas gratis para vacunarse contra el COVID-19". Kron4. 4 de junio de 2021. Consultado el 4 de octubre de 2021 .
- ^ Gore D (10 de mayo de 2021). "Explorando la legalidad de los mandatos de vacunación contra la COVID-19". factcheck.org . Consultado el 4 de octubre de 2021 .
- ^ Hotez PJ (2023). El ascenso letal de la anticiencia: la advertencia de un científico . Prensa de la Universidad Johns Hopkins. ISBN 978-1421447223.
- ^ Bing C, Schechtman J (14 de junio de 2024). "El Pentágono lanzó una campaña secreta contra las vacunas para debilitar a China durante la pandemia". Reuters .
Lectura adicional
- Copaescu AM, Rosa Duque JS, Phillips EJ (julio de 2022). "¿Qué hemos aprendido sobre la alergenicidad y las reacciones adversas asociadas con las vacunas contra el coronavirus 2 del síndrome respiratorio agudo severo? Un año después". Anales de alergia, asma e inmunología . 129 (1): 40–51. doi : 10.1016/j.anai.2022.03.030 . PMC 8979618 . PMID 35390476.
- Krause PR, Fleming TR, Longini IM, Peto R, Briand S, Heymann DL, et al. (julio de 2021). "Variantes y vacunas del SARS-CoV-2". N Engl J Med . 385 (2): 179–186. doi : 10.1056/NEJMsr2105280 . PMC 8262623. PMID 34161052 .
- Kyriakidis NC, López-Cortés A, González EV, Grimaldos AB, Prado EO (febrero de 2021). "Estrategias de vacunas contra el SARS-CoV-2: una revisión exhaustiva de los candidatos de fase 3". Vacunas npj . 6 (1): 28. doi : 10.1038/s41541-021-00292-w . PMC 7900244 . PMID 33619260.
- Ramsay M, ed. (2020). "COVID-19: el libro verde, capítulo 14a". Inmunización contra enfermedades infecciosas. Londres: Public Health England.
- Desarrollo y autorización de vacunas para prevenir la COVID-19: orientación para la industria (PDF) (informe). Administración de Alimentos y Medicamentos de los Estados Unidos (FDA). Junio de 2020.
Protocolos de vacunación
- «Protocolo ARNm-1273-P301» (PDF) . Moderna . Archivado desde el original (PDF) el 28 de septiembre de 2020 . Consultado el 21 de septiembre de 2020 .
- «Protocolo C4591001 PF-07302048 (Vacunas contra la COVID-19 basadas en ARN BNT162)» (PDF) . Pfizer . Archivado desde el original (PDF) el 6 de diciembre de 2021 . Consultado el 6 de agosto de 2022 .
- "Protocolo AZD1222 – D8110C00001" (PDF) . AstraZeneca .
- "Protocolo VAC31518COV3001; Fase 3 (Conjunto)" (PDF) . Janssen Vaccines & Prevention .
- "Protocolo VAC31518COV3009; Fase 3 (Conjunto 2)" (PDF) . Janssen Vaccines & Prevention .
- "Protocol VAT00008 – Study of Monovalent and Bivalent Recombinant Protein Vaccines against COVID-19 in Adults 18 Years of Age and Older Protocol" (PDF). Sanofi Pasteur. Archived from the original (PDF) on 23 July 2021. Retrieved 30 July 2021.
- "Protocol 2019nCoV-301". Novavax.
External links
- "COVID-19 vaccine tracker and landscape". World Health Organization (WHO).
- M.I.T. Lecture 10: Kizzmekia Corbett, Vaccines on YouTube
- M.I.T. Lecture 12: Dan Barouch, Covid-19 Vaccine Development on YouTube
- "The 5 Stages of COVID-19 Vaccine Development: What You Need to Know About How a Clinical Trial Works". Johnson & Johnson. September 2020.
- "Coronavirus vaccine – weekly summary of Yellow Card reporting". UK Medicines and Healthcare products Regulatory Agency (MHRA).
- "COVID-19 vaccine safety report - 05-10-2023". Therapeutic Goods Administration (TGA). 4 October 2023.
- Kolata G, Mueller B (15 January 2022). "Halting Progress and Happy Accidents: How mRNA Vaccines Were Made". The New York Times. Archived from the original on 15 January 2022.


![Mapa que muestra la proporción de la población completamente vacunada contra la COVID-19 en relación con la población total de un país[nota 1]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b4/World_map_of_share_of_people_who_received_all_doses_prescribed_by_the_initial_COVID-19_vaccination_protocol.png/510px-World_map_of_share_of_people_who_received_all_doses_prescribed_by_the_initial_COVID-19_vaccination_protocol.png)