Cloruro de tubocurarina
 | |
 | |
| Datos clínicos | |
|---|---|
| AHFS / Drogas.com | Nombres internacionales de medicamentos |
| MedlinePlus | a682860 |
Categoría de embarazo |
|
| Vías de administración | IV |
| Código ATC |
|
| Estatus legal | |
| Estatus legal |
|
| Datos farmacocinéticos | |
| Biodisponibilidad | 100% (IV) |
| Unión de proteínas | 50% |
| Vida media de eliminación | 1–2 horas |
| Identificadores | |
| |
| Número CAS | |
| Identificador de centro de PubChem |
|
| Unión Internacional para la Investigación y el Desarrollo (IUPHAR)/BPS |
|
| Banco de medicamentos | |
| Araña química | |
| UNIVERSIDAD |
|
| EBICh | |
| Química biológica | |
| Panel de control CompTox ( EPA ) |
|
| Datos químicos y físicos | |
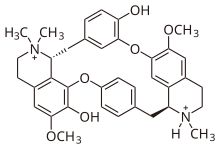
| Fórmula | C37H42Cl2N2O6 |
| Masa molar | 681,65 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
 norte norte Y (¿que es esto?) (verificar) Y (¿que es esto?) (verificar) | |
La tubocurarina (también conocida como d -tubocurarina o DTC ) es un alcaloide bencilisoquinolínico tóxico conocido históricamente por su uso como veneno para flechas . A mediados del siglo XX, se utilizaba junto con un anestésico para proporcionar relajación del músculo esquelético durante la cirugía o la ventilación mecánica . Alternativas más seguras, como el cisatracurio y el rocuronio , lo han reemplazado en gran medida como complemento de la anestesia clínica y ahora se utiliza raramente.
Historia
La tubocurarina es un alcaloide monocuaternario natural obtenido de la corteza de la planta menispermacea sudamericana Chondrodendron tomentosum , una enredadera conocida en el mundo europeo desde la conquista española de Sudamérica. Los nativos sudamericanos habían utilizado el curare como fuente de veneno para flechas para cazar animales, y pudieron comer la carne contaminada de los animales posteriormente sin ningún efecto adverso porque la tubocurarina no puede atravesar fácilmente las membranas mucosas . Por lo tanto, la tubocurarina es efectiva solo si se administra por vía parenteral , como lo demostró Bernard , quien también mostró que el sitio de su acción estaba en la unión neuromuscular. [1] Virchow y Munter confirmaron que la acción paralizante se limitaba a los músculos voluntarios . [2]
Etimología
La palabra curare proviene del nombre nativo sudamericano para el veneno de flecha, ourare . [ ¿Qué idioma es esto? ] Presumiblemente, la sílaba inicial se pronunciaba con una parada glotal fuerte . [ ¿ Investigación original? ] La tubocurarina se llama así porque algunos de los extractos de plantas designados curare se almacenaban y luego se enviaban a Europa en tubos de bambú. Del mismo modo, el curare almacenado en recipientes de calabaza se llamaba curare de calabaza, aunque generalmente no era un extracto de Chondrodendron, sino de la especie Strychnos S. toxifera , que contenía un alcaloide diferente, a saber, toxiferina . El curare en maceta era generalmente una mezcla de extractos de varios géneros de las familias Menispermaceae y Strychnaceae . La clasificación tripartita en curares de "tubo", "calabaza" y "maceta" pronto se volvió insostenible, debido a las inconsistencias en el uso de los diferentes tipos de recipientes y las complejidades de las propias recetas de veneno de dardo. [3]
Uso en anestesia
A Griffith y Johnson se les atribuye la introducción clínica formal de la tubocurarina como complemento a la práctica anestésica el 23 de enero de 1942, en el Hospital Homeopático de Montreal. [4] En este sentido, la tubocurarina es el agente neuromuscular no despolarizante adyuvante prototípico . Sin embargo, otros antes de Griffith y Johnson habían intentado el uso de la tubocurarina en varias situaciones: [5] [6] [7] algunas en condiciones de estudio controladas [8] [9] mientras que otras no estaban del todo controladas y permanecieron inéditas. [10] En cualquier caso, en total, alrededor de 30.000 pacientes habían recibido tubocurarina en 1941, aunque fue la publicación de Griffith y Johnson de 1942 [4] la que proporcionó el impulso al uso estándar de agentes bloqueantes neuromusculares en la práctica anestésica clínica, una revolución que rápidamente se metamorfoseó en la práctica estándar de la anestesia "equilibrada": la tríada de hipnosis barbitúrica, anestesia inhalatoria ligera y relajación muscular. [11] La técnica descrita por Gray y Halton era ampliamente conocida como la "técnica de Liverpool", [11] y se convirtió en la técnica anestésica estándar en Inglaterra en los años 1950 y 1960 para pacientes de todas las edades y estados físicos. La práctica anestésica clínica actual todavía emplea el principio central de la anestesia equilibrada , aunque con algunas diferencias para dar cabida a los avances tecnológicos posteriores y la introducción de nuevos y mejores anestésicos gaseosos, agentes bloqueadores hipnóticos y neuromusculares y la intubación traqueal, así como técnicas de monitorización que no existían en la época de Gray y Halton: oximetría de pulso, capnografía, estimulación de nervios periféricos, monitorización no invasiva de la presión arterial, etc.
Propiedades químicas
Estructuralmente, la tubocurarina es un derivado de la bencilisoquinolina . Cuando se dilucidó por primera vez en 1948 y durante muchos años [12] , se pensó incorrectamente que su estructura era biscuaternaria: en otras palabras, se pensaba que era un alcaloide N , N -dimetilado. En 1970, finalmente se estableció la estructura correcta [13] , mostrando que uno de los dos nitrógenos era terciario, en realidad un alcaloide mono- N -metilado.
Biosíntesis
La biosíntesis de tubocurarina implica un acoplamiento radical de los dos enantiómeros de N-metilcoclaurina. ( R ) y ( S )-N -metilcoclaurina provienen de una reacción similar a la de Mannich entre la dopamina y el 4-hidroxifenilacetaldehído, facilitada por la norcoclaurina sintasa (NCS). Tanto la dopamina como el 4-hidroxifenilacetaldehído se originan a partir de la L -tirosina. La metilación de los sustituyentes amina e hidroxilo se ve facilitada por la S -adenosil metionina (SAM) . Un grupo metilo está presente en cada átomo de nitrógeno antes del acoplamiento radical. El grupo metilo adicional se transfiere para formar tubocurarina, con su único grupo cuaternario N,N-dimetilamino. [14]

Efectos biológicos

Sin intervención, la acetilcolina (ACh) en el sistema nervioso periférico activa los músculos esqueléticos. La acetilcolina es producida en el cuerpo de la neurona por la colina acetiltransferasa y transportada a través del axón hasta el espacio sináptico. El cloruro de tubocurarina actúa como antagonista del receptor nicotínico de acetilcolina (nAChr) , lo que significa que bloquea el sitio receptor de la ACh. [16] Esto puede deberse al motivo estructural amino cuaternario que se encuentra en ambas moléculas.
Farmacología clínica
Unna et al. informaron los efectos de la tubocurarina en humanos:
Cuarenta y cinco segundos después de comenzar la inyección, se percibió pesadez de los párpados y diplopía transitoria . Al terminar la inyección, la diplopía se volvió fija, pero sólo se pudo notar cuando el operador levantó los párpados del sujeto. A medida que avanzaba la curarización, al sujeto le pareció como si los músculos faciales, los de la lengua, faringe y mandíbula inferior, los músculos del cuello y la espalda y los músculos de las extremidades se relajaran aproximadamente en ese orden. Acompañando la parálisis de la faringe y los músculos de la mandíbula, se notó la incapacidad del sujeto para tragar ... Poco después de terminar la inyección, los sujetos experimentaron una sensación de mayor dificultad para respirar, como si fuera necesario un esfuerzo extra para mantener un intercambio respiratorio adecuado. Esta sensación estaba presente a pesar de que no había evidencia objetiva de oxigenación alterada o de retención de dióxido de carbono. Alcanzó su máximo aproximadamente cinco minutos después de la inyección, coincidiendo con la depresión máxima de la capacidad vital. En la mayoría de los experimentos, la frecuencia respiratoria aumentó entre un 50 y un 100 por ciento en los primeros minutos después de la inyección de cualquiera de los fármacos, mientras que el volumen corriente disminuyó. [17]
La tubocurarina tiene un tiempo de inicio de acción de alrededor de 5 minutos, que es relativamente lento entre los fármacos bloqueadores neuromusculares , y tiene una duración de acción de 60 a 120 minutos. [18] [19] También causa liberación de histamina , [20] ahora un sello distintivo reconocido de la clase de agentes bloqueadores neuromusculares tetrahidroisioquinolinio. La liberación de histamina se asocia con broncoespasmos , hipotensión y secreciones salivales , lo que la hace peligrosa para asmáticos, niños y mujeres embarazadas o lactantes. [21] Sin embargo, la principal desventaja en el uso de tubocurarina es su significativo efecto de bloqueo ganglionar, [22] que se manifiesta como hipotensión, [23] en muchos pacientes; esto constituye una contraindicación relativa para su uso en pacientes con isquemia miocárdica.
Debido a las deficiencias del tubocurare, poco después de su introducción clínica se emprendieron muchos esfuerzos de investigación para encontrar un sustituto adecuado. Los esfuerzos dieron lugar a una multitud de compuestos derivados de las relaciones estructura-actividad desarrolladas a partir de la molécula de tubocurare. Algunos compuestos clave que han tenido uso clínico se identifican en el cuadro de plantilla de relajantes musculares que aparece a continuación. De los muchos que se probaron como sustitutos, solo unos pocos gozaron de tanta popularidad como la tubocurarina: pancuronio , vecuronio , rocuronio , atracurio y cisatracurio . La succinilcolina es un fármaco relajante muscular ampliamente utilizado que actúa activando, en lugar de bloquear, el receptor de ACh.
Se ha demostrado que el bloqueador de los canales de potasio tetraetilamonio (TEA) revierte los efectos de la tubocurarina. Se cree que lo hace al aumentar la liberación de ACh, lo que contrarresta los efectos antagónicos de la tubocurarina sobre el receptor de ACh.
Úselo como tratamiento para picaduras de araña.
Las arañas del género Latrodectus tienen α-latrotoxina en su veneno. La araña más conocida de este género es la araña viuda negra. La α-latrotoxina provoca la liberación de neurotransmisores en el espacio sináptico, incluida la acetilcolina . [24] Las picaduras no suelen ser mortales, pero sí provocan una cantidad significativa de dolor además de espasmos musculares. El veneno es el más dañino para las terminaciones nerviosas, pero la introducción de cloruro de d -tubocurarina bloquea el nAChr , aliviando el dolor y los espasmos musculares mientras se puede administrar un antiveneno. [25]
Toxicología
Una persona a la que se le administre cloruro de tubocurarina no podrá mover ningún músculo voluntario, incluido el diafragma. Por lo tanto, una dosis suficientemente grande provocará la muerte por insuficiencia respiratoria a menos que se inicie la ventilación artificial. La DL50 para ratones y conejos es de 0,13 mg/kg y 0,146 mg/kg por vía intravenosa, respectivamente. Libera histamina y causa hipotensión. [26]
Referencias
- ^ Bernardo C (1856). "Analizar la fisiología de las propiedades de las acciones de curación y de la nicotina en los sistemas musculares y nerviosos au moyen du curare". compt. Rendir . 43 : 305–319.
- ^ Betcher AM (1977). "La civilización del curare: una historia de su desarrollo e introducción en la anestesiología". Anestesia y analgesia . 56 (2): 305–319. doi : 10.1213/00000539-197703000-00032 . PMID 322548.
- ^ Los alcaloides: química y fisiología ed. RHF Manske (Dominion Rubber Research Laboratory Guelph, Ontario) Academic Press Inc., editores Nueva York 1955 Volumen 5: Farmacología
- ^ ab Griffith HR, Johnson GE (1942). "El uso de curare en anestesia general". Anestesiología . 3 (4): 418–420. doi : 10.1097/00000542-194207000-00006 . S2CID 71400545.
- ^ Läwen A (1912). "Ueber die verbindung der lokakanaesthesie und epidurale injektion anesthesiernder losungen bei tabischen magenkrisen". Beitr Klin Chir . 80 : 168–189.
- ^ Wilkinson DJ (enero de 1991). "Dr. FP de Caux: el primer usuario de curare para anestesia en Inglaterra". Anestesia . 46 (1): 49–51. doi : 10.1111/j.1365-2044.1991.tb09317.x . PMID 1996757.
- ^ Bennett AE (1941). "Curare: un método preventivo de complicaciones traumáticas en la terapia de choque electroconvulsivo". Am J Psychiatry . 97 : 1040–1060. doi :10.1176/ajp.97.5.1040.
- ^ West R (octubre de 1984). "Una excursión a la farmacología: el curare en medicina". Historia médica . 28 (4): 391–405. doi :10.1017/s0025727300036279. PMC 1140012 . PMID 6390032.
- ^ Burman MS (1939). "Uso terapéutico de curare y clorhidrato de eritroidina para estados espásticos y distónicos". Arch Neurol Psychiatry . 41 (2): 307–327. doi :10.1001/archneurpsyc.1939.02270140093008.
- ^ Bevan DR (1992). ""Curare". En: Maltby JR, Shephard DAE (Eds.), Harold Griffith – Su vida y legado". Can J Anaesth . 39 (1): 49–55.
- ^ ab Gray TC, Halton J (agosto de 1946). "Curarina con anestesia balanceada". British Medical Journal . 2 (4469): 293–295. doi :10.1136/bmj.2.4469.293. PMC 2054113 . PMID 20786887.
- ^ King H (1948). "64. Alcaloides del curare. Parte VII. Constitución del cloruro de dextrotubocurarina". J Chem Soc : 265. doi :10.1039/jr9480000265.
- ^ Everett AJ, Lowe LA, Wilkinson S (1970). "Revisión de las estructuras del cloruro de (+)-tubocurarina y la (+)-condrocurina". J. Chem. Soc. Chem. Commun. (16): 1020. doi :10.1039/c29700001020.
- ^ Dewick, PM Productos naturales medicinales; un enfoque biosintético. 3.ª ed.; John Wiley and Sons Ltd.: 2009.
- ^ Katzung BG (2001). Farmacología básica y clínica: Introducción a la farmacología autonómica (8.ª ed.). The McGraw Hill Companies. pp. 75–91. ISBN 978-0-07-160405-5.
- ^ Wenningmann I, Dilger JP (octubre de 2001). "La cinética de inhibición de los receptores nicotínicos de acetilcolina por (+)-tubocurarina y pancuronio". Farmacología molecular . 60 (4): 790–796. PMID 11562442.
- ^ Unna KR (marzo de 1950). "Evaluación de fármacos curativos en el hombre". Revista de farmacología y terapéutica experimental . 98 .
- ^ Thompson MA (febrero de 1980). «Fármacos relajantes musculares». British Journal of Hospital Medicine . 23 (2): 153–4, 163–4, 167–8 pássim. PMID 6102875.
- ^ Página 151 en: Rang HP (2003). Farmacología . Edimburgo: Churchill Livingstone. ISBN 0-443-07145-4.OCLC 51622037 .
- ^ Maclagen J (1976). "Fármacos bloqueantes neuromusculares competitivos". En Zaimis E (ed.). Unión neuromuscular . Manual de farmacología experimental. Vol. 42. Berlín: Springer-Verlag. págs. 421–486. doi :10.1007/978-3-642-45476-9_6. ISBN 978-3-642-45476-9.
- ^ "d-Tubocurarina (bloqueador neuromuscular no despolarizante prototipo)". Universidad de Tulane . Consultado el 4 de mayo de 2015 .
- ^ Bowman WC, Webb SN (octubre de 1972). "Actividades de bloqueo neuromuscular y bloqueo ganglionar de algunos antagonistas de la acetilcolina en el gato". The Journal of Pharmacy and Pharmacology . 24 (10): 762–772. doi :10.1111/j.2042-7158.1972.tb08880.x. PMID 4403972. S2CID 27668701.
- ^ Coleman AJ, Downing JW, Leary WP, Moyes DG, Styles M (octubre de 1972). "Los efectos cardiovasculares inmediatos del pancuronio, el alcuronio y la tubocurarina en el hombre". Anestesia . 27 (4): 415–422. doi : 10.1111/j.1365-2044.1972.tb08247.x . PMID 4264060.
- ^ Südhof TC (marzo de 2001). "Alfa-latrotoxina y sus receptores: neurexinas y CIRL/latrofilinas". Revisión anual de neurociencia . 24 : 933–962. doi :10.1146/annurev.neuro.24.1.933. PMID 11520923. S2CID 906456.
- ^ Allen GW (septiembre de 1953). "Intoxicación por araña viuda negra (Latrodectus mactans) tratada con cloruro de d-tubocurarina". Anales de Medicina Interna . 39 (3): 624–625. doi :10.7326/0003-4819-39-3-624. PMID 13080907.
- ^ Gesler RM, Hoppe JO (diciembre de 1956). "3, 6-bis(3-dietilaminopropoxi) piridazina bismetioduro, un agente bloqueador neuromuscular de acción prolongada". The Journal of Pharmacology and Experimental Therapeutics . 118 (4): 395–406. PMID 13385800.