Proteína L
| Dominio de la proteína L b1 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
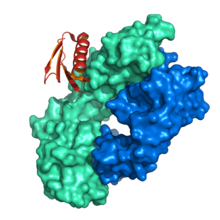 Estructura de la proteína L uniéndose a la cadena ligera de un Fab murino ( PDB : 1MHH ). [1] | |||||||||||
| Identificadores | |||||||||||
| Símbolo | Personas | ||||||||||
| Pfam | PF02246 | ||||||||||
| Interprofesional | IPR003147 | ||||||||||
| SCOP2 | 1MHH / ALCANCE / SUPFAM | ||||||||||
| |||||||||||
La proteína L se aisló por primera vez de la superficie de la especie bacteriana Peptostreptococcus magnus y se descubrió que se une a las inmunoglobulinas a través de la interacción de la cadena L , de donde se sugirió el nombre. [2] Consta de 719 residuos de aminoácidos. [3] El peso molecular de la proteína L purificada de las paredes celulares de Peptostreptoccus magnus se estimó por primera vez en 95 kD por SDS-PAGE en presencia del agente reductor 2-mercaptoetanol, mientras que el peso molecular se determinó en 76 kD por cromatografía en gel en presencia de 6 M de guanidina HCl. La proteína L no contiene ningún bucle disulfuro entre cadenas, ni consta de subunidades unidas por disulfuro. Es una molécula ácida con un pI de 4,0. [4] A diferencia de la proteína A y la proteína G , que se unen a la región Fc de las inmunoglobulinas ( anticuerpos ), la proteína L se une a los anticuerpos a través de interacciones de cadena ligera . Dado que ninguna parte de la cadena pesada está involucrada en la interacción de unión, la proteína L se une a una gama más amplia de clases de anticuerpos que la proteína A o G. La proteína L se une a representantes de todas las clases de anticuerpos, incluidos IgG , IgM , IgA , IgE e IgD . Los fragmentos variables de cadena única ( scFv ) y los fragmentos Fab también se unen a la proteína L.
A pesar de este amplio rango de unión, la proteína L no es una proteína de unión universal a anticuerpos . La unión de la proteína L está restringida a aquellos anticuerpos que contienen cadenas ligeras kappa. En humanos y ratones, la mayoría de las moléculas de anticuerpos contienen cadenas ligeras kappa (κ) y el resto tienen cadenas ligeras lambda (λ). La proteína L solo es eficaz en la unión de ciertos subtipos de cadenas ligeras kappa. Por ejemplo, se une a los subtipos humanos VκI, VκIII y VκIV, pero no se une al subtipo VκII. La unión de las inmunoglobulinas de ratón está restringida a aquellas que tienen cadenas ligeras VκI. [5]
Dados estos requisitos específicos para una unión eficaz, la principal aplicación de la proteína L inmovilizada es la purificación de anticuerpos monoclonales de ascitis o sobrenadante de cultivo celular que se sabe que tienen la cadena ligera kappa . La proteína L es extremadamente útil para la purificación de anticuerpos monoclonales que contienen VLκ del sobrenadante de cultivo porque no se une a las inmunoglobulinas bovinas , que a menudo están presentes en los medios como suplemento sérico . Además, la proteína L no interfiere con el sitio de unión al antígeno del anticuerpo, lo que la hace útil para ensayos de inmunoprecipitación , incluso utilizando IgM.
Gen de la proteína L
El gen de la proteína L contiene cinco componentes: una secuencia señal de 18 aminoácidos; una región terminal NH2 ("A") de 79 residuos; cinco repeticiones "B" homólogas de 72-76 aminoácidos cada una; una región terminal COOH de dos repeticiones "C" adicionales (52 aminoácidos cada una); una región hidrofílica rica en prolina que atraviesa la pared celular ("W") después de las repeticiones C; un anclaje de membrana hidrofóbico ("M"). Se descubrió que las repeticiones B (36 kD) eran responsables de la interacción con las cadenas ligeras de Ig. [2]
Otras proteínas de unión a anticuerpos
Además de la proteína L, otras proteínas bacterianas que se unen a las inmunoglobulinas, como la proteína A , la proteína G y la proteína A/G, se utilizan habitualmente para purificar, inmovilizar o detectar inmunoglobulinas. Cada una de estas proteínas que se unen a las inmunoglobulinas tiene un perfil de unión de anticuerpos diferente en términos de la porción del anticuerpo que se reconoce y la especie y el tipo de anticuerpos a los que se unirá.
Referencias
- ^ Graille M, Harrison S, Crump MP, Findlow SC, Housden NG, Muller BH, Battail-Poirot N, Sibaï G, Sutton BJ, Taussig MJ, Jolivet-Reynaud C, Gore MG, Stura EA (diciembre de 2002). "Evidencia de plasticidad y mimetismo estructural en la interfase de la cadena ligera de inmunoglobulina-proteína L". J Biol Chem . 277 (49): 47500–6. doi : 10.1074/jbc.M206105200 . PMID 12221088.
- ^ Björck L (febrero de 1988). "Proteína L. Una nueva proteína de la pared celular bacteriana con afinidad por las cadenas L de Ig". J. Immunol . 140 (4): 1194–7. doi : 10.4049/jimmunol.140.4.1194 . PMID: 3125250. S2CID : 35781778.
- ^ Kastern W, Sjöbring U, Björck L (junio de 1992). "Estructura de la proteína L peptostreptocócica e identificación de un dominio repetido de unión a la cadena ligera de inmunoglobulina". J. Biol. Chem . 267 (18): 12820–5. doi : 10.1016/S0021-9258(18)42349-6 . PMID 1618782.
- ^ Akerström B, Björck L (noviembre de 1989). "Proteína L: una proteína bacteriana que se une a la cadena ligera de inmunoglobulina. Caracterización de la unión y propiedades fisicoquímicas". J. Biol. Chem . 264 (33): 19740–6. doi : 10.1016/S0021-9258(19)47174-3 . PMID 2479638.
- ^ Nilson BH, Lögdberg L, Kastern W, Björck L, Akerström B (agosto de 1993). "Purificación de anticuerpos utilizando estructuras de unión a la proteína L en el dominio variable de la cadena ligera". J. Immunol. Methods . 164 (1): 33–40. doi :10.1016/0022-1759(93)90273-a. PMID 8360508.