Cadena ligera de inmunoglobulina
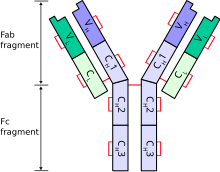
La cadena ligera de inmunoglobulina es la pequeña subunidad polipeptídica de un anticuerpo (inmunoglobulina).
Un anticuerpo típico se compone de dos cadenas pesadas de inmunoglobulina (Ig) y dos cadenas ligeras de Ig.
En los humanos
Existen dos tipos de cadenas ligeras en los humanos:
- Cadena kappa (κ), codificada por el locus kappa de inmunoglobulina (IGK@) en el cromosoma 2 (locus: 2p11.2)
- cadena lambda (λ), codificada por el locus lambda de inmunoglobulina (IGL@) en el cromosoma 22 (locus: 22q11.2)
Los anticuerpos son producidos por los linfocitos B , cada uno de los cuales expresa solo una clase de cadena ligera. Una vez establecida, la clase de cadena ligera permanece fija durante la vida del linfocito B. En un individuo sano, la relación total kappa-lambda es aproximadamente 2:1 en suero (midiendo anticuerpos completos intactos) o 1:1,5 si se miden las cadenas ligeras libres, con una relación altamente divergente indicativa de neoplasia . La relación de cadenas ligeras libres varía de 0,26 a 1,65. [1] Tanto las cadenas kappa como las lambda pueden aumentar proporcionalmente, manteniendo una relación normal. Esto suele ser indicativo de algo más que una discrasia de células sanguíneas, como una enfermedad renal.
En otros animales
Los genes de la cadena ligera de inmunoglobulina en los tetrápodos se pueden clasificar en tres grupos distintos: kappa (κ), lambda (λ) y sigma (σ). La divergencia de los isotipos κ, λ y σ precedió a la radiación de los tetrápodos . El isotipo σ se perdió después de la evolución del linaje de los anfibios y antes de la aparición del linaje de los reptiles. [2]
Se pueden encontrar otros tipos de cadenas ligeras en vertebrados inferiores , como la cadena Ig-Light-Iota de los condrictios y los teleósteos . [3] [4]
Los camélidos son únicos entre los mamíferos porque también tienen anticuerpos completamente funcionales que tienen dos cadenas pesadas, pero carecen de las cadenas ligeras que generalmente se combinan con cada cadena pesada. [5]
Los tiburones también poseen, como parte de su sistema inmunológico adaptativo, una molécula homodímera funcional de cadena pesada similar a un anticuerpo, conocida como IgNAR (receptor de nuevo antígeno de inmunoglobulina). Se cree que el IgNAR nunca ha tenido una cadena ligera asociada, en contraste con la idea de que los anticuerpos de cadena pesada en los camélidos pueden haber perdido sus cadenas ligeras asociadas a través de la evolución. [6] [7]
Estructura
En un anticuerpo típico sólo está presente un tipo de cadena ligera, por lo que las dos cadenas ligeras de un anticuerpo individual son idénticas.
Cada cadena ligera está compuesta por dos dominios de inmunoglobulina en tándem :
- un dominio constante (C L )
- un dominio variable (VL ) que es importante para la unión del antígeno
La longitud aproximada de una proteína de cadena ligera es de 211 a 217 aminoácidos . [3] La región constante determina a qué clase (kappa o lambda) pertenece la cadena ligera. [8] La clase lambda tiene 4 subtipos ( 1 , 2 , 3 y 7 ). [8]
En patología
Las células B individuales en el tejido linfoide poseen cadenas ligeras kappa o lambda, pero nunca ambas juntas. Mediante inmunohistoquímica , es posible determinar la abundancia relativa de células B que expresan cadenas ligeras kappa y lambda. Si el ganglio linfático o tejido similar es reactivo , o benigno, debería poseer una mezcla de células kappa positivas y lambda positivas. Sin embargo, si un tipo de cadena ligera es significativamente más común que el otro, es probable que todas las células deriven de una pequeña población clonal, lo que puede indicar una afección maligna , como el linfoma de células B. [9]
Las cadenas ligeras de inmunoglobulina libres secretadas por células plasmáticas neoplásicas , como en el mieloma múltiple , pueden denominarse proteína de Bence Jones cuando se detectan en la orina, aunque existe una tendencia a denominarlas cadenas ligeras libres urinarias.
También se han detectado niveles elevados de cadenas ligeras de Ig libres en diversas enfermedades inflamatorias. Es importante señalar que, a diferencia de los niveles elevados en pacientes con linfoma, estas cadenas ligeras de Ig son policlonales. Estudios recientes han demostrado que estas cadenas ligeras de Ig pueden unirse a los mastocitos y, utilizando su capacidad para unirse al antígeno, facilitar la activación de estos mastocitos. [10] La activación de los mastocitos da como resultado la liberación de varios mediadores proinflamatorios que se cree que contribuyen al desarrollo de la enfermedad inflamatoria. Estudios recientes han demostrado que las cadenas ligeras de Ig no solo activan a los mastocitos, sino también a los ganglios de la raíz dorsal [11] y a los neutrófilos, [12] ampliando su posible papel como mediadores en la enfermedad inflamatoria.
Véase también
Referencias
- ^ Katzmann JA, Clark RJ, Abraham RS, Bryant S, Lymp JF, Bradwell AR, Kyle RA (2001). "Intervalos de referencia séricos y rangos de diagnóstico para cadenas ligeras de inmunoglobulina kappa y lambda libres: sensibilidad relativa para la detección de cadenas ligeras monoclonales". Clin Chem . 48 (9): 1437–44. doi : 10.1093/clinchem/48.9.1437 . PMID 12194920.
- ^ Das S, Nikolaidis N, Klein J, Nei M (2008). "Redefinición evolutiva de isotipos de cadena ligera de inmunoglobulina en tetrápodos utilizando marcadores moleculares". Proc Natl Acad Sci USA . 105 (43): 16647–52. Bibcode :2008PNAS..10516647D. doi : 10.1073/pnas.0808800105 . PMC 2575474 . PMID 18940927.
- ^ ab Janeway CA, Jr. ; et al. (2001). Inmunobiología (5.ª ed.). Garland Publishing. ISBN 0-8153-3642-X. (texto completo electrónico vía NCBI Bookshelf).
- ^ Índice IMGT Archivado el 27 de abril de 2007 en Wayback Machine Anticuerpos (o inmunoglobulinas).
- ^ Hamers-Casterman C, Atarhouch T, Muyldermans S, Robinson G, Hamers C, Songa E, Bendahman N, Hamers R (1993). "Anticuerpos naturales desprovistos de cadenas ligeras". Nature . 363 (6428): 446–8. Bibcode :1993Natur.363..446H. doi :10.1038/363446a0. PMID 8502296. S2CID 4265902.
- ^ Flajnik, MF; Deschacht, N; Muyldermans, S (2011). "Un caso de convergencia: ¿por qué surgió una alternativa simple a los anticuerpos canónicos en tiburones y camellos?". PLOS Biology . 9 (8): e1001120. doi : 10.1371/journal.pbio.1001120 . PMC 3149040 . PMID 21829328.
- ^ Greenberg, AS; Avila, D.; Hughes, M.; Hughes, A.; McKinney, EC; Flajnik, MF (9 de marzo de 1995). "Una nueva familia de genes de receptores de antígenos que sufre reordenamiento y diversificación somática extensa en tiburones". Nature . 374 (6518): 168–173. Bibcode :1995Natur.374..168G. doi :10.1038/374168a0. ISSN 0028-0836. PMID 7877689. S2CID 4304231.
- ^ ab Owen, Judith A.; Punt, Jenni; Stranford, Sharon (2013). Inmunología de Kuby . Nueva York, NY: WH Freeman and Company. pág. 85. ISBN 9781429219198.
- ^ Leong, Anthony SY; Cooper, Kumarason; Leong, F Joel WM (2003). Manual de citología diagnóstica (2.ª edición). Greenwich Medical Media, Ltd., págs. 283-285. ISBN 1-84110-100-1.
- ^ Redegeld, Frank A.; van der Heijden, Maurice W.; Kool, Mirjam; Heijdra, Bianca M.; Garssen, Johan; Kraneveld, Aletta D.; Loveren, Henk Van; Roholl, Paul; Saito, Takashi; Verbeek, J. Sjef; Claassens, Jill; Koster, Andries S.; Nijkamp, Frans P. (julio de 2002). "Las cadenas ligeras libres de inmunoglobulinas provocan respuestas inmediatas similares a las de hipersensibilidad". Medicina de la Naturaleza . 8 (7): 694–701. doi :10.1038/nm722. PMID 12068287. S2CID 1322642.
- ^ Rijnierse, Anneke; Kroese, Alfons BA; Redegeld, Frank A.; Blokhuis, Bart RJ; van der Heijden, Maurice W.; Koster, Andries S.; Timmermans, Jean-Pierre; Nijkamp, Frans P.; Kraneveld, Aletta D. (marzo de 2009). "Las cadenas ligeras libres de inmunoglobulinas median respuestas específicas de antígeno de las neuronas del ganglio de la raíz dorsal murinas". Revista de Neuroinmunología . 208 (1–2): 80–86. doi :10.1016/j.jneuroim.2009.01.008. PMID 19232443. S2CID 46629005.
- ^ Braber, Saskia; Thio, Marco; Blokhuis, Bart R.; Henricks, Paul AJ; Koelink, Pim J.; Kormelink, Tom Groot; Bezemer, Gillina FG; Kerstjens, Huib AM; Postma, Dirkje S.; Garssen, Johan; Kraneveld, Aletta D.; Redegeld, Frank A.; Folkerts, Gert (15 de abril de 2012). "Una asociación entre neutrófilos y cadenas ligeras libres de inmunoglobulinas en la patogénesis de la enfermedad pulmonar obstructiva crónica". Revista Estadounidense de Medicina Respiratoria y de Cuidados Críticos . 185 (8): 817–824. doi :10.1164/rccm.201104-0761OC. PMID 22227380.
Enlaces externos
- Cadenas ligeras de inmunoglobulina en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Recurso educativo sobre cadenas ligeras de inmunoglobulina
