Amastatina
 | |
| Datos clínicos | |
|---|---|
| Código ATC |
|
| Identificadores | |
| |
| Número CAS |
|
| Identificador de centro de PubChem |
|
| Araña química |
|
| BARRIL |
|
| Panel de control CompTox ( EPA ) |
|
| Tarjeta informativa de la ECHA | 100.131.532 |
| Datos químicos y físicos | |
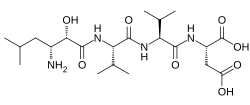
| Fórmula | C21H38N4O8 |
| Masa molar | 474,555 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
| |
La amastatina , también conocida como ácido 3-amino-2-hidroxi-5-metilhexanoil -L -valil- L -valil - L -aspártico , es un inhibidor natural , competitivo y reversible de la aminopeptidasa que fue aislado de Streptomyces sp. ME 98-M3 . [1] Inhibe específicamente la leucil aminopeptidasa , la alanil aminopeptidasa (aminopeptidasa M/N), la leucil aminopeptidasa bacteriana ( aminopeptidasa de Aeromonas proteolytica ), la leucil/cistinil aminopeptidasa (oxitocinasa/vasopresinasa), [2] y, en menor medida, la glutamil aminopeptidasa (aminopeptidasa A), [3] así como otras aminopeptidasas. [4] No inhibe la arginil aminopeptidasa (aminopeptidasa B). [5] [6] Se ha descubierto que la amastatina potencia los efectos de la oxitocina y la vasopresina en el sistema nervioso central in vivo . [7] También inhibe la degradación de la met-encefalina , la dinorfina A y otros péptidos endógenos . [8]
Véase también
Referencias
- ^ Buckingham J (2 de diciembre de 1993). "Amastatinas". Diccionario de productos naturales . CRC Press. pp. 197–. ISBN 978-0-412-46620-5.
- ^ Nakanishi Y, Nomura S, Okada M, Ito T, Katsumata Y, Kikkawa F, et al. (Septiembre de 2000). "Purificación por inmunoafinidad y caracterización de leucina aminopeptidasa / oxitocinasa placentaria nativa de placenta humana". Placenta . 21 (7): 628–634. doi :10.1053/plac.2000.0564. PMID 10985965.
- ^ Schloss JV (31 de julio de 1989). "Aspectos modernos de la inhibición enzimática con especial énfasis en los análogos de los intermediarios de reacción y otros inhibidores potentes y reversibles". En Boger P, Sandmann G (eds.). Sitios de acción de los herbicidas . CRC Press. págs. 203–. ISBN 978-0-8493-4985-0.
- ^ Scott T, Mercer EI (1997). Enciclopedia concisa de bioquímica y biología molecular . Walter de Gruyter. pp. 35–. ISBN 978-3-11-014535-9.
- ^ Umezawa H (9 de mayo de 2014). Inmunomodificadores moleculares pequeños de origen microbiano: estudios fundamentales y clínicos de bestatina. Elsevier Science. pp. 10–. ISBN 978-1-4831-9033-4.
- ^ Drey CN (6 de diciembre de 2012). "Beta and Higher Homologous Amino Acids". En Barrett G (ed.). Química y bioquímica de los aminoácidos . Springer Science & Business Media. págs. 28–. doi :10.1007/978-94-009-4832-7_3. ISBN 978-94-009-4832-7.
- ^ Meisenberg G, Simmons WH (1984). "La amastatina potencia los efectos conductuales de la vasopresina y la oxitocina en ratones". Péptidos . 5 (3): 535–539. doi :10.1016/0196-9781(84)90083-4. PMID 6540873. S2CID 3881661.
- ^ Oka T, Hiranuma T, Liu XF, Ohgiya N, Iwao K, Matsumiya T (abril de 1993). "[Enzimas inactivadoras de encefalina]". Nihon Yakurigaku Zasshi. Folia Pharmacologica Japonica (en japonés). 101 (4): 197–207. doi : 10.1254/fpj.101.4_197 . PMID 8390390.
