Metal


| Parte de una serie sobre el |
| Tabla periódica |
|---|
Un metal (del griego antiguo μέταλλον ( métallon ) 'mina, cantera, metal') es un material que, cuando se pule o fractura, muestra una apariencia brillante y conduce la electricidad y el calor relativamente bien. Todas estas propiedades están asociadas con la disponibilidad de electrones en el nivel de Fermi , a diferencia de los materiales no metálicos que no los tienen. [1] : Cap. 8 y 19 [2] : Cap. 7 y 8 Los metales suelen ser dúctiles (se pueden estirar para formar alambres) y maleables (se pueden martillar para formar láminas delgadas). [3]
Un metal puede ser un elemento químico como el hierro ; una aleación como el acero inoxidable ; o un compuesto molecular como el nitruro de azufre polimérico . [4] La ciencia general de los metales se llama metalurgia , un subtema de la ciencia de los materiales ; los aspectos de las propiedades electrónicas y térmicas también están dentro del alcance de la física de la materia condensada y la química del estado sólido , es un tema multidisciplinario . En el uso coloquial, los materiales como las aleaciones de acero se denominan metales, mientras que otros como los polímeros, la madera o la cerámica son materiales no metálicos .
Un metal conduce electricidad a una temperatura de cero absoluto , [5] lo cual es una consecuencia de estados deslocalizados en la energía de Fermi. [1] [2] Muchos elementos y compuestos se vuelven metálicos bajo altas presiones, por ejemplo, el yodo se convierte gradualmente en un metal a una presión de entre 40 y 170 mil veces la presión atmosférica . El sodio se convierte en un no metal a una presión de poco menos de dos millones de veces la presión atmosférica, y a presiones aún más altas se espera que se convierta nuevamente en un metal.
Cuando se habla de la tabla periódica y de algunas propiedades químicas, el término metal se utiliza a menudo para designar aquellos elementos que, en estado puro y en condiciones estándar, son metales en el sentido de conducción eléctrica mencionado anteriormente. El término relacionado metálico también puede utilizarse para los tipos de átomos dopantes o elementos de aleación.
En astronomía, el término metal hace referencia a todos los elementos químicos de una estrella que son más pesados que el helio . En este sentido, los primeros cuatro "metales" que se acumulan en los núcleos estelares a través de la nucleosíntesis son el carbono , el nitrógeno , el oxígeno y el neón . Una estrella fusiona átomos más ligeros, principalmente hidrógeno y helio, en átomos más pesados a lo largo de su vida. La metalicidad de un objeto astronómico es la proporción de su materia formada por los elementos químicos más pesados. [6] [7]
La fuerza y resiliencia de algunos metales ha llevado a su uso frecuente en, por ejemplo, la construcción de edificios de gran altura y puentes , así como en la mayoría de los vehículos, muchos electrodomésticos , herramientas, tuberías y vías ferroviarias. Los metales preciosos se usaban históricamente como moneda , pero en la era moderna, los metales de acuñación se han extendido a al menos 23 de los elementos químicos. [8] También hay un uso extensivo de metales multielementos como el nitruro de titanio [9] o semiconductores degenerados en la industria de los semiconductores.
Se cree que la historia de los metales refinados comienza con el uso del cobre hace unos 11.000 años. El oro, la plata, el hierro (como hierro meteórico), el plomo y el latón también se utilizaban antes de la primera aparición conocida del bronce en el quinto milenio a. C. Los desarrollos posteriores incluyen la producción de formas primitivas de acero; el descubrimiento del sodio (el primer metal ligero ) en 1809; el surgimiento de los aceros aleados modernos ; y, desde el final de la Segunda Guerra Mundial, el desarrollo de aleaciones más sofisticadas.
Propiedades
Forma y estructura

La mayoría de los metales son brillantes y lustrosos , al menos cuando están pulidos o fracturados. Las láminas de metal con un grosor superior a unos pocos micrómetros parecen opacas, pero la hoja de oro transmite luz verde. Esto se debe a los electrones que se mueven libremente y reflejan la luz. [1] [2]
Aunque la mayoría de los metales elementales tienen densidades más altas que los no metales , [10] existe una amplia variación en sus densidades, siendo el litio el menos denso (0,534 g/cm 3 ) y el osmio (22,59 g/cm 3 ) el más denso. Se espera que algunos de los metales de transición 6d sean más densos que el osmio, pero sus isótopos conocidos son demasiado inestables para que sea posible la producción en masa [11] El magnesio, el aluminio y el titanio son metales ligeros de gran importancia comercial. Sus densidades respectivas de 1,7, 2,7 y 4,5 g/cm 3 pueden compararse con las de los metales estructurales más antiguos, como el hierro con 7,9 y el cobre con 8,9 g/cm 3 . Los metales ligeros más comunes son las aleaciones de aluminio [12] [13] y magnesio [14] [15] .

(a) Fractura frágil
(b) Fractura dúctil
(c) Fractura completamente dúctil
Los metales son típicamente maleables y dúctiles, deformándose bajo tensión sin escindirse . [10] La naturaleza no direccional del enlace metálico contribuye a la ductilidad de la mayoría de los sólidos metálicos, donde la tensión de Peierls es relativamente baja, lo que permite el movimiento de dislocación , y también hay muchas combinaciones de planos y direcciones para la deformación plástica . [16] Debido a que tienen arreglos de átomos muy empaquetados, el vector de Burgers de las dislocaciones es bastante pequeño, lo que también significa que la energía necesaria para producir una es pequeña. [3] [16] Por el contrario, en un compuesto iónico como la sal de mesa, los vectores de Burgers son mucho más grandes y la energía para mover una dislocación es mucho mayor. [3] La deformación elástica reversible en metales se puede describir bien mediante la Ley de Hooke para las fuerzas de restauración, donde la tensión es linealmente proporcional a la deformación . [17]
Un cambio de temperatura puede provocar el movimiento de defectos estructurales en el metal, como límites de grano , vacantes puntuales , dislocaciones lineales y helicoidales , fallas de apilamiento y maclas , tanto en metales cristalinos como no cristalinos . También pueden producirse deslizamiento interno , fluencia y fatiga del metal . [3] [16]
Los átomos de sustancias metálicas simples suelen tener una de las tres estructuras cristalinas más comunes : cúbica centrada en el cuerpo (bcc), cúbica centrada en las caras (fcc) y compactada hexagonal (hcp). En la bcc, cada átomo está situado en el centro de un cubo formado por otros ocho átomos. En la fcc y la hcp, cada átomo está rodeado por otros doce, pero el apilamiento de las capas difiere. Algunos metales adoptan estructuras diferentes según la temperatura. [18]
- Estructura cristalina cúbica centrada en el cuerpo, con una celda unitaria de 2 átomos, como la que se encuentra, por ejemplo, en el cromo, el hierro y el tungsteno.
- Estructura cristalina cúbica centrada en las caras, con una celda unitaria de 4 átomos, como la que se encuentra, por ejemplo, en el aluminio, el cobre y el oro.
- Estructura cristalina compacta hexagonal, con una celda unitaria de 6 átomos, como la que se encuentra, por ejemplo, en el titanio, el cobalto y el zinc.
- Disposición de los átomos en un cristal de sal de roca como TiN
Muchos otros metales con elementos diferentes tienen estructuras más complicadas, como la estructura de sal de roca en el nitruro de titanio o la perovskita (estructura) en algunos niquelatos. [19]
Eléctrico y térmico

La estructura electrónica de los metales significa que son relativamente buenos conductores de electricidad . Todos los electrones tienen diferentes momentos , que en promedio son cero cuando no hay voltaje externo . Cuando se aplica un voltaje, algunos se mueven un poco más rápido en una dirección dada, algunos un poco más lento, por lo que hay una velocidad de deriva neta que conduce a una corriente eléctrica. [1] [2] Esto implica pequeños cambios en las funciones de onda en las que se encuentran los electrones, cambiando a aquellos con los momentos más altos. La mecánica cuántica dicta que solo se puede tener un electrón en un estado dado, el principio de exclusión de Pauli . [20] Por lo tanto, tiene que haber estados de electrones deslocalizados vacíos (con los momentos más altos) disponibles en las energías ocupadas más altas, como se esboza en la Figura. En un semiconductor como el silicio o un no metal como el titanato de estroncio, hay una brecha de energía entre los estados llenos más altos de los electrones y los vacíos más bajos, por lo que no hay estados accesibles con momentos ligeramente más altos. En consecuencia, los semiconductores y los no metales son malos conductores, aunque pueden transportar algo de corriente cuando se dopan con elementos que introducen estados de energía parcialmente ocupados adicionales a temperaturas más altas. [21]
Los metales elementales tienen valores de conductividad eléctrica de 6,9 × 10 3 S /cm para el manganeso a 6,3 × 10 5 S/cm para la plata . En contraste, un metaloide semiconductor como el boro tiene una conductividad eléctrica de 1,5 × 10 −6 S/cm. Con una excepción, los elementos metálicos reducen su conductividad eléctrica cuando se calientan. El plutonio aumenta su conductividad eléctrica cuando se calienta en el rango de temperatura de alrededor de −175 a +125 °C, con un coeficiente de expansión térmica anómalamente grande y un cambio de fase de monoclínico a cúbico centrado en las caras cerca de 100 °C. [22] Hay evidencia de que este y un comportamiento comparable en elementos transuránicos se debe a interacciones relativistas y de espín más complejas que no se capturan en modelos simples. [23]

Todas las aleaciones metálicas, así como los materiales cerámicos y polímeros conductores, son metales según la misma definición; por ejemplo, el nitruro de titanio tiene estados deslocalizados en el nivel de Fermi. Tienen conductividades eléctricas similares a las de los metales elementales. Las formas líquidas también son conductores metálicos de la electricidad, por ejemplo, el mercurio . En condiciones normales, ningún gas es conductor metálico. Sin embargo, un plasma (física) es un conductor metálico y las partículas cargadas en un plasma tienen muchas propiedades en común con las de los electrones en los metales elementales, en particular en el caso de las estrellas enanas blancas. [24]
Los metales son relativamente buenos conductores de calor , que en los metales es transportado principalmente por los electrones de conducción. [25] A temperaturas más altas, los electrones pueden ocupar niveles de energía ligeramente más altos dados por las estadísticas de Fermi-Dirac . [2] [21] Estos tienen momentos ligeramente más altos ( energía cinética ) y pueden transmitir energía térmica. La ley empírica de Wiedemann-Franz establece que en muchos metales la relación entre las conductividades térmica y eléctrica es proporcional a la temperatura, con una constante de proporcionalidad que es aproximadamente la misma para todos los metales. [2]
.jpg/440px-Battery_Demonstration_Unit_-_DPLA_(cropped).jpg)
La contribución de los electrones de un metal a su capacidad calorífica y conductividad térmica, y la conductividad eléctrica del propio metal se pueden calcular aproximadamente a partir del modelo de electrones libres . [2] Sin embargo, esto no tiene en cuenta la estructura detallada de la red iónica del metal. Tener en cuenta el potencial positivo causado por la disposición de los núcleos iónicos permite considerar la estructura de la banda electrónica y la energía de enlace de un metal. Se pueden aplicar varios modelos, siendo el más simple el modelo de electrones casi libres . [2] Normalmente se utilizan métodos modernos como la teoría funcional de la densidad . [27] [28]
Químico
Los elementos que forman metales suelen formar cationes a través de la pérdida de electrones. [10] La mayoría reaccionará con el oxígeno del aire para formar óxidos en varias escalas de tiempo ( el potasio se quema en segundos, mientras que el hierro se oxida durante años), que dependen de si el óxido nativo forma una capa de pasivación que actúa como barrera de difusión . [29] [30] Algunos otros, como el paladio , el platino y el oro , no reaccionan en absoluto con la atmósfera; el oro puede formar compuestos donde gana un electrón (auros, por ejemplo, el aururo de cesio ). Los óxidos de los metales elementales suelen ser básicos . Sin embargo, los óxidos con estados de oxidación muy altos , como CrO 3 , Mn 2 O 7 y OsO 4 , a menudo tienen reacciones estrictamente ácidas; y los óxidos de los metales menos electropositivos, como BeO, Al 2 O 3 y PbO, pueden mostrar propiedades tanto básicas como ácidas. Estos últimos se denominan óxidos anfóteros .
Distribución de la tabla periódica
Los elementos que forman estructuras exclusivamente metálicas en condiciones normales se muestran en amarillo en la tabla periódica que aparece a continuación. Los elementos restantes forman estructuras de red covalente (azul claro), estructuras covalentes moleculares (azul oscuro) o permanecen como átomos individuales (violeta). [31] El astato (At), el francio (Fr) y los elementos a partir del fermio (Fm) se muestran en gris porque son extremadamente radiactivos y nunca se han producido en masa. La evidencia teórica y experimental sugiere que estos elementos no investigados deberían ser metales, [32] excepto el oganesón (Og) que, según los cálculos de DFT, sería un semiconductor. [33]
MetálicoRed covalenteCovalente molecularÁtomos individualesDesconocidoEl color de fondo muestra la unión de sustancias simples en la tabla periódica . Si hay varias, se considera el alótropo más estable.
La situación cambia con la presión: a presiones extremadamente altas, se espera que todos los elementos (y, de hecho, todas las sustancias) se metalicen. [32] El arsénico (As) tiene un alótropo metálico estable y un alótropo semiconductor metaestable en condiciones estándar. Una situación similar afecta al carbono (C): el grafito es metálico, pero el diamante no.
Aleaciones

En el contexto de los metales, una aleación es una sustancia que tiene propiedades metálicas y que está compuesta por dos o más elementos . A menudo, al menos uno de ellos es un elemento metálico; el término "aleación" se utiliza a veces de forma más general, como en las aleaciones de silicio-germanio . Una aleación puede tener una composición variable o fija. Por ejemplo, el oro y la plata forman una aleación en la que se pueden variar las proporciones de oro o plata; el titanio y el silicio forman una aleación TiSi 2 en la que la proporción de los dos componentes es fija (también conocida como compuesto intermetálico [34] [35] ).

La mayoría de los metales puros son demasiado blandos, quebradizos o químicamente reactivos para su uso práctico. La combinación de diferentes proporciones de metales y otros elementos en aleaciones modifica las propiedades para producir características deseables, por ejemplo, más dúctil, más duro, resistente a la corrosión o tener un color y brillo más deseables. De todas las aleaciones metálicas en uso hoy en día, las aleaciones de hierro ( acero , acero inoxidable , hierro fundido , acero para herramientas , acero de aleación ) constituyen la mayor proporción tanto por cantidad como por valor comercial. [36] El hierro aleado con diversas proporciones de carbono da aceros de bajo, medio y alto contenido de carbono, y el aumento de los niveles de carbono reduce la ductilidad y la tenacidad. La adición de silicio producirá hierros fundidos, mientras que la adición de cromo , níquel y molibdeno a los aceros al carbono (más del 10%) da como resultado aceros inoxidables con mayor resistencia a la corrosión.
Otras aleaciones metálicas importantes son las de aluminio , titanio , cobre y magnesio . Las aleaciones de cobre se conocen desde la prehistoria ( el bronce dio nombre a la Edad del Bronce ) y tienen muchas aplicaciones en la actualidad, la más importante en el cableado eléctrico. Las aleaciones de los otros tres metales se han desarrollado hace relativamente poco tiempo; debido a su reactividad química, necesitan procesos de extracción electrolítica . Las aleaciones de aluminio, titanio y magnesio son valoradas por sus altas relaciones resistencia-peso; el magnesio también puede proporcionar blindaje electromagnético . [37] [38] Estos materiales son ideales para situaciones en las que una alta relación resistencia-peso es más importante que el coste del material, como en la industria aeroespacial y algunas aplicaciones automotrices. [39]
Las aleaciones especialmente diseñadas para aplicaciones muy exigentes, como los motores a reacción , pueden contener más de diez elementos.
Categorías
Los metales se pueden clasificar por su composición y sus propiedades físicas o químicas. Las categorías descritas en las subsecciones siguientes incluyen metales ferrosos y no ferrosos ; metales frágiles y refractarios ; metales blancos; metales pesados y ligeros ; metales básicos , nobles y preciosos , así como cerámicas metálicas y polímeros.
Metales ferrosos y no ferrosos
El término "ferroso" se deriva de la palabra latina que significa "que contiene hierro". Esto puede incluir hierro puro, como el hierro forjado , o una aleación como el acero . Los metales ferrosos suelen ser magnéticos , pero no exclusivamente. Los metales no ferrosos y las aleaciones carecen de cantidades apreciables de hierro.
Metal elemental frágil
Si bien casi todos los metales elementales son maleables o dúctiles, unos pocos (berilio, cromo, manganeso, galio y bismuto) son frágiles. [40] El arsénico y el antimonio, si se admiten como metales, son frágiles. Los valores bajos de la relación entre el módulo elástico volumétrico y el módulo de corte (criterio de Pugh) son indicativos de fragilidad intrínseca. [41] Un material es frágil si es difícil que las dislocaciones se muevan, lo que a menudo se asocia con grandes vectores de Burgers y solo un número limitado de planos de deslizamiento. [42]
Metal refractario
Un metal refractario es un metal muy resistente al calor y al desgaste. Los metales que pertenecen a esta categoría varían; la definición más común incluye niobio, molibdeno, tantalio, tungsteno y renio, así como sus aleaciones. Todos ellos tienen puntos de fusión superiores a 2000 °C y una alta dureza a temperatura ambiente. Varios compuestos, como el nitruro de titanio, también se describen como metales refractarios.
- Cristales de niobio y un cubo de niobio anodizado de 1 cm3 para comparación
- Impresión 3D de albóndigas de la NASA, fabricadas con GRX-810, una aleación de alta temperatura reforzada con dispersión de óxido
- Monocristal de renio, barra refundida y cubo de renio de 1 cm3 para comparación
- Polvo de nitruro de titanio
Metal blanco
Un metal blanco es cualquiera de una gama de aleaciones de color blanco con puntos de fusión relativamente bajos utilizados principalmente con fines decorativos. [43] [44] En Gran Bretaña, el comercio de bellas artes utiliza el término "metal blanco" en los catálogos de subastas para describir artículos de plata extranjeros que no llevan marcas de la Oficina de Ensayos Británica, [45] pero que, no obstante, se entienden como plata y tienen un precio acorde.
Metales pesados y ligeros
Un metal pesado es cualquier metal relativamente denso. [46] Las aleaciones de magnesio , aluminio y titanio son metales ligeros de gran importancia comercial. [47] Sus densidades de 1,7, 2,7 y 4,5 g/cm 3 varían entre el 19 y el 56% de las densidades de otros metales estructurales, [48] como el hierro (7,9) y el cobre (8,9).
Metales básicos, nobles y preciosos
El término metal base se refiere a un metal que se oxida o corroe fácilmente , como por ejemplo, que reacciona fácilmente con ácido clorhídrico diluido (HCl) para formar un cloruro metálico e hidrógeno . Algunos ejemplos son el hierro, el níquel , el plomo y el zinc. El cobre se considera un metal base, ya que se oxida con relativa facilidad, aunque no reacciona con el HCl.

El término metal noble se utiliza comúnmente en oposición a metal base . Los metales nobles son menos reactivos, resistentes a la corrosión o la oxidación , [49] a diferencia de la mayoría de los metales base . Suelen ser metales preciosos, a menudo debido a su rareza percibida. Algunos ejemplos incluyen oro, platino, plata, rodio , iridio y paladio.
En alquimia y numismática , el término metal base se contrasta con metal precioso , es decir, aquellos de alto valor económico. [50] La mayoría de las monedas actuales están hechas de metales base con bajo valor intrínseco ; en el pasado, las monedas frecuentemente derivaban su valor principalmente de su contenido de metal precioso ; el oro , la plata , el platino y el paladio tienen cada uno un código de moneda ISO 4217. Actualmente tienen usos industriales como el platino y el paladio en convertidores catalíticos , se utilizan en joyería y también un papel como inversiones y reserva de valor . [51] El paladio y el platino, a partir del verano de 2024, estaban valorados en un poco menos de la mitad del precio del oro, mientras que la plata es sustancialmente menos costosa.
Metales para válvulas
En electroquímica, un metal de válvula es un metal que pasa corriente en una sola dirección debido a la formación posterior de cualquier óxido aislante. [52]
Cerámica metálica

Existen muchos compuestos cerámicos que tienen conducción eléctrica metálica, pero no son combinaciones simples de elementos metálicos. (No son lo mismo que los cermets , que son compuestos de una cerámica no conductora y un metal conductor). Un grupo, los nitruros de metales de transición, tienen un carácter iónico significativo en la unión, por lo que pueden clasificarse como cerámicas y metales. [9] Tienen estados parcialmente llenos en el nivel de Fermi [9], por lo que son buenos conductores térmicos y eléctricos, y a menudo hay una transferencia de carga significativa de los átomos de metales de transición al nitrógeno. [9] Sin embargo, a diferencia de la mayoría de los metales elementales, los metales cerámicos a menudo no son particularmente dúctiles. Sus usos están muy extendidos, por ejemplo, el nitruro de titanio se utiliza en dispositivos ortopédicos [53] y como revestimiento resistente al desgaste. [54] En muchos casos, su utilidad depende de que existan métodos de deposición efectivos para que puedan usarse como revestimientos de película delgada. [55]
Polímeros metálicos

Existen muchos polímeros que tienen conducción eléctrica metálica, [57] [58] típicamente asociada con componentes aromáticos extendidos como en los polímeros indicados en la Figura. La conducción de las regiones aromáticas es similar a la del grafito, por lo que es altamente direccional. [59]
Medio metal
Un semimetal es cualquier sustancia que actúa como conductor para los electrones de una orientación de espín , pero como aislante o semiconductor para los de espín opuesto. Fueron descritos por primera vez en 1983, como una explicación de las propiedades eléctricas de las aleaciones de Heusler basadas en manganeso . [60] Aunque todos los semimetales son ferromagnéticos (o ferrimagnéticos ), la mayoría de los ferroimanes no son semimetales. Muchos de los ejemplos conocidos de semimetales son óxidos , sulfuros o aleaciones de Heusler . [61]
Semimetal
Un semimetal es un material con una pequeña superposición de energía entre la parte inferior de la banda de conducción y la parte superior de la banda de valencia , pero no se superponen en el espacio de momento . [62] A diferencia de un metal regular, los semimetales tienen portadores de carga de ambos tipos (huecos y electrones), aunque los portadores de carga suelen aparecer en cantidades mucho menores que en un metal real. En este sentido, se parecen a los semiconductores degenerados . Esto explica por qué las propiedades eléctricas de los semimetales están a medio camino entre las de los metales y los semiconductores . Hay tipos adicionales, en particular los semimetales de Weyl y Dirac . [63]
Los elementos semimetálicos elementales clásicos son el arsénico , el antimonio , el bismuto , el α- estaño (estaño gris) y el grafito . También existen compuestos químicos , como el telururo de mercurio (HgTe), [64] y algunos polímeros conductores . [65]
Ciclo vital
Formación
| Abundancia y ocurrencia principal o fuente, en peso [n 1] | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 1 | yo | Él | |||||||||||||||||
| 2 | Li | Ser | B | do | norte | Oh | F | Nordeste | |||||||||||
| 3 | N / A | Mg | Alabama | Si | PAG | S | Cl | Arkansas | |||||||||||
| 4 | K | California | Carolina del Sur | Sí | V | Cr | Minnesota | Fé | Co | Ni | Cu | Zinc | Georgia | En | Como | Sí | Es | Kr | |
| 5 | Rb | Sr | Y | Zr | Nótese bien | Mes | Ru | Rh | Pd | Ag | Cd | En | Sn | Sb | Te | I | Xe | ||
| 6 | Cs | Licenciado en Letras |  | Lu | alta frecuencia | Ejército de reserva | Yo | Re | El sistema operativo | Ir | En | Au | Hg | El | Pb | Bi | |||
| 7 |  | ||||||||||||||||||
 | La | Este | Pr | Dakota del Norte | Pequeño | UE | Dios | Tuberculosis | Por favor | Hola | Sí. | Yo soy | Yb | ||||||
 | El | tú | |||||||||||||||||
Más abundante (hasta82 000 ppm) | |||||||||||||||||||
Abundante (100 –(999 ppm) | |||||||||||||||||||
Poco común (1–99 ppm) | |||||||||||||||||||
Extraño (0,01 –0,99 ppm) | |||||||||||||||||||
Muy raro (0,0001 –0,0099 ppm) | |||||||||||||||||||
| Los metales que están a la izquierda de la línea divisoria se encuentran (o se obtienen) principalmente como litófilos ; los que están a la derecha, como calcófilos, excepto el oro (un siderófilo ) y el estaño (un litófilo). | |||||||||||||||||||
Los elementos metálicos hasta la proximidad del hierro (en la tabla periódica) se forman en gran parte mediante nucleosíntesis estelar . En este proceso, los elementos más ligeros, desde el hidrógeno hasta el silicio, experimentan reacciones de fusión sucesivas dentro de las estrellas, liberando luz y calor y formando elementos más pesados con números atómicos más altos. [66]
Los elementos más pesados no suelen formarse de esta manera, ya que las reacciones de fusión que involucran tales núcleos consumirían energía en lugar de liberarla. [67] Más bien, se sintetizan en gran medida (a partir de elementos con un número atómico más bajo) por captura de neutrones , siendo los dos modos principales de esta captura repetitiva el proceso s y el proceso r . En el proceso s ("s" significa "lento"), las capturas singulares están separadas por años o décadas, lo que permite que los núcleos menos estables se desintegren beta , [68] mientras que en el proceso r ("rápido"), las capturas ocurren más rápido de lo que los núcleos pueden desintegrarse. Por lo tanto, el proceso s toma un camino más o menos claro: por ejemplo, los núcleos estables de cadmio-110 son bombardeados sucesivamente por neutrones libres dentro de una estrella hasta que forman núcleos de cadmio-115 que son inestables y se desintegran para formar indio-115 (que es casi estable, con una vida media30 000 veces la edad del universo). Estos núcleos capturan neutrones y forman indio-116, que es inestable, y se desintegra para formar estaño-116, y así sucesivamente. [66] [69] [n 2] Por el contrario, no existe tal camino en el proceso r. El proceso s se detiene en el bismuto debido a las cortas vidas medias de los siguientes dos elementos, polonio y astato, que se desintegran en bismuto o plomo. El proceso r es tan rápido que puede saltarse esta zona de inestabilidad y continuar creando elementos más pesados como el torio y el uranio. [71]
Los metales se condensan en los planetas como resultado de los procesos de evolución y destrucción estelar. Las estrellas pierden gran parte de su masa cuando esta es expulsada al final de su vida, y a veces después como resultado de una fusión de estrellas de neutrones , [72] [n 3] aumentando así la abundancia de elementos más pesados que el helio en el medio interestelar . Cuando la atracción gravitatoria hace que esta materia se fusione y colapse, se forman nuevas estrellas y planetas . [74]
Abundancia y ocurrencia

La corteza terrestre está compuesta por aproximadamente un 25% de elementos metálicos en peso, de los cuales un 80% son metales ligeros como el sodio, el magnesio y el aluminio. A pesar de la escasez general de algunos metales más pesados como el cobre, estos pueden llegar a concentrarse en cantidades económicamente extraíbles como resultado de la formación de montañas, la erosión u otros procesos geológicos.
Los elementos metálicos se encuentran principalmente como litófilos (amantes de las rocas) o calcófilos (amantes de los minerales). Los elementos litófilos son principalmente los elementos del bloque s, los más reactivos de los elementos del bloque d y los elementos del bloque f. Tienen una fuerte afinidad por el oxígeno y existen principalmente como minerales de silicato de densidad relativamente baja. Los elementos calcófilos son principalmente los elementos del bloque d menos reactivos y los metales del bloque p del período 4-6. Por lo general, se encuentran en minerales de sulfuro (insolubles). Al ser más densos que los litófilos, por lo tanto se hunden más en la corteza en el momento de su solidificación, los calcófilos tienden a ser menos abundantes que los litófilos.
Por otra parte, el oro es un siderófilo, o elemento que ama el hierro. No forma fácilmente compuestos ni con el oxígeno ni con el azufre. En el momento de la formación de la Tierra, y como el más noble (inerte) de los elementos metálicos, el oro se hundió en el núcleo debido a su tendencia a formar aleaciones metálicas de alta densidad. En consecuencia, es relativamente raro. Algunos otros (menos) nobles —molibdeno, renio, los metales del grupo del platino (rutenio, rodio, paladio, osmio, iridio y platino), germanio y estaño— pueden considerarse siderófilos, pero solo en términos de su presencia primaria en la Tierra (núcleo, manto y corteza), más que en la corteza. Estos otros se encuentran en la corteza, en pequeñas cantidades, principalmente como calcófilos (menos en su forma nativa). [n 4]
Se cree que el núcleo externo fluido giratorio del interior de la Tierra, que está compuesto principalmente de hierro, es la fuente del campo magnético protector de la Tierra. [n 5] El núcleo se encuentra por encima del núcleo interno sólido de la Tierra y debajo de su manto. Si pudiera reorganizarse en una columna con una superficie de 5 m2 ( 54 pies cuadrados), tendría una altura de casi 700 años luz. El campo magnético protege a la Tierra de las partículas cargadas del viento solar y de los rayos cósmicos que de otro modo destruirían la atmósfera superior (incluida la capa de ozono que limita la transmisión de la radiación ultravioleta).
Extracción
Los elementos metálicos se extraen a menudo de la Tierra mediante la extracción de minerales que son fuentes ricas de los elementos necesarios, como la bauxita . Los minerales se localizan mediante técnicas de prospección , seguidas de la exploración y el examen de los depósitos. Las fuentes minerales se dividen generalmente en minas de superficie , que se extraen mediante excavación con equipo pesado, y minas subterráneas . En algunos casos, el precio de venta de los metales involucrados hace que sea económicamente viable extraer fuentes de menor concentración.
Una vez extraído el mineral, es necesario extraer los elementos , generalmente mediante reducción química o electrolítica. La pirometalurgia utiliza altas temperaturas para convertir el mineral en metales en bruto, mientras que la hidrometalurgia emplea la química acuosa con el mismo fin.
Cuando un mineral metálico es un compuesto iónico, generalmente debe fundirse (calentarse con un agente reductor) para extraer el metal puro. Muchos metales comunes, como el hierro, se funden utilizando carbono como agente reductor. Algunos metales, como el aluminio y el sodio , no tienen un agente reductor comercialmente práctico y se extraen mediante electrólisis . [75] [76]
Los minerales de sulfuro no se reducen directamente al metal, sino que se tuestan al aire para convertirlos en óxidos.
Reciclaje

La demanda de metales está estrechamente vinculada al crecimiento económico, dado su uso en infraestructura, construcción, manufactura y bienes de consumo. Durante el siglo XX, la variedad de metales utilizados en la sociedad creció rápidamente. Hoy, el desarrollo de grandes naciones, como China e India, y los avances tecnológicos, están impulsando una demanda cada vez mayor. El resultado es que las actividades mineras se están expandiendo y cada vez más existencias de metales del mundo están en la superficie en uso, en lugar de debajo de la tierra como reservas no utilizadas. Un ejemplo es el stock en uso de cobre . Entre 1932 y 1999, el cobre en uso en los EE. UU. aumentó de 73 g a 238 g por persona. [77]
Los metales son reciclables por naturaleza, por lo que, en principio, se pueden utilizar una y otra vez, lo que minimiza los impactos ambientales negativos y ahorra energía. Por ejemplo, el 95% de la energía utilizada para fabricar aluminio a partir de mineral de bauxita se ahorra utilizando material reciclado. [78]
En general, el reciclaje de metales es bajo a nivel mundial. En 2010, el Panel Internacional de Recursos , auspiciado por el Programa de las Naciones Unidas para el Medio Ambiente, publicó informes sobre las reservas de metales que existen en la sociedad [79] y sus tasas de reciclaje. [77] Los autores del informe observaron que las reservas de metales en la sociedad pueden servir como enormes minas sobre la tierra. Advirtieron que las tasas de reciclaje de algunos metales raros utilizados en aplicaciones como teléfonos móviles, baterías para automóviles híbridos y células de combustible son tan bajas que, a menos que se incrementen drásticamente las tasas de reciclaje al final de la vida útil en el futuro, estos metales críticos dejarán de estar disponibles para su uso en la tecnología moderna.
Historia
Prehistoria
El cobre, que se presenta en forma nativa, puede haber sido el primer metal descubierto debido a su apariencia distintiva, su peso y su maleabilidad. El oro, la plata, el hierro (como hierro meteórico) y el plomo también se descubrieron en la prehistoria. Las formas de latón , una aleación de cobre y zinc hecha mediante la fundición simultánea de los minerales de estos metales, se originaron en este período (aunque el zinc puro no se aisló hasta el siglo XIII). La maleabilidad de los metales sólidos condujo a los primeros intentos de fabricar adornos, herramientas y armas de metal. El hierro meteórico que contenía níquel se descubrió de vez en cuando y, en algunos aspectos, fue superior a cualquier acero industrial fabricado hasta la década de 1880, cuando los aceros aleados se volvieron prominentes. [80]
- Cristales de oro
- Plata cristalina
- Un trozo de hierro meteórico
- Un peso de latón (35 g)
Antigüedad

El descubrimiento del bronce (una aleación de cobre con arsénico o estaño) permitió a las personas crear objetos metálicos que eran más duros y duraderos de lo que era posible hasta entonces. Las herramientas, armas, armaduras y materiales de construcción de bronce , como los azulejos decorativos, eran más duros y duraderos que sus predecesores de piedra y cobre (" Calcolítico "). Inicialmente, el bronce se fabricaba con cobre y arsénico (formando bronce arsénico ) fundiendo minerales mezclados de cobre y arsénico de forma natural o artificial. [81] Los primeros artefactos conocidos hasta ahora provienen de la meseta iraní en el quinto milenio a. C. [82] Fue más tarde cuando se utilizó el estaño , que se convirtió en el principal ingrediente no cobre del bronce a fines del tercer milenio a. C. [83] El estaño puro en sí fue aislado por primera vez en 1800 a. C. por trabajadores metalúrgicos chinos y japoneses.
El mercurio era conocido por los antiguos chinos e indios antes del año 2000 a. C. y se encontró en tumbas egipcias que datan del año 1500 a. C.
La producción más antigua conocida de acero, una aleación de hierro y carbono, se ve en piezas de hierro excavadas en un sitio arqueológico en Anatolia ( Kaman-Kalehöyük ) que tienen casi 4.000 años de antigüedad y datan del 1800 a. C. [84] [85]
Desde aproximadamente el año 500 a. C., los fabricantes de espadas de Toledo, España , fabricaban formas tempranas de acero aleado agregando un mineral llamado wolframita , que contenía tungsteno y manganeso, al mineral de hierro (y carbono). El acero de Toledo resultante llamó la atención de Roma cuando Aníbal lo utilizó en las Guerras Púnicas . Pronto se convirtió en la base del armamento de las legiones romanas; tales espadas eran "más fuertes en composición que cualquier espada existente y, debido a que... [no] se rompían, proporcionaban una ventaja psicológica al soldado romano". [86]
En la América precolombina , entre los años 300 y 500 d. C., se empezaron a producir en Panamá y Costa Rica objetos hechos de tumbaga , una aleación de cobre y oro. Eran comunes las pequeñas esculturas de metal y una amplia gama de adornos de tumbaga (y oro) formaban parte de las vestimentas habituales de las personas de alto estatus.
Casi al mismo tiempo, los indígenas ecuatorianos combinaban oro con una aleación de platino natural que contenía pequeñas cantidades de paladio, rodio e iridio para producir miniaturas y máscaras de una aleación de oro blanco y platino. Los trabajadores del metal calentaban el oro con granos de la aleación de platino hasta que el oro se derretía. Después de enfriarse, el conglomerado resultante se martillaba y se recalentaba repetidamente hasta que se volvía homogéneo, equivalente a fundir todos los metales (alcanzar los puntos de fusión de los metales del grupo del platino en cuestión estaba más allá de la tecnología de la época). [87] [n 7]
- Una gota de estaño fundido solidificado
- El electrum, una aleación natural de plata y oro, se utilizaba a menudo para fabricar monedas. En el anverso se muestra al dios romano Apolo y, en el anverso, un trípode de Delfos ( c. 310-305 a. C.).
- Placa hecha de peltre , una aleación de 85 a 99 % de estaño y (normalmente) cobre. El peltre se empezó a utilizar a principios de la Edad del Bronce en Oriente Próximo.
- Un pectoral (coraza ornamental) hecho de tumbaga , una aleación de oro y cobre.
Edad media
El oro es para la señora, la plata para la doncella,
el cobre para el artesano hábil en su oficio.
"¡Bien!", dijo el barón, sentado en su salón,
"pero el hierro, el hierro frío, es el amo de todos ellos".
De Hierro frío de Rudyard Kipling [88]
Los alquimistas árabes y medievales creían que todos los metales y la materia estaban compuestos por el principio del azufre, el padre de todos los metales y portador de la propiedad combustible, y el principio del mercurio, la madre de todos los metales [n 8] y portador de las propiedades de liquidez, fusibilidad y volatilidad. Estos principios no eran necesariamente las sustancias comunes azufre y mercurio que se encuentran en la mayoría de los laboratorios. Esta teoría reforzaba la creencia de que todos los metales estaban destinados a convertirse en oro en las entrañas de la tierra mediante las combinaciones adecuadas de calor, digestión, tiempo y eliminación de contaminantes, todo lo cual podía desarrollarse y acelerarse mediante el conocimiento y los métodos de la alquimia. [n 9]
Se empezaron a conocer el arsénico, el cinc, el antimonio y el bismuto, aunque al principio se los llamaba semimetales o metales bastardos debido a su inmaleabilidad. Se cree que Alberto Magno fue el primero en aislar el arsénico de un compuesto en 1250, calentando jabón junto con trisulfuro de arsénico . El cinc metálico, que es frágil si es impuro, se aisló en la India en 1300 d. C. La primera descripción de un procedimiento para aislar el antimonio se encuentra en el libro De la pirotechnia de Vannoccio Biringuccio de 1540. El bismuto fue descrito por Agricola en De Natura Fossilium (c. 1546); en los primeros tiempos se había confundido con el estaño y el plomo debido a su parecido con esos elementos.
- Arsénico, sellado en un recipiente para evitar que se empañe.
- Fragmentos de zinc y un cubo de 1 cm3
- Antimonio, mostrando su brillante lustre
- Bismuto en forma cristalina, con una capa de oxidación muy fina, y un cubo de bismuto de 1 cm3
El renacimiento




El primer texto sistemático sobre las artes de la minería y la metalurgia fue De la Pirotechnia (1540) de Vannoccio Biringuccio , que trata del examen, la fusión y el trabajo de los metales.
Dieciséis años después, Georgius Agricola publicó De Re Metallica en 1556, un relato de la profesión de la minería, la metalurgia y las artes y ciencias accesorias, un extenso tratado sobre la industria química hasta el siglo XVI.
Dio la siguiente descripción de un metal en su De Natura Fossilium (1546):
El metal es un cuerpo mineral, por naturaleza líquido o algo duro. Este último puede fundirse con el calor del fuego, pero cuando se ha enfriado de nuevo y ha perdido todo calor, se vuelve duro de nuevo y recupera su forma original. En este aspecto se diferencia de la piedra que se funde en el fuego, pues aunque esta última recupera su dureza, pierde su forma y propiedades originales.
Tradicionalmente, hay seis clases diferentes de metales: oro, plata, cobre, hierro, estaño y plomo. En realidad, hay otros, ya que el mercurio es un metal, aunque los alquimistas no están de acuerdo con nosotros en este tema, y el bismuto también lo es. Los escritores griegos antiguos parecen haber ignorado el bismuto, por lo que Amonio afirma con razón que hay muchas especies de metales, animales y plantas que nos son desconocidas. El estibio , cuando se funde en el crisol y se refina, tiene tanto derecho a ser considerado un metal propio como lo que los escritores conceden al plomo. Si, cuando se funde, se añade una cierta porción al estaño, se produce una aleación de librería a partir de la cual se fabrican los tipos que utilizan quienes imprimen libros en papel.
Cada metal tiene su propia forma, que conserva cuando se separa de los metales con los que se ha mezclado. Por lo tanto, ni el electrum ni el estaño son en sí mismos un metal real, sino más bien una aleación de dos metales. El electrum es una aleación de oro y plata, el estaño de plomo y plata. Y, sin embargo, si se separa la plata del electrum, queda oro y no electrum; si se quita la plata del estaño, queda plomo y no estaño.
Sin embargo, no se puede determinar con certeza si el latón se encuentra como metal nativo o no. Solo conocemos el latón artificial, que consiste en cobre teñido con el color del mineral calamina . Y, sin embargo, si se desenterrara alguno, sería un metal auténtico. El cobre negro y blanco parece ser diferente del tipo rojo.
El metal, por tanto, es por naturaleza sólido, como he dicho, o fluido, como en el caso único del mercurio.
Pero ya basta de hablar de los tipos simples. [89]
El platino, el tercer metal precioso después del oro y la plata, fue descubierto en Ecuador durante el período de 1736 a 1744 por el astrónomo español Antonio de Ulloa y su colega el matemático Jorge Juan y Santacilia. Ulloa fue la primera persona en escribir una descripción científica del metal, en 1748.
En 1789, el químico alemán Martin Heinrich Klaproth aisló un óxido de uranio, que él creía que era el metal en sí. Posteriormente, a Klaproth se le atribuyó el descubrimiento del uranio. No fue hasta 1841 cuando el químico francés Eugène-Melchior Péligot preparó la primera muestra de uranio metálico. Posteriormente, Henri Becquerel descubrió la radiactividad en 1896 utilizando uranio.
En la década de 1790, Joseph Priestley y el químico holandés Martinus van Marum observaron el efecto de las superficies metálicas en la deshidrogenación del alcohol, un desarrollo que posteriormente condujo, en 1831, a la síntesis a escala industrial de ácido sulfúrico utilizando un catalizador de platino.
En 1803, el cerio fue el primer metal lantánido que se descubrió, en Bastnäs (Suecia) por Jöns Jakob Berzelius y Wilhelm Hisinger, y de forma independiente por Martin Heinrich Klaproth en Alemania. Los metales lantánidos se consideraban rarezas hasta la década de 1960, cuando se desarrollaron métodos para separarlos entre sí de forma más eficiente. Posteriormente se han utilizado en teléfonos móviles, imanes, láseres, iluminación, baterías, convertidores catalíticos y en otras aplicaciones que hacen posible las tecnologías modernas.
Otros metales descubiertos y preparados durante este tiempo fueron el cobalto, el níquel, el manganeso, el molibdeno, el tungsteno y el cromo; y algunos de los metales del grupo del platino , el paladio, el osmio, el iridio y el rodio.
Elementos metálicos ligeros
Todos los metales elementales descubiertos antes de 1809 tenían densidades relativamente altas; su peso se consideraba un criterio distintivo. A partir de 1809, se aislaron metales ligeros como el sodio, el potasio y el estroncio. Sus bajas densidades desafiaron la creencia convencional sobre la naturaleza de los metales. Sin embargo, se comportaron químicamente como metales y posteriormente se los reconoció como tales.
El aluminio se descubrió en 1824, pero no fue hasta 1886 cuando se desarrolló un método de producción industrial a gran escala. Los precios del aluminio cayeron y su uso se extendió en joyería, artículos de uso diario, monturas de gafas, instrumentos ópticos, vajillas y láminas en la década de 1890 y principios del siglo XX. La capacidad del aluminio para formar aleaciones duras pero ligeras con otros metales le proporcionó muchos usos en esa época. Durante la Primera Guerra Mundial, los principales gobiernos exigieron grandes envíos de aluminio para fuselajes ligeros y resistentes.
Aunque el titanio metálico puro (99,9 %) se preparó por primera vez en 1910, no se utilizó fuera del laboratorio hasta 1932. En las décadas de 1950 y 1960, la Unión Soviética fue pionera en el uso del titanio en aplicaciones militares y submarinas como parte de programas relacionados con la Guerra Fría. A principios de la década de 1950, el titanio comenzó a utilizarse en la aviación militar, en particular en aviones a reacción de alto rendimiento, empezando por aviones como el F-100 Super Sabre y los Lockheed A-12 y SR-71 .
El escandio metálico se produjo por primera vez en 1937. El primer kilo de escandio metálico con una pureza del 99 % se produjo en 1960. La producción de aleaciones de aluminio y escandio comenzó en 1971, tras una patente estadounidense. Las aleaciones de aluminio y escandio también se desarrollaron en la URSS.
- Trozos de sodio
- Perlas de potasio bajo aceite de parafina. El tamaño de la perla más grande es de 0,5 cm.
- Cristales de estroncio
- Trozo de aluminio,
2,6 gramos, 1 x 2 cm - Una barra de cristales de titanio.
- Escandio, incluido un cubo de 1 cm3
La era del acero

La era moderna en la fabricación de acero comenzó con la introducción del proceso Bessemer de Henry Bessemer en 1855, cuya materia prima era el arrabio. Su método le permitió producir acero en grandes cantidades a bajo costo, por lo que el acero dulce pasó a utilizarse para la mayoría de los fines para los que antes se utilizaba el hierro forjado. El proceso Gilchrist-Thomas (o proceso Bessemer básico ) fue una mejora del proceso Bessemer, que se realizó revistiendo el convertidor con un material básico para eliminar el fósforo.
Debido a su alta resistencia a la tracción y su bajo costo, el acero llegó a ser un componente importante utilizado en edificios , infraestructura , herramientas , barcos , automóviles , máquinas , electrodomésticos y armas .
En 1872, los ingleses Clark y Woods patentaron una aleación que hoy se consideraría un acero inoxidable . La resistencia a la corrosión de las aleaciones de hierro y cromo había sido reconocida en 1821 por el metalúrgico francés Pierre Berthier . Observó su resistencia al ataque de algunos ácidos y sugirió su uso en cuchillería. Los metalúrgicos del siglo XIX no pudieron producir la combinación de bajo contenido de carbono y alto contenido de cromo que se encuentra en la mayoría de los aceros inoxidables modernos, y las aleaciones con alto contenido de cromo que podían producir eran demasiado frágiles para ser prácticas. No fue hasta 1912 que se produjo la industrialización de las aleaciones de acero inoxidable en Inglaterra, Alemania y Estados Unidos.
Los últimos elementos metálicos estables
En 1900 aún quedaban por descubrir tres metales con números atómicos menores que el plomo (#82), el metal estable más pesado: los elementos 71, 72 y 75.
En 1906, Von Welsbach demostró que el antiguo iterbio también contenía un nuevo elemento (#71), al que llamó casiopeio . Urbain lo demostró simultáneamente, pero sus muestras eran muy impuras y solo contenían trazas del nuevo elemento. A pesar de esto, el nombre elegido, lutecio, fue adoptado.
En 1908, Ogawa encontró el elemento 75 en la torianita, pero lo asignó como elemento 43 en lugar de 75 y lo llamó nipponio . En 1925, Walter Noddack, Ida Eva Tacke y Otto Berg anunciaron su separación de la gadolinita y le dieron el nombre actual, renio .
Georges Urbain afirmó haber encontrado el elemento 72 en residuos de tierras raras, mientras que Vladimir Vernadsky lo encontró de forma independiente en ortita. Ninguna de las dos afirmaciones fue confirmada debido a la Primera Guerra Mundial, y ninguna pudo ser confirmada más tarde, ya que la química que informaron no coincide con la que ahora se conoce para el hafnio . Después de la guerra, en 1922, Coster y Hevesy lo encontraron mediante análisis espectroscópico de rayos X en circón noruego. El hafnio fue, por lo tanto, el último elemento estable en ser descubierto, aunque el renio fue el último en ser reconocido correctamente.
- Lutecio, incluido un cubo de 1 cm 3
- Renio, incluido un cubo de 1 cm3
- Hafnio, en forma de barra de 1,7 kg
Al final de la Segunda Guerra Mundial, los científicos habían sintetizado cuatro elementos posteriores al uranio, todos ellos metales radiactivos (inestables): neptunio (en 1940), plutonio (1940-1941) y curio y americio (1944), que representan los elementos 93 a 96. Los dos primeros de estos elementos también se encontraron finalmente en la naturaleza. El curio y el americio fueron subproductos del proyecto Manhattan, que produjo la primera bomba atómica del mundo en 1945. La bomba se basó en la fisión nuclear del uranio, un metal que se creía que había sido descubierto casi 150 años antes.
Acontecimientos posteriores a la Segunda Guerra Mundial
Superaleaciones

Las superaleaciones compuestas de combinaciones de Fe, Ni, Co y Cr, y cantidades menores de W, Mo, Ta, Nb, Ti y Al se desarrollaron poco después de la Segunda Guerra Mundial para su uso en motores de alto rendimiento, que funcionan a temperaturas elevadas (por encima de los 650 °C (1200 °F)). Conservan la mayor parte de su resistencia en estas condiciones, durante períodos prolongados, y combinan una buena ductilidad a baja temperatura con resistencia a la corrosión o la oxidación. En la actualidad, las superaleaciones se pueden encontrar en una amplia gama de aplicaciones, incluidas turbinas terrestres, marítimas y aeroespaciales, y plantas químicas y petroleras.
Metales transcurios
El desarrollo exitoso de la bomba atómica al final de la Segunda Guerra Mundial desencadenó nuevos esfuerzos para sintetizar nuevos elementos, casi todos los cuales son, o se espera que sean, metales, y todos ellos son radiactivos. No fue hasta 1949 que el elemento 97 ( Berkelio ), siguiente al elemento 96 ( Curio ), fue sintetizado disparando partículas alfa a un blanco de americio. En 1952, el elemento 100 ( Fermio ) fue encontrado en los restos de la primera explosión de la bomba de hidrógeno; el hidrógeno, un no metal, había sido identificado como un elemento casi 200 años antes. Desde 1952, se han sintetizado los elementos 101 ( Mendelevio ) a 118 ( Oganesón ).
Vasos metalizados a granel

Un vidrio metálico (también conocido como metal amorfo o vítreo) es un material metálico sólido, generalmente una aleación, con una estructura desordenada a escala atómica. La mayoría de los metales puros y aleados, en su estado sólido, tienen átomos dispuestos en una estructura cristalina altamente ordenada. En contraste, estos tienen una estructura no cristalina similar al vidrio. Pero a diferencia de los vidrios comunes, como el vidrio de ventana, que son típicamente aislantes eléctricos, los metales amorfos tienen buena conductividad eléctrica. Los metales amorfos se producen de varias maneras, incluido el enfriamiento extremadamente rápido, la deposición física de vapor, la reacción en estado sólido, la irradiación de iones y la aleación mecánica. El primer vidrio metálico reportado fue una aleación (Au 75 Si 25 ) producida en Caltech en 1960. Más recientemente, se han producido lotes de acero amorfo con tres veces la resistencia de las aleaciones de acero convencionales. Actualmente, las aplicaciones más importantes dependen de las propiedades magnéticas especiales de algunos vidrios metálicos ferromagnéticos. La baja pérdida de magnetización se utiliza en transformadores de alta eficiencia. Las etiquetas de identificación para control de robo y otros esquemas de vigilancia de artículos a menudo utilizan vidrios metálicos debido a sus propiedades magnéticas.
Aleaciones con memoria de forma
Una aleación con memoria de forma (SMA) es una aleación que "recuerda" su forma original y, cuando se deforma, vuelve a su forma anterior a la deformada cuando se calienta. Si bien el efecto de memoria de forma se observó por primera vez en 1932, en una aleación de Au-Cd, no fue hasta 1962, con el descubrimiento accidental del efecto en una aleación de Ni-Ti, que se inició la investigación en serio, y otros diez años antes de que surgieran aplicaciones comerciales. Las SMA tienen aplicaciones en las industrias robótica, automotriz, aeroespacial y biomédica. Existe otro tipo de SMA, llamada aleación ferromagnética con memoria de forma (FSMA), que cambia de forma bajo campos magnéticos fuertes. Estos materiales son de interés ya que la respuesta magnética tiende a ser más rápida y eficiente que las respuestas inducidas por la temperatura.
Aleaciones cuasidicristalinas

En 1984, el metalúrgico israelí Dan Shechtman descubrió una aleación de aluminio y manganeso con simetría quíntuple, lo que violaba la convención cristalográfica de la época, que decía que las estructuras cristalinas solo podían tener simetría doble, triple, cuádruple o séxtuple. Debido a las reservas sobre la reacción de la comunidad científica, tardó dos años en publicar los resultados por los que recibió el Premio Nobel de Química en 2011. Desde entonces, se han descrito y confirmado cientos de cuasicristales. Existen en muchas aleaciones metálicas (y algunos polímeros). Los cuasicristales se encuentran con mayor frecuencia en aleaciones de aluminio (Al-Li-Cu, Al-Mn-Si, Al-Ni-Co, Al-Pd-Mn, Al-Cu-Fe, Al-Cu-V, etc.), pero también se conocen numerosas otras composiciones (Cd-Yb, Ti-Zr-Ni, Zn-Mg-Ho, Zn-Mg-Sc, In-Ag-Yb, Pd-U-Si, etc.). Los cuasicristales efectivamente tienen celdas unitarias infinitamente grandes. La icosaedrita Al 63 Cu 24 Fe 13 , el primer cuasicristal encontrado en la naturaleza, fue descubierto en 2009. La mayoría de los cuasicristales tienen propiedades similares a las de la cerámica, incluyendo baja conductividad eléctrica (que se acerca a los valores observados en los aislantes) y baja conductividad térmica, alta dureza, fragilidad y resistencia a la corrosión y propiedades antiadherentes. Los cuasicristales se han utilizado para desarrollar aislamiento térmico, LED, motores diésel y nuevos materiales que convierten el calor en electricidad. Las nuevas aplicaciones pueden aprovechar el bajo coeficiente de fricción y la dureza de algunos materiales cuasicristalinos, por ejemplo, incrustando partículas en plástico para fabricar engranajes de plástico resistentes, duraderos y de baja fricción. Otras aplicaciones potenciales incluyen absorbedores solares selectivos para la conversión de energía, reflectores de longitud de onda amplia y aplicaciones de reparación y prótesis óseas donde se requieren biocompatibilidad, baja fricción y resistencia a la corrosión.
Aleaciones metálicas complejas
Las aleaciones metálicas complejas (CMAs) son compuestos intermetálicos caracterizados por grandes celdas unitarias que comprenden algunas decenas hasta miles de átomos; la presencia de racimos bien definidos de átomos (frecuentemente con simetría icosaédrica); y desorden parcial dentro de sus redes cristalinas. Están compuestas de dos o más elementos metálicos, a veces con metaloides o calcogenuros añadidos. Incluyen, por ejemplo, NaCd2, con 348 átomos de sodio y 768 átomos de cadmio en la celda unitaria. Linus Pauling intentó describir la estructura de NaCd2 en 1923, pero no tuvo éxito hasta 1955. En un principio llamados "cristales de celda unitaria gigantes", el interés en las CMAs, como llegaron a llamarse, no despertó hasta 2002, con la publicación de un artículo llamado "Fases de aleación estructuralmente complejas", presentado en la 8.ª Conferencia internacional sobre cuasicristales. Las aplicaciones potenciales de las CMAs incluyen el aislamiento térmico, la calefacción solar, la calefacción por suelo radiante ... refrigeradores magnéticos; uso de calor residual para generar electricidad; y recubrimientos para álabes de turbinas en motores militares.
Aleaciones de alta entropía
Las aleaciones de alta entropía (HEAs, por sus siglas en inglés), como AlLiMgScTi, están compuestas por cantidades iguales o casi iguales de cinco o más metales. En comparación con las aleaciones convencionales con solo uno o dos metales base, las HEAs tienen relaciones resistencia-peso considerablemente mejores, mayor resistencia a la tracción y mayor resistencia a la fractura, la corrosión y la oxidación. Aunque las HEAs se describieron ya en 1981, no despertaron un interés significativo hasta la década de 2010; siguen siendo un foco de investigación en la ciencia y la ingeniería de materiales debido a sus propiedades deseables.
Fase MÁXIMA
| MÁXIMO | METRO | A | incógnita |
|---|---|---|---|
| Hf2SnC | alta frecuencia | Sn | do |
| Ti4AlN3 | Sí | Alabama | norte |
| Ti3SiC2 | Sí | Si | do |
| Ti2AlC | Sí | Alabama | do |
| Cr2AlC2 | Cr | Alabama | do |
| Ti3AlC2 | Sí | Alabama | do |
En una fase Max, M es un metal de transición temprana, A es un elemento del grupo A (principalmente grupo IIIA y IVA, o grupos 13 y 14), y X es carbono o nitrógeno. Algunos ejemplos son Hf2SnC y Ti4AlN3 . Dichas aleaciones tienen alta conductividad eléctrica y térmica, resistencia al choque térmico, tolerancia al daño, maquinabilidad, alta rigidez elástica y bajos coeficientes de expansión térmica. [ 90] Se pueden pulir hasta obtener un brillo metálico debido a sus excelentes conductividades eléctricas. Durante las pruebas mecánicas, se ha descubierto que los cilindros policristalinos de Ti3SiC2 se pueden comprimir repetidamente a temperatura ambiente, hasta tensiones de 1 GPa, y recuperarse completamente al retirar la carga. Algunas fases MAX también son muy resistentes al ataque químico (por ejemplo, Ti3SiC2 ) y a la oxidación a alta temperatura en el aire ( Ti2AlC , Cr2AlC2 y Ti3AlC2 ) . Las posibles aplicaciones de las aleaciones de fase MAX incluyen: refractarios duros, mecanizables y resistentes al choque térmico; elementos de calentamiento de alta temperatura; recubrimientos para contactos eléctricos; y piezas resistentes a la irradiación de neutrones para aplicaciones nucleares.
Véase también
Nota
- ^ Los oligoelementos que tienen una abundancia igual o mucho menor que una parte por billón (a saber , Tc , Pm , Po , At , Ra , Ac , Pa , Np y Pu ) no se muestran.
- ^ En algunos casos, por ejemplo en presencia de rayos gamma de alta energía o en un entorno rico en hidrógeno a muy alta temperatura , los núcleos en cuestión pueden experimentar pérdida de neutrones o ganancia de protones, lo que resulta en la producción de isótopos deficientes en neutrones (comparativamente raros) . [70]
- ^ La expulsión de materia cuando dos estrellas de neutrones chocan se atribuye a la interacción de sus fuerzas de marea , posible disrupción de la corteza y calentamiento por choque (que es lo que sucede si pisas a fondo el acelerador en un automóvil cuando el motor está frío). [73]
- ^ El hierro, el cobalto, el níquel y el estaño también son siderófilos desde la perspectiva de toda la Tierra.
- ^ Otra función del hierro en la vida es ser un componente clave de la hemoglobina , que permite el transporte de oxígeno desde los pulmones al resto del cuerpo.
- ^ El bronce es una aleación que consiste principalmente de cobre, comúnmente con alrededor de un 12% de estaño y a menudo con la adición de otros metales (como aluminio, manganeso, níquel o zinc) y, a veces, no metales o metaloides como arsénico, fósforo o silicio.
- ^ En Damasco, Siria, los herreros forjaban cuchillos y espadas con un patrón de superficie distintivo compuesto por patrones en espiral de regiones grabadas con luz sobre un fondo casi negro. Estas hojas tenían capacidades de corte legendarias. El hierro que utilizaban los herreros provenía de la India y contenía uno o más elementos formadores de carburo, como V, Mo, Cr, Mn y Nb. El análisis moderno de estas armas ha demostrado que estos elementos respaldaban la formación catalítica de nanotubos de carbono, que a su vez promovían la formación de nanocables de cementita (Fe 3 C). La maleabilidad de los nanotubos de carbono compensaba la naturaleza frágil de la cementita y otorgaba al acero resultante una combinación única de resistencia y flexibilidad. El conocimiento de cómo fabricar lo que llegó a llamarse acero de Damasco se extinguió en el siglo XVIII, posiblemente debido al agotamiento de las fuentes de mineral con la combinación adecuada de impurezas. Las técnicas involucradas no se redescubrieron hasta 2009.
- ^ En la antigüedad, el plomo era considerado el padre de todos los metales.
- ^ Paracelso , un escritor renacentista alemán posterior , añadió el tercer principio de la sal, que le confiere propiedades no volátiles e incombustibles, en su doctrina de los tria prima . Estas teorías conservaron los cuatro elementos clásicos como base de la composición del azufre, el mercurio y la sal.
Referencias
- ^ abcd Kittel, Charles (2018). Introducción a la física del estado sólido . Paul McEuen (edición global, 9.ª edición). Hoboken, NJ: Wiley. ISBN 978-1-119-45416-8.
- ^ abcdefgh Ashcroft, Neil W.; Mermin, N. David (1976). Física del estado sólido . Nueva York: Holt, Rinehart y Winston. ISBN 978-0-03-083993-1.
- ^ abcd Callister, William D. (1997). Ciencia e ingeniería de materiales: una introducción (4.ª ed.). Nueva York: John Wiley & Sons. ISBN 978-0-471-13459-6.
- ^ Chiang, CK (1977). "Propiedades ópticas y de transporte de bromuros de politiazilo: (SNBr 0,4 )x". Solid State Communications . 23 (9): 607–612. Código Bibliográfico :1977SSCom..23..607C. doi :10.1016/0038-1098(77)90530-0.; Greenwood, NN; Earnshaw, A (1998). Química de los elementos . Oxford: Butterworth-Heinemann. pág. 727. ISBN 978-0-7506-3365-9.; Mutlu, H; Theato, P (2021). "Polímeros con enlaces azufre-nitrógeno". En Zhang, X; Theato, P (eds.). Polímeros que contienen azufre: de la síntesis a los materiales funcionales . Weinheim: Wiley-VCH. págs. 191–234 (191). ISBN 978-3-527-34670-7.
- ^ Yonezawa, F. (2017). Física de las transiciones metal-no metal . Ámsterdam: IOS Press. p. 257. ISBN 978-1-61499-786-3
Sir
Nevill Mott
(1905–1996) escribió una carta a un colega físico,
el profesor Peter P. Edwards
, en la que señala... He pensado mucho en "¿Qué es un metal?" y creo que solo se puede responder a la pregunta en
T=
0 (el cero absoluto de temperatura). Allí, un metal conduce y un no metal no.
- ^ Martin, John C. "Lo que aprendemos del contenido de metales de una estrella". Página de inicio de John C. Martin . Consultado el 25 de marzo de 2021 .
- ^ Martin, John C.; Morrison, Heather L. (18 de mayo de 1998) [1998]. "Un nuevo análisis de la cinemática de RR Lyrae en el vecindario solar". The Astronomical Journal . 116 (4) (publicado el 1 de octubre de 1998): 1724–1735. arXiv : astro-ph/9806258 . Bibcode :1998AJ....116.1724M. doi :10.1086/300568. S2CID 18530430 – vía IOPscience.
- ^ Roe, J.; Roe, M. (1992). "Las monedas del mundo utilizan 24 elementos químicos". World Coinage News . 19 (4, 5): 24–25, 18–19.
- ^ abcd Stampfl, C.; Mannstadt, W.; Asahi, R.; Freeman, AJ (2001). "Estructura electrónica y propiedades físicas de los primeros mononitruros de metales de transición: cálculos de LDA, GGA y FLAPW de LDA de intercambio apantallado con teoría funcional de la densidad". Physical Review B . 63 (15): 155106. Bibcode :2001PhRvB..63o5106S. doi :10.1103/PhysRevB.63.155106.
- ^ abc Mortimer, Charles E. (1975). Química: un enfoque conceptual (3.ª ed.). Nueva York: D. Van Nostrad Company.
- ^ Moller, P.; Nada, JR (1994). Propiedades de fisión de los elementos más pesados (PDF) . Simposio de simulación Dai 2 Kai Hadoron Tataikei no, Tokai-mura, Ibaraki, Japón. Universidad del Norte de Texas . Consultado el 16 de febrero de 2020 .
- ^ Benedyk, JC (1 de enero de 2010), Mallick, PK (ed.), "3 - Aleaciones de aluminio para estructuras automotrices livianas", Materiales, diseño y fabricación de vehículos livianos , Woodhead Publishing Series in Composites Science and Engineering, Woodhead Publishing, págs. 79-113, doi : 10.1533/9781845697822.1.79, ISBN 978-1-84569-463-0, consultado el 23 de julio de 2024
- ^ Li, Shuang-Shuang; Yue, Xin; Li, Qing-Yuan; Peng, He-Li; Dong, Bai-Xin; Liu, Tian-Shu; Yang, Hong-Yu; Fan, junio; Shu, Shi-Li; Qiu, Feng; Jiang, Qi-Chuan (1 de noviembre de 2023). "Desarrollo y aplicaciones de aleaciones de aluminio para la industria aeroespacial". Revista de investigación y tecnología de materiales . 27 : 944–983. doi : 10.1016/j.jmrt.2023.09.274 . ISSN 2238-7854.
- ^ Gupta, M.; Wong, WLE (1 de julio de 2015). "Nanocompuestos basados en magnesio: materiales ligeros del futuro". Caracterización de materiales . 105 : 30–46. doi :10.1016/j.matchar.2015.04.015. ISSN 1044-5803.
- ^ Ogawa, Yukiko; Ando, Daisuke; Sutou, Yuji; Koike, Junichi (22 de julio de 2016). "Una aleación ligera de magnesio con memoria de forma". Science . 353 (6297): 368–370. Bibcode :2016Sci...353..368O. doi :10.1126/science.aaf6524. ISSN 0036-8075. PMID 27463668.
- ^ abc Weertman, Johannes; Weertman, Julia R. (1992). Teoría de dislocaciones elementales . Nueva York: Oxford University Press. ISBN 978-0-19-506900-6.
- ^ Timoshenko, Stephen (1 de enero de 1983). Historia de la resistencia de los materiales: con una breve reseña de la historia de la teoría de la elasticidad y la teoría de las estructuras. Courier Corporation. ISBN 978-0-486-61187-7.
- ^ Holleman, AF; Wiberg, E. (2001). Química inorgánica . San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ Koster, G. (2015). Crecimiento epitaxial de óxidos metálicos complejos . Boston, MA: Elsevier. ISBN 978-1-78242-245-7.
- ^ Schiff, Leonard (1959). Mecánica cuántica (PDF) . McGraw-Hill .
- ^ ab Solymar, L.; Walsh, D. (2004). Propiedades eléctricas de los materiales (7.ª ed.). Oxford ; Nueva York: Oxford University Press. ISBN 978-0-19-926793-4.
- ^ Hecker, Siegfried S. (2000). "Plutonio y sus aleaciones: de los átomos a la microestructura" (PDF) . Los Alamos Science . 26 : 290–335. Archivado (PDF) desde el original el 24 de febrero de 2009. Consultado el 15 de febrero de 2009 .
- ^ Tsiovkin, Yu. Yu.; Lukoyánov, AV; Shorikov, AO; Tsiovkina, L. Yu.; Dyachenko, AA; Bystrushkin, VB; Korotin, MA; Anisimov, VI; Drémov, VV (2011). "Resistividad eléctrica de metales transuránicos puros bajo presión". Revista de materiales nucleares . 413 (1): 41–46. Código Bib : 2011JNuM..413...41T. doi :10.1016/j.jnucmat.2011.03.053. ISSN 0022-3115.
- ^ Koester, D; Chanmugam, G (1990). "Física de las estrellas enanas blancas". Informes sobre el progreso en física . 53 (7): 837–915. doi :10.1088/0034-4885/53/7/001. ISSN 0034-4885.
- ^ Skośkiewicz, T. (2005). "Conductividad térmica a bajas temperaturas". Enciclopedia de física de la materia condensada . Elsevier. págs. 159-164. doi :10.1016/b0-12-369401-9/01168-2. ISBN. 978-0-12-369401-0.
- ^ "El Premio Nobel de Química 2000". NobelPrize.org . Consultado el 23 de julio de 2024 .
- ^ Burke, Kieron (2007). "El ABC de la DFT" (PDF) .
- ^ Gross, Eberhard KU; Dreizler, Reiner M. (2013). Teoría del funcional de la densidad. Springer Science & Business Media. ISBN 978-1-4757-9975-0.
- ^ Bockris, J. O'M; Reddy, Amulya KN (1977). Electroquímica moderna. 2 (3.ª edición impresa). Nueva York: Plenum Pr. ISBN 978-0-306-25002-6.
- ^ Kelly, Robert G.; Scully, John R.; Shoesmith, David; Buchheit, Rudolph G. (13 de septiembre de 2002). Técnicas electroquímicas en la ciencia y la ingeniería de la corrosión (0.ª ed.). CRC Press. doi :10.1201/9780203909133. ISBN 978-0-203-90913-3.
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ ab Siekierski, S.; Burgess, J. (2002). Química concisa de los elementos . Horwood. págs. 60–66. ISBN 978-1-898563-71-6.
- ^ Mewes, Jan-Michael; Smits, Odile Rosette; Jerabek, Paul; Schwerdtfeger, Peter (25 de julio de 2019). "El oganesón es un semiconductor: acerca del estrechamiento relativista de la brecha de banda en los sólidos de gases nobles más pesados". Angewandte Chemie . 58 (40): 14260–14264. doi :10.1002/anie.201908327. PMC 6790653 . PMID 31343819.
- ^ Liu, CT; Stiegler, JO (9 de noviembre de 1984). "Aleaciones intermetálicas ordenadas dúctiles". Science . 226 (4675): 636–642. Bibcode :1984Sci...226..636L. doi :10.1126/science.226.4675.636. ISSN 0036-8075. PMID 17774926.
- ^ Cinca, Nuria; Lima, Carlos Roberto Camello; Guilemany, Jose Maria (2013). "Una visión general de la investigación y aplicación de intermetálicos: estado de los recubrimientos por pulverización térmica". Revista de Investigación y Tecnología de Materiales . 2 (1): 75–86. doi : 10.1016/j.jmrt.2013.03.013 . ISSN 2238-7854.
- ^ "Uso de acero por sector". worldsteel.org . Consultado el 18 de septiembre de 2024 .
- ^ Jang, JM; Lee, HS; Singh, JK (17 de diciembre de 2020). "Rendimiento de blindaje electromagnético de diferentes recubrimientos metálicos depositados mediante el proceso de pulverización térmica por arco". Materiales . 13 (24): 5776. Bibcode :2020Mate...13.5776J. doi : 10.3390/ma13245776 . PMC 7767199 . PMID 33348891.
- ^ "Descripción general del programa de metales" (PDF) . arpa-e.energy.gov . Consultado el 4 de junio de 2024 .
- ^ Gialanella, Stefano; Malandruccolo, Alessio (2020). Aleaciones aeroespaciales. Temas de minería, metalurgia e ingeniería de materiales. Cham: Springer International Publishing. doi :10.1007/978-3-030-24440-8. ISBN 978-3-030-24439-2.
- ^ Russell, AM; Lee, KL (2005). Relaciones estructura-propiedad en metales no ferrosos . Hoboken, NJ: John Wiley & Sons. pp. 1-10. Código Bibliográfico : 2005srnm.book.....R. ISBN 978-0-471-64952-6.
- ^ Senkov, ON; Miracle, DB (25 de febrero de 2021). "Generalización de los criterios intrínsecos de dúctil a frágil de Pugh y Pettifor para materiales con una estructura cristalina cúbica". Scientific Reports . 11 (1): 4531. Bibcode :2021NatSR..11.4531S. doi :10.1038/s41598-021-83953-z. ISSN 2045-2322. PMC 7907099 . PMID 33633140.
- ^ Introducción a las dislocaciones. Elsevier. 2001. doi :10.1016/b978-0-7506-4681-9.x5000-7. ISBN 978-0-7506-4681-9.
- ^ "Belmont Metals - Metales blancos". Belmont Metals . 2019-04-17 . Consultado el 2024-07-08 .
- ^ Roden, Arabella (4 de noviembre de 2019). "Una mirada más cercana al mundo de los metales blancos". jewellermagazine.com . Consultado el 8 de julio de 2024 .
- ^ Orientación práctica en relación con la Ley de Contraseñas de 1973 (PDF) . Oficinas de contraseñas de Gran Bretaña.
- ^ Contaminación por metales. Ediciones Quae. 2006.ISBN 978-2-7592-0011-5.
- ^ Brandes EA y Brook GB (eds) 1998, Light Metals Handbook, Butterworth Heinemann, Oxford, ISBN 0-7506-3625-4 , pág. viii
- ^ Polmear I 2006, Aleaciones ligeras: de aleaciones tradicionales a nanocristales, 4.ª ed., Butterworth Heinemann, Oxford, ISBN 0-7506-6371-5 , pág. 1
- ^ Tunay, Olcay; Kabdasli, Isik; Arslan-Alaton, Idil; Olmez-Hanci, Tugba (2010). Aplicaciones de oxidación química para aguas residuales industriales. Publicaciones IWA. ISBN 978-1-84339-307-8.
- ^ Walther, John V. (2013). Recursos naturales de la Tierra. Jones & Bartlett Publishers. ISBN 978-1-4496-3234-2.
- ^ Abdul-Rahman, Yahia (2014). El arte de la banca y las finanzas islámicas sin riba: herramientas y técnicas para la banca comunitaria. John Wiley & Sons. ISBN 978-1-118-77096-2.
- ^ Yasuda, Kouji; Macak, Jan M.; Berger, Steffen; Ghicov, Andrei; Schmuki, Patrik (2007). "Aspectos mecanicistas del proceso de autoorganización para la formación de nanotubos de óxido en metales de válvula". Revista de la Sociedad Electroquímica . 154 (9): C472. Código Bibliográfico :2007JElS..154C.472Y. doi :10.1149/1.2749091.
- ^ van Hove, Ruud P.; Sierevelt, Inger N.; van Royen, Barend J.; Nolte, Peter A. (2015). "Recubrimiento de nitruro de titanio de implantes ortopédicos: una revisión de la literatura". BioMed Research International . 2015 : 1–9. doi : 10.1155/2015/485975 . ISSN 2314-6133. PMC 4637053 . PMID 26583113.
- ^ Santecchia, Eleonora; Hamouda, AMS; Musharavati, Farayi; Zalnezhad, Erfan; Cabibbo, Marcello; Spigarelli, Stefano (2015). "Investigación de la resistencia al desgaste de recubrimientos a base de nitruro de titanio". Cerámica Internacional . 41 (9, Parte A): 10349–10379. doi :10.1016/j.ceramint.2015.04.152. ISSN 0272-8842.
- ^ Matthews, A. (1985). "Tecnología de recubrimiento PVD de nitruro de titanio". Ingeniería de superficies . 1 (2): 93–104. doi :10.1179/sur.1985.1.2.93. ISSN 0267-0844.
- ^ K, Namsheer; Rout, Chandra Sekkha (2021). "Polímeros conductores: una revisión exhaustiva de los avances recientes en síntesis, propiedades y aplicaciones". RSC Advances . 11 (10): 5659–5697. Bibcode :2021RSCAd..11.5659K. doi :10.1039/D0RA07800J. PMC 9133880 . PMID 35686160.
- ^ Das, Tapan K.; Prusty, Smita (2012). "Revisión sobre polímeros conductores y sus aplicaciones". Tecnología e ingeniería de polímeros y plásticos . 51 (14): 1487–1500. doi :10.1080/03602559.2012.710697. ISSN 0360-2559.
- ^ Swager, Timothy M. (2017). "Perspectiva del 50.º aniversario: polímeros conjugados conductores/semiconductores. Una perspectiva personal sobre el pasado y el futuro". Macromolecules . 50 (13): 4867–4886. Bibcode :2017MaMol..50.4867S. doi :10.1021/acs.macromol.7b00582. hdl : 1721.1/116306 . ISSN 0024-9297.
- ^ Beygisangchin, Mahnoush; Abdul Rashid, Suraya; Shafie, Suhaidi; Sadrolhosseini, Amir Reza; Lim, Hong Ngee (18 de junio de 2021). "Preparaciones, propiedades y aplicaciones de polianilina y películas delgadas de polianilina: una revisión". Polímeros . 13 (12): 2003. doi : 10.3390/polym13122003 . ISSN 2073-4360. PMC 8234317 . PMID 34207392.
- ^ de Groot, RA; Mueller, FM; Engen, PG van; Buschow, KHJ (20 de junio de 1983). "Nueva clase de materiales: ferroimanes semimetálicos". Physical Review Letters . 50 (25): 2024–2027. Código Bibliográfico :1983PhRvL..50.2024D. doi :10.1103/PhysRevLett.50.2024. ISSN 0031-9007.
- ^ Coey, JMD; Venkatesan, M. (15 de mayo de 2002). "Ferromagnetismo semimetálico: ejemplo de CrO2 (invitado)". Revista de Física Aplicada . 91 (10): 8345–8350. doi :10.1063/1.1447879. ISSN 0021-8979.
- ^ Zhai, Enzi; Liang, Tianyu; Liu, Ruizi; Cai, Mingyang; Li, Ran; Shao, Qiming; Su, Cong; Lin, Yuxuan Cosmi (1 de agosto de 2024). "El auge de la electrónica semimetálica". Reseñas de la naturaleza Ingeniería eléctrica . 1 (8): 497–515. doi :10.1038/s44287-024-00068-z. ISSN 2948-1201.
- ^ Armitage, NP; Mele, EJ; Vishwanath, Ashvin (22 de enero de 2018). "Semimetales de Weyl y Dirac en sólidos tridimensionales". Reseñas de Física Moderna . 90 (1): 015001. arXiv : 1705.01111 . Bibcode :2018RvMP...90a5001A. doi :10.1103/RevModPhys.90.015001. ISSN 0034-6861.
- ^ Wang, Yang; N. Mansour; A. Salem; KF Brennan y PP Ruden (1992). "Estudio teórico de un fotodetector de avalancha basado en semimetales de bajo ruido potencial". IEEE Journal of Quantum Electronics . 28 (2): 507–513. Bibcode :1992IJQE...28..507W. doi :10.1109/3.123280.
- ^ Bubnova, Olga; Zia, Ullah Khan; Wang, Hui (2014). "Polímeros semimetálicos". Nature Materials . 13 (2): 190–4. Código Bibliográfico :2014NatMa..13..190B. doi :10.1038/nmat3824. PMID 24317188. S2CID 205409397.
- ^ ab Cox 1997, págs. 73-89
- ^ Cox 1997, págs. 32, 63, 85
- ^ Podosek 2011, pág. 482
- ^ Padmanabhan 2001, pág. 234
- ^ Rehder 2010, págs. 32, 33
- ^ Hofmann 2002, págs. 23-24
- ^ Hadhazy 2016
- ^ Choptuik, Lehner y Pretorias 2015, pág. 383
- ^ Cox 1997, págs. 83, 91, 102-103
- ^ "Los Alamos National Laboratory – Sodium" (Laboratorio Nacional de Los Álamos – Sodio) . Consultado el 8 de junio de 2007 .
- ^ "Los Alamos National Laboratory – Aluminium" (Laboratorio Nacional de Los Álamos – Aluminio) . Consultado el 8 de junio de 2007 .
- ^ ab Las tasas de reciclaje de metales: un informe de situación Archivado el 1 de enero de 2016 en Wayback Machine. 2010, Panel Internacional de Recursos , Programa de las Naciones Unidas para el Medio Ambiente
- ^ Pisar con cuidado: ataque con aluminio Carolyn Fry, Guardian.co.uk, 22 de febrero de 2008.
- ^ Existencias de metales en la sociedad: síntesis científica Archivado el 1 de enero de 2016 en Wayback Machine. 2010, Panel Internacional de Recursos , Programa de las Naciones Unidas para el Medio Ambiente
- ^ Reardon, Arthur C. (2011). Metalurgia para no metalúrgicos. Materials Park, Ohio: ASM International. pp. 73–84. ISBN 978-1-61503-845-9.OCLC 780082219 .
- ^ Tylecote, RF (1992). Una historia de la metalurgia, segunda edición. Londres: Maney Publishing, para el Instituto de Materiales. ISBN 978-1-902653-79-2. Archivado desde el original el 2 de abril de 2015.
- ^ Thornton, C.; Lamberg-Karlovsky, CC; Liezers, M.; Young, SMM (2002). "En ascuas: rastreando la evolución de la aleación a base de cobre en Tepe Yahya, Irán, a través del análisis ICP-MS de elementos comunes". Revista de ciencia arqueológica . 29 (12): 1451–1460. Código Bibliográfico :2002JArSc..29.1451T. doi :10.1006/jasc.2002.0809.
- ^ Kaufman, Brett. "Metalurgia y cambio arqueológico en el antiguo Cercano Oriente". Backdirt: Annual Review . 2011 : 86.
- ^ Akanuma, H. (2005). "La importancia de la composición de los fragmentos de hierro excavados en el Estrato III del yacimiento de Kaman-Kalehöyük, Turquía". Estudios arqueológicos de Anatolia . 14 . Tokio: Instituto Japonés de Arqueología de Anatolia: 147–158.
- ^ "Se descubrió una pieza de hierro en Turquía que es el acero más antiguo". The Hindu . Chennai, India. 26 de marzo de 2009. Archivado desde el original el 29 de marzo de 2009. Consultado el 27 de marzo de 2009 .
- ^ Gabriel, RA (1990). La cultura de la guerra: invención y desarrollo temprano . Westport, CT: Greenwood Publishing Group. pág. 108. ISBN. 978-0-313-26664-5.
- ^ Knauth, P. (1976). The Metalsmiths, edición revisada . Londres: Time-Life International. págs. 133, 137.
- ^ Publicado en The Delineator , septiembre de 1909. Reimpreso como introducción a Rewards and Fairies en 1910.
- ^ Georgius Agricola, De Re Metallica (1556) Trad. Herbert Clark Hoover y Lou Henry Hoover (1912); Nota al pie que cita De Natura Fossilium (1546), pág. 180
- ^ Hanaor, DAH; Hu, L.; Kan, WH; Proust, G.; Foley, M.; Karaman, I.; Radovic, M. (2016). "Rendimiento compresivo y propagación de grietas en compuestos de aleación de Al/Ti2AlC". Ciencia e ingeniería de materiales: A . 672 : 247–256. arXiv : 1908.08757 . doi :10.1016/j.msea.2016.06.073.
Lectura adicional
- Choptuik MW , Lehner L. y Pretorias F. 2015, "Investigación de la gravedad de campo fuerte mediante simulación numérica", en A. Ashtekar , BK Berger , J. Isenberg y M. MacCallum (eds), Relatividad general y gravitación: una perspectiva centenaria , Cambridge University Press, Cambridge, ISBN 978-1-107-03731-1 .
- Cox, PA (1997). Los elementos: su origen, abundancia y distribución . Oxford: Oxford University Press. ISBN 978-0-19-855298-7.
- Crow JM 2016, "Aleaciones imposibles: cómo crear metales nunca antes vistos", New Scientist, 12 de octubre
- Hadhazy A. 2016, "Una 'mina de oro' galáctica explica el origen de los elementos más pesados de la naturaleza", Science Spotlights , 10 de mayo de 2016, consultado el 11 de julio de 2016.
- Hofmann S. 2002, Más allá del uranio: viaje al final de la tabla periódica , Taylor & Francis , Londres, ISBN 978-0-415-28495-0 .
- Padmanabhan T. 2001, Astrofísica teórica , vol. 2, Estrellas y sistemas estelares, Cambridge University Press , Cambridge, ISBN 978-0-521-56241-6 .
- Parish RV 1977, Los elementos metálicos, Longman, Londres, ISBN 978-0-582-44278-8
- Podosek FA 2011, "Gases nobles", en HD Holland y KK Turekian (eds), Geoquímica de isótopos: del Tratado de geoquímica , Elsevier, Ámsterdam, págs. 467–492, ISBN 978-0-08-096710-3 .
- Raymond R. 1984, Fuera del horno ardiente: El impacto de los metales en la historia de la humanidad, Macmillan Australia, Melbourne, ISBN 978-0-333-38024-6
- Rehder D. 2010, Química en el espacio: de la materia interestelar al origen de la vida , Wiley-VCH, Weinheim, ISBN 978-3-527-32689-1 .
- Russell AM y Lee KL 2005, Relaciones estructura-propiedad en metales no ferrosos, John Wiley & Sons, Hoboken, Nueva Jersey, ISBN 978-0-471-64952-6
- Street A. y Alexander W. 1998, Los metales al servicio del hombre, 11. a edición, Penguin Books, Londres, ISBN 978-0-14-025776-2
- Wilson AJ 1994, La roca viva: La historia de los metales desde los tiempos más remotos y su impacto en el desarrollo de la civilización , Woodhead Publishing, Cambridge, ISBN 978-1-85573-154-7
Enlaces externos
- Sitio web oficial de ASM International (anteriormente Sociedad Estadounidense de Metales)
- Sitio web oficial de la Sociedad de Minerales, Metales y Materiales

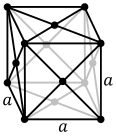
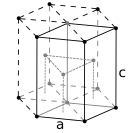


_High_Temperature_Alloy_(GRC-2023-C-02309).jpg/440px-Macro_Photographs_of_3D_Print_of_NASA_Meatball_-_Made_out_of_GRX-810,_an_Oxide_Dispersion_Strengthened_(ODS)_High_Temperature_Alloy_(GRC-2023-C-02309).jpg)











.jpg/440px-Passover_Plate_(4047010755).jpg)





.jpg/440px-Na_(Sodium).jpg)








