Ion de carbonio

En química , un ion carbonio es un catión que tiene un átomo de carbono pentacoordinado . [2] Son un tipo de carbocatión . En la literatura más antigua, se utilizaba el nombre "ion carbonio" para lo que hoy se llama carbenio . La carga de los iones carbonio está deslocalizada en enlaces de dos electrones y tres centros . Los miembros más estables suelen ser bicíclicos o policíclicos. [3]
Catión 2-norbornilo
El catión 2-norbornilo es uno de los iones carbonio mejor caracterizados. Es el prototipo de los iones no clásicos. Como se indicó por primera vez mediante espectroscopia RMN de baja temperatura y se confirmó mediante cristalografía de rayos X, [1] tiene una estructura simétrica con un grupo RCH 2 + unido a un grupo alqueno, estabilizado por una estructura bicíclica.
Catión ciclopropilmetilo
Una estructura no clásica para C
4yo+
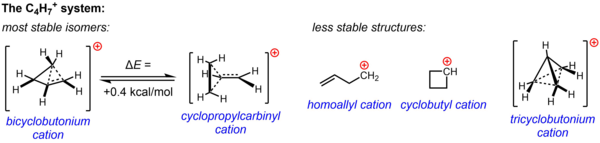
7El espectro de RMN está respaldado por evidencia experimental sustancial de experimentos de solvólisis y estudios de RMN. Se invocó una o ambas de dos estructuras, el catión ciclopropilcarbinilo y el catión biciclobutonio, para explicar la reactividad observada. El espectro de RMN consta de dos señales de RMN de 13 C, incluso a temperaturas tan bajas como −132 °C. Los cálculos sugieren que el paisaje energético del C
4yo+
7El sistema es muy plano. Se calcula que la estructura del biciclobutonio es 0,4 kcal/mol más estable que la estructura del ciclopropilcarbinilo. En la fase de solución (SbF 5 ·SO 2 ClF·SO 2 F 2 , con SbF–
6Como contraión, la estructura del biciclobutonio predomina sobre la del ciclopropilcarbinilo en una proporción de 84:16 a -61 °C. Otras tres estructuras posibles, dos estructuras clásicas (el catión homoalilo y el catión ciclobutilo) y una estructura no clásica más deslocalizada (el ion triciclobutonio), son menos estables. [4]
El espectro de RMN de baja temperatura de un derivado de dimetilo muestra dos señales de metilo, lo que indica que la conformación molecular de este catión no es perpendicular (como en A), que posee un plano especular, sino que está bisecada (como en B) con el orbital p vacío paralelo al sistema de anillo de ciclopropilo:
En términos de la teoría de enlaces doblados , esta preferencia se explica asumiendo una superposición orbital favorable entre los enlaces doblados del ciclopropano llenos y el orbital p vacío. [5]
Metanio y etano
Los iones de carbonio más simples son también los menos accesibles. En el metanio ( CH+5) el carbono está unido covalentemente a cinco átomos de hidrógeno . [6] [7] [8] [9]
El ion etano C 2 H+7Se ha caracterizado por espectroscopia infrarroja. [10] Los isómeros del octonio (octano protonado, C 8 H+19) han sido estudiados. [11]
Carbocationes piramidales
| Carbocationes piramidales | ||
|---|---|---|
 |  | Una clase de iones de carbonio se denominan carbocationes piramidales . En estos iones, un solo átomo de carbono flota sobre un polígono de cuatro o cinco lados , formando en efecto una pirámide . El ion piramidal cuadrado tendrá una carga de +1, el ion piramidal pentagonal tendrá una carga de +2. La cristalografía de rayos X confirma que la dicatión del hexametilbenceno ([C 6 (CH 3 ) 6 ] 2+ ) es pentagonal-piramidal. [12] |
| Un ejemplo del carbocatión monovalente | Un ejemplo del carbocatión divalente |
Aplicaciones
Los iones de carbonio son intermediarios en la isomerización de alcanos catalizada por ácidos sólidos muy fuertes . [13] Dichos iones de carbonio se utilizan en el craqueo (mecanismo de Haag-Dessau). [14] [15] [16]
Véase también
- El complejo pentakis(trifenilfosfina-oro(I))metanio ( Ph 3 PAu) 5 C + . [17]
- Moléculas fluxionales
- En ciertos sistemas norbornilo se encuentran más iones de carbonio llamados iones no clásicos.
- Compuestos de onio
- Ion de carbenio
Referencias
- ^ ab Scholz, F.; Himmel, D.; Heinemann, F.W.; Schleyer, P. v. R.; Meyer, K.; Krossing, I. (5 de julio de 2013). "Determinación de la estructura cristalina del catión 2-norbornilo no clásico". Science . 341 (6141): 62–64. Bibcode :2013Sci...341...62S. doi :10.1126/science.1238849. ISSN 0036-8075. PMID 23828938. S2CID 206549219.
- ^ IUPAC , Compendio de terminología química , 2.ª ed. (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "Ion carbonio". doi :10.1351/goldbook.C00839
- ^ Thomas H. Lowery; Kathleen Schueller Richardson (1981). Mecanismo y teoría en química orgánica, segunda edición . Harper y Rowe. pág. 396. ISBN 0-06-044083-X.
- ^ Olah, George A.; Surya Prakash, GK; Rasul, Golam (julio de 2008). "Estudio ab initio/GIAO-CCSD(T) de estructuras, energías y desplazamientos químicos de RMN de 13C de iones C4H+7 y C5H+9: estabilidad relativa y aspectos dinámicos de los iones ciclopropilcarbinilo frente a biciclobutonio". Journal of the American Chemical Society . 130 (28): 9168–9172. doi :10.1021/ja802445s. ISSN 0002-7863. PMID 18570420.
- ^ Carey, FA; Sundberg, RJ Química orgánica avanzada Parte A (2.ª ed.).
- ^ Boo, Doo Wan; Lee, Yuan T (1995). "Espectroscopia infrarroja de iones de carbonio solvatados con hidrógeno molecular, CH+5(H2)n (n = 1–6)". The Journal of Chemical Physics . 103 (2): 520. Bibcode :1995JChPh.103..520B. doi :10.1063/1.470138.
- ^ Asvany, O.; Kumar P, P.; Redlich, B.; Hegemann, I.; Schlemmer, S.; Marx, D. (2005). "Comprensión del espectro infrarrojo del CH5+ desnudo". Science . 309 (5738): 1219–1222. Bibcode :2005Sci...309.1219A. doi : 10.1126/science.1113729 . PMID 15994376. S2CID 28745636.
- ^ Xiao-Gang Wang; Tucker Carrington Jr (2016). "Niveles de energía de flexión rotacional calculados de CH 5 + y una comparación con el experimento". Journal of Chemical Physics . 144 (20): 204304. Bibcode :2016JChPh.144t4304W. doi :10.1063/1.4948549. PMID 27250303.
- ^ H. Schmiedt; Per Jensen; S. Schlemmer (2017). "Movimiento de rotación-vibración de moléculas extremadamente flexibles - El superrotor molecular". Chemical Physics Letters . 672 : 34–46. Bibcode :2017CPL...672...34S. doi : 10.1016/j.cplett.2017.01.045 .
- ^ Yeh, L. I; Price, J. M; Lee, Yuan T (1989). "Espectroscopia infrarroja del ion carbonio pentacoordinado C
2yo+
7". Revista de la Sociedad Química Americana . 111 (15): 5597. doi :10.1021/ja00197a015. - ^ Seitz, Christa; East, Allan L. L (2002). "Isómeros del octano protonado, C
8yo+
19". Revista de Química Física A. 106 ( 47): 11653. Código Bibliográfico : 2002JPCA..10611653S. doi : 10.1021/jp021724v. - ^ Malischewski, Moritz; Seppelt, K. (25 de noviembre de 2016). "Determinación de la estructura cristalina del dicatión pentagonal-piramidal de hexametilbenceno C
6(ES
3)2+
6". Edición internacional Angewandte Chemie . 56 (1): 368–370. doi :10.1002/anie.201608795. ISSN 1433-7851. PMID 27885766. - ^ Sommer, J; Jost, R (2000). "Iones de carbenio y carbonio en la activación catalizada por superácidos líquidos y sólidos de pequeños alcanos". Química Pura y Aplicada . 72 (12): 2309. doi : 10.1351/pac200072122309 .
- ^ Oficina de Eficiencia Energética y Energía Renovable, Departamento de Energía de los Estados Unidos (2006). "Ancho de banda de energía para los procesos de refinación de petróleo"
- ^ Kotrel, S.; Knözinger, H.; Gates, BC (abril de 2000). "El mecanismo Haag–Dessau de craqueo protolítico de alcanos". Materiales microporosos y mesoporosos . 35–36: 11–20. Código Bibliográfico :2000MicMM..35...11K. doi :10.1016/S1387-1811(99)00204-8.
- ^ Marczewski, M.; Popielarska, D.; Marczewska, H. (2016). "Transformaciones de pentano sobre catalizador de alúmina sulfatada". Cinética de reacción, mecanismos y catálisis . 118 : 267–280. doi : 10.1007/s11144-016-0978-9 .
- ^ George A. Olah (1998). Iones de onio . John Wiley & Sons. ISBN 9780471148777.
