Cirugía de bypass de la arteria coronaria
| Cirugía de bypass de la arteria coronaria | |
|---|---|
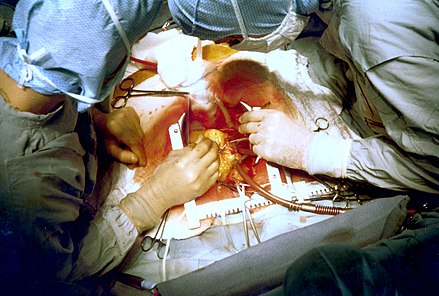
 Al principio de una operación de bypass de la arteria coronaria, durante la extracción de venas de las piernas (izquierda de la imagen) y el establecimiento de un bypass cardiopulmonar mediante la colocación de una cánula aórtica (parte inferior de la imagen). El perfusionista y el sistema de circulación extracorpórea se encuentran en la parte superior derecha. La cabeza del paciente (no se ve) se encuentra en la parte inferior. | |
| Otros nombres | Injerto de derivación de la arteria coronaria |
| CIE-10-PCS | 021209W |
| CIE-9-CM | 36.1 |
| Malla | D001026 |
| MedlinePlus | 002946 |
La cirugía de bypass de la arteria coronaria , también conocida como injerto de derivación de la arteria coronaria ( CABG , pronunciado "cabbage"), es un procedimiento quirúrgico para tratar la enfermedad de la arteria coronaria (CAD), la acumulación de placas en las arterias del corazón. Puede aliviar el dolor de pecho causado por la CAD, retrasar la progresión de la CAD y aumentar la esperanza de vida. Su objetivo es evitar los estrechamientos de las arterias del corazón mediante el uso de arterias o venas extraídas de otras partes del cuerpo, restaurando así el suministro de sangre adecuado al corazón previamente isquémico (privado de sangre).
Existen dos enfoques principales. El primero utiliza una máquina de derivación cardiopulmonar , una máquina que asume las funciones del corazón y los pulmones durante la cirugía al hacer circular sangre y oxígeno. Con el corazón en paro cardiopléjico , se utilizan las arterias y venas extraídas para conectar las regiones problemáticas, una construcción conocida como anastomosis quirúrgica . En el segundo enfoque, llamado derivación de la arteria coronaria sin circulación extracorpórea (OPCAB), estas anastomosis se construyen mientras el corazón todavía está latiendo. La anastomosis que irriga la rama descendente anterior izquierda es la más importante y, por lo general, se extrae la arteria mamaria interna izquierda para su uso. Otras fuentes empleadas comúnmente son la arteria mamaria interna derecha, la arteria radial y la vena safena mayor .
Desde principios del siglo XX se han buscado formas efectivas de tratar el dolor de pecho (en concreto, la angina de pecho , un síntoma común de la enfermedad coronaria). En la década de 1960, se introdujo la cirugía de revascularización coronaria en su forma moderna y desde entonces se ha convertido en el principal tratamiento para la enfermedad coronaria grave. Las complicaciones importantes de la operación incluyen hemorragia, problemas cardíacos ( ataque cardíaco , arritmias ), accidente cerebrovascular , infecciones (a menudo neumonía ) y lesiones en los riñones .

Usos
La cirugía de bypass de la arteria coronaria tiene como objetivo prevenir la muerte por enfermedad de la arteria coronaria y mejorar la calidad de vida al aliviar la angina , la sensación asociada de dolor en el pecho. [1] La decisión de realizar la cirugía se basa en estudios de la eficacia de la CABG en diferentes subgrupos de pacientes, en función de la anatomía de las lesiones o del funcionamiento del corazón. Estos resultados se comparan con los de otras estrategias, la más importante de las cuales es la intervención coronaria percutánea (ICP). [2] [3]
Arteriopatía coronaria

La enfermedad de la arteria coronaria se produce cuando las arterias coronarias del corazón acumulan placas ateromatosas , causando estenosis (estrechamiento) en una o más arterias y con riesgo de infarto de miocardio , la interrupción del suministro de sangre al corazón. La CAD puede ocurrir en cualquiera de los vasos principales de la circulación coronaria : el tronco principal izquierdo, la arteria ascendente izquierda, la arteria circunfleja y la arteria coronaria derecha, y sus ramas. Los síntomas de la CAD varían desde ninguno, hasta dolor en el pecho solo al hacer ejercicio (angina estable), hasta dolor en el pecho incluso en reposo (angina inestable). Incluso puede manifestarse como un infarto de miocardio; si el flujo sanguíneo al corazón no se restablece en unas pocas horas, ya sea de forma espontánea o por intervención médica, la parte del corazón privada de sangre se necrosa (muere) y queda cicatrizada. Puede conducir a otras complicaciones como arritmias , ruptura de los músculos papilares del corazón o muerte súbita. [4]
Existen varios métodos para detectar y evaluar la CAD. Aparte de la historia y el examen clínico, los métodos no invasivos incluyen la electrocardiografía (ECG) en reposo o durante el ejercicio y la radiografía de tórax . La ecocardiografía puede cuantificar el funcionamiento del corazón midiendo, por ejemplo, el agrandamiento del ventrículo izquierdo , la fracción de eyección y la situación de las válvulas cardíacas . Las formas más precisas de detectar la CAD son la angiografía coronaria y la angiografía coronaria por TC . [4] Una angiografía puede proporcionar una anatomía detallada de la circulación coronaria y las lesiones. La importancia de cada lesión está determinada por la pérdida de diámetro. Una pérdida de diámetro del 50% se traduce en una pérdida del área transversal del 75%, considerada moderada por la mayoría de los grupos. La estenosis grave constituye una pérdida de diámetro de 2/3 o más, una pérdida de área transversal superior al 90%. [5] Para determinar con mayor precisión la gravedad de la estenosis, los cardiólogos intervencionistas también pueden emplear la ecografía intravascular , que puede determinar la gravedad y proporcionar información sobre la composición de la placa ateromatosa. Con la técnica de reserva de flujo fraccional , la presión después de la estenosis se compara con la presión aórtica media. Si la relación es inferior a 0,80, la estenosis se considera significativa. [5]
Indicaciones para CABG
Pacientes estables
Las personas que sufren angina durante el ejercicio suelen recibir tratamiento médico en primer lugar. Las pruebas no invasivas ayudan a estimar qué pacientes podrían beneficiarse de una angiografía coronaria. En general, si partes de la pared cardíaca reciben menos sangre de lo normal, está indicada la angiografía coronaria; luego, se identifican las lesiones y se toma la decisión de someterse a una angiografía coronaria o una cirugía coronaria. [6]
En general, se prefiere la CABG a la PCI cuando existe una carga significativa de placa en las arterias coronarias, que es extensa y compleja, debido al beneficio de supervivencia. Otros indicadores de que un paciente se beneficiará más de la CABG que de la PCI incluyen: disminución de la función del ventrículo izquierdo; enfermedad del tronco coronario izquierdo ; diabetes ; y enfermedad compleja del triple sistema (incluida la arteria coronaria izquierda, el tronco coronario derecho y la arteria coronaria derecha), especialmente cuando la lesión en la arteria coronaria izquierda está en su parte proximal. [2] [3]
Síndrome coronario agudo
Durante un evento cardíaco agudo, conocido como síndrome coronario agudo , es de suma importancia restablecer rápidamente el flujo sanguíneo al tejido cardíaco. Por lo general, los pacientes llegan al hospital con dolor en el pecho. Primero se los trata con medicamentos, en particular los medicamentos más fuertes que previenen los coágulos dentro de los vasos (terapia antiplaquetaria dual: aspirina y clopidogrel ). Los pacientes con riesgo de isquemia en curso se someten a una ICP para restablecer el flujo sanguíneo y, por lo tanto, el suministro de oxígeno al corazón en crisis. [7] Si la ICP no logró restablecer el flujo sanguíneo debido a consideraciones anatómicas u otros problemas técnicos, está indicada una CABG urgente para salvar el tejido cardíaco. El momento de la operación juega un papel en la supervivencia: es preferible retrasar la cirugía si es posible (tres días si el infarto afecta el espesor total del músculo cardíaco y seis horas si no lo hace). [2]
La CABG también está indicada cuando hay complicaciones mecánicas de un infarto ( defecto del tabique ventricular , rotura del músculo papilar o rotura del miocardio). [8] No existen contraindicaciones absolutas para la CABG, pero se consideran la enfermedad grave de otros órganos como el hígado o el cerebro, la expectativa de vida limitada y la fragilidad del paciente. [8]
Otras cirugías cardíacas
La CABG también se realiza cuando un paciente se va a someter a otro procedimiento quirúrgico cardíaco, más comúnmente por enfermedad valvular , y la angiografía revela una lesión significativa de las arterias coronarias. [9] La CABG también puede abordar la disección de las arterias coronarias, donde una ruptura de las capas coronarias crea un pseudolumen ( cavidad) y disminuye el suministro de sangre al corazón. Tal disección puede ser causada por el embarazo, enfermedades de los tejidos como los síndromes de Ehlers-Danlos y el síndrome de Marfan , abuso de cocaína o PCI. Un aneurisma coronario también puede indicar CABG: un coágulo de sangre puede desarrollarse dentro del vaso y viajar río abajo. [10]
CABG versus PCI
La CABG y la intervención coronaria percutánea (ICP) son los dos métodos para restablecer el flujo sanguíneo causado por lesiones estenóticas de las arterias coronarias. La elección del método sigue siendo un tema de debate, pero está claro que en presencia de lesiones complejas, enfermedad importante del tronco coronario izquierdo o diabetes, la CABG produce una mejor supervivencia y mejores resultados a largo plazo. [11] [10] Las indicaciones sólidas para la CABG también incluyen pacientes sintomáticos y deterioro de la función del ventrículo izquierdo. [10] La CABG ofrece mejores resultados que la ICP en la enfermedad del tronco coronario izquierdo y en la CAD que afecta a múltiples vasos, debido a la protección que ofrecen los conductos arteriales a las arterias nativas del corazón, al producir factores vasodilatadores y prevenir el avance de las placas. Los estudios publicados en 2023 muestran que la CABG en pacientes con enfermedad del tronco coronario izquierdo se asocia con una menor mortalidad y menos eventos adversos en comparación con la ICP. [12] [13]
Se han estudiado como grupo a pacientes con enfermedad de la arteria principal izquierda no protegida (cuando el ramal de la arteria principal izquierda no está protegido por un injerto permeable desde una operación CABG anterior). Un estudio europeo de 2016 concluyó que en estos pacientes, la CABG supera a la PCI a largo plazo (5 años). Otro estudio de 2016 concluyó que la PCI tiene resultados similares a la CABG a los 3 años, pero que la CABG es mejor que la PCI después de 4 años. [14] [15]
Un ensayo de 2012 y un seguimiento en pacientes diabéticos demostraron una ventaja significativa de la CABG sobre la PCI. La ventaja relativa se mantuvo evidente en los seguimientos de 3,8 y 7,5 años, que encontraron beneficios particulares en fumadores y pacientes más jóvenes. [16] Un ensayo de 2015 comparó la CABG y el último avance tecnológico de la PCI, los stents liberadores de fármacos de segunda generación en la enfermedad multivaso. Sus resultados indicaron que la CABG es una mejor opción para los pacientes con CAD. [17] Un ensayo publicado en 2021, que compara los resultados después de un año, también concluyó que la CABG es una opción más segura que la PCI. [18] Un estudio a gran escala publicado en 2023 mostró que los pacientes con PCI tenían una mortalidad más alta que los pacientes con CABG con enfermedad de la arteria coronaria principal izquierda. [19]
Procedimiento

Examen y estrategia preoperatoria
El examen preoperatorio de rutina tiene como objetivo verificar el estado de los sistemas y órganos además del corazón. El examen generalmente incluye una radiografía de tórax para verificar los pulmones, un hemograma completo y pruebas de función renal y hepática. Se realiza un examen físico para determinar la calidad de los injertos o la seguridad de retirarlos, como varices en las piernas , o la prueba de Allen en el brazo para asegurarse de que el suministro de sangre al brazo no se vea gravemente afectado. [20]
Un paciente que toma anticoagulantes ( aspirina , clopidogrel , ticagrelol y otros) dejará de tomarlos varios días antes para evitar un sangrado excesivo durante y después de la operación. La warfarina también se suspende por la misma razón y el paciente comienza a tomar productos de heparina después de que el INR caiga por debajo de 2,0. [20] [21]
Después de que el equipo quirúrgico revisa la angiografía, se seleccionan los objetivos (es decir, qué arterias nativas se desviarán y dónde se debe colocar la anastomosis). Lo ideal es abordar todas las lesiones importantes en vasos importantes. Lo más común es que la arteria torácica interna izquierda (ITAI; anteriormente, arteria mamaria interna izquierda, IMAI) se anastomose con la arteria descendente anterior izquierda (DAI), porque esta última es la arteria más importante del corazón y suministra sangre a una porción más grande del miocardio que otras arterias. [21]
Se puede utilizar un conducto para injertar una o más arterias nativas. En este último caso, se realiza una anastomosis término-lateral. En el primero, mediante una anastomosis secuencial, un injerto puede suministrar sangre a dos o más vasos nativos del corazón. [21] Además, la parte proximal de un conducto se puede anastomosar al costado de otro conducto. Se prefiere no extraer demasiado conducto porque podría ser necesaria una nueva operación. [21]
Con máquina de circulación extracorpórea (con bomba)
El paciente intubado es llevado al quirófano . Se insertan vías (por ejemplo, cánulas intravenosas periféricas, vías centrales como cánulas yugulares internas) para la administración y monitorización de medicamentos. A continuación se describe una CABG tradicional. [21]
- Cosecha
Se realiza una incisión en el esternón mientras se extraen los vasos , ya sea de los brazos o el tórax o de la pierna, generalmente de la arteria mamaria interna o la vena safena. La LITA se extrae a través de la esternotomía. Hay dos formas comunes de movilizar la LITA: el pedículo (es decir, un pedículo que consiste en la arteria más la grasa y las venas circundantes) y el esqueletizado (es decir, libre de otros tejidos). Antes de dividir la LITA en su parte más distal, se administra al paciente el anticoagulante heparina a través de una vía periférica, para prevenir coágulos. [21]
- Cateterismo y establecimiento de bypass cardiopulmonar
Después de la extracción, se abre el pericardio (el saco que rodea el corazón) y se colocan suturas de retención para mantenerlo abierto. Se colocan suturas en bolsa de tabaco en la aorta para preparar las inserciones de la cánula en la aorta y un catéter que detiene temporalmente el corazón utilizando una solución rica en potasio. Se coloca otra sutura en bolsa de tabaco en la aurícula derecha para la cánula venosa. Una vez que se colocan las cánulas y el catéter, se inicia la derivación cardiopulmonar (CPB). La sangre desoxigenada que llega al corazón desde las venas se envía a la máquina de CPB para oxigenarse y luego se envía a la aorta para mantener saturado el resto del cuerpo. La sangre a menudo se enfría a 32–34 °C (90–93 °F) para desacelerar el metabolismo y minimizar la demanda de oxígeno. Se coloca una pinza en la aorta entre el catéter cardiopléjico y la cánula aórtica, de modo que el flujo de solución cardiopléjica se pueda controlar ajustando la pinza. En cuestión de minutos, el corazón deja de latir. [21] [22]
- Anastomosis (injerto)
Con el corazón inmóvil, se saca la punta del corazón del pericardio para que las arterias nativas que se encuentran en el lado posterior del corazón sean accesibles. Por lo general, primero se construyen las anastomosis distales (primero al sistema coronario derecho, luego a la circunfleja) y luego la anastomosis secuencial si es necesario. Los cirujanos verifican la permeabilidad de la anastomosis (si está suficientemente abierta) o si tiene fugas. Luego insertan el injerto dentro del pericardio, a veces conectado al catéter cardiopléjico. La anastomosis de la arteria pulmonar izquierda a la arteria coronaria izquierda suele ser la última anastomosis distal que se construye; mientras se construye, comienza el proceso de recalentamiento de la sangre (por el CPB). [21] Una vez que se completa la anastomosis y se verifica si hay fugas, las anastomosis proximales de los conductos, si los hay, son las siguientes. Se pueden realizar con la pinza todavía puesta o después de quitar la pinza aórtica y aislar un pequeño segmento de la aorta colocando una pinza parcial. Dicho esto, las aortas sobrecargadas de placas podrían dañarse o liberar restos ateromatosos si se manipulan excesivamente. [21] [23]
- Destete de la derivación cardiopulmonar y cierre
Una vez realizadas las anastomosis proximales, se retira la pinza y se desairean la aorta y los conductos. Se pueden colocar cables de estimulación, que suministran una corriente para ayudar al latido cardíaco. Si el corazón y otros sistemas funcionan, se interrumpe la circulación extracorpórea y se retiran las cánulas. Se administra protamina para revertir el efecto de la heparina anticoagulante. Después de verificar los posibles sitios de sangrado, se colocan tubos torácicos y se cierra el esternón. [21] [23]
Fuera de bomba
La cirugía de bypass de arteria coronaria sin circulación extracorpórea (OPCAB) evita el uso de la máquina de circulación extracorpórea al estabilizar pequeños segmentos del corazón a la vez. El equipo quirúrgico y los anestesiólogos deben coordinarse y tener mucho cuidado de no manipular demasiado el corazón, ya que podrían comprometer la estabilidad del flujo sanguíneo. Cualquier compromiso debe detectarse de inmediato y tomar las medidas adecuadas. [24]
Mantener un ritmo cardíaco saludable puede implicar maniobras como la colocación de cables auriculares para proteger contra la bradicardia , o la colocación de puntos o incisiones en el pericardio para facilitar la exposición. Se utilizan lazos y cintas para facilitar la exposición. El objetivo es evitar la isquemia distal causada por el bloqueo del vaso que irriga las porciones distales del ventrículo izquierdo, por lo que generalmente la LITA a la LAD es la primera en anastomosarse y las demás siguen. Para la anastomosis, un tubo fino que sopla CO2 humidificado mantiene el campo quirúrgico limpio de sangre. Además, se puede utilizar una derivación para que la sangre pueda pasar por el sitio de la anastomosis. Después de que se completan las anastomosis distales, se construyen anastomosis proximales a la aorta con una pinza aórtica parcialmente cerrada. El resto del proceso es similar a la CABG con bomba. [24]
Enfoques alternativos y situaciones especiales
Cuando se realiza una CABG como una emergencia debido a un infarto de miocardio, la máxima prioridad es salvar el miocardio en dificultades. Antes de la operación, se puede insertar un balón de contrapulsación intraaórtico (IABP) para aliviar parte de la carga de bombeo de sangre, reduciendo efectivamente la cantidad de oxígeno que necesita el miocardio. Durante la operación, la práctica estándar es colocar al paciente en CPB lo antes posible y revascularizar el corazón con tres venas safenas. Una aorta calcificada también plantea un problema porque es muy peligroso pinzarla. En este caso, la operación se puede realizar como una CAB sin bomba utilizando ambas arterias mesentéricas inferiores (AMI) o injertos Y, T y secuenciales. El paro cardíaco profundo se puede inducir con hipotermia , bajando la temperatura del cuerpo a ligeramente por encima de los 20 °C (68 °F). [25] En los casos en que una arteria importante está totalmente bloqueada, puede ser posible eliminar la placa y utilizar el mismo orificio en la arteria para realizar una anastomosis. Esta técnica se llama endarterectomía y generalmente se realiza en el sistema coronario derecho. [26]
Las reintervenciones de CABG (otra operación de CABG después de una anterior) plantean dificultades. El corazón puede estar ubicado demasiado cerca del esternón y, por lo tanto, corre riesgo al cortarlo nuevamente, por lo que se utiliza una sierra oscilante . El corazón puede estar cubierto de fuertes adherencias a las estructuras de ajuste. Los médicos deben decidir si se deben reemplazar los injertos viejos. Se evita la manipulación de los injertos venosos porque corre el riesgo de desprender la placa. [27]
La revascularización coronaria directa mínimamente invasiva (MIDCAB) intenta evitar una gran incisión en el esternón. Utiliza técnicas sin bomba para colocar un injerto, generalmente de la arteria coronaria medial en la arteria coronaria izquierda. La arteria coronaria medial se libera a través de una incisión entre las costillas izquierdas (toracotomía), o incluso utilizando un endoscopio colocado en el tórax izquierdo. [28] La revascularización coronaria asistida por robot, que aún no se usa ampliamente, evita la incisión del esternón para prevenir infecciones y sangrado. Tanto la recolección de conductos como la anastomosis se realizan con la ayuda de un robot, a través de una toracotomía. Por lo general, el procedimiento se combina con la revascularización coronaria híbrida , en la que se emplean métodos de CABG e ICP. La anastomosis de la arteria coronaria medial a la arteria coronaria izquierda se realiza en el quirófano y otras lesiones se tratan con ICP, ya sea en el quirófano inmediatamente después de la anastomosis o varios días después. [29]
- Injerto de derivación de la arteria coronaria
- Injerto de derivación de arteria coronaria, bypass único
- Injerto de derivación de arteria coronaria, doble bypass.
- Injerto de derivación de la arteria coronaria, triple bypass
- Injerto de derivación de la arteria coronaria, bypass cuádruple
Cuidados postoperatorios
Después del procedimiento, el paciente suele ser trasladado a la unidad de cuidados intensivos (UCI), donde se le retiran las intubaciones si no se han realizado ya en el quirófano. Normalmente sale de la UCI al día siguiente y cuatro días después, si no se producen complicaciones, el paciente recibe el alta hospitalaria. [30]
Una serie de medicamentos se utilizan comúnmente en el cuidado postoperatorio temprano. La dobutamina , un agente beta, puede aumentar el gasto cardíaco y se administra algunas horas después de la operación. Los betabloqueantes se utilizan para prevenir la fibrilación auricular y otras arritmias supraventriculares. Los cables de marcapasos conectados a ambas aurículas, insertados durante la operación, pueden ayudar a prevenir la fibrilación auricular. La aspirina (80 mg) se utiliza para prevenir el fracaso del injerto. [30] Los inhibidores de la enzima convertidora de angiotensina (ECA) y los bloqueadores del receptor de angiotensina (ARAII) se utilizan para controlar la presión arterial, especialmente en pacientes con baja función cardíaca (<40%). La amlodipina , un bloqueador de los canales de calcio, se utiliza para pacientes cuya arteria radial se utilizó como injerto. [2]
Después del alta, los pacientes pueden experimentar insomnio, falta de apetito, disminución del deseo sexual y problemas de memoria. Este efecto suele ser transitorio y dura entre 6 y 8 semanas. [30] Un plan de ejercicios personalizado suele ser beneficioso. [30]
Resultados
La CABG es el mejor procedimiento para reducir la mortalidad por CAD grave y mejorar la calidad de vida. [31] [32] : 153 La mortalidad operatoria se relaciona fuertemente con la edad del paciente. Según un estudio de Eagle et al ., los pacientes de 50 a 59 años tienen una tasa de mortalidad operatoria del 1,8%, mientras que los pacientes mayores de 80 años tienen una tasa del 8,3%. [33] Otros factores que aumentan la mortalidad son ser mujer, reoperación, disfunción del ventrículo izquierdo y enfermedad del tronco principal izquierdo . [33] La CABG generalmente alivia la angina, pero en algunos pacientes reaparece. Alrededor del 60% de los pacientes estarán libres de angina 10 años después de su operación. [33] El infarto de miocardio es raro cinco años después de una CABG, pero su riesgo aumenta con el tiempo. [34] El riesgo de muerte súbita para los pacientes con CABG es bajo. [34] La calidad de vida también es alta durante al menos cinco años, luego puede comenzar a declinar lentamente. [35] Sin embargo, el uso de la arteria mamaria bilateral en pacientes de menor edad y sin comorbilidades específicas (diabetes, obesidad, uso de esteroides) puede proporcionar una excelente supervivencia a largo plazo y calidad de vida. [36]
Los efectos beneficiosos de la CABG son claros a nivel cardíaco. La función del ventrículo izquierdo mejora y los segmentos del corazón que funcionan mal (discinéticos (que se mueven de manera ineficiente) o incluso acinéticos (que no se mueven)) pueden mostrar signos de mejoría. Tanto la función sistólica como la diastólica mejoran y siguen mejorando hasta cinco años en algunos casos. [37] La función del ventrículo izquierdo y la perfusión miocárdica durante el ejercicio también mejoran después de la CABG. Sin embargo, cuando el ventrículo izquierdo está gravemente afectado antes de la operación (fracción de eyección por debajo del 30%), los beneficios son menos impresionantes en términos de movimiento de la pared segmentaria, pero aún así son significativos porque otros parámetros pueden mejorar a medida que mejora la función del VI; la hipertensión pulmonar puede aliviarse y prolongar la supervivencia. [37] [38]
Determinar el riesgo total del procedimiento es difícil debido a la diversidad de pacientes que se someten a una CABG; los diferentes subgrupos tienen diferentes riesgos, pero los pacientes más jóvenes obtienen mejores resultados que los mayores. Una CABG que utilice dos arterias mamarias internas (AMI) en lugar de una puede ofrecer una mayor protección contra la enfermedad coronaria, pero los resultados aún no son concluyentes. [33] [39]
Injertos
Los conductos que se pueden utilizar para la cirugía de revascularización coronaria pueden ser arterias o venas. Las arterias tienen una permeabilidad superior a largo plazo (capacidad de expansión), pero las venas se utilizan con más frecuencia debido a su practicidad. [40]
Los injertos arteriales se originan en la parte de la arteria torácica interna (ITA) que corre cerca del borde del esternón y se pueden movilizar y anastomosar fácilmente al vaso diana nativo del corazón. La arteria izquierda se utiliza con mayor frecuencia porque está más cerca del corazón, pero a veces se utiliza la arteria derecha, según las preferencias del paciente y del cirujano. Las ITA son ventajosas debido a sus células endoteliales, que producen factor relajante derivado del endotelio y prostaciclina , protegiendo la arteria de la aterosclerosis y, por lo tanto, de la estenosis u oclusión. Las desventajas incluyen una alta tasa de complicaciones, como infecciones profundas de la herida esternal, en algunos subgrupos de pacientes, principalmente obesos y diabéticos. También se pueden utilizar la arteria radial izquierda y la arteria gastroepiploica izquierda . La permeabilidad a largo plazo está influenciada por el tipo de arteria utilizada y los factores intrínsecos de la circulación arterial cardíaca. [41]
Las venas utilizadas son principalmente la vena safena mayor y, en algunos casos, la vena safena menor . Su tasa de permeabilidad es menor que la de las arterias. La aspirina protege los injertos de la oclusión; agregar clopidogrel no mejora las tasas. [41]
En comparación con PCI
La CABG y la ICP son los dos métodos para revascularizar las lesiones estenóticas de las arterias cardíacas. Las preferencias de cada paciente aún son un tema de debate, pero en presencia de lesiones complejas y enfermedad significativa del tronco coronario izquierdo, y en pacientes diabéticos, la CABG parece ofrecer mejores resultados que la ICP. [11] [10] Las indicaciones sólidas para la CABG también incluyen a los pacientes sintomáticos y aquellos con deterioro de la función del VI. [10]
Complicaciones
Las complicaciones más comunes de la CABG son sangrado posoperatorio, insuficiencia cardíaca, fibrilación auricular (una forma de arritmia), accidente cerebrovascular , disfunción renal e infección de la herida cerca del esternón. [38]
El sangrado postoperatorio ocurre en el 2-5% de los casos y puede requerir regresar al quirófano; [42] el indicador más común es la cantidad de sangre que se drena por los tubos torácicos , que se insertan durante la operación para drenar líquido o aire del tórax. El sangrado puede originarse en la aorta , la anastomosis, una rama insuficientemente sellada del conducto o en el esternón. Otras causas incluyen anomalías plaquetarias o su incapacidad para coagular , tal vez debido al bypass o al efecto rebote de la heparina , que ocurre cuando el anticoagulante heparina se administra al comienzo de la cirugía y reaparece en la sangre después de su neutralización por protamina . [43]
El síndrome de bajo gasto cardíaco (SBCG) puede ocurrir en hasta el 14% de los pacientes con CABG. Según su gravedad, el SBG se trata con inotrópicos , un balón de contrapulsación intraaórtico (BCIA), optimización de la precarga y la poscarga o corrección de las gasas sanguíneas y los electrolitos. El objetivo es mantener una presión arterial sistólica por encima de 90 mmHg y un índice cardíaco de más de 2,2 L/min/m2 . [ 38] El SBG suele ser transitorio. [42] El infarto de miocardio puede ocurrir después de la operación debido a factores técnicos o específicos del paciente. Su incidencia es difícil de estimar debido a las diferentes definiciones, pero la mayoría de los estudios sitúan su aparición entre el 2% y el 5%. La incidencia también depende de si se trata de una CABG aislada (promedio, 4%, rango, 0,3%–10%) o una operación combinada (promedio, 2,0%, rango, 0,7%–12%). [44] Las nuevas características del electrocardiograma, como las ondas Q o la alternancia de los movimientos de la pared cardíaca documentada por ecografía, son indicativas. La isquemia en curso puede dar lugar a una angiografía de emergencia y una ICP o a una nueva operación. [45] [42] La angiografía coronaria inmediata ofrece la modalidad más expedita no solo para el diagnóstico sino también para una posible reintervención. [46] La ecocardiografía es menos valiosa para la detección o confirmación de la isquemia miocárdica posoperatoria. [47] También pueden producirse arritmias, la más común es la fibrilación auricular (incidencia del 20-40 %), que se trata con la corrección del equilibrio electrolítico y el control de la frecuencia y el ritmo. [42] [38] Sin embargo, la arritmia, como la taquicardia ventricular o la fibrilación, puede ser un signo de isquemia miocárdica posoperatoria que se trata según la causa. [48]
Los efectos neurológicos adversos ocurren después de la CABG en aproximadamente el 1,5% de los pacientes. [42] Pueden manifestarse como déficits de tipo 1 (déficits focales como accidente cerebrovascular o coma ) o déficits globales de tipo 2 como delirio causado por CEC, hipoperfusión o embolia cerebral. [38] Se ha informado de deterioro cognitivo en hasta el 80% de los casos después de la CABG al alta y dura un año en hasta el 40% de los casos. La causa sigue sin estar clara; la CEC es una causa poco probable porque incluso en pacientes con CABG sin CEC, como en los pacientes con CABG sin bomba y con ICP, la incidencia es la misma. [38] [39]
Las infecciones, como las infecciones de heridas en el esternón (superficiales o profundas), son causadas con mayor frecuencia por Staphylococcus aureus y pueden complicar el proceso posoperatorio. La extracción de ambas arterias torácicas es un factor de riesgo porque altera significativamente la perfusión de sangre a través del esternón. [38] También puede producirse neumonía . [42] Se han descrito complicaciones en el tracto gastrointestinal y se deben con mayor frecuencia a medicamentos administrados durante la operación. [39]
Historia
Pre-CABG

A principios del siglo XX, las intervenciones quirúrgicas destinadas a aliviar la angina y prevenir la muerte eran la simpatectomía (un corte en la cadena simpática que irriga el corazón) o la abrasión pericárdica, con la esperanza de que las adherencias crearan una circulación colateral significativa. La simpatectomía produjo resultados decepcionantes e inconsistentes. [50] El cirujano francés Alexis Carrel fue el primero en anastomosar un vaso (una rama de la arteria carótida ) a una arteria nativa en el corazón de un perro, pero el experimento no pudo reproducirse. [51] A mediados del siglo XX, los esfuerzos de revascularización continuaron. Beck CS utilizó un conducto carotídeo para conectar la aorta descendente al seno coronario , la vena más grande del corazón. En el "Procedimiento de Vineberg", Arthur Vineberg utilizó LITA esqueletizada, colocándola en un pequeño túnel que creó junto a la LAD y esperando que se formara una circulación colateral espontánea. Esto ocurrió en experimentos caninos, pero no en humanos. Goetz RH fue el primero en realizar una anastomosis de la ITA a la LAD en la década de 1960 utilizando una técnica sin suturas. [50]
El desarrollo de la angiografía coronaria en 1962 por Mason Sones ayudó a los médicos a identificar a los pacientes que necesitaban una operación y qué vasos cardíacos nativos debían ser desviados. [52] En 1964, el cirujano cardíaco soviético Vasilii Kolesov realizó la primera anastomosis exitosa de arteria torácica interna-arteria coronaria, seguido por Michael DeBakey en los Estados Unidos. El cirujano argentino René Favaloro estandarizó el procedimiento. Sus avances hicieron de la CABG el estándar de atención para los pacientes con CAD. [53]
La era de la cirugía de bypass coronario
La era moderna de la cirugía de revascularización coronaria comenzó en 1964, cuando el cirujano cardíaco soviético Vasilii Kolesov realizó la primera anastomosis exitosa de arteria torácica interna con arteria coronaria. Ese mismo año, el cirujano estadounidense Michael DeBakey utilizó una vena safena para crear un bypass aorta-arteria coronaria. El cirujano argentino René Favaloro avanzó y estandarizó la técnica de la cirugía de revascularización coronaria utilizando la vena safena del paciente. [53]
La introducción de la cardioplejía durante la operación hizo que la cirugía de revascularización coronaria fuera mucho menos riesgosa. Un obstáculo importante de la cirugía de revascularización coronaria era la isquemia y el infarto que se producían mientras el corazón estaba detenido para permitir a los cirujanos construir la anastomosis distal. En la década de 1970, se utilizó la cardioplejía basada en potasio. La cardioplejía minimizaba las demandas de oxígeno del corazón, reduciendo así los efectos de la isquemia. El perfeccionamiento de la cardioplejía en la década de 1980 hizo que la cirugía de revascularización coronaria fuera menos riesgosa, lo que redujo la mortalidad durante la operación. [54]
A fines de la década de 1960, después del trabajo de René Favaloro, la operación se realizaba solo en unos pocos centros, pero se anticipó que cambiaría más ampliamente el resultado de la enfermedad de la arteria coronaria. Para 1979, había 114.000 procedimientos por año en los EE. UU. La introducción de la intervención coronaria percutánea (ICP) no hizo obsoleta la CABG; las tasas de ambos procedimientos continuaron aumentando, pero las ICP crecieron más rápidamente. En las décadas siguientes, la CABG se estudió ampliamente y se comparó con la ICP. La ausencia de una clara ventaja de la CABG sobre la ICP llevó a una pequeña disminución en el número de CABG en algunos países (como los EE. UU.) para el año 2000. En Europa, principalmente Alemania, la CABG se realizó cada vez más. A partir de 2023 [actualizar], la investigación que compara las dos técnicas continúa. [55] El metanálisis publicado en 2023 sugiere que la CABG proporciona un beneficio de supervivencia constante sobre la ICP con stents liberadores de fármacos (DES). [56]
El trabajo de Favaloro es fundamental para la historia de la selección de injertos. Estableció el uso de ITA bilaterales como superiores a los injertos venosos. Los cirujanos examinaron el uso de otros injertos arteriales (esplénico, mesentérico gastroepiploico, subescapular y otros), pero ninguno igualó las tasas de permeabilidad de la ITA. En 1971, Carpentier introdujo el uso de la arteria radial, que inicialmente era propensa a fallar, pero el desarrollo de técnicas de recolección en los siguientes 20 años mejoró significativamente la permeabilidad. [57]
Otros animales
Se han utilizado cerdos, ovejas y perros como modelos experimentales para el desarrollo de la CABG. [58] Sin embargo, realizar una CABG para tratar a un animal enfermo es extremadamente raro. [59]
Véase también
- Angioplastia
- Cirugía cardiotorácica
- Síndrome de Dressler
- Cirugía de bypass de arteria coronaria totalmente endoscópica
Referencias
- ^ Al-Atassi y otros. 2016, págs. 1553-1554.
- ^ abcd Al-Atassi y otros. 2016, pág. 1554.
- ^ ab Kouchoukos et al. 2013, pág. 405.
- ^ ab Kouchoukos et al. 2013, pág. 356.
- ^ ab Kouchoukos et al. 2013, pág. 357.
- ^ Bojar 2021, págs. 4–9.
- ^ Bojar 2021, págs. 7–10.
- ^ desde Smith y Schroder 2016, pág. 549.
- ^ Al-Atassi y otros. 2016, pág. 1556.
- ^ abcde Kouchoukos y otros, 2013, pág. 409.
- ^ ab Welt 2022, págs. 185-186.
- ^ Persson, J; Yan, J; Angerås, O; Venetsanos, D; Jeppsson, A; Sjögren, I; Linder, R; Erlinge, D; Ivert, T; Omerovic, E (8 de junio de 2023). "PCI o CABG para la enfermedad de la arteria coronaria principal izquierda: el registro SWEDEHEART". Revista Europea del Corazón . 44 (30): 2833–2842. doi : 10.1093/eurheartj/ehad369 . PMC 10406339 . PMID 37288564.
- ^ Farina, Gaudino y Taggart 2020, págs.1 y 6.
- ^ Farina, Gaudino y Taggart 2020, págs.
- ^ Ngu, Sun y Ruel 2018, págs. 527–531.
- ^ Farina, Gaudino y Taggart 2020, págs.
- ^ Ngu, Sun y Ruel 2018, págs.529.
- ^ Fearon y col. 2022, págs. 128-129.
- ^ Persson, J; Yan, J; Angerås, O; Venetsanos, D; Jeppsson, A; Sjögren, I; Linder, R; Erlinge, D; Ivert, T; Omerovic, E (8 de junio de 2023). "PCI o CABG para la enfermedad de la arteria coronaria principal izquierda: el registro SWEDEHEART". Revista Europea del Corazón . 44 (30): 2833–2842. doi : 10.1093/eurheartj/ehad369 . PMC 10406339 . PMID 37288564.
- ^ ab Al-Atassi et al. 2016, Técnica Quirúrgica.
- ^ abcdefghij Kouchoukos y col. 2013, pág. 367.
- ^ Al-Atassi y otros. 2016, pág. 1562.
- ^ ab Al-Atassi et al. 2016, pág. 1564.
- ^ ab Kouchoukos et al. 2013, págs. 374–376.
- ^ Al-Atassi y otros. 2016, pág. 1563.
- ^ Kouchoukos y otros. 2013, pág. 348.
- ^ Kouchoukos y otros. 2013, pág. 386.
- ^ Mick et al. 2016, págs. 1603–1605.
- ^ Mick et al. 2016, págs. 1606–1608.
- ^ abcd Kouchoukos y col. 2013, pág. 387.
- ^ Kouchoukos y otros. 2013, págs. 404–405.
- ^ Neumann, Franz-Josef; Sousa-Uva, Miguel; Ahlsson, Anders; Alfonso, Fernando; Banning, Adrian P; Benedetto, Umberto; Byrne, Robert A; Collet, Jean-Philippe; Falk, Volkmar; Head, Stuart J; Jüni, Peter; Kastrati, Adnan; Koller, Akos; Kristensen, Steen D; Niebauer, Josef (7 de enero de 2019). «Guías ESC/EACTS 2018 sobre revascularización miocárdica». Revista Europea del Corazón . 40 (2): 87–165. doi :10.1093/eurheartj/ehy394. ISSN 0195-668X. PMID 30165437. Archivado desde el original el 30 de enero de 2024 . Consultado el 19 de enero de 2024 .
- ^ abcd Kouchoukos y col. 2013, pág. 388.
- ^ ab Kouchoukos et al. 2013, pág. 397.
- ^ Kouchoukos y otros. 2013, pág. 399.
- ^ Sef, D; Raja, SG (febrero de 2021). "Uso bilateral de la arteria torácica interna en el injerto de derivación de la arteria coronaria en la era posterior a la terapia antirretroviral: perspectiva". Revista internacional de cirugía (Londres, Inglaterra) . 86 : 1–4. doi : 10.1016/j.ijsu.2020.12.007 . PMID: 33388437. S2CID : 230488630.
- ^ ab Kouchoukos et al. 2013, pág. 401.
- ^ abcdefg Al-Atassi et al. 2016, Resultados.
- ^ abc Smith y Schroder 2016, pág. 566.
- ^ Al-Atassi y otros. 2016, págs.1561.
- ^ ab Kouchoukos et al. 2013, pág. 403.
- ^ abcdef Smith y Schroder 2016, pág. 565.
- ^ Al-Atassi y otros. 2016, 1569.
- ^ Robinson, NB; Sef, D; Gaudino, M; Taggart, DP (febrero de 2023). "Isquemia miocárdica poscirugía cardíaca: por qué, cuándo y cómo intervenir". Revista de cirugía torácica y cardiovascular . 165 (2): 687–695. doi : 10.1016/j.jtcvs.2021.05.052 . PMID: 34556355. S2CID : 237616162.
- ^ Robinson, NB; Sef, D; Gaudino, M; Taggart, DP (febrero de 2023). "Isquemia miocárdica poscirugía cardíaca: por qué, cuándo y cómo intervenir". Revista de cirugía torácica y cardiovascular . 165 (2): 687–695. doi : 10.1016/j.jtcvs.2021.05.052 . PMID: 34556355. S2CID : 237616162.
- ^ Robinson, NB; Sef, D; Gaudino, M; Taggart, DP (febrero de 2023). "Isquemia miocárdica poscirugía cardíaca: por qué, cuándo y cómo intervenir". Revista de cirugía torácica y cardiovascular . 165 (2): 687–695. doi : 10.1016/j.jtcvs.2021.05.052 . PMID: 34556355. S2CID : 237616162.
- ^ Laflamme, M; DeMey, N; Bouchard, D; Carrier, M; Demers, P; Pellerin, M; Couture, P; Perrault, LP (abril de 2012). "Manejo de la falla temprana del injerto de derivación de la arteria coronaria en el posoperatorio". Interactive Cardiovascular and Thoracic Surgery . 14 (4): 452–6. doi :10.1093/icvts/ivr127. PMC 3309816 . PMID 22223760.
- ^ Sef, D; Szavits-Nossan, J; Predrijevac, M; Golubic, R; Sipic, T; Stambuk, K; Korda, Z; Meier, P; Turina, MI (2019). "Manejo de la isquemia miocárdica perioperatoria después de una cirugía de injerto de derivación de arteria coronaria aislada". Open Heart . 6 (1): e001027. doi :10.1136/openhrt-2019-001027. PMC 6519404 . PMID 31168389.
- ^ Al-Atassi y otros. 2016, pág. 1552.
- ^ ab Head et al. 2013, págs. 2862–2863.
- ^ Al-Atassi y otros. 2016, pág. 1551.
- ^ Head y otros. 2013, pág. 2862.
- ^ ab Head et al. 2013, pág. 2863.
- ^ Head y otros. 2013, pág. 2865.
- ^ Head et al. 2013, págs. 2863–2865.
- ^ Urso, S; Sadaba, R; González-Martín, JM; Dayan, V; Nogales, E; Tena, MÁ; Abad, C; Portela, F (30 de marzo de 2023). "La cirugía coronaria proporciona una mejor supervivencia que el stent liberador de fármacos: un metaanálisis agrupado de datos de pacientes individuales derivados de Kaplan-Meier". Revista de Cirugía Torácica y Cardiovascular . 167 (6): 2138–2146.e3. doi :10.1016/j.jtcvs.2023.03.020. PMID 37001801. S2CID 257868518.
- ^ Head y otros. 2013, pág. 2868.
- ^ Connolly 2001, pág. 1.
- ^ Córdoba 2020.
Fuentes
- Al-Atassi, Talal; Toeg, Hadi D.; Chan, Vincent; Ruel, Marc (2016). "Injerto de derivación de la arteria coronaria". En Frank Sellke; Pedro J. del Nido (eds.). Cirugía de tórax Sabiston y Spencer . ISBN 978-0-323-24126-7.
- Bojar, RM (2021). Manual de cuidados perioperatorios en cirugía cardíaca en adultos. Wiley. ISBN 978-1-119-58255-7. Consultado el 26 de octubre de 2022 .
- Connolly, John E. (25 de marzo de 2001). "El desarrollo de la cirugía de la arteria coronaria: recuerdos personales". Revista del Instituto del Corazón de Texas . 29 (1): 10–14. PMC 101261 . PMID 11995842.
- Cordova, Melanie Greaver (5 de mayo de 2020). "Veterinarios y médicos se unen para la cirugía a corazón abierto canina". Cornell Chronicle . Consultado el 24 de agosto de 2023 .
- Farina, Piero; Gaudino, Mario Fulvio Luigi; Taggart, David Paul (2020). "El eterno debate con una respuesta consistente: CABG vs PCI". Seminarios en cirugía torácica y cardiovascular . 32 (1). Elsevier BV: 14–20. doi :10.1053/j.semtcvs.2019.08.009. ISSN 1043-0679. PMID 31442489. S2CID 201632303.
- Fearon, William F.; Zimmermann, Frederik M.; De Bruyne, Bernard; Piroth, Zsolt; van Straten, Albert HM; Szekely, Laszlo; Davidavičius, Giedrius; Kalinauskas, Gintaras; Mansur, Samer; Kharbanda, Rajesh; Östlund-Papadogeorgos, Nikolaos; Aminián, Adel; Oldroyd, Keith G.; Al-Attar, Nawwar; Jagic, Nikola; Dambrink, Jan-Henk E.; Kala, Petr; Angerås, Oskar; MacCarthy, Philip; Wendler, Olaf; Casselman, Filip; Witt, Nils; Mavromatis, Cretón; Minero, Steven ES; Sarma, Jaydeep; Engstrom, Thomas; Christiansen, Evald H.; Tonino, Pim AL; Reardon, Michael J.; Lu, Di; Ding, Victoria Y.; Kobayashi, Yuhei; Hlatky, Mark A.; Mahaffey, Kenneth W.; Desai, Manisha; Woo, Y. Joseph; Yeung, Alan C.; Pijls, Nico HJ (13 de enero de 2022). "ICP guiada por reserva de flujo fraccional en comparación con cirugía de bypass coronario". New England Journal of Medicine . 386 (2). Sociedad Médica de Massachusetts: 128–137. doi : 10.1056/nejmoa2112299 . ISSN 0028-4793. PMID 34735046. S2CID 242940936 .
- Head, SJ; Kieser, TM; Falk, V.; Huysmans, HA; Kappetein, AP (1 de octubre de 2013). "Injerto de derivación de la arteria coronaria: Parte 1: la evolución durante los primeros 50 años". Revista Europea del Corazón . 34 (37). Oxford University Press (OUP): 2862–2872. doi : 10.1093/eurheartj/eht330 . ISSN 0195-668X. PMID 24086085.
- "Corrigendum a: Guías ESC/EACTS 2018 sobre revascularización miocárdica". Revista Europea del Corazón . 40 (37): 3096. 2019-10-01. doi :10.1093/eurheartj/ehz507. ISSN 0195-668X. PMID 31292611.
- Smith, Peter K.; Schroder, Jacob N. (2016). "Injerto de derivación de la arteria coronaria con bomba". En Josef E. Fischer (ed.). Técnicas maestras en cirugía CIRUGÍA CARDÍACA . Wolters Kluwer. ISBN 9781451193534.
- Kouchoukos, Nicolás; Blackstone, EH; Hanley, Florida; Kirklin, JK (2013). Libro electrónico sobre cirugía cardíaca de Kirklin/Barratt-Boyes (4ª ed.). Elsevier. ISBN 978-1-4160-6391-9.
- Mick, Stephanie; Keshavamurthy, Suresh; Mihaljevicl, Tomislav; Bonatti, Johannes (2016). "Enfoques robóticos y alternativos para el injerto de derivación de la arteria coronaria". En Frank Sellke; Pedro J. del Nido (eds.). Cirugía de tórax de Sabiston y Spencer . págs. 1603–1615. ISBN 978-0-323-24126-7.
- Ngu, Janet MC; Sun, Louise Y.; Ruel, Marc (2018). "Ensayos contemporáneos fundamentales de intervención coronaria percutánea frente a injerto de derivación de la arteria coronaria: una perspectiva quirúrgica". Anales de cirugía cardiotorácica . 7 (4). AME Publishing Company: 527–532. doi : 10.21037/acs.2018.05.12 . ISSN 2225-319X. PMC 6082775 . PMID 30094218.
- Welt, Frederick GP (13 de enero de 2022). "CABG versus PCI: ¿fin del debate?". New England Journal of Medicine . 386 (2). Sociedad Médica de Massachusetts: 185–187. doi :10.1056/nejme2117325. ISSN 0028-4793. PMID 35020989. S2CID 245907473.
Enlaces externos
 Medios relacionados con Bypass de la arteria coronaria en Wikimedia Commons
Medios relacionados con Bypass de la arteria coronaria en Wikimedia Commons- Lawton JS, Tamis-Holland JE, Bangalore S, Bates ER, Beckie TM, Bischoff JM, Bittl JA, Cohen MG, DiMaio JM, Don CW, Fremes SE, Gaudino MF, Goldberger ZD, Grant MC, Jaswal JB, Kurlansky PA, Mehran R, Metkus TS Jr, Nnacheta LC, Rao SV, Sellke FW, Sharma G, Yong CM, Zwischenberger BA. Guía ACC/AHA/SCAI de 2021 para la revascularización de la arteria coronaria: un informe del Comité conjunto sobre guías de práctica clínica del Colegio Estadounidense de Cardiología y la Asociación Estadounidense del Corazón. J Am Coll Cardiol. 2022;79:e21-e129





