Histopatología
Este artículo necesita citas adicionales para su verificación . ( junio de 2021 ) |

La histopatología (compuesto de tres palabras griegas : ἱστός histos 'tejido', πάθος pathos 'sufrimiento' y -λογία -logia 'estudio de') es el examen microscópico del tejido con el fin de estudiar las manifestaciones de la enfermedad . Específicamente, en medicina clínica, la histopatología se refiere al examen de una biopsia o muestra quirúrgica por parte de un patólogo , después de que la muestra haya sido procesada y las secciones histológicas se hayan colocado en portaobjetos de vidrio. Por el contrario, la citopatología examina células libres o microfragmentos de tejido (como "bloques de células").
Colección de tejidos
El examen histopatológico de los tejidos comienza con una cirugía , una biopsia o una autopsia . El tejido se extrae del cuerpo o de la planta y, a menudo tras una disección experta en estado fresco, se coloca en un fijador que estabiliza los tejidos para evitar su descomposición . El fijador más común es la formalina tamponada neutra al 10 % (que corresponde a un 3,7 % p/v de formaldehído en agua tamponada neutra, como la solución salina tamponada con fosfato ).
Preparación para la histología

Luego se prepara el tejido para observarlo bajo un microscopio mediante fijación química o sección congelada.
Si se proporciona una muestra grande, por ejemplo, de un procedimiento quirúrgico, un patólogo examina la muestra de tejido y selecciona la parte que tiene más probabilidades de producir un diagnóstico útil y preciso; esta parte se extrae para su examen en un proceso conocido comúnmente como corte macroscópico. Las muestras más grandes se cortan para ubicar correctamente sus estructuras anatómicas en el casete. Ciertas muestras (especialmente biopsias) pueden someterse a una preinclusión en agar para asegurar la orientación correcta del tejido en el casete y luego en el bloque y luego en el portaobjetos de microscopio de diagnóstico. Luego, esto se coloca en un casete de plástico para la mayor parte del resto del proceso. [ cita requerida ]
Fijación química
Además de la formalina, se han utilizado otros fijadores químicos. Pero, con la llegada de la tinción inmunohistoquímica (IHC) y las pruebas de patología molecular diagnóstica en estas muestras de especímenes, la formalina se ha convertido en el fijador químico estándar en la histopatología diagnóstica humana. Los tiempos de fijación para muestras muy pequeñas son más cortos y existen estándares en la histopatología diagnóstica humana.
Tratamiento
El agua se elimina de la muestra en etapas sucesivas mediante el uso de concentraciones crecientes de alcohol . [1] Se utiliza xileno en la última fase de deshidratación en lugar de alcohol, esto se debe a que la cera utilizada en la siguiente etapa es soluble en xileno donde no es en alcohol, lo que permite que la cera permee (se infiltre) en la muestra. [1] Este proceso generalmente se automatiza y se realiza durante la noche. Luego, la muestra infiltrada con cera se transfiere a un recipiente de inclusión de muestras individual (generalmente de metal). Finalmente, se introduce cera fundida alrededor de la muestra en el recipiente y se enfría hasta la solidificación para incrustarla en el bloque de cera. [1] Este proceso es necesario para proporcionar una muestra correctamente orientada lo suficientemente resistente para obtener una o más secciones delgadas del micrótomo para el portaobjetos.
Una vez que el bloque con cera está terminado, se cortan secciones de él y, por lo general, se colocan para que floten en la superficie de un baño de agua que extiende la sección. Esto generalmente se hace a mano y es un trabajo especializado (histotecnólogo) en el que el personal de laboratorio toma decisiones sobre qué partes de la cinta de cera del micrótomo de la muestra colocar en los portaobjetos. Por lo general, se preparan varios portaobjetos de diferentes niveles a lo largo del bloque. Después de esto, se tiñe el portaobjetos montado en la sección delgada y se monta un cubreobjetos protector sobre él. Para las tinciones comunes, normalmente se utiliza un proceso automático; pero las tinciones que se usan raramente se suelen hacer a mano. [1]
Procesamiento de secciones congeladas

Una evaluación inicial de un linfoma sospechoso es hacer una "preparación táctil" en la que se presiona ligeramente un portaobjetos de vidrio contra el tejido linfoide extirpado y luego se tiñe (generalmente tinción H&E ) para su evaluación bajo microscopio óptico . El segundo método de procesamiento histológico se denomina procesamiento de secciones congeladas . Este es un método científico altamente técnico realizado por un histocientífico capacitado. En este método, el tejido se congela y se corta en rodajas finas utilizando un micrótomo montado en un dispositivo de refrigeración por debajo del punto de congelación llamado criostato . Las secciones delgadas congeladas se montan en un portaobjetos de vidrio, se fijan de inmediato y brevemente en fijador líquido y se tiñen utilizando técnicas de tinción similares a las de las secciones tradicionales incrustadas en cera. Las ventajas de este método son el tiempo de procesamiento rápido, la menor necesidad de equipo y una menor necesidad de ventilación en el laboratorio. La desventaja es la mala calidad del portaobjetos final. Se utiliza en patología intraoperatoria para determinaciones que podrían ayudar a elegir el siguiente paso en la cirugía durante esa sesión quirúrgica (por ejemplo, para determinar preliminarmente la claridad del margen de resección de un tumor durante la cirugía).
Tinción de portaobjetos de histología procesados
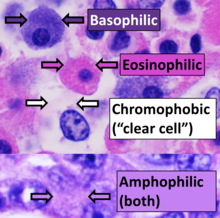
Esto se puede hacer con portaobjetos procesados mediante fijación química o con portaobjetos de secciones congeladas. Para ver el tejido bajo un microscopio, las secciones se tiñen con uno o más pigmentos . El objetivo de la tinción es revelar los componentes celulares; se utilizan contratinciones para proporcionar contraste.
La tinción más utilizada en histología es una combinación de hematoxilina y eosina (a menudo abreviada como H&E). La hematoxilina se utiliza para teñir los núcleos de azul , mientras que la eosina tiñe el citoplasma y la matriz de tejido conectivo extracelular de la mayoría de las células de rosa . Hay cientos de otras técnicas que se han utilizado para teñir selectivamente las células. Otros compuestos utilizados para colorear secciones de tejido incluyen safranina , Oil Red O , rojo Congo , sales de plata y colorantes artificiales. La histoquímica se refiere a la ciencia de utilizar reacciones químicas entre sustancias químicas de laboratorio y componentes dentro del tejido. Una técnica histoquímica que se realiza comúnmente es la reacción del azul de Prusia de Perls , que se utiliza para demostrar depósitos de hierro en enfermedades como la hemocromatosis . [2]
Recientemente, se han utilizado anticuerpos para teñir determinadas proteínas , lípidos y carbohidratos . Esta técnica, denominada inmunohistoquímica , ha aumentado considerablemente la capacidad de identificar específicamente categorías de células bajo un microscopio. Otras técnicas avanzadas incluyen la hibridación in situ para identificar moléculas específicas de ADN o ARN . Estos métodos de tinción de anticuerpos a menudo requieren el uso de histología de secciones congeladas. Estos procedimientos anteriores también se llevan a cabo en el laboratorio bajo el escrutinio y la precisión de un científico de laboratorio médico especializado capacitado (un histocientífico). Las cámaras digitales se utilizan cada vez más para capturar imágenes histopatológicas.
Interpretación
Las preparaciones histológicas son examinadas bajo un microscopio por un patólogo , un especialista médicamente calificado que ha completado un programa de formación reconocido. Este diagnóstico médico se formula como un informe patológico que describe los hallazgos histológicos y la opinión del patólogo. En el caso del cáncer , esto representa el diagnóstico de tejido requerido para la mayoría de los protocolos de tratamiento. En la extirpación del cáncer , el patólogo indicará si el margen quirúrgico está despejado o está afectado (se deja cáncer residual). Esto se hace utilizando el método de procesamiento de pan rallado o CCPDMA . Los artefactos visuales microscópicos pueden causar potencialmente un diagnóstico erróneo de las muestras.
A continuación se presentan ejemplos de características generales de hallazgos sospechosos que pueden apreciarse con un aumento bajo a alto en la histopatología:
- Orientación (aumento mínimo): En este caso, orientada por la superficie de la piel (verde). Se ve una lesión (rojo) y se puede discernir su delimitación (difusa en este caso).
- Patrón arquitectónico de cualquier célula sospechosa, en este caso nidos de células, así como componentes del estroma intermedio.
- Disposición celular , incluyendo el hacinamiento y la polaridad celular (tendencias comunes entre las células en el borde, como la elongación o la " empalizada " en este caso). La cantidad de mitosis también se puede apreciar en este nivel.
- Características subcelulares (pueden requerir el máximo aumento)
Patrones arquitectónicos
Los principales patrones arquitecturales histopatológicos incluyen:
- Nidos : islas de células de tipo similar.
- Grupos de células trabeculares , alargadas (en forma de varilla).
- Papilar : Protuberancias de células epitelioides alrededor de núcleos fibrovasculares.
- Micropapilar : penachos papilares sin núcleos fibrovasculares
- Fascicular : Generalmente el mismo tipo de célula en todas partes, pero algunas forman grupos en forma de bandas que están alineados en la misma dirección.
- Entrelazado o estoriforme : Células o núcleos alargados en los que pequeños haces están alineados en un patrón que de otro modo sería aleatorio.
- Sólido : Más o menos el mismo tipo de célula en todas partes, sin espacios entre ellas y sin ningún otro patrón particular.
- Cribiforme : Sólido con múltiples espacios claros.
- Verticilado : Múltiples objetos concéntricos o en forma de espiral.
- Patrón de rueda de carro : puntos centrales que irradian células o tejido conectivo hacia afuera
Patrones nucleares
Los principales patrones nucleares incluyen:
- Monomórfico cuando tiene tamaños y formas relativamente similares.
- Pleomórfico cuando tiene diferentes tamaños y formas. Esto a menudo se correlaciona con una mayor proporción de núcleo a citoplasma . Estas características generalmente indican malignidad .
- Cromatina fina cuando es poco visible (esencialmente solo se ven nucléolos en los núcleos), versus cromatina gruesa .
- A veces se utilizan núcleos " heterocromáticos " versus " eucromáticos " para la apariencia visual, pero esto se refiere estrictamente a la estructura molecular del ADN.
En el infarto de miocardio
Después de un infarto de miocardio (ataque cardíaco), no se observa histopatología durante los primeros ~30 minutos. El único signo posible durante las primeras 4 horas es la ondulación de las fibras en el borde. Sin embargo, más tarde se inicia una necrosis por coagulación , con edema y hemorragia. Después de 12 horas, se puede ver cariopicnosis e hipereosinofilia de los miocitos con necrosis en banda de contracción en los márgenes, así como el comienzo de la infiltración de neutrófilos. A los 1-3 días continúa la necrosis por coagulación con pérdida de núcleos y estrías y un aumento de la infiltración de neutrófilos en el intersticio. Hasta el final de la primera semana después del infarto, comienza la desintegración de las fibras musculares muertas, la necrosis de los neutrófilos y comienza la eliminación de células muertas en el borde por parte de los macrófagos, que aumenta en los días siguientes. Después de una semana también comienza la formación de tejido de granulación en los márgenes, que madura durante el mes siguiente y aumenta la deposición de colágeno y disminuye la celularidad hasta que la cicatrización del miocardio está completamente madura aproximadamente 2 meses después del infarto. [3]
Véase también
- Patología anatómica
- Patología molecular
- Procedimiento de sección congelada
- Tecnólogo médico
- Microdisección por captura láser
- Lista de patólogos
Referencias
- ^ abcd «Guía básica de tinción histológica y preparación de tejidos». Archivado desde el original el 6 de julio de 2016.
- ^ "Perl - Glóbulo rojo - Tinción". Scribd .
- ^ Capítulo 11 en: Mitchell, Richard Sheppard; Kumar, Vinay; Abbas, Abul K.; Fausto, Nelson (2007). Robbins Basic Pathology . Filadelfia: Saunders. ISBN 978-1-4160-2973-1.8va edición.
Enlaces externos
- Curso virtual de histología - Universidad de Zúrich (versión en alemán e inglés en preparación)
- Histopatología del cuello uterino: atlas digital (Grupo de detección de IARC)
- Diapositivas virtuales de histopatología - Universidad de Iowa








.jpg/440px-Encapsulated_Papillary_Carcinoma_of_the_Breast,_H&E_(15768688957).jpg)



_with_solid_sheets_of_cells_(crop).jpg/440px-Micrograph_of_prostate_cancer_with_Gleason_score_10_(5+5)_with_solid_sheets_of_cells_(crop).jpg)








